Пептидомиметик
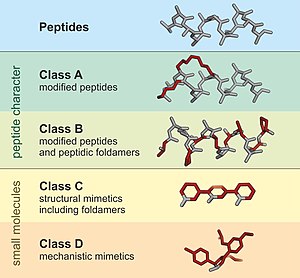
Пептидомиметик имитирующую представляет собой небольшую белковоподобную цепь, пептид . [ 1 ] [ 2 ] Обычно они возникают либо в результате модификации существующего пептида, либо в результате создания подобных систем, имитирующих пептиды, таких как пептоиды и β-пептиды . Независимо от подхода, измененная химическая структура предназначена для выгодного регулирования молекулярных свойств, таких как стабильность или биологическая активность . Это может сыграть роль в разработке лекарственных соединений из существующих пептидов. Пептидомиметики можно получить путем циклизации линейных пептидов или связывания стабильных неприродных аминокислот. [ 3 ] Эти модификации включают изменения в пептиде, которые не встречаются в природе (например, изменение основной цепи и включение неприродных аминокислот ). Неприродные аминокислоты могут быть получены из их нативных аналогов посредством таких модификаций, как алкилирование аминов, замена боковой цепи, циклизация удлинения структурных связей и изостерические замены в основной цепи аминокислот. [ 3 ] На основании сходства с пептидом-предшественником пептидомиметики можно разделить на четыре класса (A – D), где A имеет наибольшее сходство, а D – наименьшее. Классы A и B включают пептидоподобные каркасы, а классы C и D включают небольшие молекулы (рис. 1). [ 1 ]
Пептидомиметики класса А
[ редактировать ]В эту группу входят модифицированные пептиды, которые в основном состоят из протеогенных аминокислот, тем самым очень напоминающих природный эпитоп, связывающий пептид. [ 1 ] Вносимые модификации обычно направлены на повышение стабильности пептида, его сродства к желаемому партнеру по связыванию, пероральной доступности или клеточной проницаемости. Разработка пептидомиметиков класса А часто включает стратегии макроциклизации, как, например, в сшитых пептидах .
Пептидомиметики класса B
[ редактировать ]Этот класс пептидомиметиков включает пептиды с большим количеством неприродных аминокислот, основными модификациями основной цепи или более крупными неприродными строительными фрагментами, которые напоминают конформацию определенного мотива связывания пептида. [ 1 ] Примеры включают D-пептид и пептидные фолдамеры, такие как бета-пептиды .
Пептидомиметики класса C
[ редактировать ]Эти структурные миметики включают молекулы, которые сильно модифицированы по сравнению с их родительской пептидной последовательностью. [ 4 ] Обычно к проектным группам применяется низкомолекулярный каркас по аналогии с биоактивной конформацией пептида.
Пептидомиметики класса D
[ редактировать ]Эти механистические миметики не воспроизводят напрямую боковые цепи или конформацию пептида, а имитируют его механизм действия . [ 1 ] Пептидомиметики класса D могут быть созданы непосредственно из небольшой пептидной последовательности или идентифицированы путем скрининга библиотек соединений. Например, Нирмателвир — это низкомолекулярный препарат, активный для перорального применения, полученный из луфотрелвира , модифицированного L-пептида. [ 5 ]
-
Луфотрелвир (активная форма имеет отщепленную фосфатную группу)
-
Нирмарелвир
Использование и примеры
[ редактировать ]Использование пептидов в качестве лекарственных средств имеет некоторые недостатки из-за их биодоступности и биостабильности. Быстрая деградация, плохая доступность при пероральном приеме, трудная транспортировка через клеточные мембраны, неселективное связывание с рецепторами и сложная многоэтапная подготовка являются основными ограничениями пептидов в качестве активных фармацевтических ингредиентов. [ 3 ] Следовательно, небольшие белковоподобные цепи, называемые пептидомиметиками, могут быть разработаны и использованы для имитации нативных аналогов и, возможно, проявят лучшие фармакологические свойства. [ 3 ] Многие пептидомиметики используются в качестве одобренных FDA препаратов, таких как ромидепсин (Истодакс), Атазанавир (Реатаз), Саквинавир (Инвираза), Октреотид (Сандостатин), Ланреотид (Соматулин), Плеканатид (Труланс), Ксимелагатран (Эксанта), Этелкальцетид (Парсабив). ) и бортезомиб (Велкейд).
Пептидомиметические подходы были использованы для создания небольших молекул, избирательно воздействующих на раковые клетки, подход, известный как таргетная химиотерапия , путем индукции запрограммированной гибели клеток посредством процесса, называемого апоптозом . Следующие два примера имитируют белки, участвующие в ключевых белок-белковых взаимодействиях , которые реактивируют путь апоптоза при раке, но делают это по разным механизмам. [ 6 ]
В 2004 году Валенский и его коллеги сообщили о стабилизированном альфа-спиральном пептиде, который имитирует проапоптотические белки, содержащие только BH3, такие как BID и BAD . [ 7 ] Эта молекула была разработана для стабилизации нативной спиральной структуры за счет образования макроцикла между боковыми цепями, не участвующими в связывании. В этом процессе, называемом сшиванием пептидов , используются неприродные аминокислоты для облегчения макроциклизации путем метатезиса олефинов с замыканием кольца . [ 8 ] В этом случае была идентифицирована сшитая спираль BH3, которая специфически активирует митохондриальный путь апоптоза путем противодействия секвестрации белков, содержащих только BH3, антиапоптотическими белками (например, Bcl-2 , см. также внутренние и внешние индукторы апоптоза). человека Эта молекула подавляла рост лейкемии на модели ксенотрансплантата мыши . [ 7 ]
Также в 2004 году Харран и его коллеги сообщили о димерной небольшой молекуле, которая имитирует проапоптотический белок Smac (см. митохондриальную регуляцию при апоптозе). [ 9 ] Эта молекула имитирует N-концевой линейный мотив Ala-Val-Pro-Ile. Уникально то, что димерная структура этого пептидомиметика привела к заметному увеличению активности по сравнению с аналогичным мономером. Эта кооперативность связывания является результатом способности молекулы также имитировать гомодимерную структуру Smac, которая функционально важна для реактивации каспаз. [ 10 ] Миметики Smac этого типа могут сенсибилизировать множество клеток немелкоклеточного рака легких к обычным химиотерапевтическим препаратам (например, гемцитабину , винорелбину ) как in vitro, так и на моделях ксенотрансплантатов мышей. [ 11 ]
Гетероциклы часто используются для имитации амидной связи пептидов. Например, тиазолы содержатся в природных пептидах и используются исследователями для имитации амидной связи пептидов. [ 12 ]
См. также
[ редактировать ]- Апоптоз
- Бета-пептид
- Рак
- Кликнутый пептидный полимер
- Депсипептиды
- Расширенный генетический код
- Фолдамер
- Непротеиногенные аминокислоты
- Сшитые пептиды
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Пелай-Гимено М., Глас А., Кох О., Гроссманн Т.Н. (июль 2015 г.). «Структурный дизайн ингибиторов белок-белковых взаимодействий: имитирование пептидсвязывающих эпитопов» . Ангеванде Хеми . 54 (31): 8896–927. дои : 10.1002/anie.201412070 . ПМК 4557054 . ПМИД 26119925 .
- ^ Маршалл Г. Р., Балланте Ф (сентябрь 2017 г.). «Ограничивающие предположения при разработке пептидомиметиков». Исследования в области разработки лекарств . 78 (6): 245–267. дои : 10.1002/ddr.21406 . ПМИД 28875546 . S2CID 5730986 .
- ^ Перейти обратно: а б с д Аван, Илькер; Холл, К. Деннис; Катрицки, Алан Р. (22 апреля 2014 г.). «Пептидомиметика путем модификации аминокислот и пептидных связей» . Обзоры химического общества . 43 (10): 3575–3594. дои : 10.1039/C3CS60384A . ПМИД 24626261 .
- ^ Орнер, Брендан П.; Эрнст, Джастин Т.; Гамильтон, Эндрю Д. (01 июня 2001 г.). «На пути к протеомиметике: производные терфенила как структурные и функциональные имитаторы расширенных участков α-спирали» . Журнал Американского химического общества . 123 (22): 5382–5383. дои : 10.1021/ja0025548 . ISSN 0002-7863 . ПМИД 11457415 .
- ^ Оуэн Д.Р., Аллертон К.М., Андерсон А.С., Ашенбреннер Л., Эйвери М., Берритт С. и др. (ноябрь 2021 г.). «Клинический кандидат на пероральный ингибитор Mpro SARS-CoV-2 для лечения COVID-19» . Наука . 374 (6575): 1586–1593. Бибкод : 2021Sci...374.1586O . дои : 10.1126/science.abl4784 . ПМИД 34726479 . S2CID 240422219 .
- ^ Гомари М.М., Абхиз С., Пур Т.Г., Лотфи Э., Ростами Н., Монфаред Ф.Н., Гобари Б., Мосави М., Алипур Б., Дохолян Н.В. (декабрь 2022 г.). «Пептидомиметики в борьбе с раком» . Мол Мед . 28 (1): 146. дои : 10.1186/s10020-022-00577-3 . ПМЦ 9730693 . ПМИД 36476230 .
- ^ Перейти обратно: а б Валенский Л.Д., Кунг А.Л., Эшер И., Малия Т.Дж., Барбуто С., Райт Р.Д., Вагнер Г., Вердин Г.Л., Корсмейер С.Дж. (сентябрь 2004 г.). «Активация апоптоза in vivo с помощью скрепленной углеводородом спирали BH3» . Наука . 305 (5689): 1466–70. Бибкод : 2004Sci...305.1466W . дои : 10.1126/science.1099191 . ПМК 1360987 . ПМИД 15353804 .
- ^ Блэквелл Х.Э., Граббс Р.Х. (1998). «Высокоэффективный синтез ковалентно сшитых пептидных спиралей путем метатезиса с замыканием кольца». Angewandte Chemie, международное издание . 37 (23): 3281–3284. doi : 10.1002/(SICI)1521-3773(19981217)37:23<3281::AID-ANIE3281>3.0.CO;2-V . ПМИД 29711420 .
- ^ Ли Л, Томас Р.М., Сузуки Х., Де Брабандер Дж.К., Ван Икс, Харран П.Г. (сентябрь 2004 г.). «Небольшая молекула, имитирующая Smac, усиливает гибель клеток, опосредованную TRAIL и TNF-альфа». Наука . 305 (5689): 1471–4. Бибкод : 2004Sci...305.1471L . дои : 10.1126/science.1098231 . ПМИД 15353805 . S2CID 58926089 .
- ^ Чай Дж., Ду С., Ву Дж.В., Кин С., Ван Х., Ши Ю. (август 2000 г.). «Структурные и биохимические основы апоптотической активации Smac/DIABLO». Природа . 406 (6798): 855–62. Бибкод : 2000Natur.406..855C . дои : 10.1038/35022514 . ПМИД 10972280 . S2CID 4385614 .
- ^ Грир Р.М., Пейтон М., Ларсен Дж.Э., Жирар Л., Се Ю, Газдар А.Ф., Харран П., Ван Л., Бреккен Р.А., Ван Х, Минна Дж.Д. (декабрь 2011 г.). «Миметик SMAC (JP1201) повышает чувствительность немелкоклеточного рака легких к множеству химиотерапевтических агентов IAP-зависимым, но независимым от TNF-α способом» . Исследования рака . 71 (24): 7640–8. дои : 10.1158/0008-5472.CAN-10-3947 . ПМК 3382117 . ПМИД 22049529 .
- ^ Мак Дж.Ю., Сюй В., Фэрли Д.П. (1 января 2015 г.). Пептидомиметики I (PDF) . Темы гетероциклической химии. Том. 48. Шпрингер Берлин Гейдельберг. стр. 235–266. дои : 10.1007/7081_2015_176 . ISBN 978-3-319-49117-2 .

