Бета-пептид
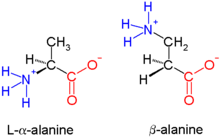
Бета-пептиды ( β-пептиды ) представляют собой пептиды, полученные из β-аминокислот , в которых аминогруппа присоединена к β-углероду (т.е. к атому углерода, находящемуся на расстоянии двух атомов от карбоксилатной группы). Исходной β-аминокислотой является β-аланин (H 2 NCH 2 CH 2 CO 2 H), обычное природное вещество, но в большинстве примеров присутствуют заместители вместо одной или нескольких связей CH. β-пептиды обычно не встречаются в природе. Антибиотики на основе β-пептидов исследуются как способы избежать устойчивости к антибиотикам . [1] Ранние исследования в этой области были опубликованы в 1996 году группой Дитера Зеебаха. [1] и Сэмюэля Геллмана. [2]
Структура
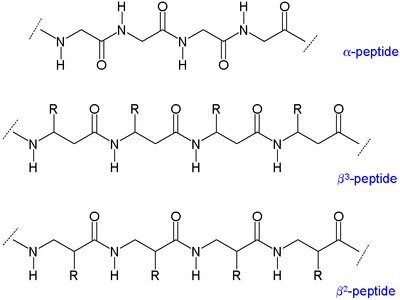
[ редактировать ]Поскольку для замены доступны два атома углерода, β-аминокислоты имеют четыре места (включая хиральность; в отличие от двух в α-аминокислотах) для присоединения группы органического остатка. [3] Соответственно, существуют два основных типа β-аминокислот, различающихся тем, к какому углероду присоединен остаток: те, у которых органический остаток (R) находится рядом с амином, называются β. 3 а те, которые расположены рядом с карбонильной группой, называются β 2 . β-пептид может состоять только из одного вида этих аминокислот (β 2 -пептиды и β 3 -пептиды) или иметь их комбинацию. Более того, β-аминокислота может образовывать кольцо, используя оба своих сайта, а также включаться в пептид. [3]
Синтез
[ редактировать ]Бета-аминокислоты получают разными способами. [4] [5] в том числе некоторые, основанные на синтезе Арндта-Эйстерта .
Вторичная структура
[ редактировать ]Поскольку их скелеты длиннее, чем у нормальных пептидов , β-пептиды образуют разрозненные вторичные структуры . Алкильные как в α- , заместители так и в β-положениях в β-аминокислоте способствуют образованию гош-конформации связи между α-углеродом и β-углеродом. Это также влияет на термодинамическую устойчивость конструкции.
Сообщалось о многих типах спиральных структур, состоящих из β-пептидов. Эти конформационные типы различаются по числу атомов в водородном кольце, образующемся в растворе; 8-спираль, 10-спираль, 12-спираль, 14-спираль, [6] и 10/12-спираль сообщалось. Вообще говоря, β-пептиды образуют более стабильную спираль, чем α-пептиды. [7]
Клинический потенциал
[ редактировать ]β-пептиды устойчивы к протеолитической деградации in vitro и in vivo , что является потенциальным преимуществом перед природными пептидами. [8] β-пептиды использовались для имитации природных антибиотиков на основе пептидов, таких как магаинины , которые очень эффективны, но их трудно использовать в качестве лекарств, поскольку они разлагаются протеолитическими ферментами. [9]
Примеры
[ редактировать ]Существуют β-аминокислоты с широким спектром заместителей. названные по аналогии с биологическими α-аминокислотами В природе были обнаружены следующие вещества, : β-аланин, β-лейцин , β-лизин , β-аргинин, β-глутамат, β-глутамин, β-фенилаланин и β-тирозин. [10] : 23 Из них β-аланин обнаружен у млекопитающих и включен в пантотеновую кислоту , важное питательное вещество. [10] : 2 Две α-аминокислоты также структурно являются β-аминокислотами: аспарагиновая кислота и аспарагин . [10] : 218 Микроцистины представляют собой класс соединений, содержащих остаток β-изоаспартила (т.е. аспарагиновой кислоты, связанной с ее бета-карбоксилом). [10] : 23
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Зеебах Д., Оверханд М., Кюнле ФНМ, Мартинони Б., Оберер Л., Хоммель У., Видмер Х. (июнь 1996 г.). «β-Пептиды: синтез путем омологации Арндта-Эйстерта с сопутствующим пептидным связыванием. Определение структуры методами ЯМР и КД-спектроскопии, а также рентгеновской кристаллографии. Спиральная вторичная структура -гексапептида в растворе и ее стабильность по отношению к пепсину». Helvetica Chimica Acta . 79 (4): 913–941. дои : 10.1002/hlca.19960790402 .
- ^ Аппелла Д.Х., Кристиансон Л.А., Карл И.Л., Пауэлл Д.Р., Геллман Ш.Х. (1996). «β-пептидные фолдамеры: прочное образование спирали в новом семействе олигомеров -аминокислот». Дж. Ам. хим. Соц. 118 (51): 13071–2. дои : 10.1021/ja963290l .
- ^ Jump up to: а б Сибах Д., Мэтьюз Дж.Л. (1997). «β-Пептиды: сюрприз на каждом шагу» (PDF) . хим. Коммун. (21): 2015–22. дои : 10.1039/a704933a .
- ^ Баслер Б., Шустер О., Бах Т. (ноябрь 2005 г.). «Конформационно ограниченные производные β-аминокислот путем внутримолекулярного [2 + 2]-фотоциклоприсоединения амида тетроновой кислоты и последующего раскрытия лактонного кольца». Дж. Орг. Хим . 70 (24): 9798–808. дои : 10.1021/jo0515226 . ПМИД 16292808 .
- ^ Мюррей Дж.К., Фаруки Б., Садовски Дж.Д. и др. (сентябрь 2005 г.). «Эффективный синтез комбинаторной библиотеки β-пептидов с помощью микроволнового облучения». Дж. Ам. хим. Соц . 127 (38): 13271–80. дои : 10.1021/ja052733v . ПМИД 16173757 .
- ^ Васантха, Басавалингаппа; Джордж, Гиджо; Раготама, Шринивасарао; Баларам, Падманабхан (январь 2017 г.). «Гомоолигомерные пептиды β3 (R)-валина: трансформация между спиральными структурами C14 и C12, индуцированная гостевым остатком Aib» . Биополимеры . 108 (1): e22935. дои : 10.1002/bip.22935 . ISSN 1097-0282 . ПМИД 27539268 . S2CID 205497333 . Архивировано из оригинала 13 февраля 2022 г. Проверено 7 мая 2022 г.
- ^ Гадеманн К., Хинтерманн Т., Шрайбер СП (октябрь 1999 г.). «Бета-пептиды: скручивание и поворот». Курс. Мед. Хим . 6 (10): 905–25. дои : 10.2174/092986730610220401154606 . ПМИД 10519905 . S2CID 247917035 .
- ^ Беке Т., Сомлаи С., Перцель А. (январь 2006 г.). «На пути к рациональному проектированию структур β-пептидов». J Comput Chem . 27 (1): 20–38. дои : 10.1002/jcc.20299 . ПМИД 16247761 . S2CID 35579693 .
- ^ Портер Э.А., Вейсблюм Б., Геллман Ш. (2002). «Мимикрия защитных пептидов хозяина неприродными олигомерами: противомикробные β-пептиды». Дж. Ам. хим. Соц. 124 (25): 7324–30. дои : 10.1021/ja0260871 . ПМИД 12071741 .
- ^ Jump up to: а б с д Хуаристи, Э.; Солошонок, Вадим А. (6 мая 2005 г.). Энантиоселективный синтез бета-аминокислот . Хобокен, Нью-Джерси (Нью-Джерси): ISBN Wiley Inc. 9780471698470 . OCLC 559972352 . Архивировано из оригинала 7 мая 2022 года . Проверено 7 мая 2022 г.