Вторичная структура белка


Вторичная структура белка — это локальная пространственная конформация основной цепи полипептида , за исключением боковых цепей. [1] Двумя наиболее распространенными вторичными структурными элементами являются альфа-спирали и бета-листы , хотя бета-повороты и омега-петли встречаются также . Элементы вторичной структуры обычно спонтанно образуются в качестве промежуточных продуктов перед тем, как белок сворачивается в свою трехмерную третичную структуру .
Вторичная структура формально определяется характером водородных связей между аминоводородом и карбоксильными пептида атомами кислорода в основной цепи . Альтернативно, вторичная структура может быть определена на основе регулярного рисунка двугранных углов основной цепи в конкретной области графика Рамачандрана, независимо от того, имеет ли она правильные водородные связи.
Понятие вторичной структуры было впервые предложено Каем Ульриком Линдерстрем-Лангом в Стэнфорде в 1952 году. [2] [3] Другие типы биополимеров, такие как нуклеиновые кислоты, также обладают характерными вторичными структурами .
Типы [ править ]
| Атрибут геометрии | α-спираль | 3 10 спираль | π-спираль |
|---|---|---|---|
| Остатки за ход | 3.6 | 3.0 | 4.4 |
| Перевод на остаток | 1,5 Å (0,15 нм) | 2,0 Å (0,20 нм) | 1,1 Å (0,11 нм) |
| Радиус спирали | 2,3 Å (0,23 нм) | 1,9 Å (0,19 нм) | 2,8 Å (0,28 нм) |
| Подача | 5,4 Å (0,54 нм) | 6,0 Å (0,60 нм) | 4,8 Å (0,48 нм) |
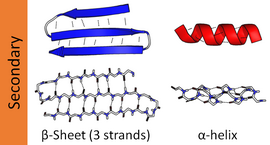

Наиболее распространенными вторичными структурами являются альфа-спирали и бета-листы . Другие спирали, такие как 310 . спираль и π-спираль , как рассчитано, имеют энергетически выгодную структуру водородных связей, но редко наблюдаются в природных белках, за исключением концов α-спиралей из-за неблагоприятной упаковки основной цепи в центре спирали Другие расширенные структуры, такие как полипролиновая спираль и альфа-лист, редко встречаются в белках в нативном состоянии, но часто предполагаются как важные промежуточные соединения сворачивания белка . Крутые повороты и свободные, гибкие петли соединяют более «правильные» элементы вторичной структуры. не Случайная спираль является истинной вторичной структурой, а представляет собой класс конформаций, которые указывают на отсутствие регулярной вторичной структуры.
Аминокислоты различаются по своей способности образовывать различные элементы вторичной структуры. Пролин и глицин иногда называют «разрушителями спирали», поскольку они нарушают регулярность конформации α-спиральной основной цепи; однако оба обладают необычными конформационными способностями и обычно встречаются по очереди . Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин , аланин , лейцин , глутамат и лизин («MALEK» в аминокислот однобуквенном коде ); напротив, большие ароматические остатки ( триптофан , тирозин и фенилаланин ) и C б -разветвленные аминокислоты ( изолейцин , валин и треонин ) предпочитают принимать конформацию β-цепи . Однако эти предпочтения недостаточно сильны, чтобы создать надежный метод предсказания вторичной структуры только на основе последовательности.
Считается, что низкочастотные коллективные вибрации чувствительны к локальной жесткости внутри белков, что показывает, что бета-структуры в целом более жесткие, чем альфа или неупорядоченные белки. [6] [7] Измерения рассеяния нейтронов напрямую связали спектральную особенность на частоте ~ 1 ТГц с коллективными движениями вторичной структуры белка бета-бочонка GFP. [8]
Характер водородных связей во вторичных структурах может быть существенно искажен, что затрудняет автоматическое определение вторичной структуры. Существует несколько методов формального определения вторичной структуры белка (например, DSSP , [9] ОПРЕДЕЛЯТЬ, [10] СТРАЙД , [11] ВинтФит, [12] ССТ [13] ).
Классификация DSSP [ править ]

Словарь вторичной структуры белков, сокращенно DSSP, обычно используется для описания вторичной структуры белка с помощью однобуквенных кодов. Вторичная структура определяется на основе структуры водородных связей, первоначально предложенной Полингом и др. в 1951 году (до того, как какая-либо структура белка была экспериментально определена). Существует восемь типов вторичной структуры, которые определяет DSSP:
- G = 3-витковая спираль ( 3 10 спираль ). Минимальная длина 3 остатка.
- H = 4-витковая спираль ( α спираль ). Минимальная длина 4 остатка.
- I = 5-витковая спираль ( π спираль ). Минимальная длина 5 остатков.
- T = виток с водородной связью (3, 4 или 5 витков)
- E = удлиненная цепь в параллельной и/или антипараллельной конформации β-листа . Минимальная длина 2 остатка.
- B = остаток в изолированном β-мостике (образование одной пары водородных связей β-листа)
- S = изгиб (единственное назначение, не основанное на водородных связях).
- C = катушка (остатки, не находящиеся ни в одной из вышеперечисленных конформаций).
«Катушка» часто обозначается как « » (пробел), C (катушка) или «–» (тире). Спирали (G, H и I) и листовые формы должны иметь разумную длину. Это означает, что два соседних остатка в первичной структуре должны образовывать одинаковую структуру водородных связей. Если спиральная или листовая структура водородных связей слишком короткая, они обозначаются буквами T или B соответственно. Существуют и другие категории присвоения вторичной структуры белков (резкие повороты, петли Омега и т. д.), но они используются реже.
Вторичная структура определяется водородной связью , поэтому точное определение водородной связи имеет решающее значение. Стандартное определение водородной связи для вторичной структуры — это определение DSSP , которое представляет собой чисто электростатическую модель. Он приписывает заряды ± q 1 ≈ 0,42 е карбонильному углероду и кислороду соответственно, а заряды ± q 2 ≈ 0,20 е амидному водороду и азоту соответственно. Электростатическая энергия
Согласно DSSP, водородная связь существует тогда и только тогда, когда E меньше -0,5 ккал/моль (-2,1 кДж/моль). Хотя формула DSSP является относительно грубым приближением физической энергии водородной связи, она обычно считается инструментом для определения вторичной структуры.
ССТ [13] классификация [ править ]
SST — это байесовский метод присвоения вторичной структуры данным координат белка с использованием информационного критерия Шеннона вывода минимальной длины сообщения ( MML ). SST рассматривает любое присвоение вторичной структуры как потенциальную гипотезу, которая пытается объяснить ( сжать ) данные о координатах белка. Основная идея заключается в том, что лучшее присвоение вторичной структуры — это то, которое может объяснить ( сжать ) координаты данного белка наиболее экономичным способом, таким образом связывая вывод о вторичной структуре со сжатием данных без потерь . SST точно разграничивает любую белковую цепь на области, связанные со следующими типами присвоения: [14]
- E = (Удлиненная) прядь β-складчатого листа.
- G = Правосторонняя 3 10 спираль
- H = правая α-спираль
- I = Правосторонняя π - спираль
- g = левая 3 10 спираль
- h = левая α-спираль
- i = левая π - спираль
- 3 = 3 10 -подобно Терну
- 4 = α -подобный поворот
- 5 = π- как поворот
- T = неопределенный поворот
- С = катушка
- - = Неназначенный остаток
SST обнаруживает π- и 3-10 - спиральные соединения со стандартными α- спиралями и автоматически собирает различные удлиненные нити в последовательные β-складчатые листы. Он обеспечивает читаемый вывод разобранных вторичных структурных элементов и соответствующий загружаемый скрипт PyMol для индивидуальной визуализации назначенных вторичных структурных элементов.
Экспериментальное определение [ править ]
Содержание грубой вторичной структуры биополимера (например, «этот белок на 40% состоит из α-спирали и на 20% из β-листа ») можно оценить спектроскопически . [15] Для белков распространенным методом является круговой дихроизм в дальнем ультрафиолете (дальний УФ, 170–250 нм) . Выраженный двойной минимум при 208 и 222 нм указывает на α-спиральную структуру, тогда как одиночный минимум при 204 нм или 217 нм отражает структуру случайного клубка или β-листа соответственно. Менее распространенным методом является инфракрасная спектроскопия , которая обнаруживает различия в колебаниях связей амидных групп из-за водородных связей. Наконец, содержание вторичной структуры можно точно оценить, используя химические сдвиги первоначально неустановленного спектра ЯМР . [16]
Прогноз [ править ]
Предсказание третичной структуры белка только по его аминокислотной последовательности — очень сложная задача (см. «Предсказание структуры белка» ), но использование более простых определений вторичной структуры является более простым.
Ранние методы прогнозирования вторичной структуры ограничивались предсказанием трех преобладающих состояний: спираль, лист или случайный клубок. Эти методы были основаны на склонности отдельных аминокислот к образованию спиралей или листов, иногда в сочетании с правилами оценки свободной энергии образования элементов вторичной структуры. Первым широко используемым методом предсказания вторичной структуры белка по аминокислотной последовательности был метод Чоу-Фасмана. [17] [18] [19] и метод ГОР . [20] Хотя такие методы утверждали, что достигают точности ~ 60% в предсказании того, какое из трех состояний (спираль/лист/клубок) принимает остаток, слепые компьютерные оценки позже показали, что фактическая точность была намного ниже. [21]
Значительное увеличение точности (почти до ~80%) было достигнуто за счет использования множественного выравнивания последовательностей ; знание полного распределения аминокислот, которые встречаются в определенном положении (и вблизи него, обычно ~7 остатков с каждой стороны) на протяжении эволюции, дает гораздо лучшую картину структурных тенденций вблизи этого положения. [22] [23] Например, данный белок может иметь глицин в заданном положении, что само по себе может указывать на случайный клубок. Однако множественное выравнивание последовательностей может показать, что аминокислоты, благоприятствующие спирали, встречаются в этом положении (и близлежащих положениях) в 95% гомологичных белков, охватывающих почти миллиард лет эволюции. Более того, исследуя среднюю гидрофобность в этом и близлежащих положениях, такое же выравнивание может также указывать на структуру доступности остатка для растворителя, соответствующую α-спирали. В совокупности эти факторы позволяют предположить, что глицин исходного белка имеет α-спиральную структуру, а не случайный клубок. Для объединения всех доступных данных для формирования прогноза с тремя состояниями используется несколько типов методов, включая нейронные сети , скрытые модели Маркова и машины опорных векторов . Современные методы прогнозирования также обеспечивают оценку достоверности своих прогнозов в каждой позиции.
Методы прогнозирования вторичной структуры оценивались с помощью экспериментов по критической оценке прогнозирования структуры белка (CASP) и постоянно подвергались сравнительному анализу, например, с помощью EVA (эталонный показатель) . По результатам этих испытаний наиболее точными оказались методы Псипред , САМ, [24] ПОРТЬЕ, [25] ПРОФ, [26] и СОБЕЛЬ. [27] Главной областью для улучшения, по-видимому, является предсказание β-цепей; остатки, уверенно предсказанные как β-цепи, скорее всего, таковы, но методы склонны игнорировать некоторые сегменты β-цепи (ложноотрицательные результаты). Вероятнее всего, существует верхний предел общей точности прогнозирования ~90% из-за особенностей стандартного метода ( DSSP ) назначения классов вторичной структуры (спираль/цепь/катушка) структурам PDB, по которым сравниваются прогнозы. [28]
Точное предсказание вторичной структуры является ключевым элементом предсказания третичной структуры во всех случаях, кроме самых простых ( моделирование гомологии ). Например, уверенно предсказанный паттерн из шести элементов вторичной структуры βαββαβ является признаком складки ферредоксина . [29]
Приложения [ править ]
Вторичные структуры как белка, так и нуклеиновой кислоты можно использовать для содействия множественному выравниванию последовательностей . Это выравнивание можно сделать более точным за счет включения информации о вторичной структуре в дополнение к простой информации о последовательности. Иногда это менее полезно в РНК, поскольку спаривание оснований гораздо более консервативно, чем последовательность. Отдаленные связи между белками, первичные структуры которых не совпадают, иногда можно обнаружить по вторичной структуре. [22]
Было показано, что α-спирали более стабильны, устойчивы к мутациям и поддаются конструированию, чем β-цепи в природных белках. [30] таким образом, разработка функциональных белков all-α, вероятно, будет проще, чем разработка белков как со спиралями, так и с нитями; недавно это было подтверждено экспериментально. [31]
См. также [ править ]
Ссылки [ править ]
- ^ Sun PD, Foster CE, Boyington JC (май 2004 г.). «Обзор структурных и функциональных складок белка» . Современные протоколы в науке о белках . 17 (1): Раздел 17.1. дои : 10.1002/0471140864.ps1701s35 . ПМК 7162418 . ПМИД 18429251 .
- ^ Линдерстрем-Ланг КУ (1952). Медицинские лекции Лейна: Белки и ферменты . Издательство Стэнфордского университета. п. 115. АСИН B0007J31SC .
- ^ Шеллман Дж.А., Шеллман К.Г. (1997). «Кай Ульрик Линдерстрем-Ланг (1896–1959)» . Белковая наука . 6 (5): 1092–100. дои : 10.1002/pro.5560060516 . ПМК 2143695 . ПМИД 9144781 .
Он уже ввел понятия первичной, вторичной и третичной структуры белков в третьей Лейновской лекции (Линдерстрам-Ланг, 1952).
- ^ Боттомли С. (2004). «Интерактивное руководство по структуре белка» . Архивировано из оригинала 1 марта 2011 года . Проверено 9 января 2011 г.
- ^ Шульц Г.Е., Ширмер Р.Х. (1979). Принципы строения белка . Нью-Йорк: Springer-Verlag. ISBN 0-387-90386-0 . OCLC 4498269 .
- ^ Пертикароли С., Никелс Дж.Д., Элерс Г., О'Нил Х., Чжан К., Соколов А.П. (октябрь 2013 г.). «Вторичная структура и жесткость модельных белков». Мягкая материя . 9 (40): 9548–56. Бибкод : 2013SMat....9.9548P . дои : 10.1039/C3SM50807B . ПМИД 26029761 .
- ^ Пертикароли С., Никелс Дж.Д., Элерс Г., Соколов А.П. (июнь 2014 г.). «Жесткость, вторичная структура и универсальность бозонного пика в белках» . Биофизический журнал . 106 (12): 2667–74. Бибкод : 2014BpJ...106.2667P . дои : 10.1016/j.bpj.2014.05.009 . ПМК 4070067 . ПМИД 24940784 .
- ^ Никелс Дж.Д., Пертикароли С., О'Нил Х., Чжан К., Элерс Г., Соколов А.П. (2013). «Когерентное рассеяние нейтронов и коллективная динамика в белке GFP» . Биофиз. Дж . 105 (9): 2182–87. Бибкод : 2013BpJ...105.2182N . дои : 10.1016/j.bpj.2013.09.029 . ПМЦ 3824694 . ПМИД 24209864 .
- ^ Кабш В., Сандер С. (декабрь 1983 г.). «Словарь вторичной структуры белков: распознавание образов водородных связей и геометрических особенностей». Биополимеры . 22 (12): 2577–637. дои : 10.1002/bip.360221211 . ПМИД 6667333 . S2CID 29185760 .
- ^ Ричардс FM, Кундрот CE (1988). «Идентификация структурных мотивов по данным координат белков: вторичная структура и супервторичная структура первого уровня». Белки . 3 (2): 71–84. дои : 10.1002/прот.340030202 . ПМИД 3399495 . S2CID 29126855 .
- ^ Фришман Д., Аргос П. (декабрь 1995 г.). «Научное определение вторичной структуры белка» (PDF) . Белки . 23 (4): 566–79. CiteSeerX 10.1.1.132.9420 . дои : 10.1002/прот.340230412 . ПМИД 8749853 . S2CID 17487756 . Архивировано из оригинала (PDF) 13 июня 2010 г.
- ^ Каллигари П.А., Кнеллер Г.Р. (декабрь 2012 г.). «ScrewFit: сочетание локализации и описания вторичной структуры белка». Acta Crystallographica Раздел D. 68 (Часть 12): 1690–3. дои : 10.1107/s0907444912039029 . ПМИД 23151634 .
- ↑ Перейти обратно: Перейти обратно: а б Конагурту А.С., Леск А.М., Эллисон Л. (июнь 2012 г.). «Вывод о вторичной структуре по минимальной длине сообщения на основе данных о координатах белка» . Биоинформатика . 28 (12): i97–i105. doi : 10.1093/биоинформатика/bts223 . ПМК 3371855 . ПМИД 22689785 .
- ^ «Веб-сервер SST» . Проверено 17 апреля 2018 г.
- ^ Пелтон Дж. Т., Маклин Л. Р. (2000). «Спектроскопические методы анализа вторичной структуры белков». Анальный. Биохим . 277 (2): 167–76. дои : 10.1006/abio.1999.4320 . ПМИД 10625503 .
- ^ Мейлер Дж., Бейкер Д. (2003). «Быстрое определение складки белка с использованием неназначенных данных ЯМР» . Учеб. Натл. акад. наук. США . 100 (26): 15404–09. Бибкод : 2003PNAS..10015404M . дои : 10.1073/pnas.2434121100 . ПМК 307580 . ПМИД 14668443 .
- ^ Чжоу П.Ю., Фасман Г.Д. (январь 1974 г.). «Прогнозирование конформации белка». Биохимия . 13 (2): 222–45. дои : 10.1021/bi00699a002 . ПМИД 4358940 .
- ^ Чжоу П.Ю., Фасман Г.Д. (1978). «Эмпирические предсказания конформации белка». Ежегодный обзор биохимии . 47 : 251–76. дои : 10.1146/annurev.bi.47.070178.001343 . ПМИД 354496 .
- ^ Чжоу П.Ю., Фасман Г.Д. (1978). «Предсказание вторичной структуры белков по их аминокислотной последовательности» . Достижения энзимологии и смежных областей молекулярной биологии . Достижения в энзимологии и смежных областях молекулярной биологии. Том. 47. С. 45–148 . дои : 10.1002/9780470122921.ch2 . ISBN 9780470122921 . ПМИД 364941 .
- ^ Гарнье Дж., Диджей Осгуторп, Робсон Б. (март 1978 г.). «Анализ точности и применения простых методов предсказания вторичной структуры глобулярных белков». Журнал молекулярной биологии . 120 (1): 97–120. дои : 10.1016/0022-2836(78)90297-8 . ПМИД 642007 .
- ^ Кабш В., Сандер С. (май 1983 г.). «Насколько точны предсказания вторичной структуры белка?». Письма ФЭБС . 155 (2): 179–82. дои : 10.1016/0014-5793(82)80597-8 . ПМИД 6852232 . S2CID 41477827 .
- ↑ Перейти обратно: Перейти обратно: а б Симоссис В.А., Херинга Дж. (август 2004 г.). «Интеграция предсказания вторичной структуры белка и множественного выравнивания последовательностей». Современная наука о белках и пептидах . 5 (4): 249–66. дои : 10.2174/1389203043379675 . ПМИД 15320732 .
- ^ Пировано В., Херинга Дж. (2010). «Прогнозирование вторичной структуры белка». Методы интеллектуального анализа данных для наук о жизни . Методы молекулярной биологии. Том. 609. стр. 327–48. дои : 10.1007/978-1-60327-241-4_19 . ISBN 978-1-60327-240-7 . ПМИД 20221928 .
- ^ Карплюс К (2009). «SAM-T08, предсказание структуры белка на основе HMM» . Нуклеиновые кислоты Рез . 37 (проблема с веб-сервером): W492–97. дои : 10.1093/нар/gkp403 . ПМК 2703928 . ПМИД 19483096 .
- ^ Полластри Г., МакЛисахт А. (2005). «Портер: новый точный сервер для прогнозирования вторичной структуры белков» . Биоинформатика . 21 (8): 1719–20. doi : 10.1093/биоинформатика/bti203 . hdl : 2262/39594 . ПМИД 15585524 .
- ^ Яхдав Г, Клоппманн Е, Каян Л, Хехт М, Гольдберг Т, Хэмп Т, Хёнигшмид П, Шафферханс А, Роос М, Бернхофер М, Рихтер Л, Ашкенази Х, Пунта М, Шлезингер А, Бромберг Ю, Шнайдер Р, Вриенд Г , Сандер С., Бен-Тал Н., Рост Б. (2014). «PredictProtein — открытый ресурс для онлайн-прогноза структурных и функциональных особенностей белков» . Нуклеиновые кислоты Рез . 42 (проблема с веб-сервером): W337–43. дои : 10.1093/nar/gku366 . ПМК 4086098 . ПМИД 24799431 .
- ^ Адамчак Р., Поролло А., Меллер Дж. (2005). «Сочетание предсказания вторичной структуры и доступности растворителей в белках». Белки . 59 (3): 467–75. дои : 10.1002/прот.20441 . ПМИД 15768403 . S2CID 13267624 .
- ^ Кихара Д. (август 2005 г.). «Влияние дальнодействующих взаимодействий на формирование вторичной структуры белков» . Белковая наука . 14 (8): 1955–963. дои : 10.1110/ps.051479505 . ПМК 2279307 . ПМИД 15987894 .
- ^ Ци Й, Гришин Н.В. (2005). «Структурная классификация тиоредоксин-подобных складчатых белков» (PDF) . Белки . 58 (2): 376–88. CiteSeerX 10.1.1.644.8150 . дои : 10.1002/прот.20329 . ПМИД 15558583 . S2CID 823339 .
Поскольку определение складки должно включать только основные вторичные структурные элементы, которые присутствуют в большинстве гомологов, мы определяем тиоредоксинподобную складку как двухслойный α/β-сэндвич с паттерном вторичной структуры βαβββα.
- ^ Абрусан Г., Марш Дж.А. (декабрь 2016 г.). «Альфа-спирали более устойчивы к мутациям, чем бета-цепи» . PLOS Вычислительная биология . 12 (12): e1005242. Бибкод : 2016PLSCB..12E5242A . дои : 10.1371/journal.pcbi.1005242 . ПМК 5147804 . ПМИД 27935949 .
- ^ Роклин Г.Дж., Чидьяусику Т.М., Горешник И., Форд А., Хоулистон С., Лемак А. и др. (июль 2017 г.). «Глобальный анализ сворачивания белков с использованием массово-параллельного проектирования, синтеза и тестирования» . Наука . 357 (6347): 168–175. Бибкод : 2017Sci...357..168R . дои : 10.1126/science.aan0693 . ПМЦ 5568797 . ПМИД 28706065 .
Дальнейшее чтение [ править ]
- Брэнден С., Туз Дж. (1999). Введение в структуру белка (2-е изд.). Нью-Йорк: Garland Science. ISBN 978-0815323051 .
- Полинг Л. , Кори Р.Б. (1951). «Конфигурации полипептидных цепей с предпочтительной ориентацией вокруг одинарных связей: два новых плиссированных листа» . Учеб. Натл. акад. наук. США . 37 (11): 729–40. Бибкод : 1951ПНАС...37..729П . дои : 10.1073/pnas.37.11.729 . ПМЦ 1063460 . ПМИД 16578412 . (Оригинальная статья о конформации бета-листа.)
- Полинг Л. , Кори Р.Б. , Брэнсон Х.Р. (1951). «Строение белков; две спиральные конфигурации полипептидной цепи с водородными связями» . Учеб. Натл. акад. наук. США . 37 (4): 205–11. Бибкод : 1951ПНАС...37..205П . дои : 10.1073/pnas.37.4.205 . ПМЦ 1063337 . ПМИД 14816373 . (конформации альфа- и пи-спирали, поскольку они предсказали, что спирали были бы невозможны.)
Внешние ссылки [ править ]
- NetSurfP – предиктор вторичной структуры и доступности поверхности
- ПРОФ
- Винтовая посадка
- PSSPred Программа обучения нескольких нейронных сетей для прогнозирования вторичной структуры белков.
- Метасервер Genesilico Метасервер , который позволяет запускать более 20 различных предикторов вторичной структуры одним щелчком мыши.
- Веб-сервер SST : теоретико-информационное (основанное на сжатии) вторичное структурное задание.

