Определение структуры нуклеиновой кислоты
Экспериментальные подходы к определению структуры нуклеиновых кислот , таких как РНК и ДНК , можно в значительной степени разделить на биофизические и биохимические методы. Биофизические методы используют фундаментальные физические свойства молекул для определения структуры , включая рентгеновскую кристаллографию , ЯМР и крио-ЭМ . Биохимические методы используют химические свойства нуклеиновых кислот с использованием специальных реагентов и условий для анализа структуры нуклеиновых кислот. [1] Такие методы могут включать химическое зондирование с использованием конкретных реагентов или полагаться на нативную химию или химию- аналог . Различные экспериментальные подходы имеют уникальные преимущества и подходят для разных экспериментальных целей.
Биофизические методы
[ редактировать ]Рентгеновская кристаллография
[ редактировать ]Этот раздел нуждается в расширении : его значимый вклад в изучение структур нуклеиновых кислот и некоторые примеры. Вы можете помочь, добавив к нему . ( декабрь 2018 ) |
Рентгеновская кристаллография не характерна для одних только нуклеиновых кислот, поскольку ни ДНК, ни РНК легко не образуют кристаллы. Это происходит из-за большей степени внутреннего беспорядка и динамизма в структурах нуклеиновых кислот и отрицательно заряженных (дезокси)рибозофосфатных остовов, которые отталкивают друг друга в непосредственной близости. Следовательно, кристаллизованные нуклеиновые кислоты имеют тенденцию образовывать комплекс с интересующим белком, обеспечивая структурный порядок и нейтрализуя отрицательный заряд. [ нужна ссылка ]
Спектроскопия ядерного магнитного резонанса (ЯМР)
[ редактировать ]ЯМР нуклеиновых кислот — это использование ЯМР-спектроскопии для получения информации о структуре и динамике молекул нуклеиновых кислот , таких как ДНК или РНК . По состоянию на 2003 год почти половина всех известных структур РНК была определена с помощью ЯМР-спектроскопии. [2]
В ЯМР нуклеиновых кислот используются те же методы, что и в ЯМР белков, но есть несколько отличий. Нуклеиновые кислоты содержат меньший процент атомов водорода, которые обычно наблюдаются в ЯМР, и поскольку двойные спирали нуклеиновых кислот жесткие и примерно линейные, они не сворачиваются сами по себе, образуя «дальние» корреляции. [3] Типы ЯМР, обычно выполняемые с нуклеиновыми кислотами: 1 H или протонный ЯМР , 13 С ЯМР , 15 N ЯМР и 31 П ЯМР . двумерные методы ЯМР Почти всегда используются , такие как корреляционная спектроскопия (COSY) и спектроскопия переноса полной когерентности (TOCSY) для обнаружения сквозных ядерных связей, а также спектроскопия ядерного эффекта Оверхаузера (NOESY) для обнаружения связей между ядрами, близкими к друг друга в космосе. [4]
Параметры, взятые из спектра, в основном кросс-пики NOESY и константы связи , могут использоваться для определения локальных структурных особенностей, таких как углы гликозидных связей , двугранные углы (с использованием уравнения Карплюса ) и конформации сахарных складок. Для крупномасштабной структуры эти локальные параметры должны быть дополнены другими структурными предположениями или моделями, поскольку ошибки накапливаются по мере прохождения двойной спирали, и в отличие от белков, двойная спираль не имеет компактной внутренней части и не сгибается обратно. сам. ЯМР также полезен для исследования нестандартной геометрии, такой как изогнутые спирали , спаривание оснований не по принципу Ватсона-Крика и коаксиальная укладка . Это было особенно полезно при исследовании структуры природных олигонуклеотидов РНК, которые имеют тенденцию принимать сложные конформации, такие как стебель-петли и псевдоузлы . ЯМР также полезен для исследования связывания молекул нуклеиновой кислоты с другими молекулами, такими как белки или лекарства, путем наблюдения за тем, какие резонансы смещаются при связывании другой молекулы. [4]
Криогенная электронная микроскопия (крио-ЭМ)
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( март 2020 г. ) |
Криогенная электронная микроскопия (криоЭМ) — это метод, в котором электронный луч используется для изображения образцов, криогенно законсервированных в водном растворе. Жидкие образцы отбираются пипеткой на небольшие металлические сетки и погружаются в жидкий раствор этана/пропана, который поддерживается очень холодным в ванне с жидким азотом. В результате этого процесса замораживания молекулы воды в образце не успевают сформировать гексагональные решетки, как во льду, и поэтому образец сохраняется в стеклообразном, подобном воде состоянии (также называемом остеклованным льдом ), что делает эти образцы проще получить изображение с помощью электронного луча. Преимущество крио-ЭМ перед рентгеновской кристаллографией заключается в том, что образцы сохраняются в состоянии водного раствора и не подвергаются воздействию за счет образования кристаллов образца. Одним из недостатков является то, что трудно различить структуры нуклеиновой кислоты или белка размером менее ~75 килодальтон , отчасти из-за трудности с наличием достаточного контраста для обнаружения частиц в этом застеклованном водном растворе. Еще одним недостатком является то, что для получения информации о структуре образца на атомном уровне необходимо сделать множество изображений (часто называемых электронными микрофотографиями) и усреднить эти изображения в процессе, называемом одночастичная реконструкция . Это вычислительно интенсивный процесс.
Крио-ЭМ — это новая, менее пертурбативная версия просвечивающей электронной микроскопии (ПЭМ). Это менее возмущающе, поскольку образец не высушивается на поверхности, этот процесс сушки часто выполняется в ПЭМ с отрицательным окрашиванием , а также потому, что крио-ЭМ не требует контрастных веществ, таких как соли тяжелых металлов (например, уранилацетат или фосфорновольфрамовая кислота), которые также может повлиять на структуру биомолекулы. Просвечивающая электронная микроскопия как метод использует тот факт, что образцы взаимодействуют с пучком электронов, и только части образца, которые не взаимодействуют с электронным лучом, могут «передавать» в систему обнаружения электронов. В целом ПЭМ стала полезным методом определения структуры нуклеиновых кислот с 1960-х годов. [5] [6] Хотя структуру двухцепочечной ДНК (дцДНК) традиционно нельзя считать структурой в типичном смысле чередующихся сегментов одно- и двухцепочечных областей, на самом деле дцДНК — это не просто идеально упорядоченная двойная спираль в каждом месте ее длины. из-за тепловых колебаний в ДНК и альтернативных структур, которые могут образовываться наподобие g-квадруплексов . КриоЭМ нуклеиновой кислоты была проведена на рибосомах. [7] вирусная РНК, [8] и одноцепочечные структуры РНК внутри вирусов. [9] [10] Эти исследования выявили структурные особенности с разным разрешением: от уровня нуклеиновых оснований (2-3 ангстрема) до мотивов третичной структуры (более нанометра).
Химическое зондирование
[ редактировать ]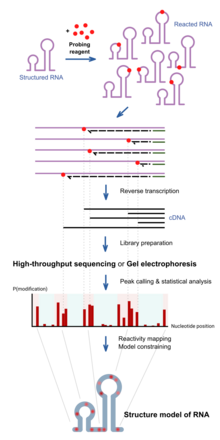
При химическом зондировании РНК используются химические вещества, которые реагируют с РНК. Важно отметить, что их реакционная способность зависит от локальной структуры РНК, например, от спаривания оснований или доступности. Таким образом, различия в реактивности могут служить отражением структуры последовательности. Различные реагенты реагируют в разных положениях структуры РНК и имеют разные спектры реакционной способности. [1] Последние достижения позволяют одновременно изучать структуру многих РНК (зондирование всего транскриптома). [11] и прямой анализ молекул РНК в их клеточном окружении (внутриклеточное зондирование). [12]
Структурированная РНК сначала подвергается реакции с реагентами-зондами в течение заданного времени инкубации. Эти реагенты будут образовывать ковалентный аддукт на РНК в месте реакции. Когда РНК обратно транскрибируется с использованием обратной транскриптазы в копию ДНК, образующаяся ДНК усекается в позициях реакции, поскольку фермент блокируется аддуктами. молекул Таким образом , совокупность ДНК различной укороченной длины определяет частоту реакции в каждом положении основания, что отражает профиль структуры вдоль РНК. Традиционно это анализируется путем анализа ДНК на геле , и интенсивность полос определяет частоту наблюдения усечения в каждой позиции. Последние подходы используют высокопроизводительное секвенирование для достижения той же цели с большей пропускной способностью и чувствительностью.
Профиль реактивности можно использовать для изучения степени структуры в определенных положениях для конкретных гипотез или использовать в сочетании с вычислительными алгоритмами для создания полной экспериментально подтвержденной модели структуры. [13]
В зависимости от используемого химического реагента некоторые реагенты, например гидроксильные радикалы, вместо этого расщепляют молекулу РНК. Результат в усеченной ДНК тот же. Некоторые реагенты, например DMS, иногда не блокируют обратную транскриптазу, а вместо этого вызывают ошибку в участке копии ДНК. Их можно обнаружить при использовании методов высокопроизводительного секвенирования, а иногда их используют для улучшения результатов зондирования в виде мутационного профилирования (MaP). [14] [15]
Позиции РНК могут быть защищены от реагентов не только локальной структурой, но и связывающим белком над этим положением. Это побудило некоторые работы по использованию химического зондирования для анализа связывания с белками. [16]
Зондирование гидроксильных радикалов
[ редактировать ]
Поскольку гидроксильные радикалы в растворе недолговечны, их необходимо генерировать в ходе эксперимента. Это можно сделать, используя H 2 O 2 , аскорбиновую кислоту и комплекс Fe(II)-ЭДТА. Эти реагенты образуют систему, которая генерирует гидроксильные радикалы посредством химии Фентона . Гидроксильные радикалы могут затем реагировать с молекулами нуклеиновой кислоты. [17] Гидроксильные радикалы атакуют кольцо рибозы/дезоксирибозы, что приводит к разрыву сахарофосфатного остова. Сайты, находящиеся под защитой от связывания белков или третичной структуры РНК, будут расщепляться гидроксильным радикалом с меньшей скоростью. [17] Таким образом, эти положения будут проявляться как отсутствие полос на геле или низкий сигнал при секвенировании. [17] [18]
ДМС
[ редактировать ]Диметилсульфат , известный как ДМС, представляет собой химическое вещество, которое можно использовать для модификации нуклеиновых кислот с целью определения вторичной структуры. Реакция с ДМС добавляет к сайту метиловый аддукт, известный как метилирование . В частности, ДМС метилирует N1 аденина (А) и N3 цитозина (С) . [19] оба расположены в месте естественных водородных связей при спаривании оснований. Следовательно, модификация может происходить только в нуклеооснованиях A и C, которые являются одноцепочечными, с парой оснований на конце спирали, или в паре оснований на или рядом с парой GU-колебаний , причем последние два являются положениями, где спаривание оснований иногда может открываться. Более того, поскольку модифицированные сайты не могут быть спарены основаниями, сайты модификации можно обнаружить с помощью RT-PCR, где обратная транскриптаза отпадает по метилированным основаниям и образует различные усеченные кДНК. Эти усеченные кДНК можно идентифицировать с помощью гель-электрофореза или высокопроизводительного секвенирования.
Совершенствуя методы, основанные на усечении, мутационное профилирование DMS с секвенированием (DMS-MaPseq) может обнаруживать множественные модификации DMS в одной молекуле РНК, что позволяет получить больше информации за одно чтение (для чтения 150 нт обычно две-три мутации). сайты, а не сайты усечения от нуля до одного), определяют структуры РНК с низким содержанием и идентифицируют субпопуляции РНК с альтернативными вторичными структурами. [20] DMS-MaPseq использует термостабильную обратную транскриптазу интрона группы II (TGIRT), которая создает мутацию (а не усечение) в кДНК , когда она встречает основание, метилированное DMS, но в остальном она осуществляет обратную транскрипцию с высокой точностью. Секвенирование полученной кДНК позволяет определить, какие основания были мутированы во время обратной транскрипции; эти основания не могли быть спарены в исходной РНК.
Модификацию DMS также можно использовать для ДНК, например, для отслеживания взаимодействий ДНК-белок. [21]
ФОРМА
[ редактировать ]Избирательное 2'- гидроксилацилирование , анализируемое с помощью праймера , использует преимущества реагентов , удлинения или SHAPE которые преимущественно модифицируют основную цепь РНК в структурно гибких областях.

Реагенты, такие как N-метилизатовый ангидрид (NMIA) и 1-метил-7-нитроизатарный ангидрид (1M7). [22] реагируют с 2'-гидроксильной группой с образованием аддуктов на 2'-гидроксиле основной цепи РНК. По сравнению с химическими веществами, используемыми в других методах зондирования РНК, эти реагенты имеют то преимущество, что в значительной степени не зависят от идентичности оснований, оставаясь при этом очень чувствительными к конформационной динамике. Нуклеотиды, которые ограничены (обычно спариванием оснований), демонстрируют меньшее образование аддуктов, чем неспаренные нуклеотиды. Образование аддукта количественно оценивают для каждого нуклеотида в данной РНК путем удлинения комплементарного праймера ДНК с помощью обратной транскриптазы и сравнения полученных фрагментов с фрагментами немодифицированного контроля. [23] Таким образом, SHAPE сообщает о структуре РНК на уровне отдельных нуклеотидов. Эти данные можно использовать в качестве входных данных для создания высокоточных моделей вторичной структуры. [24] SHAPE использовался для анализа различных структур РНК, включая структуру всего генома ВИЧ-1. [25] Лучший подход — использовать комбинацию химических реагентов для зондирования и экспериментальных данных. [26] В SHAPE-Seq SHAPE расширен за счет мультиплексирования на основе штрих-кода в сочетании с RNA-Seq и может выполняться с высокой пропускной способностью. [27]
Карбодиимиды
[ редактировать ]

Карбодиимидный гуанин фрагмент также может образовывать ковалентные аддукты при открытых азотистых основаниях, которыми являются урацил и, в меньшей степени, , при нуклеофильной атаке депротонированного N. Они реагируют в первую очередь с N3 урацила и N1 гуанина, модифицируя два сайта, ответственные за водородную связь на базы. [19]
1-циклогексил-(2-морфолиноэтил)карбодиимид мето- п -толуолсульфонат, также известный как CMCT или CMC, является наиболее часто используемым карбодиимидом для исследования структуры РНК. [29] [30] Подобно ДМС, его можно обнаружить с помощью обратной транскрипции с последующей гель-электрофорезом или высокопроизводительным секвенированием. Поскольку он реагирует на G и U, его можно использовать для дополнения данных экспериментов по зондированию DMS, которые информируют A и C. [31]
1-этил-3-(3-диметиламинопропил)карбодиимид , также известный как EDC, представляет собой водорастворимый карбодиимид, который проявляет аналогичную реакционную способность с CMC и также используется для химического исследования структуры РНК. EDC способен проникать в клетки и поэтому используется для прямого внутриклеточного зондирования РНК в их нативной среде. [32] [28]
Кетоксаль, глиоксаль и производные
[ редактировать ]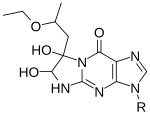

Некоторые 1,2- дикарбонильные соединения способны реагировать с одноцепочечным гуанином (G) по N1 и N2, образуя пятичленный кольцевой аддукт на грани Уотсона-Крика.
1,1-Дигидрокси-3-этокси-2-бутанон, также известный как кетоксаль , имеет структуру, родственную 1,2-дикарбонилам, и был первым в этой категории, широко используемым для химического исследования РНК. Кетоксал вызывает модификацию гуанина, одновременно изменяя N1 и экзоциклическую аминогруппу (N2) за счет ковалентного взаимодействия. [35]
Глиоксаль , метилглиоксаль и фенилглиоксаль, которые несут ключевую 1,2-дикарбонильную часть, реагируют со свободными гуанинами подобно кетоксалю и могут использоваться для исследования неспаренных гуаниновых оснований в структурированной РНК. Благодаря своим химическим свойствам эти реагенты могут легко проникать в клетки и, следовательно, могут использоваться для анализа РНК в их естественной клеточной среде. [34]
ЛАЗЕРНОЕ или НАЗ-зондирование
[ редактировать ]При светоактивированном структурном исследовании РНК (ЛАЗЕР) используется УФ-свет для активации никотиноилазида (NAz), генерирующего высокореактивный катион нитрена в воде, который реагирует с доступными растворителю гуанозином и аденозином РНК в положении C-8 через безбарьерный фильтр Фриделя. Реакция ремесла. ЛАЗЕРНОЕ зондирование нацелено как на одноцепочечные, так и на двухцепочечные остатки, если они доступны растворителю. Поскольку зондирование гидроксильных радикалов требует синхротронного излучения для измерения доступности РНК растворителем in vivo , во многих лабораториях трудно применить зондирование гидроксильных радикалов для определения следов РНК в клетках. Напротив, при ЛАЗЕРНОМ зондировании для возбуждения используется ручная УФ-лампа (20 Вт). Гораздо проще применять ЛАЗЕРНОЕ зондирование для исследования доступности растворителя РНК in vivo . Этот метод химического зондирования контролируется светом и исследует доступность азотистого основания растворителем, которое, как было показано, оставляет следы РНК-связывающих белков внутри клеток. [36]
Встроенное зондирование
[ редактировать ]
Поточное зондирование не предполагает обработки какими-либо химическими веществами или реагентами для модификации структур РНК. В этом типе зондового анализа используется структурно-зависимое расщепление РНК; одноцепочечные регионы более гибкие и нестабильные и со временем деградируют. [38] Процесс поточного зондирования часто используется для определения изменений в структуре вследствие связывания лиганда. Связывание лиганда может привести к различным моделям расщепления. Процесс поточного зондирования включает инкубацию структурных или функциональных РНК в течение длительного периода времени. Этот период может составлять несколько дней, но варьируется в каждом эксперименте. Затем инкубированные продукты обрабатывают гелем для визуализации полос. Этот эксперимент часто проводится в двух разных условиях: 1) с лигандом и 2) в отсутствие лиганда. [37] Расщепление приводит к более коротким длинам полос и указывает на области, которые не спарены основаниями, поскольку области с парами оснований имеют тенденцию быть менее чувствительными к спонтанному расщеплению. [38] Поточное зондирование — это функциональный анализ, который можно использовать для определения структурных изменений РНК в ответ на связывание лиганда. Он может напрямую показать изменение гибкости и связывания областей РНК в ответ на лиганд, а также сравнить этот ответ с аналогичными лигандами. Этот анализ обычно используется в динамических исследованиях, особенно при изучении рибопереключателей . [38]
Нуклеотидно-аналоговое интерференционное картирование (NAIM)
[ редактировать ]Картирование интерференционных аналогов нуклеотидов (NAIM) — это процесс использования аналогов нуклеотидов, молекул, которые в чем-то похожи на нуклеотиды, но лишены функции, для определения важности функциональной группы в каждом месте молекулы РНК. [39] [40] Процесс NAIM заключается во вставке единственного нуклеотидного аналога в уникальный сайт. Это можно сделать путем транскрипции короткой РНК с помощью РНК-полимеразы Т7 , затем синтеза короткого олигонуклеотида, содержащего аналог в определенном положении, а затем лигирования их вместе на матрице ДНК с помощью лигазы. [39] Аналоги нуклеотидов помечаются фосфортиоатом, затем активные члены популяции РНК отличаются от неактивных членов, затем с неактивных членов удаляется фосфоротиоатная метка, а сайты аналогов идентифицируются с помощью гель-электрофореза и авторадиографии. [39] Это указывает на функционально важный нуклеотид, поскольку расщепление фосфортиоата йодом приводит к образованию РНК, которая расщепляется в месте вставки аналога нуклеотида. Поместив эти укороченные молекулы РНК на гель, можно идентифицировать интересующий нуклеотид в ходе эксперимента по секвенированию. [40] Результаты сайт-направленного включения указывают на важные положения, в которых при работе на геле функциональные РНК, имеющие аналог, включенный в это положение, будут иметь присутствие полосы, но если аналог приводит к нефункциональности, когда функциональные молекулы РНК выполняются на геле не будет полосы, соответствующей этому положению на геле. [41] Этот процесс можно использовать для оценки всей области, где аналоги размещаются в определенных участках сайта, отличающихся одним нуклеотидом, затем, когда функциональные РНК выделяются и обрабатываются на геле, все области, где образуются полосы, указывают на несущественные нуклеотиды. но области, где полосы отсутствуют в функциональной РНК, указывают на то, что вставка аналога нуклеотида в это положение привела к тому, что молекула РНК стала нефункциональной. [39]
Ссылки
[ редактировать ]- ^ Jump up to: а б Уикс, Кевин (2010). «Достижения в анализе структуры РНК методом химического зондирования» . Современное мнение в области структурной биологии . 20 (3): 295–304. дои : 10.1016/j.sbi.2010.04.001 . ПМК 2916962 . ПМИД 20447823 .
- ^ Фюртиг Б., Рихтер С., Вёнерт Дж., Швальбе Х. (октябрь 2003 г.). «ЯМР-спектроскопия РНК». ХимБиоХим . 4 (10): 936–62. дои : 10.1002/cbic.200300700 . ПМИД 14523911 . S2CID 33523981 .
- ^ Аддесс, Кеннет Дж.; Фейгон, Джули (1996). «Введение в 1 H-ЯМР-спектроскопия ДНК». Ин Хехт, Сидни М. (ред.). Биоорганическая химия: нуклеиновые кислоты . Нью-Йорк: Oxford University Press. ISBN. 0-19-508467-5 .
- ^ Jump up to: а б Веммер, Дэвид (2000). «Глава 5: Структура и динамика по данным ЯМР». В Блумфилде, Виктор А.; Кротерс, Дональд М.; Тиноко, Игнасио (ред.). Нуклеиновые кислоты: структура, свойства и функции . Саусалито, Калифорния: Университетские научные книги. ISBN 0-935702-49-0 .
- ^ [ ГОМАТОС П.Дж., СТОЕКЕНИУС В. ЭЛЕКТРОННО-МИКРОСКОПНЫЕ ИССЛЕДОВАНИЯ РНК РЕОВИРУСА. Труды Национальной академии наук Соединенных Штатов Америки. 1964 декабрь; 52: 1449-1455. DOI: 10.1073/pnas.52.6.1449]
- ^ [Майкл Бир и Ричард Зобель (1961) «Электронные пятна II: Электронно-микроскопические исследования видимости окрашенных молекул ДНК» J. Mol. Биол. Том 3, выпуск 6, декабрь 1961 г., страницы 717–726, IN3–IN5"]
- ^ Фрэнк, Дж; Пенчек, П; Грассуччи, Р; Шривастава, С. (ноябрь 1991 г.). «Трехмерная реконструкция рибосомы 70S Escherichia coli во льду: распределение рибосомальной РНК» . Журнал клеточной биологии . 115 (3): 597–605. дои : 10.1083/jcb.115.3.597 . ПМК 2289182 . ПМИД 1918155 .
- ^ Гопал, А; Чжоу, Чж.; Кноблер, CM; Гелбарт, WM (2012). «Визуализация больших молекул РНК в растворе» . РНК . 18 (2): 284–299. дои : 10.1261/rna.027557.111 . ПМК 3264915 . ПМИД 22190747 .
- ^ Конинг Р., Гомес-Бланко Дж., Акопьяна И. и др. Асимметричная крио-ЭМ реконструкция фага MS2 выявляет структуру генома in situ. Нац Коммун 7, 12524 (2016). https://doi.org/10.1038/ncomms12524
- ^ Дай, X.; Ли, З.; Лай, М.; и др. (2017). «Структуры генома in situ и аппарат доставки генома в одноцепочечном РНК-вирусе» . Природа . 541 (7635): 112–116. Бибкод : 2017Natur.541..112D . дои : 10.1038/nature20589 . ПМК 5701785 . ПМИД 27992877 .
- ^ Квок, Чун Кит; Тан, Инь; Ассманн, Сара; Бевилаква, Филип (апрель 2015 г.). «Структурома РНК: исследование структуры всего транскриптома с помощью секвенирования следующего поколения». Тенденции биохимических наук . 40 (4): 221–232. дои : 10.1016/j.tibs.2015.02.005 . ПМИД 25797096 .
- ^ Кубота, М; Тран, С; Спитале, Р. (2015). «Прогресс и проблемы химического исследования структуры РНК внутри живых клеток» . Химическая биология природы . 11 (12): 933–941. doi : 10.1038/nchembio.1958 . ПМК 5068366 . ПМИД 26575240 .
- ^ Мэтьюз, Д.Х.; Дисней, Мэриленд; Чайлдс, Дж. Л.; Шредер, С.Дж.; Цукер, М; Тернер Д.Х. (2004). «Включение ограничений химической модификации в алгоритм динамического программирования для прогнозирования вторичной структуры РНК» . Труды Национальной академии наук . 101 (19): 7287–7292. Бибкод : 2004PNAS..101.7287M . дои : 10.1073/pnas.0401799101 . ПМК 409911 . ПМИД 15123812 .
- ^ Зигфрид, Н; Пусан, С; Уикс, К. (2014). «Обнаружение мотива РНК с помощью SHAPE и мутационное профилирование (SHAPE-MaP)» . Природные методы . 11 (9): 959–965. дои : 10.1038/nmeth.3029 . ПМЦ 4259394 . ПМИД 25028896 .
- ^ Секстон, А; Ван, П; Рутенберг-Шенберг, М; Саймон, М (2017). «Интерпретация событий терминации и мутации обратной транскриптазы для лучшего понимания химического исследования РНК» . Биохимия . 56 (35): 4713–3721. doi : 10.1021/acs.biochem.7b00323 . ПМЦ 5648349 . ПМИД 28820243 .
- ^ Смола, М; Калабрезе, Дж; Уикс, К. (2015). «Обнаружение РНК-белковых взаимодействий в живых клетках с помощью SHAPE» . Биохимия . 54 (46): 6867–6875. doi : 10.1021/acs.biochem.5b00977 . ПМК 4900165 . ПМИД 26544910 .
- ^ Jump up to: а б с д Карадуман Р., Фабрицио П., Хартмут К., Урлауб Х., Лурманн Р. (2006). «Структура РНК и взаимодействия РНК-белок в очищенных мяРНП U6 дрожжей». Дж. Мол. Биол . 356 (5): 1248–1262. дои : 10.1016/j.jmb.2005.12.013 . hdl : 11858/00-001M-0000-0012-E5F8-4 . ПМИД 16410014 .
- ^ Туллий, Т.Д.; Домброски, бакалавр (1986). «След гидроксильного радикала: информация высокого разрешения о контактах ДНК-белка и применение к лямбда-репрессору и белку Cro» . Труды Национальной академии наук . 83 (15): 5469–5473. Бибкод : 1986PNAS...83.5469T . дои : 10.1073/pnas.83.15.5469 . ПМЦ 386308 . ПМИД 3090544 .
- ^ Jump up to: а б Тиджерина П., Мор С., Рассел Р. (2007). «DMS-следы структурированных РНК и комплексов РНК-белок» . Нат Проток . 2 (10): 2608–23. дои : 10.1038/nprot.2007.380 . ПМК 2701642 . ПМИД 17948004 .
- ^ Зубрадт, Меган; Гупта, Паромита; Персад, Ситара; Ламбовиц, Алан; Вайсман, Джонатан; Рускин, Сильви (2017). «DMS-MaPseq для полногеномного или целевого исследования структуры РНК in vivo» . Природные методы . 14 (1): 75–82. дои : 10.1038/nmeth.4057 . ПМК 5508988 . ПМИД 27819661 .
- ^ Альберт С. Болдуин младший; Марджори Эттингер и Кевин Струл (1996). «Блок 12.3: Анализы метилирования и взаимодействия урацилов для анализа взаимодействий белок-ДНК». Современные протоколы молекулярной биологии . Том. Глава 12. Уайли. стр. Раздел 12.3. дои : 10.1002/0471142727.mb1203s36 . ПМИД 18265086 . S2CID 45581978 .
- ^ Мортимер С.А., Уикс К.М. (2007). «Быстродействующий реагент для точного анализа вторичной и третичной структуры РНК методом SHAPE Chemistry». J Am Chem Soc . 129 (14): 4144–45. дои : 10.1021/ja0704028 . ПМИД 17367143 .
- ^ Мерино Э.Дж., Уилкинсон К.А., Кофлан Дж.Л., Уикс К.М. (2005). «Анализ структуры РНК с разрешением в один нуклеотид путем селективного 2'-гидроксила ацилирования и удлинения праймера (SHAPE)». J Am Chem Soc . 127 (12): 4223–31. дои : 10.1021/ja043822v . ПМИД 15783204 .
- ^ Дейган К.Е., Ли Т.В., Мэтьюз Д.Х., Уикс К.М. (2009). «Точное определение структуры РНК, направленное на SHAPE» . Proc Natl Acad Sci США . 106 (1): 97–102. Бибкод : 2009PNAS..106...97D . дои : 10.1073/pnas.0806929106 . ПМК 2629221 . ПМИД 19109441 .
- ^ Уоттс Дж. М., Данг К. К., Горелик Р. Дж., Леонард К. В., Бесс Дж. В. Младшая, Суонстром Р., Берч К. Л., Уикс К. М. (2009). «Архитектура и вторичная структура всего генома РНК ВИЧ-1» . Природа . 460 (7256): 711–6. Бибкод : 2009Natur.460..711W . дои : 10.1038/nature08237 . ПМЦ 2724670 . ПМИД 19661910 .
- ^ Випапат Кладванг; Кристофер К. ВанЛанг; Пабло Кордеро; Риджу Дас (7 сентября 2011 г.). «Понимание ошибок моделирования структуры РНК, направленного на SHAPE» . Биохимия . 50 (37): 8049–8056. arXiv : 1103.5458 . Бибкод : 2011arXiv1103.5458K . дои : 10.1021/bi200524n . ПМЦ 3172344 . ПМИД 21842868 .
- ^ Лакс Дж.Б., Мортимер С.А., Трапнелл С., Луо С., Авиран С., Шрот Г.П., Пахтер Л. , Дудна Дж.А., Аркин А.П. (2011). «Характеристика структуры мультиплексной РНК с селективным 2'-гидроксильным ацилированием, анализируемым с помощью секвенирования удлинения праймера (SHAPE-Seq)» . Proc Natl Acad Sci США . 108 (27): 11063–8. Бибкод : 2011PNAS..10811063L . дои : 10.1073/pnas.1106501108 . ПМЦ 3131332 . ПМИД 21642531 .
- ^ Jump up to: а б Ван, П.Ю.; Секстон, Ан; Каллиган, WJ; Саймон, доктор медицины (2019). «Карбодиимидные реагенты для химического зондирования структуры РНК в клетках» . РНК . 25 (1): 135–146. дои : 10.1261/rna.067561.118 . ПМК 6298570 . ПМИД 30389828 .
- ^ Фриц Дж. Дж., Левин А., Хаусвирт В., Агарвал А., Грант М., Шоу Л. (2002). «Разработка рибозимов типа «головка молотка» для модуляции экспрессии эндогенных генов для функциональных исследований». Методы . 28 (2): 276–285. дои : 10.1016/S1046-2023(02)00233-5 . ПМИД 12413427 .
- ^ Мец, Д; Браун, Дж. (1969). «Исследование вторичной структуры нуклеиновой кислоты путем химической модификации карбодиимидным реагентом. II. Реакция между N-циклогексил-N'-β-(4-метилморфолиний)этилкарбодиимидом и переносной рибонуклеиновой кислотой». Биохимия . 8 (6): 2329–2342. дои : 10.1021/bi00834a013 . ПМИД 4895018 .
- ^ Инкарнато, Д; Нери, Ф; Ансельми, Ф; Оливьеро, С (2014). «Полногеномное профилирование вторичных структур РНК мыши выявляет ключевые особенности транскриптома млекопитающих» . Геномная биология . 15 (491): 491. doi : 10.1186/s13059-014-0491-2 . ПМК 4220049 . ПМИД 25323333 .
- ^ Митчелл, Д; Ренда, А; Даудс, К; Бабицке, П; Ассманн, С; Бевилаква, П. (2019). «Структурное исследование РНК in vivo спаривания оснований урацила и гуанина с помощью 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC)» . РНК . 25 (1): 147–157. дои : 10.1261/rna.067868.118 . ПМК 6298566 . ПМИД 30341176 .
- ^ Ноллер Х.Ф., Чайрес Дж.Б. (1972). «Функциональная модификация 16S рибосомальной РНК кетоксалем» . Учеб. Натл. акад. наук. США . 69 (11): 3115–3118. Бибкод : 1972PNAS...69.3115N . дои : 10.1073/pnas.69.11.3115 . ПМК 389716 . ПМИД 4564202 .
- ^ Jump up to: а б Митчелл, Д; Ричи, Л; Парк, Х; Бабицке, П; Ассманн, С; Бевилаква, П. (2018). «Глиоксали как структурные зонды РНК in vivo для спаривания оснований гуанина» . РНК . 24 (1): 114–124. дои : 10.1261/rna.064014.117 . ПМК 5733565 . ПМИД 29030489 .
- ^ Литт, М; Хэнкок, В. (1967). «Кетоксал — потенциально полезный реагент для определения нуклеотидных последовательностей в одноцепочечных участках транспортной рибонуклеиновой кислоты». Биохимия . 6 (6): 1848–1854. дои : 10.1021/bi00858a036 . ПМИД 6035923 .
- ^ Фэн С., Чан Д., Джозеф Дж., Мууронен М., Колдрен В.Х., Дай Н., Корреа-младший И.Р., Фурче Ф., Хадад С.М., Спитале Р.К. (2018). «Светоактивируемое химическое исследование доступности растворителя нуклеиновых оснований внутри клеток» . Nat Chem Biol . 14 (3): 276–283. дои : 10.1038/nchembio.2548 . ПМК 6203945 . ПМИД 29334380 .
- ^ Jump up to: а б Мюльбахер Дж., Лафонтен Д.А. (2007). «Детерминанты распознавания лигандов гуаниновых рибопереключателей» . Исследования нуклеиновых кислот . 35 (16): 5568–5580. дои : 10.1093/нар/gkm572 . ПМК 2018637 . ПМИД 17704135 .
- ^ Jump up to: а б с Регульский, Э; Брейкер, Р. (2008). «Линейный зондовый анализ рибопереключателей». В Вилуш, Дж (ред.). Посттранскрипционная регуляция генов . Методы молекулярной биологии. Том. 419. Тотова, Нью-Джерси: Humana Press. стр. 53–67. дои : 10.1007/978-1-59745-033-1_4 . ISBN 978-1-58829-783-9 . ПМИД 18369975 .
- ^ Jump up to: а б с д Райдер С.П., Стробель С.А. (1999). «Картирование аналоговых интерференций нуклеотидов» . Методы . 18 (1): 38–50. дои : 10.1006/meth.1999.0755 . ПМИД 10208815 .
- ^ Jump up to: а б Вальдсих С. (2008). «Раскрытие сворачивания РНК с помощью интерференционного картирования аналогов нуклеотидов (NAIM)» . Протоколы природы . 3 (5): 811–823. дои : 10.1038/nprot.2008.45 . ПМЦ 2873565 . ПМИД 18451789 .
- ^ Стробель С.А., Шетти К. (1997). «Определение химических групп, необходимых для функции интрона группы I тетрахимены, путем интерференционного картирования аналогов нуклеотидов» . Учеб. Натл. акад. наук. США . 94 (7): 2903–2908. Бибкод : 1997PNAS...94.2903S . дои : 10.1073/pnas.94.7.2903 . ЧВК 20295 . ПМИД 9096319 .