Криогенная электронная микроскопия
Было предложено электронную криомикроскопию объединить трансмиссионную в эту статью. ( Обсудить ) Предлагается с июля 2024 г. |

Криогенная электронная микроскопия ( криоЭМ ) — это метод криомикроскопии, применяемый к образцам, охлажденным до криогенных температур. Для биологических образцов структура сохраняется путем помещения в среду стекловидного льда . Водный раствор образца наносится на сетку и замораживается погружением в жидкий этан или смесь жидкого этана и пропана . [ 1 ] Хотя разработка этого метода началась в 1970-х годах, последние достижения в области детекторных технологий и алгоритмов программного обеспечения позволили определять биомолекулярные структуры с разрешением, близким к атомному. [ 2 ] Это привлекло широкое внимание к этому подходу как альтернативе рентгеновской кристаллографии или ЯМР-спектроскопии для определения структуры макромолекул без необходимости кристаллизации. [ 3 ]
В 2017 году Нобелевская премия по химии была присуждена Жаку Дюбоше , Иоахиму Франку и Ричарду Хендерсону «за разработку криоэлектронной микроскопии для определения структуры биомолекул в растворе с высоким разрешением». [ 4 ] Компания Nature Methods также назвала крио-ЭМ «методом года» в 2015 году. [ 5 ]
История
[ редактировать ]Раннее развитие
[ редактировать ]В 1960-е годы использование просвечивающей электронной микроскопии для определения структуры было ограничено из-за радиационного повреждения пучками электронов высокой энергии. Ученые предположили, что исследование образцов при низких температурах уменьшит радиационные повреждения, вызванные лучом. [ 6 ] И жидкий гелий (-269 ° C , или 4 K , или -452,2 ° F ), и жидкий азот (-195,79 ° C, или 77 K, или -320 ° F) считались криогенами. В 1980 году Эрвин Кнапек и Жак Дюбоше опубликовали комментарии о повреждении пучка при криогенных температурах, поделившись наблюдениями о том, что:
Было обнаружено, что тонкие кристаллы, закрепленные на углеродной пленке, в 30–300 раз более устойчивы к лучу при 4 К, чем при комнатной температуре... Большую часть наших результатов можно объяснить, предположив, что криозащита в области 4 К сильно зависит от температура. [ 7 ]
Однако эти результаты не удалось воспроизвести, и всего два года спустя в журнале Nature были опубликованы поправки , в которых сообщалось, что сопротивление луча было менее значительным, чем первоначально предполагалось. Защита, полученная при 4 К, была ближе к «десятикратной для стандартных образцов L- валина ». [ 8 ] чем было заявлено ранее.
В 1981 году Аласдер МакДауэлл и Жак Дюбоше, ученые из Европейской лаборатории молекулярной биологии , сообщили о первом успешном внедрении крио-ЭМ. [ 9 ] Макдауэлл и Дюбоше остекловали чистую воду в виде тонкой пленки, распылив ее на гидрофильную углеродную пленку, которую быстро погрузили в криоген (жидкий пропан или жидкий этан, охлажденный до 77 К). Тонкий слой аморфного льда имел толщину менее 1 мкм, и электронограмма подтвердила наличие аморфного/стекловидного льда. В 1984 году группа Дюбоше продемонстрировала возможности крио-ЭМ в структурной биологии с анализом витрифицированного аденовируса типа 2, бактериофага Т4 , вируса леса Семлики , бактериофага CbK и вируса везикулярного стоматита . [ 10 ]
Последние достижения
[ редактировать ]2010-е годы ознаменовались резким развитием электронных камер. Примечательно, что усовершенствования детекторов прямых электронов привели к «революции разрешения». [ 11 ] сдвигая барьер разрешения ниже критического предела ~ 2-3 Å для определения положения и ориентации аминокислот. [ 12 ]
Хендерсон ( Лаборатория молекулярной биологии MRC , Кембридж, Великобритания) сформировал консорциум с инженерами лаборатории Резерфорда Эпплтона и учеными Общества Макса Планка для финансирования и разработки первого прототипа. Затем консорциум объединил усилия с производителем электронных микроскопов FEI, чтобы представить и продать новую конструкцию. Примерно в то же время компания Gatan Inc. из Плезантона, Калифорния, представила аналогичный детектор, разработанный Питером Денесом ( Национальная лаборатория Лоуренса Беркли ) и Дэвидом Агардом ( Калифорнийский университет, Сан-Франциско ). Третий тип камеры был разработан Нгуеном-Хуу Сюонгом в компании Direct Electron ( Сан-Диего, Калифорния ). [ 11 ]
В последнее время достижения в использовании каркасов для визуализации на основе белков помогают решить проблемы смещения ориентации образца и ограничения размера. Белки размером менее ~50 кДа обычно имеют недостаточное соотношение сигнал/шум для разрешения белковых частиц на изображении, что затрудняет или делает невозможным трехмерную реконструкцию. [ 13 ] Каркасы для визуализации повышают SNR более мелких белков, связывая их с более крупным объектом — каркасом. Группа Йейтса из Калифорнийского университета в Лос-Анджелесе смогла создать более четкое изображение трех вариантов KRAS (размером примерно 19 кДа), используя жесткий каркас для визуализации и используя DARPins в качестве модульного связывающего домена между каркасом и интересующим белком. [ 14 ]
Нобелевская премия по химии 2017 г.
[ редактировать ]В знак признания влияния крио-ЭМ на биохимию трое учёных, Жак Дюбоше , Иоахим Франк и Ричард Хендерсон , были удостоены Нобелевской премии по химии «за разработку криоэлектронной микроскопии для определения структуры биомолекул в растворе с высоким разрешением». ." [ 4 ]
Сравнение с рентгеновской кристаллографией
[ редактировать ]Традиционно рентгеновская кристаллография была самым популярным методом определения трехмерных структур биологических молекул. [ 15 ] Однако вышеупомянутые усовершенствования крио-ЭМ увеличили ее популярность как инструмента для изучения деталей биологических молекул. С 2010 года ежегодные депозиты крио-ЭМ структур опередили рентгеновскую кристаллографию. [ 16 ] Хотя рентгеновская кристаллография имеет значительно больше общих месторождений из-за более длительной истории, общее количество месторождений этих двух методов, по прогнозам, затмит около 2035 года. [ 16 ]
Разрешение рентгеновской кристаллографии ограничено однородностью кристалла. [ 17 ] а приведение биологических молекул с неизвестными идеальными условиями кристаллизации в кристаллическое состояние может занять очень много времени, в крайних случаях — месяцы или даже годы. [ 18 ] Напротив, подготовка проб с помощью крио-ЭМ может потребовать нескольких раундов скрининга и оптимизации для преодоления таких проблем, как агрегация белков и предпочтительная ориентация. [ 19 ] [ 20 ] но для этого не требуется, чтобы образец сформировал кристалл, а образцы для крио-ЭМ подвергаются мгновенной заморозке и исследуются в их почти нативном состоянии. [ 21 ]
По данным Proteopedia , среднее разрешение, достигнутое с помощью рентгеновской кристаллографии (по состоянию на 19 мая 2019 года) в банке данных белков, составляет 2,05 Å . [ 17 ] а самое высокое зарегистрированное разрешение (по состоянию на 30 сентября 2022 г.) составляет 0,48 Å. [ 22 ] По состоянию на 2020 год большинство белковых структур, определенных с помощью криоЭМ, имеют более низкое разрешение - 3–4 Å. [ 23 ] Однако по состоянию на 2020 год лучшее разрешение крио-ЭМ было зафиксировано при 1,22 Å. [ 20 ] в некоторых случаях это делает его конкурентом по разрешению.
Коррелятивный световой крио-ТЭМ и крио-ЭТ.
[ редактировать ]В 2019 году корреляционные световые крио-ПЭМ и крио-ЭТ были использованы для наблюдения туннелирующих нанотрубок (ТНТ) в нейрональных клетках. [ 24 ]
Сканирующая электронная криомикроскопия
[ редактировать ]Сканирующая электронная криомикроскопия (криоСЭМ) — это метод сканирующей электронной микроскопии с использованием холодного столика сканирующего электронного микроскопа в криогенной камере.
Криогенная трансмиссионная электронная микроскопия
[ редактировать ]Криогенная трансмиссионная электронная микроскопия (крио-ТЕМ) — это метод трансмиссионной электронной микроскопии , который используется в структурной биологии и материаловедении . В просторечии термин «криогенная электронная микроскопия» или его сокращение «крио-ЭМ» по умолчанию относится к криогенной трансмиссионной электронной микроскопии, поскольку подавляющее большинство крио-ЭМ выполняется в трансмиссионных электронных микроскопах, а не в сканирующих электронных микроскопах.
Центры
[ редактировать ]Федеральный технологический институт , Лозаннский университет и Женевский университет открыли Центр визуализации Дюбоше (DCI) в конце ноября 2021 года с целью применения и дальнейшего развития крио-ЭМ. [ 25 ] Менее чем через месяц после первой идентификации варианта Омикрон SARS-CoV-2 исследователи из DCI смогли определить его структуру, выявить важные мутации, позволяющие обойти отдельные вакцины, и дать представление о новых терапевтических подходах. [ 26 ]
Датский национальный крио-ЭМ центр, также известный как EMBION, был открыт 1 декабря 2016 года. EMBION — это крио-ЭМ консорциум датских университетов (принимающий Орхусский университет и соучредитель Копенгагенского университета).

Расширенные методы
[ редактировать ]- Криогенная электронная томография (крио-ЭТ) — специализированное приложение, при котором делается множество изображений отдельных образцов под разными углами наклона, в результате чего получается трехмерная реконструкция одного образца. [ 27 ]
- Электронная кристаллография , метод определения расположения атомов в твердых телах с помощью ПЭМ.
- МикроЭД , [ 28 ] метод определения структуры белков , пептидов , органических молекул и неорганических соединений с помощью дифракции электронов на 3D-кристаллах. [ 29 ] [ 30 ] [ 31 ]
- Крио-ЭМ анализ одиночных частиц — метод усреднения для определения структуры белка из монодисперсных образцов. [ 32 ]
-
Структура алкогольоксидазы Pichia Pastoris методом Cryo-EM
-
Крио-ЭМ изображение интактной клетки ARMAN из биопленки Iron Mountain. Ширина изображения 576 нм.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Тивол В.Ф., Бригель А., Дженсен Г.Дж. (октябрь 2008 г.). «Улучшенный криоген для погружной заморозки» . Микроскопия и микроанализ . 14 (5): 375–379. Бибкод : 2008MiMic..14..375T . дои : 10.1017/S1431927608080781 . ПМК 3058946 . ПМИД 18793481 .
- ^ Ченг Ю., Григорьев Н., Пенчек П.А., Уолц Т. (апрель 2015 г.). «Букварь к одночастичной криоэлектронной микроскопии» . Клетка . 161 (3): 438–449. дои : 10.1016/j.cell.2015.03.050 . ПМЦ 4409659 . ПМИД 25910204 .
- ^ Стоддарт С. (1 марта 2022 г.). «Структурная биология: как белки оказались крупным планом» . Знающий журнал . doi : 10.1146/knowable-022822-1 . S2CID 247206999 . Проверено 25 марта 2022 г.
- ^ Перейти обратно: а б «Нобелевская премия по химии 2017» . NobelPrize.org . Проверено 30 сентября 2022 г.
- ^ Дорр А. (январь 2017 г.). «Криоэлектронная томография». Природные методы . 14 (1): 34. doi : 10.1038/nmeth.4115 . ISSN 1548-7091 . S2CID 27162203 .
- ^ Дубочет Дж., Кнапек Э. (апрель 2018 г.). «Взлёты и падения ранней электронной криомикроскопии» . ПЛОС Биология . 16 (4): e2005550. doi : 10.1371/journal.pbio.2005550 . ПМЦ 5929567 . ПМИД 29672565 .
- ^ Кнапек Э., Дубочет Дж (август 1980 г.). «Лучевое повреждение органического материала значительно снижается при криоэлектронной микроскопии». Журнал молекулярной биологии . 141 (2): 147–161. дои : 10.1016/0022-2836(80)90382-4 . ПМИД 7441748 .
- ^ Ньюмарк П. (30 сентября 1982 г.). «Криотрансмиссионная микроскопия. Угасающие надежды» . Природа . 299 (5882): 386–387. Бибкод : 1982Natur.299..386N . дои : 10.1038/299386c0 .
- ^ Дубоше Дж., МакДауэлл А.В. (декабрь 1981 г.). «Витрификация чистой воды для электронной микроскопии» . Журнал микроскопии . 124 (3): 3–4. дои : 10.1111/j.1365-2818.1981.tb02483.x .
- ^ Адриан М., Дюбоше Дж., Лепо Дж., Макдауэлл А.В. (март 1984 г.). «Криоэлектронная микроскопия вирусов» . Природа . 308 (5954): 32–36. Бибкод : 1984Natur.308...32A . дои : 10.1038/308032a0 . ПМИД 6322001 . S2CID 4319199 .
- ^ Перейти обратно: а б Кюльбрандт, Вернер (28 марта 2014 г.). «Революция разрешения» . Наука . 343 (6178): 1443–1444. Бибкод : 2014Sci...343.1443K . дои : 10.1126/science.1251652 . ISSN 0036-8075 . ПМИД 24675944 . S2CID 35524447 .
- ^ Кастер, Дэниел Дж.; Лю, Чэнъюй; Фан, Чжэн; Подумайте, Джей В.; Маршалл, Гарланд Р. (20 апреля 2015 г.). «Кристаллические структуры белковых спиралей высокого разрешения, согласованные с трехцентровыми водородными связями, и мультипольная электростатика» . ПЛОС ОДИН . 10 (4): e0123146. Бибкод : 2015PLoSO..1023146K . дои : 10.1371/journal.pone.0123146 . ISSN 1932-6203 . ПМК 4403875 . ПМИД 25894612 .
- ^ Герзик, Марк А.; Ву, Мэнъюй; Ландер, Габриэль К. (04 марта 2019 г.). «Определение структуры комплексов с массой менее 100 кДа с высоким разрешением с использованием традиционной криоЭМ» . Природные коммуникации . 10 (1): 1032. Бибкод : 2019NatCo..10.1032H . дои : 10.1038/s41467-019-08991-8 . ISSN 2041-1723 . ПМК 6399227 . ПМИД 30833564 .
- ^ Кастельс-Граэллс Р., Мидор К., Арбинг М.А., Савайя М.Р., Джи М., Касио Д. и др. (сентябрь 2023 г.). «Крио-ЭМ определение структуры небольших терапевтических белковых мишеней с разрешением 3 Å с использованием жесткого каркаса для визуализации» . Труды Национальной академии наук Соединенных Штатов Америки . 120 (37): e2305494120. Бибкод : 2023PNAS..12005494C . дои : 10.1073/pnas.2305494120 . ПМК 10500258 . PMID 37669364 .
- ^ Смит М.С., Мартин Дж.Х. (февраль 2000 г.). «рентгеновская кристаллография» . Молекулярная патология . 53 (1): 8–14. дои : 10.1136/mp.53.1.8 . ПМЦ 1186895 . ПМИД 10884915 .
- ^ Перейти обратно: а б Чиу, Вау; Шмид, Майкл Ф.; Пинтилие, Григоре Д.; Лоусон, Кэтрин Л. (январь 2021 г.). «Эволюция стандартизации и распространение крио-ЭМ структур и данных совместно сообществом, PDB и EMDB» . Журнал биологической химии . 296 : 100560. doi : 10.1016/j.jbc.2021.100560 . ISSN 0021-9258 . ПМК 8050867 . ПМИД 33744287 .
- ^ Перейти обратно: а б «Разрешение — Протеопедия, жизнь в 3D» . сайт proteopedia.org . Проверено 27 октября 2020 г.
- ^ Каллауэй Э (февраль 2020 г.). «Революционная криоЭМ захватывает структурную биологию» . Природа . 578 (7794): 201. Бибкод : 2020Natur.578..201C . дои : 10.1038/d41586-020-00341-9 . ПМИД 32047310 .
- ^ Люмкис, Дмитрий (29 марта 2019 г.). «Проблемы и возможности криоЭМ одночастичного анализа» . Журнал биологической химии . 294 (13): 5181–5197. дои : 10.1074/jbc.rev118.005602 . ISSN 0021-9258 . ПМК 6442032 . ПМИД 30804214 .
- ^ Перейти обратно: а б Накане Т., Котеча А., Сенте А., Макмаллан Г., Масиулис С., Браун П.М. и др. (ноябрь 2020 г.). «Одночастичная криоЭМ атомного разрешения» . Природа . 587 (7832): 152–156. Бибкод : 2020Natur.587..152N . дои : 10.1038/s41586-020-2829-0 . ПМК 7611073 . ПМИД 33087931 .
- ^ Ван Х.В., Ван Дж.В. (январь 2017 г.). «Как криоэлектронная микроскопия и рентгеновская кристаллография дополняют друг друга» . Белковая наука . 26 (1): 32–39. дои : 10.1002/pro.3022 . ПМК 5192981 . ПМИД 27543495 .
- ^ Шмидт А., Титер М., Векерт Э., Ламзин В.С. (апрель 2011 г.). «Кристаллическая структура небольшого белка крамбина с разрешением 0,48 Å» . Акта Кристаллографика. Раздел F. Структурная биология и кристаллизационные связи . 67 (Часть 4): 424–428. дои : 10.1107/S1744309110052607 . ПМК 3080141 . ПМИД 21505232 .
- ^ Йип К.М., Фишер Н., Пакния Э., Чари А., Старк Х. (ноябрь 2020 г.). «Определение структуры белка с атомным разрешением методом криоЭМ». Природа . 587 (7832): 157–161. Бибкод : 2020Natur.587..157Y . дои : 10.1038/s41586-020-2833-4 . ПМИД 33087927 . S2CID 224823207 .
- ^ Сартори-Рупп А., Кордеро Сервантес Д., Пепе А., Гуссе К., Делаж Е., Корройер-Дульмонт С. и др. (январь 2019 г.). «Корреляционная криоэлектронная микроскопия выявляет структуру ТНТ в нейрональных клетках» . Природные коммуникации . 10 (1): 342. Бибкод : 2019NatCo..10..342S . дои : 10.1038/s41467-018-08178-7 . ПМК 6341166 . ПМИД 30664666 .
- ^ «Открытие Центра визуализации Дубоше (DCI) в кампусах UNIGE, UNIL и EPFL» . unige.ch . 30 ноября 2021 г. Проверено 30 апреля 2022 г.
- ^ «Ученые раскрывают тайны варианта Омикрона с помощью микроскопов» . Swissinfo.ch . 30 декабря 2021 г. Проверено 30 апреля 2022 г.
- ^ Бауэрляйн, Феликс Дж.Б.; Баумайстер, Вольфганг (01 октября 2021 г.). «На пути к визуальной протеомике в высоком разрешении» . Журнал молекулярной биологии . От последовательности белка к структуре на сверхскорости: как альфафолд влияет на биологию. 433 (20): 167187. doi : 10.1016/j.jmb.2021.167187 . ISSN 0022-2836 . ПМИД 34384780 .
- ^ Нанненга Б.Л., Ши Д., Лесли А.Г., Гонен Т. (сентябрь 2014 г.). «Определение структуры высокого разрешения путем сбора данных непрерывного вращения в MicroED» . Природные методы . 11 (9): 927–930. дои : 10.1038/nmeth.3043 . ПМК 4149488 . ПМИД 25086503 .
- ^ Джонс К.Г., Мартинович М.В., Хаттне Дж., Фултон Т.Дж., Штольц Б.М., Родригес Дж.А. и др. (ноябрь 2018 г.). «КриоЭМ-метод MicroED как мощный инструмент для определения структуры малых молекул» . Центральная научная служба ACS . 4 (11): 1587–1592. дои : 10.1021/accentsci.8b00760 . ПМК 6276044 . ПМИД 30555912 .
- ^ де ла Круз М.Дж., Хаттне Дж., Ши Д., Зейдлер П., Родригес Дж., Рейес Ф.Е. и др. (февраль 2017 г.). «Структуры атомного разрешения из фрагментированных белковых кристаллов криоЭМ-методом MicroED» . Природные методы . 14 (4): 399–402. дои : 10.1038/nmeth.4178 . ПМК 5376236 . ПМИД 28192420 .
- ^ Грюен Т., Веннмахер Дж.Т., Заубицер С., Гольштейн Дж.Дж., Хайдлер Дж., Фекто-Лефевр А. и др. (декабрь 2018 г.). «Быстрое определение структуры микрокристаллических молекулярных соединений методом электронной дифракции» . Ангеванде Хеми . 57 (50): 16313–16317. дои : 10.1002/anie.201811318 . ПМК 6468266 . ПМИД 30325568 .
- ^ Ченг Ю (август 2018 г.). «Одночастичная крио-ЭМ-Как она сюда попала и куда пойдет» . Наука . 361 (6405): 876–880. Бибкод : 2018Sci...361..876C . дои : 10.1126/science.aat4346 . ПМК 6460916 . ПМИД 30166484 .
- ^ Сяо К., Фишер М.Г., Болотауло Д.М., Уллоа-Рондо Н., Авила Г.А. и Саттл, Калифорния (2017) «Крио-ЭМ-реконструкция капсида вируса Cafeteria roenbergensis предполагает новый путь сборки гигантских вирусов. ". Научные отчеты , 7 : 5484. doi : 10.1038/s41598-017-05824-w .

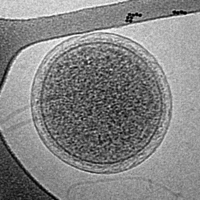
![Крио-ЭМ изображение гигантского морского вируса CroV (масштабная линейка 200 нм)[33]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/CroV_TEM_%28cropped%29.jpg/200px-CroV_TEM_%28cropped%29.jpg)