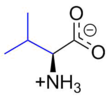
Валин
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Валин | |||
| Другие имена 2-амино-3-метилбутановая кислота 2-аминоизовалериановая кислота Валиновая кислота | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ |
| ||
| ЧЕМБЛ |
| ||
| ХимическийПаук | |||
| Лекарственный Банк |
| ||
| Информационная карта ECHA | 100.000.703 | ||
| Номер ЕС |
| ||
| |||
| КЕГГ |
| ||
ПабХим CID | |||
| НЕКОТОРЫЙ |
| ||
Панель управления CompTox ( EPA ) | |||
| Характеристики [3] | |||
| С 5 Н 11 Н О 2 | |||
| Молярная масса | 117.148 g·mol −1 | ||
| Плотность | 1,316 г/см 3 | ||
| Температура плавления | 298 ° C (568 ° F, 571 К) (разложение) | ||
| растворим, 85 г/л [1] | |||
| Кислотность ( pKa ) | 2,32 (карбоксил), 9,62 (амино) [2] | ||
| -74.3·10 −6 см 3 /моль | |||
| Страница дополнительных данных | |||
| Валин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Валин (символ Val или V ) [4] представляет собой α- аминокислоту , которая используется в биосинтезе белков. Он содержит α- аминогруппу (которая находится в протонированном состоянии −NH 3 + образуются в биологических условиях), группа α-карбоновой кислоты (которая находится в депротонированном состоянии −COO − образуются в биологических условиях) и изопропильную группу боковой цепи , что делает ее неполярной алифатической аминокислотой. Валин необходим человеку, то есть организм не может его синтезировать; его необходимо получать из пищевых источников, которые представляют собой продукты, содержащие белки , такие как мясо, молочные продукты, соевые продукты, фасоль и бобовые. Он кодируется всеми кодонами, начинающимися с GU (GUU, GUC, GUA и GUG).
История и этимология
[ редактировать ]Валин был впервые выделен из казеина в 1901 году Германом Эмилем Фишером . [5] Название валин происходит от его структурного сходства с валериановой кислотой , которая, в свою очередь, названа в честь растения валериана из-за присутствия кислоты в корнях растения. [6] [7]
Номенклатура
[ редактировать ]Согласно ИЮПАК , атомы углерода, образующие валин, нумеруются последовательно, начиная с 1, обозначающей карбоксильный углерод, тогда как 4 и 4' обозначают два концевых метильных углерода. [8]
Метаболизм
[ редактировать ]Источник и биосинтез
[ редактировать ]Валин, как и другие аминокислоты с разветвленной цепью, синтезируется бактериями и растениями, но не животными. [9] Следовательно, это незаменимая аминокислота для животных, и она должна присутствовать в рационе. Взрослым людям требуется около 24 мг/кг массы тела в день. [10] Он синтезируется в растениях и бактериях в несколько этапов, начиная с пировиноградной кислоты . Начальная часть пути также ведет к лейцину . Промежуточный α-кетоизовалерат восстановительному аминированию глутаматом подвергается . Ферменты, участвующие в этом биосинтезе, включают: [11]
- Ацетолактатсинтаза (также известная как синтаза ацетогидроксикислот)
- Изомередуктаза ацетогидроксикислоты
- Дегидратаза дигидроксикислот
- Валинаминотрансфераза
Деградация
[ редактировать ]Как и в случае других аминокислот с разветвленной цепью, катаболизм валина начинается с удаления аминогруппы путем трансаминирования с образованием альфа-кетоизовалерата , альфа -кетокислоты , которая превращается в изобутирил-КоА посредством окислительного декарбоксилирования аминокислотой с α- разветвленной цепью. -кетокислотдегидрогеназный комплекс . [12] Далее он окисляется и перегруппировывается в сукцинил-КоА , который может вступать в цикл лимонной кислоты .
Синтез
[ редактировать ]Рацемический валин можно синтезировать бромированием изовалериановой кислоты с последующим аминированием α-бромпроизводного. [13]
- HO 2 CCH 2 CH(CH 3 ) 2 + Br 2 → HO 2 CCHBrCH(CH 3 ) 2 + HBr
- HO 2 CCHBrCH(CH 3 ) 2 + 2 NH 3 → HO 2 CCH(NH 2 )CH(CH 3 ) 2 + NH 4 Br
Медицинское значение
[ редактировать ]Метаболические заболевания
[ редактировать ]Деградация валина нарушается при следующих метаболических заболеваниях :
- Комбинированная малоновая и метилмалоновая ацидурия (СМАММА)
- Болезнь мочи кленового сиропа (MSUD)
- Метилмалоновая ацидемия
- Пропионовая ацидемия
Инсулинорезистентность
[ редактировать ]Более низкие уровни валина в сыворотке, как и других аминокислот с разветвленной цепью, связаны с потерей веса и снижением резистентности к инсулину : более высокие уровни валина наблюдаются в крови мышей, крыс и людей с диабетом. [14] У мышей, которых кормили диетой, лишенной BCAA, в течение одного дня, улучшилась чувствительность к инсулину, а кормление диетой, лишенной валина, в течение одной недели значительно снижает уровень глюкозы в крови. [15] У мышей с ожирением и резистентностью к инсулину, вызванных диетой, диета со сниженным уровнем валина и других аминокислот с разветвленной цепью привела к быстрому обращению вспять ожирения и улучшению контроля уровня глюкозы. [16] Катаболит валина 3-гидроксиизобутират способствует резистентности к инсулину у мышей, стимулируя поглощение жирных кислот в мышцах и накопление липидов. [17] У мышей диета с ограничением BCAA снизила уровень глюкозы в крови натощак и улучшила состав тела. [18]
Гемопоэтические стволовые клетки
[ редактировать ]Диетический валин необходим для гемопоэтических стволовых клеток (ГСК), как показали эксперименты на мышах. самообновления [19] Диетическое ограничение валина избирательно истощает долговременно репопуляционные HSC в костном мозге мышей. Успешная трансплантация стволовых клеток была достигнута у мышей без облучения через 3 недели диеты с ограничением валина. Долгосрочная выживаемость трансплантированных мышей была достигнута, когда валин постепенно возвращался в рацион в течение 2-недельного периода, чтобы избежать синдрома повторного кормления .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Физико-химическая информация» . эмдмиллипор. 2022 . Проверено 17 ноября 2022 г.
- ^ Доусон Р.М., Эллиотт Д.К., Эллиотт У.Х., Джонс К.М., ред. (1959). Данные для биохимических исследований . Оксфорд: Кларендон Пресс. ASIN B000S6TFHA . OCLC 859821178 .
- ^ Западный RC, изд. (1981). Справочник CRC по химии и физике (62-е изд.). Бока-Ратон, Флорида: CRC Press. п. С-569. ISBN 0-8493-0462-8 .
- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 г.
- ^ «Валин» . Британская онлайн-энциклопедия . Проверено 6 декабря 2015 г.
- ^ «Валин» . Интернет-словарь Мерриам-Вебстера . Проверено 6 декабря 2015 г.
- ^ «Валериановая кислота» . Интернет-словарь Мерриам-Вебстера . Проверено 6 декабря 2015 г.
- ^ Джонс Дж. Х., изд. (1985). Аминокислоты, пептиды и белки . Специализированные периодические отчеты. Том. 16. Лондон: Королевское химическое общество . п. 389. ИСБН 978-0-85186-144-9 .
- ^ Басучаудхури П. (2016). Азотистый обмен в рисе . Бока-Ратон, Флорида: CRC Press. п. 159. ИСБН 978-1-4987-4668-7 . OCLC 945482059 .
- ^ Медицинский институт (2002). «Белки и аминокислоты» . Справочная норма потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот . Вашингтон, округ Колумбия: Издательство национальных академий. стр. 589–768. дои : 10.17226/10490 . ISBN 978-0-309-08537-3 .
- ^ Ленинджер, Альберт Л.; Нельсон, Дэвид Л.; Кокс, Майкл М. (2000). Принципы биохимии (3-е изд.). Нью-Йорк: WH Freeman. ISBN 1-57259-153-6 . .
- ^ Мэтьюз К.К. (2000). Биохимия . Ван Хольде, К.Е., Ахерн, Кевин Г. (3-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. п. 776. ИСБН 978-0-8053-3066-3 . OCLC 42290721 .
- ^ Марвел CS (1940). « дл -Валин» . Органические синтезы . 20 :106 ; Сборник томов , т. 3, с. 848 ..
- ^ Линч CJ, Адамс С.Х. (декабрь 2014 г.). «Аминокислоты с разветвленной цепью в метаболической передаче сигналов и резистентности к инсулину» . Обзоры природы. Эндокринология . 10 (12): 723–36. дои : 10.1038/nrendo.2014.171 . ПМЦ 4424797 . ПМИД 25287287 .
- ^ Сяо Ф, Юй Дж, Го Ю, Дэн Дж, Ли К, Ду Ю и др. (июнь 2014 г.). «Влияние лишения отдельных аминокислот с разветвленной цепью на чувствительность к инсулину и метаболизм глюкозы у мышей». Метаболизм . 63 (6): 841–50. дои : 10.1016/j.metabol.2014.03.006 . ПМИД 24684822 .
- ^ Каммингс Н.Э., Уильямс Э.М., Каса И., Конон Э.Н., Шайд М.Д., Шмидт Б.А. и др. (февраль 2018 г.). «Восстановление метаболического здоровья за счет снижения потребления аминокислот с разветвленной цепью» . Журнал физиологии . 596 (4): 623–645. дои : 10.1113/JP275075 . ПМК 5813603 . ПМИД 29266268 .
- ^ Чан С., О С.Ф., Вада С., Роу Г.К., Лю Л., Чан М.К. и др. (апрель 2016 г.). «Метаболит аминокислот с разветвленной цепью управляет транспортом жирных кислот в сосудах и вызывает резистентность к инсулину» . Природная медицина . 22 (4): 421–6. дои : 10.1038/нм.4057 . ПМЦ 4949205 . ПМИД 26950361 .
- ^ Фонтана Л., Каммингс Н.Э., Арриола Апело С.И., Нойман Дж.К., Каса И., Шмидт Б.А. и др. (июль 2016 г.). «Снижение потребления аминокислот с разветвленной цепью улучшает метаболическое здоровье» . Отчеты по ячейкам . 16 (2): 520–530. дои : 10.1016/j.celrep.2016.05.092 . ПМЦ 4947548 . ПМИД 27346343 .
- ^ Тая Ю., Ота Ю., Уилкинсон А.С., Канадзава А., Ватарай Х., Касаи М. и др. (декабрь 2016 г.). «Истощение диетического валина позволяет проводить немиелоаблативную трансплантацию гемопоэтических стволовых клеток мышам». Наука . 354 (6316): 1152–1155. Бибкод : 2016Sci...354.1152T . дои : 10.1126/science.aag3145 . ПМИД 27934766 . S2CID 45815137 .