Антраниловая кислота
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК 2-аминобензойная кислота [1] | |||
| Систематическое название ИЮПАК 2-аминобензолкарбоновая кислота | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 3DMeet | |||
| 471803 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.003.898 | ||
| Номер ЕС |
| ||
| 3397 | |||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| C7H7NOC7H7NO2 | |||
| Молярная масса | 137.138 g·mol −1 | ||
| Появление | белое или желтое твердое вещество | ||
| Запах | без запаха | ||
| Плотность | 1,412 г/см 3 | ||
| Температура плавления | От 146 до 148 ° C (от 295 до 298 ° F; от 419 до 421 К) [3] | ||
| Точка кипения | 200 ° C (392 ° F; 473 К) (возвышенное состояние) | ||
| 0,572 г/100 мл (25 °С) | |||
| Растворимость | очень растворим в хлороформе , пиридине растворим в этаноле , эфире , этиловом эфире мало растворим в трифторуксусной кислоте , бензоле | ||
| войти P | 1.21 | ||
| Давление пара | 0,1 Па (52,6 °С) | ||
| Кислотность ( pKa ) |
| ||
| -77.18·10 −6 см 3 /моль | |||
Показатель преломления ( n D ) | 1,578 (144 °С) | ||
| Термохимия | |||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -380,4 кДж/моль | ||
| Опасности | |||
| СГС Маркировка : | |||
  | |||
| Опасность | |||
| Х318 , Х319 | |||
| П264 , П280 , П305+П351+П338 , П310 , П337+П313 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | > 150 ° C (302 ° F; 423 К) | ||
| > 530 ° C (986 ° F; 803 К) | |||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 1400 мг/кг (перорально, крыса) | ||
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов | ||
| Юридический статус | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Антраниловая кислота представляет собой ароматическую кислоту с формулой C 6 H 4 (NH 2 )(CO 2 H) и имеет сладковатый вкус. [5] [6] [7] Молекула состоит из бензольного кольца, орто -замещенного кислотой карбоновой и амином . В результате наличия как кислотных, так и основных функциональных групп соединение является амфотерным . Антраниловая кислота в чистом виде представляет собой белое твердое вещество, хотя коммерческие образцы могут иметь желтый цвет. Анион [C 6 H 4 (NH 2 )(CO 2 )] − , полученный депротонированием антраниловой кислоты, называется антранилатом . Когда-то считалось, что антраниловая кислота является витамином, и в этом контексте ее называли витамином L1 , но теперь известно, что она не является незаменимой в питании человека. [8]
Структура
[ редактировать ]Хотя обычно это не называют так, это аминокислота . Твердая антраниловая кислота обычно состоит как из аминокарбоновой кислоты, так и из форм цвиттер-ионного карбоксилата аммония и имеет моноклинную кристаллическую структуру с пространственной группой P2 1 . [9] Он триболюминесцентный . [10] При температуре выше 81 ° C (178 ° F; 354 К) он превращается в ромбическую форму с пространственной группой Pbca, которая не является триболюминесцентной; известна также нетриболюминесцентная моноклинная фаза аналогичной структуры. [10]
Производство
[ редактировать ]Описано множество путей получения антраниловой кислоты. В промышленных масштабах его получают из фталевого ангидрида , начиная с аминирования:
- C 6 H 4 (CO) 2 O + NH 3 + NaOH → C 6 H 4 (C(O)NH 2 )CO 2 Na + H 2 O
Образующаяся натриевая соль фталаминовой кислоты декарбонилируется посредством перегруппировки Гофмана амидной группы, индуцированной гипохлоритом : [11]
- C 6 H 4 (C(O)NH 2 )CO 2 Na + HOCl → C 6 H 4 NH 2 CO 2 H + NaCl + CO 2
Родственный метод включает обработку фталимида натрия гипобромитом в водном растворе гидроксида натрия с последующей нейтрализацией. [12] В эпоху, когда краситель индиго получали из растений, его разлагали с образованием антраниловой кислоты.
Антраниловая кислота была впервые получена путем деградации индиго, вызванной основаниями. [13]
Биосинтез
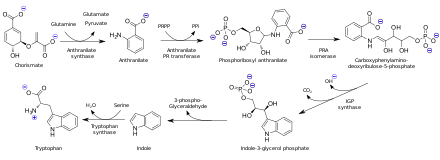
[ редактировать ]Антраниловая кислота биосинтезируется из хоризмовой кислоты под действием антранилатсинтазы . В организмах, способных синтезировать триптофан, антранилат является предшественником аминокислоты триптофана путем присоединения фосфорибозилпирофосфата к аминогруппе . После этого происходит циклизация с образованием индола .
Использование
[ редактировать ]В промышленности антраниловая кислота является промежуточным продуктом при производстве азокрасителей и сахарина . Он и его сложные эфиры используются при приготовлении духов , имитирующих жасмин и апельсин , фармацевтических препаратов ( петлевые диуретики , такие как фуросемид ) и поглотителей ультрафиолетовых лучей, а также ингибиторов коррозии металлов и ингибиторов плесени в соевом соусе .
репелленты от насекомых на основе антранилата были предложены В качестве замены ДЭТА .
Фенаминовая кислота – производное антраниловой кислоты. [14] : 235 является изостером азота салициловой кислоты , которая является активным метаболитом аспирина который, в свою очередь , . [14] : 235 Некоторые нестероидные противовоспалительные препараты , в том числе мефенаминовая кислота , толфенаминовая кислота , флуфенаминовая кислота и меклофенаминовая кислота , являются производными фенаминовой кислоты или антраниловой кислоты и называются «производными антраниловой кислоты» или «фенаматами». [15] : 17
Реакции
[ редактировать ]Антраниловую кислоту можно диазотировать с образованием катиона диазония [C 6 H 4 (CO 2 H)(N 2 )] + . Этот катион можно использовать для получения бензина . [16] димеризуется с образованием дифеновой кислоты , [17] или подвергаться реакциям сочетания диазония, например, при синтезе метилового красного . [18]
Он реагирует с фосгеном с образованием изатового ангидрида , универсального реагента. [19]
Хлорирование антраниловой кислоты дает производное 2,4-дихлора, которое может подвергаться восстановительному сочетанию с образованием биарильного соединения. [20]
Безопасность и регулирование
[ редактировать ]Он также внесен в список I химического вещества DEA из-за его использования в производстве широко запрещенного эйфорического седативного препарата метаквалона (Quaalude, Mandrax). [21]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Фронт материи». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 748. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ Хейнс, Уильям М., изд. (2016). Справочник CRC по химии и физике (97-е изд.). ЦРК Пресс . стр. 5–89. ISBN 978-1498754286 .
- ^ МПХБ
- ^ Анвиса (31 марта 2023 г.). «ПДК № 784 - Перечни наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» [Постановление Коллегиального совета № 784]. 784 - Списки наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем] (на бразильском португальском языке). Официальный вестник Союза (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 03 августа 2023 г. Проверено 15 августа 2023 г.
- ^ Эктон, К. Эштон (2013). Аминобензойные кислоты - достижения в исследованиях и применении (изд. 2013 г.). Атланта: ScholarlyEditions. п. 23. ISBN 9781481684842 – через Google Книги.
- ^ Харди, Марк Р. (1997). «Метка гликанов флурофорами 2-аминобензамида и антраниловой кислоты». В Таунсенде, Р. Рид; Хочкисс, Арланд Т. младший (ред.). Методы гликобиологии . Марсель Деккер, Inc. с. 360. ИСБН 9780824798222 – через Google Книги.
- ^ Индекс Merck, 10-е изд. (1983), стр.62, Rahway: Merck & Co.
- ^ Дэвидсон, Майкл В. (2004). «Антраниловая кислота (витамин L)]» . Университет штата Флорида . Проверено 20 ноября 2019 г.
- ^ Браун, CJ (1968). «Кристаллическая структура антраниловой кислоты». Труды Лондонского королевского общества. Серия А. Математические и физические науки . 302 (1469): 185–199. Бибкод : 1968RSPSA.302..185B . дои : 10.1098/rspa.1968.0003 . S2CID 93221347 .
- ^ Перейти обратно: а б Харди, Гордон Э.; Каска, Уильям К.; Чандра, BP; Зинк, Джеффри И. (март 1981 г.). «Структурные взаимоотношения триболюминесценции в полиморфах гексафенилкарбодифосфорана и антраниловой кислоты, молекулярных кристаллах и солях». Журнал Американского химического общества . 103 (5): 1074–1079. дои : 10.1021/ja00395a014 .
- ^ Маки, Такао; Такеда, Кадзуо (2000). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a03_555 . ISBN 3527306730 . .
- ^ Учебник практической органической химии Фогеля, 4-е изд. , (BS Furniss et al., Eds.) (1978), стр.666, Лондон: Longman.
- ^ Шейбли, Фред Э. (1943). «Карл Юлиус Фриче и открытие антраниловой кислоты, 1841 год». Журнал химического образования . 20 (3): 115. Бибкод : 1943ЖЧЭд..20..115С . дои : 10.1021/ed020p115 .
- ^ Перейти обратно: а б Шрирам Д., Йогеесвари П. Медицинская химия, 2-е издание . Pearson Education India, 2010. ISBN 9788131731444
- ^ Материалы курса Обернского университета. Джек ДеРуитер, Принципы действия лекарственных средств 2, осень 2002 г. 1: Нестероидные противовоспалительные препараты (НПВП)
- ^ Логулло, FM; Зейтц, А.Х.; Фридман, Л. (1968). «Бензолдиазоний-2-карбокси- и бифенилен» . Органические синтезы . 48:12 .
- ^ Аткинсон, скорая помощь; Лоулер, HJ (1927). «Дифеновая кислота». Органические синтезы . 7:30 . дои : 10.15227/orgsyn.007.0030 .
- ^ Кларк, ХТ; Кирнер, WR (1922). «Метиловый красный» . Органические синтезы . 2:47 .
- ^ Вагнер, ЕС; Фегли, Мэрион Ф. (1947). «Изатоовый ангидрид». Орг. Синтез . 27 : 45. дои : 10.15227/orgsyn.027.0045 .
- ^ Аткинсон, Эдвард Р.; Мерфи, Дональд М.; Лафкин, Джеймс Э. (1951). « dl -4,4',6,6'-Тетрахлордифеновая кислота» . Органические синтезы . 31:96 .
- ^ Ангелос С.А., Мейерс Дж.А. (1985). «Выделение и идентификация прекурсоров и продуктов реакций при подпольном производстве метаквалона и меклоквалона». Журнал судебной медицины . 30 (4): 1022–1047. дои : 10.1520/JFS11044J . ПМИД 3840834 .