Арине
В органической химии арины [1] и бензины [2] представляют собой класс высокореактивных химических соединений , полученных из ароматического кольца путем удаления двух заместителей . Арины являются примерами дидегидроаренов (в данном случае 1,2-дидегидроаренов), хотя известны также 1,3- и 1,4-дидегидроарены. [3] [4] [5] Арины являются примерами алкинов при высоких нагрузках .
Связывание в арине
[ редактировать ]Алкиновое представление бензина является наиболее широко встречающимся. Арины обычно описывают как имеющие напряженную тройную связь. [6]

Геометрические ограничения тройной связи в бензине приводят к уменьшению перекрытия p-орбиталей в плоскости и, следовательно, к более слабой тройной связи. [7] Частота колебаний тройной связи в бензине Радзишевским была установлена равной 1846 см-1. −1 , [8] что указывает на более слабую тройную связь, чем в ненапряженном алкине с частотой колебаний примерно 2150 см-1. −1 . Тем не менее, бензин больше похож на напряженный алкин, чем на дирадикал, о чем свидетельствует большой синглет-триплетный разрыв и алкин-подобная реакционная способность. [3]

НСМО арина значительно ниже , чем НСМО ненапряженных алкинов, что делает его более энергетически совместимым с ВЗМО нуклеофилов. Следовательно, бензон обладает электрофильным характером и вступает в реакции с нуклеофилами. [9] Подробный МО-анализ бензина был представлен в 1968 году. [10]

Поколение аринов
[ редактировать ]Из-за своей чрезвычайной реакционной способности арины должны генерироваться in situ . Бензин, что типично для других реакционноспособных промежуточных продуктов , необходимо улавливать, иначе он димеризуется до бифенилена .
Ранние пути получения бензона дегидрогалогенирование арилгалогенидов включали :

Такие реакции требуют сильного основания и высоких температур. 1,2-Дисзамещенные арены служат предшественниками бензолов в более мягких условиях. Бензин получают путем дегалогенирования 1-бром-2-фторбензола магнием. [11] Антраниловую кислоту можно превратить в 2-диазониобензол-1-карбоксилат путем диазотирования и нейтрализации. Хоть и взрывной, [12] эта цвиттер-ионная разновидность является удобным и недорогим предшественником бензона. [13]

Другой метод основан на использовании триметилсилиларилтрифлатов . [14] Этот метод нашел широкое применение и был рассмотрен в 2021 году. [15] Замещение триметилсилильной группы фторидом вызывает отщепление трифлата и выделение бензона:

Реакция гексадегидро Дильса-Альдера (HDDA) включает циклоприсоединение 1,3-диина и алкина. [16]

N -аминирование 1 H -бензотриазола приводит гидроксиламин- O -сульфоновой кислотой к образованию промежуточного соединения, которое можно окислить до бензола с почти количественным выходом ацетатом свинца (IV) . [17]

Реакции аринов
[ редактировать ]Даже при низких температурах арины чрезвычайно реакционноспособны. Их реакционную способность можно разделить на три основных класса: (1) нуклеофильное присоединение, (2) перициклические реакции и (3) внедрение связи.
Нуклеофильные присоединения к аринам
[ редактировать ]При обработке основными нуклеофилами арилгалогениды депротонируют альфа до уходящей группы, что приводит к дегидрогалогенированию . Исследования изотопного обмена показывают, что для арилфторидов и иногда арилхлоридов элиминирование протекает в две стадии: депротонирование с последующим изгнанием нуклеофила. Таким образом, процесс формально аналогичен механизму E1cb алифатических соединений. С другой стороны, арилбромиды и йодиды, как правило, подвергаются элиминированию посредством согласованного синкопланарного механизма Е2. [18] [19] Образующийся бензон образует продукты присоединения, обычно путем нуклеофильного присоединения и протонирования. Образование промежуточного бензола является медленной стадией реакции. [20]

Реакции «аринового сочетания» позволяют получать дифенильные соединения, которые ценны в фармацевтической промышленности, сельском хозяйстве и в качестве лигандов во многих превращениях, катализируемых металлами. [21]
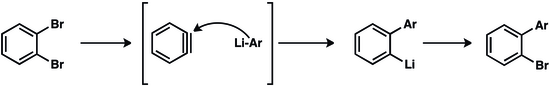
Продукт металл-арен также может присоединяться к другому арину, что приводит к полимеризации с ростом цепи . Использование цианида меди(I) в качестве инициатора для добавления к первому арину привело к получению полимеров, содержащих до примерно 100 ареновых звеньев. [22]
Когда уходящая группа (LG) и заместитель (Y) взаимно орто- или пара-, возможен только один промежуточный бензол. Однако когда LG является мета-по отношению к Y, возможны региохимические результаты (А и Б). Если Y является электроноакцепторным, то H B более кислый, чем H A, что приводит к образованию региоизомера B. Аналогично, если Y является донором электронов, образуется региоизомер А, поскольку теперь H A представляет собой более кислый протон.

Возможны два региоизомера бензола с заместителем (Y): тройная связь может располагаться между C2 и C3 или между C3 и C4. Заместители в орто-положении к уходящей группе приводят к образованию тройной связи между C2 и C3. Para Y и LG приведут к региоизомеру с тройной связью между C3 и C4. Мета-заместитель может содержать оба региоизомера, как описано выше. Нуклеофильные присоединения могут происходить с региоселективностью. Хотя классические объяснения региоселективности относятся к стабильности карбаниона после атаки нуклеофила, [20] это объяснение было заменено моделью аринового искажения Хоука и Гарга . [23] [24] [25] В этой модели заместители вызывают геометрическое искажение структуры основного состояния арина, что приводит к региоселективным реакциям, согласующимся с реакциями, протекающими через ранние переходные состояния.
Перициклические реакции аринов
[ редактировать ]Бензин подвергается быстрой димеризации с образованием бифенилена. Некоторые пути получения бензона приводят к особенно быстрому и высокому выходу этой последующей реакции. [13] [17] Тримеризация дает трифенилен . [26]
Бензины могут подвергаться реакциям [4+2] циклизации. При образовании в присутствии антрацена триптицен образуется . [11] В этом методе ниже показан согласованный механизм реакции Дильса-Альдера между бензолом и фураном. Считается, что другие циклоприсоединения бензола [4+2] протекают по ступенчатому механизму.

Классическим примером является синтез 1,2,3,4-тетрафенилнафталина . [27] Тетрабромбензол может реагировать с бутиллитием и фураном с образованием тетрагидроантрацена. [28]

[4+2]-циклоприсоединения аринов обычно применяются для полного синтеза природных продуктов. Однако основным ограничением такого подхода является необходимость использования связанных диенов, таких как фуран и циклопентадиен. [14] В 2009 году Бушек и его коллеги синтезировали гербиндол А с использованием аринового [4+2]-циклоприсоединения. [29] 6,7-индолин подвергается [4+2]-циклоприсоединению с циклопентадиеном с образованием сложного тетрациклического продукта.

Бензины подвергаются [2+2]-циклоприсоединению с широким кругом алкенов. Из-за электрофильной природы бензона для этой реакции лучше всего подходят алкены, содержащие электронодонорные заместители. [30]
Из-за образования значительного количества побочных продуктов химия аринов [2+2] редко используется в полном синтезе натуральных продуктов. [14] Тем не менее, несколько примеров существуют. В 1982 году Стивенс и его коллеги сообщили о синтезе таксодиона, в котором использовалось [2+2] циклоприсоединение между арином и ацеталем кетена. [31]

Мори и его коллеги выполнили катализируемую палладием [2+2+2]-коциклизацию арина и диина при полном синтезе тайванинов C. [32]

Реакции внедрения аринов
[ редактировать ]Первым примером реакции внедрения ариновой σ-связи является синтез меллеина в 1973 году. [33]

Прочие дегидробензолы
[ редактировать ]Если бензол представляет собой 1,2-дидегидробензол, возможны еще два изомера: 1,3-дидегидробензол и 1,4-дидегидробензол. [3] Их энергия in silico составляет соответственно 106, 122 и 138 ккал/моль (444, 510 и 577 кДж/моль). [34] 1,2- и 1,3-изомеры имеют синглетные основные состояния, тогда как для 1,4-дидегидробензола щель меньше.

Изучена взаимопревращение 1,2-, 1,3- и 1,4-дидегидробензолов. [34] [35] Предполагается, что превращение 1,2- в 1,3-дидегидробензол происходит при пиролизе (900 ° C) предшественников фенилзамещенных аринов . [34] как показано ниже. Для взаимного превращения бензола необходимы чрезвычайно высокие температуры.

1,4-дидегидроарены
[ редактировать ]1,4-дидегидробензолом при нагревании до 300 °C [1,6-D2]-A легко уравновешивается с [3,2-D2] -B , но не уравновешивается с C или D. В классических экспериментах с Одновременную миграцию атомов дейтерия с образованием B и тот факт, что ни C , ни D не образуется, можно объяснить только наличием циклического и симметричного интермедиата – 1,4-дидегидробензола. [36]

Для 1,4-дидегидробензола предложены два состояния: синглетное и триплетное, причем синглетное состояние имеет меньшую энергию. [37] [38] Триплетное состояние представляет собой два невзаимодействующих радикальных центра и, следовательно, должно отрывать водороды с той же скоростью, что и фенильный радикал. Однако синглетное состояние более стабилизировано, чем триплетное, и поэтому часть стабилизирующей энергии будет потеряна для формирования переходного состояния для расщепления водорода, что приведет к более медленному отщеплению водорода. Чен предложил использовать аналоги 1,4-дидегидробензола, которые имеют большие синглет-триплетные энергетические щели, для повышения селективности кандидатов в ендииновые лекарства. [39]
История
[ редактировать ]Первые свидетельства существования аринов были получены в работах Штёрмера и Калерта. В 1902 г. они заметили, что при обработке 3-бромбензофурана основанием в этаноле образуется 2-этоксибензофуран. На основании этого наблюдения они предположили, что существует ариновый промежуточный продукт. [40]

Виттиг и др. использовал цвиттер-ионное промежуточное соединение в реакции фторбензола и фениллития с образованием бифенила. [41] [42] [43] Эта гипотеза позже подтвердилась. [44] [45] [46] [47] [48]

В 1953 году 14 Эксперименты по мечению C предоставили убедительное подтверждение посреднической роли бензона. [44] Джон Д. Робертс и др. показали, что реакция хлорбензол-1- 14 С и амид калия дали равные количества анилина с 14 Включение C в C-1 и C-2.

Виттиг и Помер обнаружили, что бензон участвует в реакциях [4+2]-циклоприсоединения. [49]
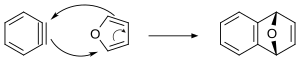
Дополнительные доказательства существования бензона были получены в результате спектроскопических исследований. [3] Бензин наблюдался в «молекулярном контейнере». [50]
было получено изображение одной молекулы арина В 2015 году с помощью СТМ . [51]
1,3-Дидегидроарены были впервые продемонстрированы в 1990-х годах, когда они были получены из 1,3-дизамещенных производных бензола, таких как пероксиэфир 1,3-C 6 H 4 (O 2 C(O)CH 3 ) 2 . [3]
Прорыв в области 1,4-дидегидробензола произошел в 1960-х годах после исследований циклизации Бергмана . [36] Эта тема стала актуальной с открытием ендииновых «цитостатиков», таких как калихеамицин , который генерирует 1,4-дидегидробензол. [52]
Примеры бензинов в полном синтезе
[ редактировать ]С использованием аринов в качестве промежуточных продуктов были получены различные натуральные продукты. [14] Нуклеофильные добавки к аринам широко используются в полном синтезе природных продуктов. Действительно, нуклеофильные присоединения аринов являются одними из старейших известных применений химии аринов. [14] Нуклеофильное присоединение к арину было использовано при попытке синтеза криптаустолина (1) и криптоволина (2). [53]

В синтезе тетрациклического меротерпеноида (+)-липагала участвует ариновый промежуточный продукт. [54] В их подходе использовалась ариновая циклизация, чтобы замкнуть последнее кольцо натурального продукта. [14]

Многокомпонентные реакции аринов представляют собой мощные превращения, позволяющие быстро образовывать 1,2-дизамещенные арены. Несмотря на их потенциальную полезность, примеры многокомпонентных ариновых реакций в синтезе природных продуктов немногочисленны. [14] Реакцию четырехкомпонентного сочетания аринов использовали при синтезе дегидроалтенуола Б. [55]

См. также
[ редактировать ]- Дополнительные примеры использования химии аринов: трициклобутабензол , ин-метилциклофан , бензольный комплекс переходного металла.
- Пиридиновый эквивалент пиридина
Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Арыне ». два : 10.1351/goldbook.A00465
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Бензины ». дои : 10.1351/goldbook.B00634
- ^ Jump up to: а б с д и Ханс Хеннинг Венк; Майкл Винклер; Вольфрам Сандер (2003). «Один век аринской химии». Энджью. хим. Межд. Эд . 42 (5): 502–528. дои : 10.1002/anie.200390151 . ПМИД 12569480 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Дегидроарены ». два : 10.1351/goldbook.D01574
- ^ ИЮПАК Запись в Золотой книге для термина «бензины» определяет « м -бензин» и « п -бензин» как ошибочные термины для 1,3- и 1,4-дидегидробензола.
- ^ Анслин, EV; Догерти, Д.А.: Современная физико-органическая химия , University Science Books, 2006, стр. 612.
- ^ Гампе, КМ; Каррейра, ЕМ (2012). «Арины и циклогексин в синтезе натуральных продуктов». Энджью. хим. Межд. Эд. англ . 51 (16): 3766–78. дои : 10.1002/anie.201107485 . ПМИД 22422638 .
- ^ Радзишевский, Ю.Г.; Хесс, бакалавр наук младший; Заградник, Р. (1992). «Инфракрасный спектр о-бензина: эксперимент и теория». Дж. Ам. хим. Соц . 114 : 52. дои : 10.1021/ja00027a007 .
- ^ Гилкрист, TL. Приложение C: Химия функциональных групп с тройной связью, Часть 1 . Патай, С.; Раппапорт, З. Ред., John Wiley & Sons, Нью-Йорк, 1983 г.
- ^ Хоффманн, Р.; Имамура, А.; Хере, WJ (1968). «Бензины, дегидросопряженные молекулы и взаимодействие орбиталей, разделенных рядом промежуточных сигма-связей». Дж. Ам. хим. Соц . 90 (6): 1499. doi : 10.1021/ja01008a018 .
- ^ Jump up to: а б Виттиг, Георг (1959). «Триптицен». Орг. Синтез . 39 : 75. дои : 10.15227/orgsyn.039.0075 .
- ^ Салливан, Джон М. (1 июня 1971 г.). «Взрыв при получении бензолдиазоний-2-карбоксилата гидрохлорида». Журнал химического образования . 48 (6): 419. Бибкод : 1971ЖЧЭд..48..419С . дои : 10.1021/ed048p419.3 . ISSN 0021-9584 .
- ^ Jump up to: а б Логулло, Фрэнсис М.; Зейтц, Арнольд М.; Фридман, Лестер (1968). «Бензолдиазоний-2-карбоксилат и бифенилен (бензолдиазоний, о -карбокси-, гидроксид, внутренняя соль)». Орг. Синтез . 48 : 12. дои : 10.15227/orgsyn.048.0012 .
- ^ Jump up to: а б с д и ж г Тадросс, премьер-министр; Штольц, Б.М. (2012). «Всесторонняя история аринов в полном синтезе натуральных продуктов». хим. Преподобный . 112 (6): 3550–3577. дои : 10.1021/cr200478h . ПМИД 22443517 .
- ^ Ши, Цзярун; Ли, Лянгуй; Ли, Ян (14 апреля 2021 г.). «О-Силиларил Трифлаты: Путешествие предшественников Кобаяши Арина» . Химические обзоры . 121 (7): 3892–4044. doi : 10.1021/acs.chemrev.0c01011 . ISSN 0009-2665 .
- ^ Хой, TR; Бэр, Б.; Ню, Д.; Уиллоуби, штат Пенсильвания; Вудс, БП (2012). «Гексадегидро-Реакция Дильса – Альдера» . Природа . 490 (7419): 208–212. Бибкод : 2012Natur.490..208H . дои : 10.1038/nature11518 . ПМЦ 3538845 . ПМИД 23060191 .
- ^ Jump up to: а б Кэмпбелл, CD; К.В. Рис (1969). «Реакционноспособные интермедиаты. Часть I. Синтез и окисление 1- и 2-аминобензотриазолов». Дж. Хим. Соц. С. 1969 (5): 742–747. дои : 10.1039/J39690000742 .
- ^ Панар, Мануэль (1961). Механизм элиминирования-присоединения нуклеофильного ароматического замещения . Пасадена, Калифорния: Калифорнийский технологический институт (докторская диссертация). стр. 4–5.
- ^ Х., Лоури, Томас (1987). Механизм и теория в органической химии . Ричардсон, Кэтлин Шуллер (3-е изд.). Нью-Йорк: Харпер и Роу. стр. 643 . ISBN 0-06-044084-8 . OCLC 14214254 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Анслин, Э.В.; Догерти, Д.А. Современная физико-органическая химия. Университетские научные книги, 2006 г.
- ^ Diemer, V.; Begaut, M.; Leroux, F. R.; Colobert, F. Eur. J. Org. Chem. 2011 , 341
- ^ Мизукоси, Ёсихидэ; Миками, Коитиро; Утияма, Масанобу (2015). «Ариновая полимеризация, обеспечивающая прямой синтез неуловимых поли( орто -ариленов)». Дж. Ам. хим. Соц . 137 (1): 74–77. дои : 10.1021/ja5112207 . ПМИД 25459083 .
- ^ Чеонг, Пол Х.-Й.; Патон, Роберт С.; Броннер, Сара М.; Им, Джи-Юн Дж.; Гарг, Нил К.; Хоук, КН (3 февраля 2010 г.). «Индолиновые и ариновые искажения и нуклеофильные региоселективиты» . Журнал Американского химического общества . 132 (4): 1267–1269. дои : 10.1021/ja9098643 . ISSN 0002-7863 . ПМК 2819077 . ПМИД 20058924 .
- ^ Им, Джи-Юн Дж.; Броннер, Сара М.; Гетц, Адам Э.; Патон, Роберт С.; Чеонг, Пол Х.-Й.; Хоук, КН; Гарг, Нил К. (22 декабря 2010 г.). «Экспериментальные и вычислительные исследования индолина: синтетические применения и происхождение селективности нуклеофильных добавок» . Журнал Американского химического общества . 132 (50): 17933–17944. дои : 10.1021/ja1086485 . ISSN 0002-7863 . ПМК 3075889 . ПМИД 21114321 .
- ^ Медина, Хосе М.; Макки, Джоэл Л.; Гарг, Нил К.; Хоук, КН (5 ноября 2014 г.). «Роль аринных искажений, стерических эффектов и зарядов в региоселективности аринных реакций» . Журнал Американского химического общества . 136 (44): 15798–15805. дои : 10.1021/ja5099935 . ISSN 0002-7863 . ПМК 4221504 . ПМИД 25303232 .
- ^ Хини, Х.; Миллар, IT (1960). «Трифенилен» . Органические синтезы . 40 :105 ; Сборник томов , т. 5, 1973, с. 1120 .
- ^ «1,2,3,4-Тетрафенилнафталин». Органические синтезы . 46 : 107. 1966. doi : 10.15227/orgsyn.046.0107 .
- ^ «Использование 1,2,4,5-тетрабромбензола в качестве 1,4-нензадийского эквивалента: анти- и син-1,4,5,8-тетрагидроантрацен-1,4:5,8-диэпоксиды». Органические синтезы . 75 : 201. 1998. doi : 10.15227/orgsyn.075.0201 .
- ^ Бушек, КР; Браун, Н.; Куо, Д. (2009). «Краткий полный синтез (±)-цис-трикентрина А и (±)-гербиндола А посредством межмолекулярного индол-аринового циклоприсоединения» . Орг. Летт . 11 (1): 201–204. дои : 10.1021/ol802425m . ПМК 2723800 . ПМИД 19055375 .
- ^ Пеллиссье, Х.; Сантелли, М. Тетраэдр, 2003; 59, 701
- ^ Стивенс, Р.В.; Бисакки, GS J. Org, Chem. 1982 год; 47, 2396
- ^ Сато, Ю.; Тамура, Т.; Мори, М. Ангью. хим. Межд. Эд. 2004 г.; 43, 2436
- ^ Гайо, М.; Соус, Д. Тетраэдр Летт. 1973 год; 14, 3433
- ^ Jump up to: а б с Блейк, Мэн; Бартлетт, КЛ; Джонс, М. младший (2003). «Превращение м-бензина в о-бензин посредством 1,2-сдвига фенильной группы». Дж. Ам. хим. Соц . 125 (21): 6485–90. дои : 10.1021/ja0213672 . ПМИД 12785789 .
- ^ Полищук А.Л.; Бартлетт, КЛ; Фридман, Луизиана; Джонс, М. младший (2004). «Превращение п-бензина в м-бензин посредством 1,2-сдвига фенильной группы. Завершение бензойного каскада». Дж. Физ. Орг. Хим . 17 (9): 798–806. дои : 10.1002/poc.797 .
- ^ Jump up to: а б Ричард Р. Джонс; Роберт Г. Бергман (1972). «П-бензин. Образование в качестве промежуточного продукта в реакции термической изомеризации и улавливание доказательств структуры 1,4-бензолдиила». Дж. Ам. хим. Соц. 94 (2): 660–661. дои : 10.1021/ja00757a071 .
- ^ Клауберг, Х.; Минсек, Д.В.; Чен, П. (1992). «Масс- и фотоэлектронная спектроскопия C3H2. .DELTA.Hf синглетных карбенов отклоняются от аддитивности из-за своих синглет-триплетных промежутков». Дж. Ам. хим. Соц . 114 : 99. дои : 10.1021/ja00027a014 .
- ^ Блаш, Дж. А.; Клауберг, Х.; Кон, Д.В.; Минсек, Д.В.; Чжан, X.; Чен, П. (1992). «Фотоионизационная массовая и фотоэлектронная спектроскопия радикалов, карбенов и бирадикалов». Акк. хим. Рез . 25 (9): 385. дои : 10.1021/ar00021a001 .
- ^ Чен, П. (1996). «Разработка агентов абстрагирования водорода на основе дирадикалов» . Энджью. хим. Межд. Эд. англ . 35 (1314): 1478. doi : 10.1002/anie.199614781 .
- ^ Стермер, Р.; Калерт, Б. (1902). «Об 1- и 2-бромкумароне» . Отчеты Немецкого химического общества . 35 (2): 1633–1640. дои : 10.1002/cber.19020350286 .
- ^ Виттиг, Г.; Пипер, Г.; Фурманн, Г. (1940). «Об образовании дифенила из фторбензола и фениллития (IV. Сообщение об обменных реакциях с фениллитием)». Отчеты Немецкого химического общества (серии A и B) . 73 (11): 1193–1197. дои : 10.1002/cber.19400731113 .
- ^ Виттиг, Георг (1942). «Фениллитий, ключ к новой химии металлоорганических соединений». Естественные науки . 30 (46–47): 696–703. Бибкод : 1942NW.....30..696W . дои : 10.1007/BF01489519 . S2CID 37148502 .
- ^ Виттиг, Г (1954). «Достижения в области органической анионохимии». Прикладная химия . 66 (1): 10–17. Нагрудный код : 1954АнгЧ..66...10Вт . дои : 10.1002/anie.19540660103 .
- ^ Jump up to: а б Робертс, Джон Д. (1953). «Перегруппировка в реакции хлорбензола-1-C14 с амидом калия1». Журнал Американского химического общества . 75 (13): 3290–3291. дои : 10.1021/ja01109a523 .
- ^ Робертс, Джон Д. (1956). «Механизм аминирования галогенбензолов 1». Журнал Американского химического общества . 78 (3): 601–611. дои : 10.1021/ja01584a024 .
- ^ Робертс, Джон Д. (1956). «Ориентация в аминировании замещенных галогенбензолов 1». Журнал Американского химического общества . 78 (3): 611–614. дои : 10.1021/ja01584a025 .
- ^ Современные методы арилирования . Под редакцией Лутца Аккермана, 2009 г. WILEY-VCH Verlag GmbH & Co. KGaA, Вайнхайм ISBN 978-3-527-31937-4
- ^ Хини, Х. (1962). «Бензин и родственные промежуточные продукты». Химические обзоры . 62 (2): 81–97. дои : 10.1021/cr60216a001 .
- ^ Виттиг, Г.; Помер, Л. Ангью. хим. 1955 год; 67(13), 348.
- ^ Вармут, Р.; Юн (2001). «Последние достижения в области гемикарцероза и химии». Акк. хим. Рез . 34 (2): 96. дои : 10.1021/ar980082k . ПМИД 11263868 .
- ^ На поверхности; Перес, Э.Гитиан; Пенья, Л.Гросс (2015). «Генерация на поверхности и визуализация аринов с помощью атомно-силовой микроскопии». Природная химия . 7 (8): 623–8. Бибкод : 2015НатЧ...7..623П . дои : 10.1038/nchem.2300 . ПМИД 26201737 .
- ^ Галм, У; Хагер, Миннесота; Ван Ланен, генеральный директор; Джу, Дж; Торсон, Дж. С.; Шен, Б. (февраль 2005 г.). «Противоопухолевые антибиотики: блеомицин, эндиины и митомицин». Химические обзоры . 105 (2): 739–58. дои : 10.1021/cr030117g . ПМИД 15700963 .
- ^ Каметани, Т.; Огасавара, KJ J. Chem. Сок., С 1967, 2208.
- ^ Дэй, Джей-Джей; Макфадден, РМ; Вирджил, Южная Каролина; Колдинг, Х.; Аллева, Дж.Л.; Штольц, Б.М. (2011). «Каталитический энантиоселективный полный синтез (+)-липагала» . Энджью. хим. Межд. Эд . 50 (30): 6814–8. дои : 10.1002/anie.201101842 . ПМК 3361906 . ПМИД 21671325 .
- ^ Сорукрам, Д.; Цюй, Т.; Барретт, годовое общее собрание (2008 г.). «Реакции четырехкомпонентного связывания бензола: краткий общий синтез дегидроальтенуена B». Орг. Летт . 10 (17): 3833–3835. дои : 10.1021/ol8015435 . ПМИД 18672878 .
Внешние ссылки
[ редактировать ] СМИ, связанные с Аринесом, на Викискладе?
СМИ, связанные с Аринесом, на Викискладе?