Антрацен
этой статьи Начальный раздел может быть слишком коротким, чтобы адекватно суммировать ключевые моменты . ( апрель 2023 г. ) |
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Антрацен | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 1905429 | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.003.974 |
| Номер ЕС |
|
| 67837 | |
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 14 Ч 10 | |
| Молярная масса | 178.234 g·mol −1 |
| Появление | Бесцветный |
| Запах | Слабый ароматический |
| Плотность | 1,28 г/см 3 (25 °С) [1] 0,969 г/см 3 (220 °С) |
| Температура плавления | 216 ° С (421 ° F, 489 К) [1] при 760 мм рт.ст. |
| Точка кипения | 341,3 ° C (646,3 ° F; 614,5 К) [1] при 760 мм рт.ст. |
| 0,022 мг/л (0 °С) 0,044 мг/л (25 °С) 0,29 мг/л (50 °С) 0,00045 % по массе (100 °C, 3,9 МПа) [2] | |
| Растворимость | Растворим в спирте , (C 2 H 5 ) 2 O , ацетоне , C 6 H 6 , CHCl 3 , [1] КС 2 [3] |
| Растворимость в этаноле | 0,76 г/кг (16 °С) 19 г/кг (19,5 °С) 3,28 г/кг (25 °С) [3] |
| Растворимость в метаноле | 18 г/кг (19,5 °С) [3] |
| Растворимость в гексане | 3,7 г/кг [3] |
| Растворимость в толуоле | 9,2 г/кг (16,5 °С) 129,4 г/кг (100 °С) [3] |
| Растворимость в четыреххлористом углероде | 7,32 г/кг [3] |
| войти P | 4.56 |
| Давление пара | 0,01 кПа (125,9 °С) 0,1 кПа (151,5 °С) [4] 13,4 кПа (250 °С) [5] |
Закон Генри постоянная ( k H ) | 0,0396 л·атм/моль [6] |
| УФ-видимое излучение (λ макс .) | 345,6 нм, 363,2 нм [5] |
| −129.8 × 10 −6 см 3 /моль [7] | |
| Теплопроводность | 0,1416 Вт/(м·К) (240 °С) 0,1334 Вт/(м·К) (270 °С) 0,1259 Вт/(м·К) (300 °С) [8] |
| Вязкость | 0,602 сП (240 °С) 0,498 сП (270 °С) 0,429 сП (300 °С) [8] |
| Структура | |
| Моноклиника (290 К) [9] | |
| Р2 1 /б [9] | |
| Д 5 2 часа [9] | |
а = 8,562 Å, b = 6,038 Å, c = 11,184 Å [9] α = 90°, β = 124,7°, γ = 90° | |
| Термохимия [10] | |
Теплоемкость ( С ) | 210,5 Дж/(моль·К) |
Стандартный моляр энтропия ( S ⦵ 298 ) | 207,5 Дж/(моль·К) |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 129,2 кДж/моль |
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | 7061 кДж/моль [5] |
| Опасности | |
| СГС Маркировка : | |
  [11] [11] | |
| Предупреждение | |
| Х302 , Х305 , Х315 , Х319 , Х335 , Х410 [11] | |
| П261 , П273 , П305+П351+П338 , П501 [11] | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 121 ° С (250 ° F; 394 К) [11] |
| 540 ° C (1004 ° F; 813 К) [11] | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 100-149 мг/кг (крысы, перорально) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Антрацен — твердый полициклический ароматический углеводород (ПАУ) формулы C 14 H 10 , состоящий из трех конденсированных бензольных колец. Это компонент каменноугольной смолы . Антрацен используется в производстве красного красителя ализарина и других красителей. Антрацен бесцветен, но проявляет синюю (пик 400–500 нм) флуоресценцию под ультрафиолетовым излучением. [13]
Возникновение и производство
[ редактировать ]Угольная смола, содержащая около 1,5% антрацена, остается основным источником этого материала. Обычными примесями являются фенантрен и карбазол . Минеральная форма антрацена называется фрейталитом и связана с угольным месторождением. [14] Классическим лабораторным методом получения антрацена является циклодегидратация о-метил- или о-метилензамещенных диарилкетонов по так называемой реакции Эльбса , например из о -толилфенилкетона. [15]
Реакции
[ редактировать ]Снижение
[ редактировать ]Восстановление антрацена щелочными металлами приводит к образованию глубоко окрашенных анион-радикальных солей M. + [антрацен] − (М = Li, Na, К). Гидрирование дает 9,10- дигидроантрацен с сохранением ароматичности двух фланкирующих колец. [16]
Циклодополнения
[ редактировать ]В любом растворителе, кроме воды, [17] антрацен фотодимеризуется под действием УФ- света:
Димер , называемый диантраценом (или иногда парантраценом), соединяется парой новых углерод-углеродных связей, образующихся в результате [4+4] циклоприсоединения . Он превращается в антрацен термически или при УФ- облучении с длиной волны ниже 300 нм. Аналогично ведут себя замещенные производные антрацена. На реакцию влияет присутствие кислорода . [18] [19]
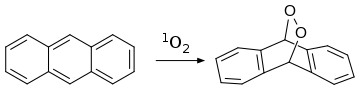
Антрацен также реагирует с диенофильным синглетным кислородом в результате [4+2]-циклоприсоединения ( реакция Дильса-Альдера ):
С электрофилами
[ редактировать ]Химическое окисление происходит легко с образованием антрахинона C 14 H 8 O 2 (ниже), например, с использованием перекиси водорода и ацетилацетоната ванадила . [20]
Электрофильное замещение антрацена происходит в положении 9. Например, формилирование дает 9-антраценкарбоксальдегид . Замещение в других положениях осуществляется косвенно, например, начиная с антрохинона. [21] Бромирование антрацена дает 9,10-дибромантрацен. [22]
Использование
[ редактировать ]Антрацен превращается в основном в антрахинон , предшественник красителей. [23]
Ниша
[ редактировать ]с широкой запрещенной зоной, Антрацен, органический полупроводник используется в качестве сцинтиллятора высоких энергий для детекторов фотонов , электронов и альфа-частиц . Пластмассы, такие как поливинилтолуол , могут быть легированы антраценом для получения пластикового сцинтиллятора , который примерно эквивалентен воде для использования в лучевой терапии дозиметрии . антрацена Пик спектра излучения приходится на длину волны от 400 до 440 нм.
Он также используется в древесины средствах для защиты , инсектицидах и материалах для покрытий . [ нужна ссылка ]
Антрацен обычно используется в качестве индикатора УФ-излучения в конформных покрытиях, наносимых на печатные платы. Антраценовый индикатор позволяет проверять конформное покрытие в УФ-свете. [24]
Производные
[ редактировать ]
Разнообразные производные антрацена находят специализированное применение. Производными, имеющими гидроксильную группу , являются 1-гидроксиантрацен и 2-гидроксиантрацен, гомологичные фенолу и нафтолам , и гидроксиантрацен (также называемый антролом и антраценолом). [25] [26] являются фармакологически активными. Антрацен также может содержать несколько гидроксильных групп, как, например, в 9,10-дигидроксиантрацене .
Некоторые производные антрацена используются в качестве фармацевтических препаратов, включая бисантрен , тразитилин и бензоктамин .
возникновение
[ редактировать ]Антрацен, как и многие другие полициклические ароматические углеводороды , образуется в процессах сгорания. Воздействие на человека происходит главным образом через табачный дым и употребление в пищу продуктов питания, загрязненных продуктами горения.
Токсикология
[ редактировать ]Многие исследования показывают, что антрацен не канцерогенен: «постоянно отрицательные результаты многочисленных тестов на генотоксичность in vitro и in vivo». Ранние эксперименты предполагали обратное, поскольку образцы сырой нефти были загрязнены другими полициклическими ароматическими углеводородами. Кроме того, он легко биоразлагается в почве. Он особенно подвержен деградации в присутствии света. [23]
См. также
[ редактировать ]- 9,10-Дитиоантрацен , производное с двумя тиоловыми группами, добавленными к центральному кольцу.
- Фенантрен
- Тетрацен
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Хейнс, с. 3.28
- ^ Хейнс, с. 5.157
- ^ Перейти обратно: а б с д и ж Зейделл, Атертон; Линке, Уильям Ф. (1919). Растворимость неорганических и органических соединений (2-е изд.). Нью-Йорк: Компания Д. Ван Ностранда. стр. 81 .
- ^ Хейнс, с. 6.116
- ^ Перейти обратно: а б с Антрацен в Линстреме, Питере Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , справочная база данных стандартов NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд) (получено 22 июня 2014 г.)
- ^ Хейнс, с. 5.157
- ^ Хейнс, с. 3,579
- ^ Перейти обратно: а б «Свойства антрацена» . www.infotherm.com . Wiley Information Services GmbH. Архивировано из оригинала 1 ноября 2014 г. Проверено 22 июня 2014 г.
- ^ Перейти обратно: а б с д Дуглас, Боди Э.; Хо, Ши-Минг (2007). Строение и химия кристаллических твердых тел . Нью-Йорк: Springer Science+Business Media, Inc., с. 289. ИСБН 978-0-387-26147-8 .
- ^ Хейнс, с. 5.41
- ^ Перейти обратно: а б с д и Sigma-Aldrich Co. , Антрацен . Проверено 22 июня 2014 г.
- ^ «Паспорт безопасности антрацена» . www.fishersci.ca . Фишер Сайентифик . Проверено 22 июня 2014 г.
- ^ Линдси, Джонатан; и др. «Антрацен» . Фотохимкад . Проверено 20 февраля 2014 г.
- ^ Freitalite, Mindat, https://www.mindat.org/min-54360.html
- ^ «Антрацен» . Американское химическое общество . Проверено 14 сентября 2022 г.
- ^ Басс, КЦ (1962). «9,10-Дигидроантрацен». Органические синтезы . 42 : 48. дои : 10.15227/orgsyn.042.0048 .
- ^ Джонсон, Кейт Э.; Паньи, Ричард М., «Жидкие соли для реакций», Энциклопедия химической технологии Кирка-Отмера , Нью-Йорк: Джон Уайли, стр. 28, номер домена : 10.1002/0471238961.liqupagn.a01 , ISBN 9780471238966
- ^ Рикборн, Брюс (1998). "Ретро- <SCP>D</SCP> илс- <SCP>А</SCP> Реакция Часть <SCP>I</SCP> . <SCP>C</SCP> <SCP>C</SCP» > Диенофилы». Органические реакции . стр. 1–393. дои : 10.1002/0471264180.или052.01 . ISBN 978-0471264187 .
- ^ Буа-Лоран, Анри; Девернь, Жан-Пьер; Кастелян, Ален; Лапуяд, Рене (2000). «Фотодимеризация антраценов в жидком растворе: структурные аспекты». Обзоры химического общества . 29 : 43–55. дои : 10.1039/a801821i .
- ^ Чарлтон, Кимберли, DM; Прокопчук, Эрнест М. (2011). «Координационные комплексы как катализаторы: окисление антрацена перекисью водорода в присутствии VO (acac) 2». Журнал химического образования . 88 (8): 1155–1157. Бибкод : 2011JChEd..88.1155C . дои : 10.1021/ed100843a .
- ^ Шкаламера, Джани; Велькович, Елена; Птичек, Люсия; Самбол, Матия; Млинарич-Майерски, Ката; Басарич, Никола (2017). «Синтез асимметрично дизамещенных антраценов». Тетраэдр . 73 (40): 5892–5899. дои : 10.1016/j.tet.2017.08.038 .
- ^ Хейлброн, ИМ; Хитон, Дж. С. (1923). «9,10-Дибромантрацен». Органические синтезы . 3 : 41. дои : 10.15227/orgsyn.003.0041 .
- ^ Перейти обратно: а б Коллин, Герд; Хёке, Хартмут и Тальбирски, Йорг (2006) «Антрацен» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a02_343.pub2
- ^ Цейтлер, Алекс (27 июня 2012 г.) Конформное покрытие 101: Общий обзор, разработка процесса и методы управления . Кстати, Inc.
- ^ 1-Гидроксиантрацен . Страница данных НИСТ
- ^ 2-Гидроксиантрацен . Страница данных НИСТ
Цитируемые источники
[ редактировать ]- Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). ЦРК Пресс . ISBN 978-1439855119 .