Давление пара


Давление пара [а] или равновесное давление пара — это давление, оказываемое паром, находящимся в термодинамическом равновесии со своими конденсированными фазами (твердыми или жидкими) при данной температуре в закрытой системе . Равновесное давление пара является показателем термодинамической тенденции жидкости к испарению. Это относится к балансу частиц, выходящих из жидкости (или твердого тела) в равновесии с частицами, находящимися в сосуществующей паровой фазе. Вещество с высоким давлением пара при нормальной температуре часто называют летучим . Давление пара, присутствующего над поверхностью жидкости, известно как давление пара. По мере повышения температуры жидкости притягивающие взаимодействия между молекулами жидкости становятся менее значимыми по сравнению с энтропией этих молекул в газовой фазе, что увеличивает давление пара. Таким образом, жидкости с сильными межмолекулярными взаимодействиями, вероятно, будут иметь меньшее давление пара, а для более слабых взаимодействий верно обратное.
Давление пара любого вещества увеличивается нелинейно с температурой, что часто описывается соотношением Клаузиуса-Клапейрона . Точка при атмосферном давлении кипения жидкости (также известная как нормальная точка кипения ) — это температура, при которой давление пара равняется атмосферному давлению окружающей среды. При любом постепенном повышении этой температуры давление пара становится достаточным, чтобы преодолеть атмосферное давление и заставить жидкость образовывать пузырьки пара. Для формирования пузырьков на большей глубине жидкости требуется немного более высокая температура из-за более высокого давления жидкости из-за гидростатического давления массы жидкости наверху. Более важным на малых глубинах является более высокая температура, необходимая для начала образования пузырьков. Поверхностное натяжение стенок пузырька приводит к избыточному давлению в очень маленьких начальных пузырьках.
Давление пара, которое один компонент смеси вносит в общее давление в системе, называется ее парциальным давлением . Например, воздух на уровне моря, насыщенный водяным паром при температуре 20 °C, имеет парциальное давление около 2,3 кПа воды, 78 кПа азота , 21 кПа кислорода и 0,9 кПа аргона , что в сумме составляет 102,2 кПа, что составляет основу для стандартного атмосферного давления .
Измерение и единицы измерения
[ редактировать ]Давление пара измеряется в стандартных единицах давления . Международная система единиц (СИ) признает давление как производную единицу измерения силы на площадь и определяет паскаль (Па) в качестве стандартной единицы. Один паскаль — это один ньютон на квадратный метр (Н·м −2 или кг·м −1 ·с −2 ).
Экспериментальное измерение давления пара — простая процедура для обычных давлений от 1 до 200 кПа. [1] Наиболее точные результаты получаются вблизи температуры кипения вещества; измерения менее 1 кПа подвержены серьезным ошибкам. Процедуры часто состоят из очистки испытуемого вещества, его изоляции в контейнере, удаления постороннего газа и последующего измерения равновесного давления газовой фазы вещества в контейнере при различных температурах. Лучшая точность достигается, если следить за тем, чтобы все вещество и его пары имели заданную температуру. Это часто делается, как и при использовании изотенископа , путем погружения зоны содержания в ванну с жидкостью.
Очень низкое давление паров твердых веществ можно измерить с помощью метода эффузионной ячейки Кнудсена .
В медицинском контексте давление пара иногда выражается в других единицах, например в миллиметрах ртутного столба (мм рт. ст.) . Точное знание давления пара важно для летучих ингаляционных анестетиков , большинство из которых представляют собой жидкости при температуре тела, но имеют относительно высокое давление паров.
Оценка давления пара с помощью уравнения Антуана
[ редактировать ]Уравнение Антуана [2] [3] представляет собой прагматическое математическое выражение связи между давлением пара и температурой чистых жидких или твердых веществ. Он получается путем аппроксимации кривой и адаптирован к тому факту, что давление пара обычно увеличивается и вогнуто в зависимости от температуры. Основная форма уравнения:
и его можно преобразовать в такую явную для температуры форму:
где:
- абсолютное давление паров вещества
- это температура вещества
- , и являются коэффициентами, специфичными для вещества (т.е. константами или параметрами)
- обычно либо или [3]
Иногда используется более простая форма уравнения всего с двумя коэффициентами:
который можно преобразовать в:
Сублимация и испарение одного и того же вещества имеют разные наборы коэффициентов Антуана, как и компоненты в смесях. [2] Каждый набор параметров для конкретного соединения применим только в определенном диапазоне температур. Обычно температурные диапазоны выбираются так, чтобы поддерживать точность уравнения на уровне от нескольких до 8–10 процентов. Для многих летучих веществ доступно несколько различных наборов параметров, которые используются для разных температурных диапазонов. Уравнение Антуана имеет низкую точность при использовании любого набора параметров от точки плавления соединения до его критической температуры. Точность также обычно низкая, когда давление пара ниже 10 Торр из-за ограничений прибора. [ нужна ссылка ] используется для установления значений параметров Антуана.
Уравнение Вагнера [4] дает "один из лучших" [5] соответствует экспериментальным данным, но довольно сложен. Он выражает пониженное давление пара как функцию пониженной температуры.
Связь с температурой кипения жидкостей
[ редактировать ]
Как правило, давление паров жидкостей при температуре окружающей среды увеличивается с понижением температуры кипения. Это проиллюстрировано на диаграмме давления пара (см. справа), на которой показаны графики зависимости давления пара от температуры для различных жидкостей. [6] При нормальной температуре кипения жидкости давление паров равно стандартному атмосферному давлению, определяемому как 1 атмосфера. [7] 760 Торр, 101,325 кПа или 14,69595 фунтов на квадратный дюйм.
Например, при любой заданной температуре хлористый метил имеет самое высокое давление паров среди всех жидкостей, представленных на диаграмме. Он также имеет самую низкую нормальную температуру кипения - -24,2 ° C (-11,6 ° F), где кривая давления пара метилхлорида (синяя линия) пересекает горизонтальную линию в одну атмосферу ( атм абсолютного давления пара ). .
Хотя зависимость между давлением пара и температурой нелинейна, на диаграмме используется логарифмическая вертикальная ось для создания слегка изогнутых линий, поэтому на одной диаграмме можно отобразить множество жидкостей. Почти прямая линия получается, если отобразить логарифм давления пара в зависимости от 1/(T + 230). [8] где Т — температура в градусах Цельсия. Давление пара жидкости при температуре ее кипения равно давлению окружающей среды.
Жидкие смеси: закон Рауля
[ редактировать ]Закон Рауля дает приближение к давлению пара смесей жидкостей. В нем говорится, что активность (давление или фугитивность ) однофазной смеси равна взвешенной по мольным долям сумме давлений паров компонентов:
где - давление паров смеси, - мольная доля компонента в жидкой фазе и - мольная доля компонента в паровой фазе соответственно. давление паров компонента . Закон Рауля применим только к неэлектролитам (незаряженным веществам); он наиболее подходит для неполярных молекул со слабым межмолекулярным притяжением (например, силами Лондона ).
О системах, давление паров которых выше, чем указано в приведенной выше формуле, говорят, что они имеют положительные отклонения. Такое отклонение предполагает более слабое межмолекулярное притяжение, чем в чистых компонентах, так что молекулы можно считать менее прочно «удерживаемыми» в жидкой фазе, чем в чистой жидкости. Примером является азеотроп примерно 95% этанола и воды. Поскольку давление пара азеотропа выше, чем предсказывает закон Рауля, он кипит при температуре ниже температуры любого чистого компонента.
Существуют также системы с отрицательными отклонениями, у которых давление пара ниже ожидаемого. Такое отклонение свидетельствует о более сильном межмолекулярном притяжении между компонентами смеси, чем в чистых компонентах. Таким образом, молекулы «удерживаются» в жидкости сильнее, когда присутствует вторая молекула. Примером может служить смесь трихлорметана (хлороформа) и 2-пропанона (ацетона), которая кипит выше температуры кипения любого чистого компонента.
Отрицательные и положительные отклонения можно использовать для определения коэффициентов термодинамической активности компонентов смесей.
Твердые вещества
[ редактировать ]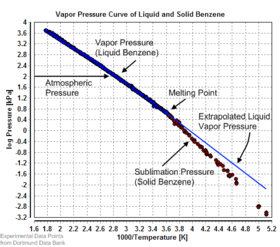
Равновесное давление пара можно определить как давление, достигаемое, когда конденсированная фаза находится в равновесии с собственным паром. В случае равновесного твердого тела, такого как кристалл , это можно определить как давление, при котором скорость сублимации твердого тела соответствует скорости осаждения его паровой фазы. Для большинства твердых веществ это давление очень низкое, но некоторыми заметными исключениями являются нафталин , сухой лед (давление паров сухого льда составляет 5,73 МПа (831 фунт на квадратный дюйм, 56,5 атм) при 20 ° C, что приводит к разрыву большинства герметичных контейнеров) и лед. Все твердые материалы имеют давление пара. Однако из-за их часто чрезвычайно низких значений измерение может быть довольно трудным. Типичные методы включают использование термогравиметрии и транспирации газа.
Существует ряд методов расчета давления сублимации (т. е. давления пара) твердого тела. Один из методов состоит в том, чтобы оценить давление сублимации на основе экстраполированного давления паров жидкости (переохлажденной жидкости), если теплота плавления , с использованием этой конкретной формы соотношения Клаузиуса-Клапейрона: известна [9]
где:
- – давление сублимации твердого компонента при температуре .
- - экстраполированное давление пара жидкого компонента при температуре .
- это теплота плавления.
- это газовая постоянная .
- – температура сублимации.
- – температура плавления.
Этот метод предполагает, что теплота плавления не зависит от температуры, игнорирует дополнительные температуры перехода между различными твердыми фазами и дает точную оценку температур, не слишком далеких от точки плавления. Это также показывает, что давление сублимации ниже, чем экстраполированное давление паров жидкости (Δ fus H > 0), и разница растет с увеличением расстояния от точки плавления.
Точка кипения воды
[ редактировать ]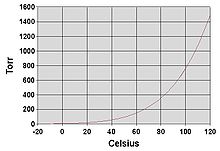
Как и все жидкости, вода закипает, когда давление ее пара достигает окружающего давления. В природе атмосферное давление ниже на возвышенностях и вода кипит при более низкой температуре. Температуру кипения воды при атмосферном давлении можно аппроксимировать уравнением Антуана :
или преобразовано в эту явно выраженную по температуре форму:
где температура - температура кипения в градусах Цельсия и давление находится в торре .
Правило Дюринга
[ редактировать ]Правило Дюринга гласит, что существует линейная зависимость между температурами, при которых два раствора оказывают одинаковое давление пара.
Примеры
[ редактировать ]В следующей таблице представлен список различных веществ, упорядоченных по увеличению давления паров (в абсолютных единицах).
| Вещество | Давление пара | Температура (°С) | ||
|---|---|---|---|---|
| (хорошо) | (бар) | (мм рт.ст.) | ||
| Октаэтиленгликоль [10] | 9.2×10 −8 Хорошо | 9.2×10 −13 | 6.9×10 −10 | 89.85 |
| Глицерин | 0,4 Па | 0.000004 | 0.003 | 50 |
| Меркурий | 1 Ну | 0.00001 | 0.0075 | 41.85 |
| вольфрам | 1 Ну | 0.00001 | 0.0075 | 3203 |
| дифторид ксенона | 600 Па | 0.006 | 4.50 | 25 |
| Вода (Н 2 О) | 2,3 кПа | 0.023 | 17.5 | 20 |
| Пропанол | 2,4 кПа | 0.024 | 18.0 | 20 |
| Метилизобутилкетон | 2,66 кПа | 0.0266 | 19.95 | 25 |
| Пентакарбонил железа | 2,80 кПа | 0.028 | 21 | 20 |
| Этанол | 5,83 кПа | 0.0583 | 43.7 | 20 |
| Фреон 113 | 37,9 кПа | 0.379 | 284 | 20 |
| ацетальдегид | 98,7 кПа | 0.987 | 740 | 20 |
| Бутан | 220 кПа | 2.2 | 1650 | 20 |
| Формальдегид | 435,7 кПа | 4.357 | 3268 | 20 |
| Пропан [11] | 997,8 кПа | 9.978 | 7584 | 26.85 |
| Карбонилсульфид | 1,255 МПа | 12.55 | 9412 | 25 |
| Закись азота [12] | 5,660 МПа | 56.60 | 42453 | 25 |
| Углекислый газ | 5,7 МПа | 57 | 42753 | 20 |
Оценка давления пара по молекулярной структуре
[ редактировать ]Существует несколько эмпирических методов оценки давления пара на основе молекулярной структуры органических молекул. Некоторые примеры: метод SIMPOL.1, [13] метод Моллера и др., [9] ИСПАРЕНИЕ (Оценка давления пара органики с учетом температурных, внутримолекулярных и неаддитивных эффектов). [14] [15]
Значение в метеорологии
[ редактировать ]В метеорологии термин «давление пара» означает парциальное давление водяного пара в атмосфере, даже если оно не находится в равновесии. [16] Это отличается от его значения в других науках. [16] Согласно Американского метеорологического общества глоссарию метеорологии , давление насыщенного пара правильно относится к равновесному давлению пара воды над плоской поверхностью жидкой воды или твердого льда и является функцией только температуры и того, является ли конденсированная фаза жидкой или твердой. [17] Относительная влажность определяется относительно давления насыщенного пара. [18] Равновесное давление пара не требует, чтобы конденсированная фаза имела плоскую поверхность; он может состоять из крошечных капель, возможно, содержащих растворенные вещества (примеси), например облако . [19] [18] Равновесное давление пара может существенно отличаться от давления насыщенного пара в зависимости от размера капель и присутствия других частиц, которые действуют как ядра конденсации облаков . [19] [18]
Однако эти термины используются непоследовательно, и некоторые авторы используют «давление насыщенного пара» за пределами узкого значения, данного в Глоссарии AMS . Например, в тексте об атмосферной конвекции говорится: « Эффект Кельвина приводит к тому, что давление насыщенного пара над изогнутой поверхностью капли становится больше, чем над плоской поверхностью воды» (выделено автором). [20]
Все еще актуальный термин « давление пара насыщения» происходит от устаревшей теории о том, что водяной пар растворяется в воздухе и что воздух при данной температуре может удерживать только определенное количество воды, прежде чем станет «насыщенным». [18] На самом деле, как утверждает закон Дальтона (известный с 1802 г.), парциальное давление водяного пара или любого вещества вообще не зависит от воздуха, а соответствующей температурой является температура жидкости. [18] Тем не менее, среди общественности и даже метеорологов сохраняется ошибочное мнение, чему способствуют вводящие в заблуждение термины « давление насыщения» и «пересыщение» , а также связанное с ними определение относительной влажности . [18]
См. также
[ редактировать ]- Абсолютная влажность
- Уравнение Антуана
- Метод Ли-Кеслера
- Осмотический коэффициент
- Закон Рауля : понижение давления пара в растворе.
- Давление пара по Риду
- Относительная влажность
- Относительная волатильность
- Плотность насыщенного пара
- Тройная точка
- Истинное давление пара
- Равновесие пар-жидкость
- Давление паров элементов (страница данных)
- Давление пара воды
- Химия высокого давления
Примечания
[ редактировать ]- ^ Записанное давление пара в Великобритании; см. различия в написании .
Ссылки
[ редактировать ]- ^ Ружичка, К.; Фулем М. и Ружичка В. «Давление паров органических соединений. Измерение и корреляция» (PDF) . Архивировано из оригинала (PDF) 26 декабря 2010 г. Проверено 18 октября 2009 г.
- ^ Jump up to: а б Что такое уравнение Антуана? (Химический факультет, Государственный университет Фростбурга , Мэриленд )
- ^ Jump up to: а б Синнот, РК (2005). Химический технологический дизайн] (4-е изд.). Баттерворт-Хайнеманн. п. 331. ИСБН 978-0-7506-6538-4 .
- ^ Вагнер, В. (1973), «Новые измерения давления паров аргона и азота и новый метод установления рациональных уравнений давления пара», Cryogenics , 13 (8): 470–482, Bibcode : 1973Cryo...13..470W , дои : 10.1016/0011-2275(73)90003-9
- ^ Справочник инженеров-химиков Перри, 7-е изд. стр. 4–15
- ^ Перри, Р. Х.; Грин, Д.В., ред. (1997). Справочник инженеров-химиков Перри (7-е изд.). МакГроу-Хилл. ISBN 978-0-07-049841-9 .
- ^ Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2002). Общая химия (8-е изд.). Прентис Холл. п. 484 . ISBN 978-0-13-014329-7 .
- ^ Дрейсбах, Р.Р. и Спенсер, Р.С. (1949). «Бесконечные точки семейств диаграмм Кокса и значения dt/dP при любом давлении». Промышленная и инженерная химия . 41 (1): 176. doi : 10.1021/ie50469a040 .
- ^ Jump up to: а б Моллер Б.; Рэри Дж.; Рамьюгернатх Д. (2008). «Оценка давления пара неэлектролитных органических соединений по групповым вкладам и групповым взаимодействиям». Журнал молекулярных жидкостей . 143 : 52–63. дои : 10.1016/j.molliq.2008.04.020 .
- ^ Кригер, Ульрих К.; Зигрист, Франциска; Марколли, Клаудия; Эмануэльссон, Ева У.; Гёбель, Фрейя М.; Бильде, Мерете (8 января 2018 г.). «Набор справочных данных для проверки методов измерения давления пара: гомологический ряд полиэтиленгликолей» (PDF) . Методы измерения атмосферы . 11 (1). Публикации Коперника : 49–63. Бибкод : 2018АМТ....11...49К . дои : 10.5194/amt-11-49-2018 . ISSN 1867-1381 . S2CID 41910898 . Архивировано (PDF) из оригинала 9 октября 2022 г. Проверено 7 апреля 2022 г.
- ^ « Теплофизические свойства жидкостей II - метан, этан, пропан, изобутан и нормальный бутан ». Архивировано 21 декабря 2016 г. в Wayback Machine (стр. 110 PDF-файла, стр. 686 исходного документа), Б. А. Янглав и Дж. Ф. Эли.
- ^ « Теплофизические свойства закиси азота » (стр. 14 PDF, стр. 10 исходного документа), ESDU.
- ^ Панков, Дж. Ф.; и др. (2008). «SIMPOL.1: простой метод группового вклада для прогнозирования давления пара и энтальпии испарения многофункциональных органических соединений» . Атмосфера. хим. Физ . 8 (10): 2773–2796. Бибкод : 2008ACP.....8.2773P . дои : 10.5194/acp-8-2773-2008 .
- ^ «Давление пара чистых жидких органических соединений: оценка по ИСПАРЕНИЮ» . Моделирование химии тропосферы в BIRA-IASB . 11 июня 2014 года . Проверено 26 ноября 2018 г.
- ^ Компернолле, С.; и др. (2011). «ИСПАРЕНИЕ: новый метод оценки давления пара для органических молекул, включая неаддитивность и внутримолекулярные взаимодействия» . Атмосфера. хим. Физ . 11 (18): 9431–9450. Бибкод : 2011ACP....11.9431C . дои : 10.5194/acp-11-9431-2011 .
- ^ Jump up to: а б Американское метеорологическое общество (2012 г.). «давление пара» . Словарь метеорологии . Проверено 28 ноября 2022 г.
- ^ Американское метеорологическое общество (2020). «давление насыщенного пара» . Словарь метеорологии . Проверено 28 ноября 2022 г.
- ^ Jump up to: а б с д и ж Бабин, Стивен М. (1998). «Относительная влажность и давление насыщенного пара: краткое руководство» . Лаборатория прикладной физики Университета Джонса Хопкинса . Архивировано из оригинала 13 июля 1998 г. Проверено 28 ноября 2022 г. (Альтернативное название: «Мифы о водяном паре: краткое руководство».)
- ^ Jump up to: а б Американское метеорологическое общество (2012 г.). «равновесное давление пара» . Словарь метеорологии . Проверено 28 ноября 2022 г.
- ^ Рэймонд, Дэвид Дж. (12 мая 2011 г.). «Глава 5: Облачная микрофизика» (PDF) . Атмосферная конвекция . Институт горного дела и технологий Нью-Мексико . п. 73. Архивировано (PDF) из оригинала 29 марта 2017 г. Проверено 28 ноября 2022 г.
Внешние ссылки
[ редактировать ]- Таблица характеристик жидкости , преимущество инженера
- Давление пара , Гиперфизика
- Давление пара , Гиперглоссарий MSDS
- Онлайн-инструмент для расчета давления пара (требуется регистрация)
- Прогнозирование давления паров чистых жидких органических соединений




























