Меркурий (стихия)
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Меркурий | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | блестящая, серебристая жидкость | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Hg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Меркурий в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Автомобиль ] 4f 14 5д 10 6 с 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 32, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | жидкость | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 234,3210 К (-38,8290 ° C, -37,8922 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 629,88 К (356,73 °С, 674,11 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около комнатной температуры ) | 13,546 г/см 3 [3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тройная точка | 234,3156 К, 1,65×10 −7 кПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 1750 К, 172,00 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 2,29 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 59,11 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 27,983 Дж/(моль·К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стадии окисления | −2, +1 , +2 (слабоосновный оксид ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 2,00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 151 час. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 132±17:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 155 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | ромбоэдрический ( hR1 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Константы решетки | а р = 15:01.06 α = 70,529° в час = 15:47,64 c h = 673,20 вечера (в тройной точке) [4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 60,4 мкм/(м⋅К) (при 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 8,30 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 961 нОм⋅м (при 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −33.44 × 10 −6 см 3 /моль (293 К) [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | жидкость: 1451,4 м/с (при 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7439-97-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Древние египтяне (до 1500 г. до н.э. ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Символ | «Hg»: от латинского названия Hydrargyrum , которое происходит от греческого HYDRARGYROS , «вода-серебро». | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотопы ртути | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ртуть — химический элемент ; он имеет символ Hg и атомный номер 80. Он также известен как ртуть и ранее назывался гидраргирум ( / h aɪ ˈ d r ɑːr dʒ ər ə m / hy- DRAR -jər-əm ) от греческих слов hydor (вода) и аргирос (серебро). [8] Тяжелый стандартной серебристый элемент с d-блоком , ртуть — единственный металлический элемент, который, как известно, находится в жидком состоянии при температуре и давлении ; единственным другим элементом, который является жидким в этих условиях, является бромгалоген , хотя такие металлы , как цезий , галлий и рубидий, плавятся при температуре чуть выше комнатной . [а]
Ртуть встречается в месторождениях по всему миру в основном в виде киновари ( сульфида ртути ). Красный пигмент киновари получают путем измельчения натуральной киновари или синтетического сульфида ртути. Воздействие ртути и ртутьсодержащих органических соединений токсично для нервной системы , иммунной системы и почек человека и других животных; Отравление ртутью может возникнуть в результате воздействия водорастворимых форм ртути (таких как хлорид сулемы или метилртуть ) либо напрямую, либо посредством механизмов биомагнификации .
Ртуть используется в термометрах , барометрах , манометрах , сфигмоманометрах , поплавковых клапанах , ртутных переключателях , ртутных реле , люминесцентных лампах и других устройствах, хотя опасения по поводу токсичности элемента привели к постепенному отказу от таких ртутьсодержащих приборов. [9] он по-прежнему используется в научных исследованиях и в составе амальгамы для реставрации зубов В некоторых регионах . Он также используется в люминесцентном освещении . Электричество, пропущенное через пары ртути в люминесцентной лампе, производит коротковолновый ультрафиолетовый свет , который затем вызывает люминофора в трубке флуоресценцию , создавая видимый свет.
Характеристики
Физические свойства

Ртуть — тяжелый серебристо-белый металл, жидкий при комнатной температуре. По сравнению с другими металлами он плохой проводник тепла, но хороший проводник электричества. [11]
Он имеет температуру плавления -38,83 ° C. [б] и температура кипения 356,73 °С. [с] , [12] [13] [14] оба являются самыми низкими из всех стабильных металлов, хотя предварительные эксперименты с коперницием и флеровием показали, что они имеют еще более низкие температуры кипения. [15] Этот эффект обусловлен сокращением лантаноидов и релятивистским сжатием, уменьшающим радиус орбиты крайних электронов и, таким образом, ослабляющим металлические связи в ртути. [12] При замерзании объем ртути уменьшается на 3,59%, а ее плотность изменяется с 13,69 г/см. 3 в жидком состоянии до 14,184 г/см 3 когда твердый. Коэффициент объемного расширения 181,59×10. −6 при 0 °С, 181,71 × 10 −6 при 20 °C и 182,50 × 10 −6 при 100 °С (на °С). Твердая ртуть податлива и пластична, ее можно резать ножом. [16]
Таблица теплофизических свойств жидкой ртути: [17] [18]
| Температура (°С) | Плотность (кг/м^3) | Удельная теплоемкость (кДж/кг К) | Кинематическая вязкость (м^2/с) | Проводимость (Вт/м·К) | Температуропроводность (м^2/с) | Число Прандтля | Объемный модуль (К^-1) |
Химические свойства
Ртуть не реагирует с большинством кислот, таких как разбавленная серная кислота , хотя кислоты-окислители, такие как концентрированная серная кислота и азотная кислота или царская водка, растворяют ее с образованием сульфата , нитрата и хлорида . Подобно серебру, ртуть реагирует с сероводородом воздуха . Ртуть вступает в реакцию с твердыми чешуйками серы, которые используются в наборах для устранения ртути для поглощения ртути (в наборах для устранения утечки также используется активированный уголь и порошкообразный цинк). [19]
Амальгамы

Ртуть растворяет многие металлы, такие как золото и серебро, с образованием амальгам . Железо является исключением, и для транспортировки материала традиционно использовались железные фляги. [20] Некоторые другие переходные металлы первого ряда, за исключением марганца , меди и цинка, также устойчивы к образованию амальгам. Другие элементы, которые с трудом образуют амальгамы с ртутью, включают платину . [21] [22] Амальгама натрия является распространенным восстановителем в органическом синтезе , а также используется в высокого давления натриевых лампах .
Ртуть легко соединяется с алюминием , образуя амальгаму ртути и алюминия при контакте двух чистых металлов. Поскольку амальгама разрушает слой оксида алюминия , который защищает металлический алюминий от глубокого окисления (как при ржавлении железа ), даже небольшое количество ртути может серьезно разъедать алюминий. По этой причине ртуть не допускается на борт самолета в большинстве случаев из-за риска образования амальгамы с открытыми алюминиевыми деталями самолета. [23]
Ртутное охрупчивание является наиболее распространенным типом жидкометаллического охрупчивания, поскольку ртуть является естественным компонентом некоторых углеводородных резервуаров и при нормальных условиях вступает в контакт с нефтеперерабатывающим оборудованием. [24]
изотопы
Существует семь стабильных изотопов ртути, причем 202
Ртуть является наиболее распространенной (29,86%). Самыми долгоживущими радиоизотопами являются 194
Hg с периодом полураспада 444 года и 203
Hg с периодом полураспада 46,612 дней. Период полураспада большинства оставшихся радиоизотопов составляет менее суток. 206
В природе ртуть встречается в виде крошечных следов как промежуточный продукт распада 238
В . 199
ртуть и 201
Hg — наиболее часто изучаемые ЯМР -активные ядра, имеющие спины 1 ⁄ 2 и 3 ⁄ 2 соответственно. [11]
Этимология

«Hg» — современный химический символ ртути. Это аббревиатура гидраргирума , латинизированной формы древнегреческого названия ртути ὑδράργυρος ( гидраргирос ). Гидраргирос — греческое составное слово, означающее «вода-серебро», от ὑδρ — ( гидр —), корня ὕδωρ ( гидор ) — «вода», и ἄργυρος ( аргирос ) — «серебро». [8] Как и английское название Quicksilver («живое серебро»), это название произошло из-за жидких и блестящих свойств ртути. [25]
Современное английское название «Меркурий» происходит от планеты Меркурий . В средневековой алхимии семь известных металлов — ртуть, золото , серебро , медь , железо , свинец и олово — были связаны с семью планетами. Ртуть ассоциировалась с самой быстрой планетой, названной в честь римского бога Меркурия , который ассоциировался со скоростью и подвижностью. Астрологический символ планеты стал одним из алхимических символов металла, а «Меркурий» стал альтернативным названием металла. Ртуть - единственный металл, для которого сохранилось алхимическое планетарное название, поскольку было решено, что в качестве химического названия предпочтительнее «ртуть». [26] [27]
История
Ртуть была найдена в египетских гробницах, датируемых 1500 годом до нашей эры; [28] киноварь , наиболее распространенный природный источник ртути, использовался со времен неолита . [29]
В Китае и Тибете считалось, что употребление ртути продлевает жизнь, лечит переломы и поддерживает в целом хорошее здоровье, хотя сейчас известно, что воздействие паров ртути приводит к серьезным неблагоприятным последствиям для здоровья. [30] Первый император объединенного Китая, Цинь Шу Хуан Ди, предположительно похороненный в гробнице , содержащей реки текущей ртути на модели земли, которой он правил, представитель рек Китая, как сообщается, был убит, выпив ртуть и измельченный нефрит. смесь, составленная алхимиками Цинь , задуманная как эликсир бессмертия. [31] [32] Хумаравайх ибн Ахмад ибн Тулун , второй тулунидский правитель Египта (годы правления 884–896), известный своей расточительностью и расточительностью, как сообщается, построил таз, наполненный ртутью, на котором он лежал на наполненных воздухом подушках и его раскачивали. спать. [33]
В ноябре 2014 года «большие количества» ртути были обнаружены в камере на высоте 60 футов ниже 1800-летней пирамиды, известной как « Храм Пернатого Змея », «третьей по величине пирамиды Теотиуакана » в Мексике, а также «нефритовых статуй». , останки ягуара, ящик, наполненный резными ракушками и резиновыми шариками». [34]
Аристотель рассказывает, что Дедал заставил деревянную статую Венеры двигаться, налив в нее ртути. [35] В греческой мифологии Дедал придавал своим статуям видимость голоса с помощью ртути. Древние греки использовали киноварь (сульфид ртути) в мазях; древние египтяне и римляне использовали его в косметике . В Ламанаи , когда-то главном городе цивилизации майя была обнаружена лужа ртути , под маркером на мезоамериканской площадке для игры в мяч . [36] [37] К 500 году до нашей эры ртуть использовалась для изготовления амальгам (средневековая латинская амальгама , «сплав ртути») с другими металлами. [38]
Алхимики считали ртуть первоматерией, из которой образовались все металлы. Они полагали, что различные металлы можно производить, изменяя качество и количество серы , содержащейся в ртути. Самым чистым из них было золото, а ртуть использовалась в попытках трансмутации неблагородных (или нечистых) металлов в золото, что было целью многих алхимиков. [26]
Шахты в Альмадене (Испания), Монте-Амиата (Италия) и Идрии (ныне Словения) доминировали в производстве ртути с момента открытия рудника в Альмадене 2500 лет назад до тех пор, пока в конце XIX века не были обнаружены новые месторождения. [39]
Возникновение
Ртуть — чрезвычайно редкий элемент в земной коре , его среднее содержание в коре по массе составляет всего 0,08 частей на миллион (ppm). [40] Поскольку ртутные руды не смешиваются геохимически с теми элементами, которые составляют большую часть массы земной коры, ртутные руды могут быть чрезвычайно концентрированными, учитывая обилие этого элемента в обычных горных породах. Самые богатые ртутные руды содержат до 2,5% ртути по массе, и даже самые бедные концентрированные месторождения содержат не менее 0,1% ртути (в 12 000 раз больше среднего содержания в земной коре). Он встречается либо в виде самородного металла (редкий), либо в киновари , метациннавари , сфалерите , кордероите , ливингстоните и других минералах , причем наиболее распространенной рудой является киноварь (HgS). [41] [42] Ртутные руды часто встречаются в горячих источниках или других вулканических регионах. [43]
Начиная с 1558 года, с изобретением патио -процесса извлечения серебра из руды с использованием ртути, ртуть стала важным ресурсом в экономике Испании и ее американских колоний. Ртуть использовалась для добычи серебра из прибыльных рудников Новой Испании и Перу . Первоначально всю ртуть для колоний поставляли рудники испанской короны в Альмадене на юге Испании. [44] Месторождения ртути были обнаружены в Новом Свете, и более 100 000 тонн ртути было добыто в регионе Уанкавелика , Перу, в течение трех столетий после открытия там месторождений в 1563 году. Процесс патио, а затем и пан-амальгамации процесс продолжался. создать большой спрос на ртуть для обработки серебряных руд до конца 19 века. [45]

Бывшие рудники в Италии, США и Мексике, которые когда-то производили большую часть мировых поставок, теперь полностью выработаны или, в случае Словении ( Идрия ) и Испании ( Альмаден ), закрыты из-за падения цены на ртуть. Неваде в Шахта МакДермитт , последняя ртутная шахта в Соединенных Штатах, закрылась в 1992 году. Цена на ртуть на протяжении многих лет была очень нестабильной и в 2006 году составляла 650 долларов за 76-фунтовую (34,46 кг) колбу . [46]
Ртуть извлекают путем нагрева киновари в токе воздуха и конденсации паров. Уравнение для этого извлечения:
- HgS + O 2 → Hg + SO 2

В 2020 году Китай стал крупнейшим производителем ртути, обеспечив 88% мирового производства (2200 тонн из 2500 тонн), за ним следовали Таджикистан (178 тонн), Россия (50 тонн) и Мексика (32 тонны). [47]
Из-за высокой токсичности ртути как добыча киновари, так и переработка ртути являются опасными и историческими причинами отравления ртутью. [48] В Китае труд заключенных использовался частной горнодобывающей компанией совсем недавно, в 1950-х годах, для разработки новых рудников киновари. Горнодобывающая компания Луо Си использовала тысячи заключенных для строительства новых туннелей. [49] Здоровье работников действующих шахт подвергается высокому риску.
Газета утверждала, что неизвестная директива Европейского Союза, призывающая сделать энергосберегающие лампочки обязательными к 2012 году, побудила Китай вновь открыть рудники киновари для получения ртути, необходимой для производства КЛЛ . Экологическая опасность вызывает обеспокоенность, особенно в южных городах Фошань и Гуанчжоу , а также в Гуйчжоу на юго-западе. провинции [49]
Заброшенные предприятия по переработке ртути часто содержат очень опасные кучи отходов обожженных киноварных огарков . Сток воды с таких объектов является признанным источником экологического ущерба. Бывшие ртутные рудники могут быть пригодны для повторного конструктивного использования; например, в 1976 году округ Санта-Клара, штат Калифорния, приобрел историческую шахту Альмаден Ртуть и создал на ее месте окружной парк после проведения обширного анализа безопасности и экологического объекта. [50]
Химия
Все известные соединения ртути обладают одной из двух положительных степеней окисления: I и II. Эксперименты не смогли однозначно продемонстрировать какие-либо более высокие степени окисления: как заявленный в 1976 году электросинтез нестабильных частиц Hg(III), так и криогенное выделение HgF 4 в 2007 году , имеют спорные интерпретации и остаются трудными (если не невозможными) для воспроизведения. [51]
Соединения ртути(I)
В отличие от своих более легких соседей, кадмия и цинка, ртуть обычно образует простые стабильные соединения со связями металл-металл. Большинство соединений ртути(I) диамагнитны и содержат димерный катион Hg. 2+
2 . Стабильные производные включают хлорид и нитрат. Обработка комплексообразования соединений Hg(I) с сильными лигандами, такими как сульфид, цианид и т. д., вызывает диспропорционирование Hg. 2+
и элементарная ртуть. [52] Хлорид ртути(I) , бесцветное твердое вещество, также известное как каломель , на самом деле представляет собой соединение с формулой Hg 2 Cl 2 со связностью Cl-Hg-Hg-Cl. Он реагирует с хлором с образованием хлорида сулемы, который устойчив к дальнейшему окислению. Гидрид ртути (I) — бесцветный газ формулы HgH, не содержащий связи Hg-Hg; однако газ когда-либо наблюдался только в виде изолированных молекул. [53]
Ввиду своей склонности к связыванию с самим собой ртуть образует поликатионы ртути , которые состоят из линейных цепочек ртутных центров, увенчанных положительным зарядом. Одним из примеров является ртуть 2+
3 (АсФ −
6 )
2 . [54]
Соединения ртути(II)
Ртуть(II) является наиболее распространенной степенью окисления, а также основной в природе. Все четыре галогенида ртути известны, и было продемонстрировано, что они образуют линейную координационную геометрию , несмотря на тенденцию ртути образовывать тетраэдрическую молекулярную геометрию с другими лигандами. Такое поведение похоже на поведение Ag + ион. Самый известный галогенид ртути — хлорид ртути(II) , легко сублимируемое белое твердое вещество. [55]
Оксид ртути(II) , основной оксид ртути, образуется, когда металл подвергается длительному воздействию воздуха при повышенных температурах. Он возвращается к элементам при нагревании около 400 °C, как это было продемонстрировано Джозефом Пристли при раннем синтезе чистого кислорода . [19] Гидроксиды ртути плохо охарактеризованы, поскольку попытки исследования выделения гидроксида ртути (II) вместо этого дали оксид ртути. [56]
Будучи мягким металлом , ртуть образует очень стабильные производные с более тяжелыми халькогенами . Выдающимся является сульфид ртути(II) , HgS, который встречается в природе в виде киноварной руды и представляет собой блестящий пигмент киновари . Как и ZnS, HgS кристаллизуется в двух формах : красноватой кубической форме и черной цинковой обманке . [11] Последний иногда встречается в природе в виде метациннавари. [42] Селенид ртути(II) (HgSe) и теллурид ртути(II) (HgTe) также известны; они, а также различные производные, например теллурид ртути-кадмия и теллурид ртути-цинка, являются полупроводниками, полезными в качестве для инфракрасных детекторов . материалов [57]
множество комплексных производных Соли ртути(II) образуют с аммиаком . К ним относятся основание Миллона (Hg 2 N + ), одномерный полимер (соли HgNH +
2 )
n ) и «плавкий белый осадок» или [Hg(NH 3 ) 2 ]Cl 2 . Известный как реактив Несслера , тетраиодомеркурат(II) калия ( HgI 2−
4 ) до сих пор иногда используется для проверки на аммиак из-за его склонности к образованию ярко окрашенной йодистой соли основания Миллона. [58]
Гремучая ртуть — детонатор, широко используемый во взрывчатых веществах . [11]
Ртутьорганические соединения
ртути Органические соединения исторически важны, но не имеют большой промышленной ценности в западном мире. Соли ртути(II) представляют собой редкий пример простых комплексов металлов, которые непосредственно реагируют с ароматическими кольцами. Ртутьорганические соединения всегда двухвалентны, обычно двухкоординатны и имеют линейную геометрию. В отличие от кадмийорганических и цинкорганических соединений, ртутьорганические соединения не вступают в реакцию с водой. Обычно они имеют формулу HgR 2 , которые часто являются летучими, или HgRX, которые часто представляют собой твердые вещества, где R представляет собой арил или алкил , а X обычно представляет собой галогенид или ацетат. Метилртуть , общий термин для соединений с формулой CH 3 HgX, представляет собой опасное семейство соединений, которые часто встречаются в загрязненной воде. [59] Они возникают в результате процесса, известного как биометилирование .
Приложения

Ртуть используется в основном для производства промышленных химикатов или для электрических и электронных устройств. Он используется в некоторых жидкостных термометрах , особенно в тех, которые используются для измерения высоких температур. Все большее количество ртути используется в виде газообразной ртути в люминесцентных лампах , в то время как большинство других применений постепенно вытесняются из-за норм охраны труда и техники безопасности. В некоторых случаях ртуть заменяют менее токсичным, но значительно более дорогим Галинстан сплавом . [60]
Лекарство
Историческое и народное
Ртуть и ее соединения используются в медицине, хотя сегодня они гораздо менее распространены, чем когда-то, поскольку токсическое воздействие ртути и ее соединений стало более широко изучено. Пример раннего терапевтического применения ртути был опубликован в 1787 году Джеймсом Линдом . [61]
В первом издании «Руководства Мерка» (1899 г.) были описаны многие соединения ртути, имеющие тогда медицинское значение, такие как хлорид ртути-аммония , желтый протойодид ртути , каломель и хлорид сулемы и другие. [62]
Ртуть в форме одной из ее распространенных руд, киновари, используется в различных традиционных лекарствах, особенно в традиционной китайской медицине . Обзор ее безопасности показал, что киноварь может привести к значительной ртутной интоксикации при нагревании, передозировке или длительном приеме, а также может иметь побочные эффекты при приеме терапевтических доз, хотя эффекты от терапевтических доз обычно обратимы. Хотя эта форма ртути кажется менее токсичной, чем другие формы, ее использование в традиционной китайской медицине еще не оправдано, поскольку терапевтическая основа использования киновари не ясна. [63]
Хлорид ртути(I) (также известный как каломель или хлорид ртути) использовался в традиционной медицине в качестве мочегонного , местного дезинфицирующего средства и слабительного средства . Хлорид ртути(II) (также известный как хлорид ртути или едкая сулема) когда-то использовался для лечения сифилиса (наряду с другими соединениями ртути), хотя он настолько токсичен, что иногда симптомы его токсичности путали с симптомами сифилиса. считали, что лечат. [64] Его также используют в качестве дезинфицирующего средства. Голубая масса , таблетка или сироп, основным ингредиентом которого является ртуть, на протяжении XIX века назначалась при многочисленных заболеваниях, включая запоры, депрессию, деторождение и зубную боль. [65] В начале 20 века ртуть ежегодно давали детям в качестве слабительного и дегельминтного средства, а также использовали в зубных порошках для младенцев. Содержащий ртуть галоидорганический препарат мербромин (иногда продаваемый как меркурохром) по-прежнему широко используется, но запрещен в некоторых странах, например в США. [66]
Современный
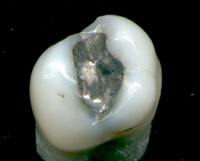
Ртуть входит в состав зубных амальгам . [67]
Тиомерсал (называемый тимерсалом в США ) — это органическое соединение, используемое в качестве консерванта в вакцинах , хотя его использование сокращается. [68] Хотя широко распространено мнение , что этот консервант на основе ртути может вызвать или спровоцировать аутизм у детей, нет никаких доказательств, подтверждающих такую связь. [69] Тем не менее, тиомерсал был исключен из всех вакцин США, рекомендованных для детей в возрасте 6 лет и младше, или сокращен до их следовых количеств, за исключением инактивированной вакцины против гриппа. [68] Мербромин (меркурохром), еще одно соединение ртути, представляет собой местный антисептик, используемый в некоторых странах при небольших порезах и царапинах. Сегодня использование ртути в медицине сильно сократилось по всем показателям, особенно в развитых странах. [70]
Ртуть до сих пор используется в некоторых диуретиках заменители, такие как тиазиды . , хотя в настоящее время для большинства терапевтических целей существуют [71] В 2003 году соединения ртути были обнаружены в некоторых безрецептурных лекарствах , включая местные антисептики , стимулирующие слабительные средства, от опрелостей мази , глазные капли и назальные спреи . « У FDA недостаточно данных, чтобы установить общее признание безопасности и эффективности» ртутных ингредиентов в этих продуктах. [72]
Производство хлора и каустической соды
Хлор производят из хлорида натрия (поваренной соли NaCl) с помощью электролиза для отделения металлического натрия от газообразного хлора. Обычно соль растворяют в воде для получения рассола. Побочными продуктами любого такого хлорщелочного процесса являются водород (H 2 ) и гидроксид натрия (NaOH), который обычно называют каустической содой или щелочью . Безусловно, самое большое использование ртути [73] [74] в конце 20-го века использовался ртутный процесс (также называемый процессом Кастнера-Келлнера ), при котором металлический натрий образуется в виде амальгамы на катоде, сделанном из ртути; затем этот натрий реагирует с водой с образованием гидроксида натрия. [75] Многие промышленные выбросы ртути в 20-м веке произошли в результате этого процесса, хотя современные предприятия заявляют, что они безопасны в этом отношении. [74] Начиная с 1960-х годов, большинство промышленных предприятий перешли от процессов с ртутными элементами к технологиям с диафрагменными элементами для производства хлора, хотя по состоянию на 2005 год 11% хлора, производимого в Соединенных Штатах, все еще производилось с помощью метода с использованием ртутных элементов. [76]
Лабораторное использование
Термометры
Термометры, содержащие ртуть, были изобретены в начале 18 века Даниэлем Габриэлем Фаренгейтом , хотя более ранние попытки создания приборов для измерения температуры, наполненных ртутью, были описаны в 1650-х годах. [77] : 23 Ртутный термометр Фаренгейта был основан на более ранней конструкции, в которой вместо ртути использовался спирт; ртутный термометр был значительно точнее, чем спиртовой. [78] С начала XXI века использование ртутных термометров сокращается, а ртутьсодержащие инструменты были запрещены во многих юрисдикциях после Протокола по тяжелым металлам 1998 года . [79] [80] Современные альтернативы ртутным термометрам включают термометры сопротивления , термопары и термисторные датчики, выводящие данные на цифровой дисплей. [81]
Зеркала
В некоторых транзитных телескопах используется резервуар с ртутью, образующий плоское и абсолютно горизонтальное зеркало, полезное для определения абсолютной вертикальной или перпендикулярной точки отсчета. Вогнутые горизонтальные параболические зеркала могут быть сформированы путем вращения жидкой ртути на диске, причем образующаяся таким образом параболическая форма жидкости отражает и фокусирует падающий свет. Такие телескопы с жидкостным зеркалом дешевле обычных телескопов с большими зеркалами почти в 100 раз, но зеркало нельзя наклонять и оно всегда направлено строго вверх. [82] [83] [84]
Электрохимия
Жидкая ртуть является частью популярного вторичного электрода сравнения (называемого каломельным электродом ) в электрохимии в качестве альтернативы стандартному водородному электроду . Каломельный электрод используется для определения потенциала полуэлементов электродного . [85] Тройная точка ртути, -38,8344 °C, является фиксированной точкой, используемой в качестве стандарта температуры для Международной температурной шкалы ( ITS-90 ). [11]
Полярография и кристаллография
В полярографии используют как капающий ртутный электрод , так и капающий ртутный электрод. [86] и подвесной ртутный каплевидный электрод [87] используйте элементарную ртуть. Такое использование позволяет иметь новый незагрязненный электрод для каждого измерения или каждого нового эксперимента.
Ртутьсодержащие соединения находят применение также в области структурной биологии . Соединения ртути, такие как хлорид ртути (II) или тетраиодомеркурат (II) калия, можно добавлять к кристаллам белков с целью создания производных тяжелых атомов, которые можно использовать для решения фазовой проблемы в рентгеновской кристаллографии с помощью изоморфного замещения или аномального рассеяния методов . . [88]
Нишевое использование
Газообразная ртуть используется в ртутных лампах и некоторых рекламных вывесках типа « неоновые вывески » и люминесцентных лампах . Эти лампы низкого давления излучают очень спектрально узкие линии, которые традиционно используются в оптической спектроскопии для калибровки спектрального положения. Для этой цели продаются коммерческие калибровочные лампы; отражение люминесцентного потолочного света в спектрометр является обычной практикой калибровки. [89] Газообразная ртуть также содержится в некоторых электронных лампах , в том числе в игнитронах , тиратронах и ртутных дуговых выпрямителях . [90] Он также используется в специализированных медицинских лампах для загара и дезинфекции кожи. [91] Газообразная ртуть добавляется в лампы с холодным катодом аргоновые для повышения ионизации и электропроводности . Лампа, наполненная аргоном и не содержащая ртути, будет иметь тусклые пятна и не сможет правильно гореть. Освещение, содержащее ртуть, можно бомбардировать /закачивать в печи только один раз. При добавлении в неоновые трубки в световом излучении возникают непоследовательные красные и синие пятна до тех пор, пока не будет завершен первоначальный процесс прижигания; в конечном итоге он будет светиться постоянным тусклым не совсем синим цветом. [92]
- Глубокое фиолетовое свечение разряда паров ртути в бактерицидной лампе , спектр которого богат невидимым ультрафиолетовым излучением.
- Аппарат для загара, содержащий ртутную лампу низкого давления и две инфракрасные лампы, которые действуют как источник света и электрический балласт.
- Различные типы люминесцентных ламп.
- Миниатюрные атомные часы для глубокого космоса — это часы с линейной ионной ловушкой и ртутью, предназначенные для точной радионавигации в реальном времени в глубоком космосе.
Атомные часы для глубокого космоса (DSAC), разрабатываемые Лабораторией реактивного движения, используют ртуть в часах на основе линейных ионных ловушек. Новое использование ртути позволяет создавать компактные атомные часы с низким энергопотреблением, идеально подходящие для космических зондов и миссий на Марс. [93]
Отбеливание кожи
Ртуть эффективна в качестве активного ингредиента в составах для отбеливания кожи, используемых для депигментации кожи. [94] Минаматская конвенция о ртути ограничивает концентрацию ртути в таких отбеливателях до 1 части на миллион. Однако по состоянию на 2022 год многие коммерчески продаваемые отбеливатели продолжают превышать этот предел и считаются токсичными. [95]
Огнестрельное оружие
Гремучая ртуть(II) представляет собой первичное взрывчатое вещество , которое в основном использовалось в качестве капсюля для патронов огнестрельного оружия на протяжении 19 и 20 веков. [96]
Историческое использование


Во многих исторических приложениях использовались особые физические свойства ртути, особенно как плотной жидкости и жидкого металла:
- Количество жидкой ртути от 90 до 600 граммов (от 3,2 до 21,2 унции) было обнаружено в элитных гробницах майя (100–700 гг. н.э.). [34] или ритуальные тайники в шести местах. Эту ртуть, возможно, использовали в чашах в качестве зеркал в целях гаданий . Пять из них относятся к классическому периоду цивилизации майя (ок. 250–900 гг.), но один пример предшествовал этому. [97]
- В исламской Испании его использовали для наполнения декоративных бассейнов. Позже американский художник Александр Колдер построил ртутный фонтан для Испанского павильона на Всемирной выставке 1937 года в Париже . Сейчас фонтан выставлен в Фонде Жоана Миро в Барселоне . [98]
- Линзы Френеля старых маяков плавали и вращались в ванне с ртутью, которая действовала как подшипник. [99]
- Ртутные сфигмоманометры , барометры , диффузионные насосы , кулонометры и многие другие лабораторные приборы использовали свойства ртути как очень плотной, непрозрачной жидкости с почти линейным тепловым расширением. [100]
- Как электропроводящая жидкость, она использовалась в ртутных выключателях (в том числе в бытовых ртутных выключателях, установленных до 1970 года), переключателях наклона, используемых в старых пожарных извещателях и в некоторых домашних термостатах. [101]
- Благодаря своим акустическим свойствам ртуть использовалась в качестве среды распространения в устройствах памяти с линией задержки, используемых в первых цифровых компьютерах середины 20-го века, таких как компьютер SEAC . [102]
- В 1911 году Хайке Камерлинг-Оннес открыл сверхпроводимость путем охлаждения ртути ниже 4 К, вскоре после открытия и производства жидкого гелия . [103] Позже было установлено, что его сверхпроводящие свойства необычны по сравнению с другими позже открытыми сверхпроводниками, такими как более популярные ниобиевые сплавы. [104] [105]
- Экспериментальные турбины на парах ртути были установлены для повышения эффективности электростанций, работающих на ископаемом топливе. [106] На электростанции Саут-Мидоу в Хартфорде, штат Коннектикут, в качестве рабочего тела использовалась ртуть в бинарной в течение ряда лет, начиная с конца 1920-х годов, в целях повышения эффективности электростанции конфигурации со вторичным водяным контуром. Было построено несколько других электростанций, в том числе станция Шиллера в Портсмуте, штат Нью-Хэмпшир, которая была запущена в эксплуатацию в 1950 году. Идея не получила широкого распространения в отрасли из-за веса и токсичности ртути, а также из-за появления сверхкритических паровых установок в более позднем периоде. годы. [107] [108]
- Точно так же жидкая ртуть использовалась в качестве теплоносителя для некоторых ядерных реакторов ; однако натрий предлагается для реакторов, охлаждаемых жидким металлом, поскольку высокая плотность ртути требует гораздо больше энергии для циркуляции в качестве теплоносителя. [109]
- Ртуть была топливом для первых ионных двигателей в электрических космических двигательных системах. Преимуществами были высокая молекулярная масса ртути, низкая энергия ионизации, низкая энергия двойной ионизации, высокая плотность жидкости и возможность хранения жидкости при комнатной температуре . Недостатками были опасения по поводу воздействия на окружающую среду, связанного с наземными испытаниями, а также опасения по поводу возможного охлаждения и конденсации части топлива на космическом корабле при длительных операциях. Первым космическим полетом с использованием электрической силовой установки был ионный двигатель на ртутном топливе, разработанный в Исследовательском центре Гленна НАСА и запущенный на испытательном космическом корабле SERT-1, запущенном НАСА на летном комплексе в Уоллопсе в 1964 году. Полет SERT-1 за ним последовал полет SERT-2 в 1970 году. Ртуть и цезий были предпочтительными топливами для ионных двигателей, пока исследовательская лаборатория Хьюза не провела исследования, обнаружившие, что газ ксенон может быть подходящей заменой. Ксенон в настоящее время является предпочтительным топливом для ионных двигателей, поскольку он имеет высокую молекулярную массу и малую реакционную способность или вообще ее не имеет. природа благородного газа и высокая плотность жидкости при мягком криогенном хранении. [110] [111]
В других приложениях использовались химические свойства ртути:
- Ртутная батарея — это неперезаряжаемая электрохимическая батарея , первичный элемент , распространенный в середине 20 века. Он использовался в самых разных целях и был доступен в различных размерах, особенно в размерах кнопок. Постоянное выходное напряжение и длительный срок хранения дали ему нишу для использования в фотоэкспонометрах и слуховых аппаратах. Ртутные элементы были фактически запрещены в большинстве стран в 1990-х годах из-за опасений по поводу свалок, загрязняющих ртуть. [112]
- Ртуть использовалась для консервации древесины, создания дагерротипов , серебрения зеркал , [113] противообрастающие краски , [114] гербициды , [115] латексная краска для интерьера, портативные игры-лабиринты, устройства для уборки и выравнивания дорог в автомобилях. Соединения ртути используются в антисептиках , слабительных средствах, антидепрессантах и антисифилитиках . [65] В большинстве, если не во всех, случаях ртуть была заменена более безопасными соединениями.
- Его якобы использовали шпионы союзников наносили ртутную пасту для саботажа самолетов Люфтваффе: на голый алюминий металла , вызывавшую быструю коррозию ; это приведет к структурным сбоям. [116]
- Ртуть когда-то использовалась в качестве очистителя ствола оружия. [117] [118]
- С середины XVIII до середины XIX веков шляп использовался процесс, называемый « морковкой при изготовлении фетровых » . Шкуры животных ополаскивали в оранжевом растворе (от этого цвета возник термин «морковь») соединения ртути нитрата ртути Hg(NO 3 ) 2 ·2H 2 O. [119] В ходе этого процесса мех отделялся от шкуры и спутывался вместе. Этот раствор и выделяемые им пары были очень токсичными. Служба общественного здравоохранения США запретила использование ртути в войлочной промышленности в декабре 1941 года. Психологические симптомы, связанные с отравлением ртутью, послужили причиной появления фразы « безумный как шляпник ». » Льюиса Кэрролла « Безумный Шляпник в его книге « Приключения Алисы в стране чудес» представлял собой игру слов, основанную на старой фразе, но сам персонаж не проявляет симптомов отравления ртутью. [120]
- Исторически ртуть широко использовалась при гидравлической добыче золота , чтобы помочь золоту проникнуть сквозь текущую смесь воды и гравия. Тонкие частицы золота могут образовывать амальгаму ртути и золота и, следовательно, увеличивать скорость извлечения золота. [11] Масштабное использование ртути прекратилось в 1960-х годах. Однако ртуть по-прежнему используется в небольших масштабах, часто тайных, при разведке золота. По оценкам, 45 000 метрических тонн ртути, использованной в Калифорнии для добычи россыпей, не были извлечены. [121] Ртуть также использовалась при добыче серебра для извлечения металла из руды посредством патио-процесса . [122]
Токсичность и безопасность
| Опасности | |
|---|---|
| СГС Маркировка : | |
   | |
| Опасность | |
| Х330 , Х360Д , Х372 , Х410 | |
| P201 , P233 , P260 , P273 , P280 , P304 , P308 , P310 , P313 , P340 , P391 , P403 [123] | |
| NFPA 704 (огненный алмаз) | |
| Часть серии о |
| Загрязнение |
|---|
 |
Жидкая ртуть из-за своих физических свойств и относительной химической инертности очень плохо всасывается через неповрежденную кожу и желудочно-кишечный тракт. [124] Пары ртути представляют собой основную опасность элементарной ртути. В результате контейнеры с ртутью надежно герметизируются, чтобы избежать разливов и испарения. Нагревание ртути или соединений ртути, которые могут разлагаться при нагревании, следует проводить при достаточной вентиляции, чтобы свести к минимуму воздействие паров ртути. Наиболее токсичными формами ртути являются ее органические соединения , такие как диметилртуть и метилртуть . Ртуть может вызвать как хроническое, так и острое отравление. [125] [126]
Релизы в окружающей среде

Доиндустриальные темпы выпадения ртути из атмосферы могли составлять около 4 нг на 1 л выпавшего льда. Извержения вулканов и связанные с ними природные источники являются причиной примерно половины выбросов ртути в атмосферу. [127]
Загрязнение ртутью наружного городского воздуха в начале XXI века измерялось на уровне 0,01–0,02 мкг/м. 3 . В ходе исследования 2001 года были измерены уровни ртути в 12 закрытых помещениях, выбранных с учетом типов зданий, их местоположений и возрастов в районе Нью-Йорка. Это исследование показало, что концентрация ртути значительно выше, чем концентрация на открытом воздухе, в диапазоне 0,0065–0,523 мкг/м. 3 . Среднее значение составило 0,069 мкг/м. 3 . [128]
Половина выбросов ртути приходится на человечество. Источники можно разделить на следующие оценочные проценты: [129]
- 65% приходится на стационарное сжигание, из которых угольные электростанции крупнейшим совокупным источником являются (40% выбросов ртути в США в 1999 г.). Сюда входят электростанции, работающие на газе, из которых ртуть не была удалена. Выбросы от сжигания угля на один-два порядка выше, чем выбросы от сжигания нефти, в зависимости от страны. [129]
- 11% от добычи золота. Тремя крупнейшими точечными источниками выбросов ртути в США являются три крупнейших золотых рудника. Гидрогеохимические выбросы ртути из хвостов золотых рудников считаются важным источником атмосферной ртути на востоке Канады. [130]
- 6,8% приходится на производство цветных металлов , обычно на металлургические заводы .
- 6,4% от производства цемента .
- 3,0% от утилизации отходов , включая бытовые и опасные отходы , крематориев и сжигания осадков сточных вод .
- 3,0% от производства каустической соды .
- 1,4% от производства чугуна и стали .
- 1,1% от производства ртути, в основном для аккумуляторов.
- 2,0% из других источников.
Приведенные выше проценты представляют собой оценки глобальных антропогенных выбросов ртути в 2000 году, исключая сжигание биомассы, важного источника в некоторых регионах. [129]
Серьезной промышленной катастрофой стал сброс отходов ртутных соединений в залив Минамата , Япония, в период с 1932 по 1968 год. По оценкам, более 3000 человек пострадали от различных уродств, тяжелых симптомов отравления ртутью или умерли от того, что стало известно как болезнь Минамата . [131] [132]
По оценкам, Китай производит 50% выбросов ртути, большая часть которых связана с производством винилхлорида . [133]
Ртуть также попадает в окружающую среду в результате неправильной утилизации ртутьсодержащих продуктов. [134] Из-за проблем со здоровьем (см. ниже) усилия по сокращению использования токсичных веществ направлены на сокращение или исключение ртути из таких продуктов. Например, количество ртути, проданной в термостатах в США, снизилось с 14,5 тонн в 2004 году до 3,9 тонн в 2007 году. [135]
Табачное растение легко поглощает и накапливает в своих листьях тяжелые металлы, такие как ртуть, из окружающей почвы. Впоследствии они вдыхаются во время курения табака . [136] Хотя ртуть входит в состав табачного дыма , [137] исследования в основном не смогли обнаружить значимой корреляции между курением и потреблением ртути людьми по сравнению с такими источниками, как профессиональное воздействие, потребление рыбы и амальгамные зубные пломбы . [138]
Менее известный источник ртути — сжигание бумажной бумаги . [139] Это обычная традиция, практикуемая в Азии, включая Китай, [140] Вьетнам, Гонконг, Таиланд, Тайвань и Малайзия. [141]
Очистка разливов
Разливы ртути представляют собой непосредственную угрозу для людей, работающих с материалом, а также представляют опасность для окружающей среды, если материал не содержится должным образом. Это вызывает особую озабоченность в отношении видимой ртути или ртути в жидком состоянии, поскольку ее необычный внешний вид и поведение для металла делают ее привлекательной неприятностью для неосведомленных людей. [142] Разработаны процедуры локализации разливов ртути, а также рекомендации по соответствующим мерам реагирования с учетом условий разлива. [143] [144] Отслеживание жидкой ртути за пределами места разлива является серьезной проблемой при разливах жидкой ртути; правила подчеркивают, что сдерживание видимой ртути является первым действием, за которым следует мониторинг паров ртути и очистка паров. Некоторые продукты продаются в качестве адсорбентов для разлива ртути : от солей металлов до полимеров и цеолитов . [145]
Загрязнение осадками
Отложения в крупных городских промышленных устьях служат важным поглотителем точечных источников и рассеивают ртутное загрязнение внутри водосборных бассейнов . [146] В ходе исследования прибрежных отложений устья Темзы , проведенного в 2015 году , общее содержание ртути составило от 0,01 до 12,07 мг/кг со средним значением 2,10 мг/кг и медианным значением 0,85 мг/кг (n = 351). [146] Было показано, что самые высокие концентрации ртути наблюдаются в Лондоне и его окрестностях в сочетании с мелкозернистым илом и высоким общим содержанием органического углерода. [146] Сильное сродство ртути к отложениям, богатым углеродом, также наблюдалось в отложениях солончаков реки Мерси со средней концентрацией от 2 мг/кг до 5 мг/кг. [147] Эти концентрации намного выше, чем в отложениях ручьев солончаков Нью-Джерси и мангровых зарослях Южного Китая, где концентрация ртути низкая, около 0,2 мг/кг. [148] [149]
Профессиональное воздействие

Из-за последствий воздействия ртути на здоровье ее промышленное и коммерческое использование во многих странах регулируется. Всемирная организация здравоохранения , [150] OSHA и NIOSH рассматривают ртуть как профессиональную опасность; OSHA и NIOSH, среди других регулирующих органов, установили конкретные пределы профессионального воздействия этого элемента и его производных соединений в жидкой и парообразной форме. [151] [152] Выбросы в окружающую среду и утилизация ртути регулируются в США главным образом Агентством по охране окружающей среды США .
Рыба
Рыбы и моллюски имеют естественную тенденцию концентрировать ртуть в своем организме, часто в форме метилртути , высокотоксичного органического соединения ртути. Виды рыб, занимающие верхние позиции в пищевой цепи , такие как акула , рыба-меч , королевская макрель , голубой тунец , тунец-альбакор и кафель , содержат более высокие концентрации ртути, чем другие. Поскольку ртуть и метилртуть жирорастворимы, они в основном накапливаются во внутренних органах , хотя обнаруживаются также и в мышечной ткани. [153] Присутствие ртути в мышцах рыб можно изучить с помощью нелетальной биопсии мышц . [154] Ртуть, присутствующая в добыче рыбы, накапливается в организме хищника, который ее поедает. Поскольку рыба менее эффективно очищает метилртуть, чем накапливает ее, концентрация метилртути в тканях рыбы со временем увеличивается. Таким образом, виды, находящиеся на вершине пищевой цепи, накапливают в организме ртуть, которая может быть в десять раз выше, чем виды, которые они потребляют. Этот процесс называется биомагнификацией . Отравление ртутью произошло в Минамате , Япония , и теперь называется болезнью Минамата . [131] [132]
Косметика
Некоторые кремы для лица содержат опасные уровни ртути. Большинство из них содержат сравнительно нетоксичную неорганическую ртуть, однако встречаются продукты, содержащие высокотоксичную органическую ртуть. [155] [156] Нью-Йорка подвергаются воздействию значительных уровней неорганических соединений ртути при использовании средств по уходу за кожей. Было обнаружено, что жители [157]
Последствия и симптомы отравления ртутью
Токсическое воздействие включает повреждение головного мозга, почек и легких. Отравление ртутью может привести к нескольким заболеваниям, включая акродинию (розовую болезнь), синдром Хантера-Рассела и болезнь Минаматы . Симптомы обычно включают сенсорные нарушения (зрения, слуха, речи), нарушение чувствительности и отсутствие координации. Тип и степень проявлений симптомов зависят от конкретного токсина, дозы, метода и продолжительности воздействия. Исследования «случай-контроль» показали такие эффекты, как тремор, нарушение когнитивных навыков и нарушение сна у работников, подвергающихся хроническому воздействию паров ртути даже при низких концентрациях в диапазоне 0,7–42 мкг/м. 3 . [158] [159]
Исследование показало, что острое воздействие (4–8 часов) расчетных уровней элементарной ртути от 1,1 до 44 мг/м 3 привело к боли в груди, одышке , кашлю, кровохарканью , нарушению функции легких и признакам интерстициального пневмонита . [125] Было показано, что острое воздействие паров ртути приводит к глубоким последствиям для центральной нервной системы, включая психотические реакции, характеризующиеся бредом, галлюцинациями и склонностью к суициду. Профессиональное воздействие привело к широкому спектру функциональных нарушений, включая возбудимость , раздражительность, возбудимость, чрезмерную застенчивость и бессонницу. При продолжительном воздействии развивается мелкий тремор, который может перерасти в сильные мышечные спазмы. Тремор сначала поражает руки, а затем распространяется на веки, губы и язык. Длительное воздействие низкого уровня было связано с более тонкими симптомами возбудимости, включая усталость, раздражительность, потерю памяти, яркие сны и депрессию. [126] [160]
Уход
Исследования по лечению отравления ртутью ограничены. В настоящее время доступные препараты для лечения острого отравления ртутью включают хелаторы N -ацетил- D , L - пеницилламин (NAP), британский антилюизит (BAL), 2,3-димеркапто-1-пропансульфоновую кислоту (DMPS) и димеркаптоянтарную кислоту (DMSA). . В одном небольшом исследовании, в котором приняли участие 11 строителей, подвергшихся воздействию элементарной ртути, пациентов лечили DMSA и NAP. [161] Хелатная терапия обоими препаратами привела к мобилизации небольшой доли предполагаемой ртути в организме. DMSA смог увеличить выведение ртути в большей степени, чем NAP. [161]
Правила
Международный
140 стран согласились в Минаматской конвенции по ртути Программы Организации Объединенных Наций по окружающей среде (ЮНЕП) предотвращать выбросы паров ртути. [162] Конвенция была подписана 10 октября 2013 года. [163]
Соединенные Штаты
В Соединенных Штатах Агентство по охране окружающей среды отвечает за регулирование и управление ртутным загрязнением. Несколько законов наделяют Агентство по охране окружающей среды такими полномочиями, в том числе Закон о чистом воздухе , Закон о чистой воде , Закон о сохранении и восстановлении ресурсов и Закон о безопасной питьевой воде . Кроме того, Закон об обращении с ртутьсодержащими и перезаряжаемыми батареями , принятый в 1996 году, постепенно прекращает использование ртути в батареях и обеспечивает эффективную и экономичную утилизацию многих типов использованных батарей. [164] На долю Северной Америки в 1995 году пришлось примерно 11% общих мировых антропогенных выбросов ртути. [165]
Закон США о чистом воздухе , принятый в 1990 году, включил ртуть в список токсичных загрязнителей, которые необходимо контролировать в максимально возможной степени. Таким образом, отрасли промышленности, которые выбрасывают высокие концентрации ртути в окружающую среду, согласились внедрить максимально достижимые технологии контроля (MACT). В марте 2005 года Агентство по охране окружающей среды опубликовало постановление. [166] это добавило электростанции в список источников, которые следует контролировать, и установило национальную систему ограничения выбросов и торговли . Штатам было дано до ноября 2006 года ввести более строгий контроль, но после судебного иска со стороны нескольких штатов эти правила были отменены федеральным апелляционным судом 8 февраля 2008 года. Это правило было сочтено недостаточным для защиты здоровья людей, живущих вблизи угля. электростанции, работающие на электростанциях, учитывая негативные последствия, задокументированные в отчете об исследовании Агентства по охране окружающей среды Конгрессу в 1998 году. [167] Однако новые данные, опубликованные в 2015 году, показали, что после введения более строгого контроля уровень ртути резко снизился, что указывает на то, что Закон о чистом воздухе оказал запланированное воздействие. [168]
Агентство по охране окружающей среды объявило о новых правилах для угольных электростанций . 22 декабря 2011 года [169] К цементным печам , сжигающим опасные отходы, применяются более мягкие стандарты, чем к стандартным опасных отходов установкам для сжигания в Соединенных Штатах, и в результате они являются непропорциональным источником ртутного загрязнения. [170]
Евросоюз
В Европейском Союзе директива об ограничении использования некоторых опасных веществ в электрическом и электронном оборудовании (см. RoHS ) запрещает использование ртути в некоторых электрических и электронных продуктах и ограничивает количество ртути в других продуктах до уровня менее 1000 частей на миллион . [171] Существуют ограничения по концентрации ртути в упаковке (предел 100 ppm по сумме ртути, свинца , шестивалентного хрома и кадмия ) и аккумуляторах (предел 5 ppm). [172] В июле 2007 года Европейский Союз также запретил использование ртути в неэлектрических измерительных устройствах, таких как термометры и барометры . Запрет распространяется только на новые устройства и содержит исключения для сектора здравоохранения и двухлетний льготный период для производителей барометров. [173]
Норвегия ввела полный запрет на использование ртути при производстве и импорте/экспорте ртутных продуктов с 1 января 2008 года. [174] В 2002 году было обнаружено, что несколько озер в Норвегии имеют плохое загрязнение ртутью: в их отложениях содержание ртути превышает 1 мкг/г. [175] В 2008 году министр экологического развития Норвегии Эрик Солхейм заявил: «Ртуть является одним из самых опасных токсинов для окружающей среды. Удовлетворительные альтернативы ртути в продуктах доступны, и поэтому вполне уместно ввести запрет». [176] Продукты, содержащие ртуть, были запрещены в Швеции в 2009 году. [177] [178] в то время как элементарная ртуть запрещена к производству и использованию во всех сферах применения, за исключением некоторых (например, в некоторых энергосберегающих источниках света и амальгамных зубных пломбах) в Дании с 2008 года. [179]
См. также
- Процесс COLEX (разделение изотопов)
- Загрязнение океана ртутью
- Красная ртуть
Примечания
Ссылки
- ^ «Стандартный атомный вес: Меркурий» . ЦИАВ . 2011.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Фелауэр, Х.; Беттин, Х. (2004). «Плотность ртути – измерения и эталонные значения» . Метрология . 41 (2): С16–С22. дои : 10.1088/0026-1394/41/2/S02 . Проверено 8 июля 2023 г.
- ^ Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ «Магнитная восприимчивость элементов и неорганических соединений» (PDF) . www-d0.fnal.gov . Национальная ускорительная лаборатория Ферми: Эксперимент DØ (запоздалый документ). Архивировано из оригинала (PDF) 24 марта 2004 года . Проверено 18 февраля 2015 г.
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Перейти обратно: а б «Определение гидраргирума | Dictionary.com» . Архивировано из оригинала 12 августа 2014 года . Проверено 22 декабря 2022 г. Полный словарь Random House Webster .
- ^ «Что делает Агентство по охране окружающей среды в отношении выбросов ртути в воздух?» . Агентство по охране окружающей среды США (EPA). Архивировано из оригинала 8 февраля 2007 года . Проверено 1 мая 2007 г.
- ^ «Новая 12-гранная фунтовая монета поступит в обращение в марте» . Новости Би-би-си . 1 января 2017 года . Проверено 2 января 2017 г.
- ^ Перейти обратно: а б с д и ж Хаммонд, ЧР «Элементы» (PDF) . Архивировано из оригинала (PDF) 26 июня 2008 г. в Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Перейти обратно: а б Норрби, ЖЖ (1991). «Почему ртуть жидкая? Или почему релятивистские эффекты не попадают в учебники химии?». Журнал химического образования . 68 (2): 110. Бибкод : 1991ЖЧЭд..68..110Н . дои : 10.1021/ed068p110 . S2CID 96003717 .
- ^ Сенезе, Ф. «Почему ртуть при STP является жидкостью?» . Общая химия онлайн в Государственном университете Фростбурга. Архивировано из оригинала 4 апреля 2007 года . Проверено 1 мая 2007 г.
- ^ Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. стр. 4.125–4.126. ISBN 0-8493-0486-5 .
- ^ «Динамическая таблица Менделеева» . www.ptable.com . Архивировано из оригинала 20 ноября 2016 года . Проверено 22 ноября 2016 г.
- ^ Саймонс, EN (1968). Путеводитель по необычным металлам . Фредерик Мюллер. п. 111.
- ^ Холман, Джек П. (2002). Теплопередача (9-е изд.). Нью-Йорк, штат Нью-Йорк: cGraw-Hill Companies, Inc., стр. 600–606. ISBN 978-0-07-240655-9 .
- ^ Incropera, Фрэнк П. (2007). Основы тепломассообмена (6-е изд.). Хобокен, Нью-Джерси: John Wiley and Sons, Inc., стр. 941–950. ISBN 978-0-471-45728-2 .
- ^ Перейти обратно: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Свакхамер, Барри (26 ноября 2011 г.). «Хранилище Меркурия» . База данных исторических маркеров . Проверено 11 декабря 2023 г.
- ^ Гмелин, Леопольд (1852). Справочник по химии . Кавендишское общество. С. 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt). Архивировано из оригинала 9 мая 2013 года . Проверено 30 декабря 2012 г.
- ^ Соратур, С.Х. (2002). Основы стоматологических материалов . Издательство Jaypee Brothers. п. 14. ISBN 978-81-7179-989-3 .
- ^ Варгель, К.; Жак, М.; Шмидт, член парламента (2004). Коррозия алюминия . Эльзевир. п. 158. ИСБН 978-0-08-044495-6 .
- ^ Кейс, Раймундо; Макинтайр, Дейл Р. (14 марта 2010 г.). Ртутный жидкий металл, охрупчивающий сплавы для добычи и переработки нефти и газа .
- ^ Пересмотренный полный словарь Вебстера . Спрингфилд, Массачусетс: G. & C. Merriam . 1913. OCLC 800618302 . Проверено 27 декабря 2023 г.
- ^ Перейти обратно: а б Стиллман, Дж. М. (2003). История алхимии и ранней химии . Издательство Кессинджер. стр. 7–9. ISBN 978-0-7661-3230-6 . OCLC 233637688 .
- ^ Морис Кросланд (2004) Исторические исследования на языке химии
- ^ «Ртуть и окружающая среда — Основные факты» . Окружающая среда Канады , Федеральное правительство Канады. 2004. Архивировано из оригинала 16 сентября 2011 года . Проверено 27 марта 2008 г.
- ^ Мартин Гил, Дж.; Мартин Гил, FJ; Делиб Кастро, Г.; Сапожник Магдалина, П.; Кузнец Сарабия, ФДж (1995). «Первое известное использование вермиллиона» Опыт 51 (8): 759–761. дои : 10.1007/BF01922425 . ISSN 0014-4754 . ПМИД 7649232 . S2CID 21900879 .
- ^ «Меркурий — стихия древних» . Центр наук о гигиене окружающей среды, Дартмутский колледж . Архивировано из оригинала 2 декабря 2012 года . Проверено 9 апреля 2012 г.
- ^ «Цинь Шихуан» . Министерство культуры Китайской Народной Республики . 2003. Архивировано из оригинала 4 июля 2008 года . Проверено 27 марта 2008 г.
- ^ Райт, Дэвид Кертис (2001). История Китая . Издательская группа Гринвуд. п. 49. ИСБН 978-0-313-30940-3 .
- ^ Собернхайм, Мориц (1987). «Хумараваих» . В Хоутсме, Мартин Теодор (ред.). Первая энциклопедия ислама Э. Дж. Брилла, 1913–1936, том IV: «Итк – Кватта» . Лейден: БРИЛЛ. п. 973. ИСБН 978-90-04-08265-6 . Архивировано из оригинала 3 июня 2016 года.
- ^ Перейти обратно: а б Юхас, Алан (24 апреля 2015 г.). «Жидкая ртуть, найденная под мексиканской пирамидой, может привести к гробнице короля » Хранитель . ISSN 0261-3077 . Архивировано из оригинала 1 декабря 2016 года . Проверено 22 ноября 2016 г.
- ^ Хикс, Р.Д. (1907). «Глава 3». Аристотель де Анима . Кембридж: Издательство Кембриджского университета. Текст
- ^ Пендергаст, Дэвид М. (6 августа 1982 г.). «Древняя ртуть майя». Наука . 217 (4559): 533–535. Бибкод : 1982Sci...217..533P . дои : 10.1126/science.217.4559.533 . ПМИД 17820542 . S2CID 39473822 .
- ^ «Ламанай» . Архивировано из оригинала 11 июня 2011 года . Проверено 17 июня 2011 г.
- ^ Гессен, RW (2007). Ювелирное дело через историю . Издательская группа Гринвуд. п. 120. ИСБН 978-0-313-33507-5 .
- ^ Эйслер, Р. (2006). Опасность ртути для живых организмов . ЦРК Пресс. ISBN 978-0-8493-9212-2 .
- ^ Эрлих, Х.Л.; Ньюман, ДК (2008). Геомикробиология . ЦРК Пресс. п. 265. ИСБН 978-0-8493-7906-2 .
- ^ Ритуба, Джеймс Дж (2003). «Ртуть из месторождений полезных ископаемых и потенциальное воздействие на окружающую среду». Экологическая геология . 43 (3): 326–338. дои : 10.1007/s00254-002-0629-5 . S2CID 127179672 .
- ^ Перейти обратно: а б «Метациннабарь» . Mindat.org . Проверено 16 ноября 2023 г.
- ^ «Переработка ртути в США в 2000 году» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 26 марта 2009 г. Проверено 7 июля 2009 г.
- ^ Беркхолдер, М. и Джонсон, Л. (2008). Колониальная Латинская Америка . Издательство Оксфордского университета. стр. 157–159. ISBN 978-0-19-504542-0 .
- ^ Джеймисон, RW (2000). Внутренняя архитектура и энергетика . Спрингер. п. 33. ISBN 978-0-306-46176-7 .
- ^ Брукс, МЫ (2007). «Меркурий» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 27 мая 2008 г. Проверено 30 мая 2008 г.
- ^ «Мировая добыча полезных ископаемых» (PDF) . п. 48 . Проверено 22 ноября 2023 г.
- ^ «Спасибо президенту Обаме и администратору Джексону за защиту нас от токсичной ртути» . Act.credoaction.com . 21 декабря 2011 г. Архивировано из оригинала 1 мая 2012 г. Проверено 30 декабря 2012 г.
- ^ Перейти обратно: а б Шеридан, М. (3 мая 2009 г.). « «Зеленые» лампочки отравляют рабочих: сотни работников фабрик заболевают ртутью, используемой в лампочках, предназначенных для Запада» . The Sunday Times (Лондон, Великобритания). Архивировано из оригинала 17 мая 2009 года.
- ^ Булланд М (2006). Новый Альмаден . Издательство Аркадия. п. 8. ISBN 978-0-7385-3131-1 .
- ^ Общий обзор см. Ридель, С.; Каупп, М. (2009). «Высшие состояния окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–624. дои : 10.1016/j.ccr.2008.07.014 .
Заявленный синтез 1976 г. Деминг, Ричард Л.; Оллред, Алабама; Даль, Алан Р.; Херлингер, Альберт В.; Кестнер, Марк О. (июль 1976 г.). «Триположительная ртуть. Низкотемпературное электрохимическое окисление тетрафторбората 1,4,8,11-тетраазациклотетрадеканртути(II)». Журнал Американского химического общества . 98 (14): 4132–4137. дои : 10.1021/ja00430a020 ; но обратите внимание, что Рейдель и Каупп цитируют более позднюю работу, утверждающую, что циклама . вместо этого окисляется лиганд
Заявленная изоляция 2007 года Сюэфан Ван; Эндрюс, Лестер; Ридель, Себастьян; Каупп, Мартин (2007). «Ртуть — переходный металл: первое экспериментальное свидетельство существования HgF 4 ». Энджью. хим. Межд. Эд . 46 (44): 8371–8375. дои : 10.1002/anie.200703710 . PMID 17899620 , но спектральная идентификация оспаривается в Номера, JF; Уилсон, А.В.; Харви, И.; Бриджман, Эй Джей; Янг, Н.А. (2008). «Взаимодействие ртути с фтором: исследование матричной изоляции Hg⋯F 2 , HgF 2 и HgF 4 в матрицах аргона». Физ хим хим физ . 10 (31): 4594–605. Бибкод : 2008PCCP...10.4594R . дои : 10.1039/b805608k . ПМИД 18665309 .
- ^ Хендерсон, В. (2000). Основная группа химии . Великобритания: Королевское химическое общество. п. 162. ИСБН 978-0-85404-617-1 . Архивировано из оригинала 13 мая 2016 года.
- ^ Найт, Лон Б. (1971). «Сверхтонкое взаимодействие, химическая связь и изотопный эффект в молекулах ZnH, CdH и HgH». Журнал химической физики . 55 (5): 2061–2070. Бибкод : 1971ЖЧФ..55.2061К . дои : 10.1063/1.1676373 .
- ^ Браун, ID; Гиллеспи, Р.Дж.; Морган, КР; Тун, З.; Уммат, ПК (1984). «Получение и кристаллическая структура гексафторниобата ртути ( Hg
33НбФ
6 ) и гексафторотанталат ртути ( Hg
3 ТаФ
6 ): соединения слоя ртути». Неорганическая химия . 23 (26): 4506–4508. doi : 10.1021/ic00194a020 . - ^ Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 7 (11-е изд.). Издательство Кембриджского университета. п. 197.
- ^ Андерегг, Г.; Шварценбах, Г.; Падмойо, М.; Борг, О. Ф (1958). «Мономолекулярно растворенный гидроксид ртути и его основность». Helvetica Chimica Acta . 41 (4): 988–996. дои : 10.1002/hlca.19580410411 .
- ^ Рогальский, А (2000). Инфракрасные детекторы . ЦРК Пресс. п. 507. ИСБН 978-90-5699-203-3 .
- ^ Фогель, Артур И.; Свехла, Г. (1979), Учебник Фогеля по макро- и полумикро-качественному неорганическому анализу (5-е изд.), Лондон: Longman, стр. 319, ISBN 0-582-44367-9 – через Интернет-архив
- ^ Комитет по токсикологическому воздействию метилртути; Совет по экологическим исследованиям и токсикологии; Комиссия по наукам о жизни; Национальный исследовательский совет (2000). Токсикологическое действие метилртути . Пресса национальных академий. ISBN 978-0-309-07140-6 .
- ^ Сурманн, П; Зеят, Х. (ноябрь 2005 г.). «Вольтамперометрический анализ с использованием самовозобновляемого безртутного электрода». Аналитическая и биоаналитическая химия . 383 (6): 1009–13. дои : 10.1007/s00216-005-0069-7 . ПМИД 16228199 . S2CID 22732411 .
- ^ Линд, Дж (1787). «Отчет об эффективности ртути в лечении воспалительных заболеваний и дизентерии» . Лондонский медицинский журнал . 8 (Часть 1): 43–56. ISSN 0952-4177 . ПМЦ 5545546 . ПМИД 29139904 .
- ^ Руководство компании Merck, 1899 г. (1-е изд.). Архивировано из оригинала 24 августа 2013 года . Проверено 16 июня 2013 г.
- ^ Лю Дж; Ши Дж.З.; Ю Л.М.; Гойер Р.А.; Депутат Валкеса (2008). «Ртуть в традиционных лекарствах: токсикологически киноварь похожа на обычные ртуть?» . Эксп. Биол. Мед. (Мэйвуд) . 233 (7): 810–7. дои : 10.3181/0712-MR-336 . ПМЦ 2755212 . ПМИД 18445765 .
- ^ Пимпл К.Д., Педрони Дж.А., Бердон В. (9 июля 2002 г.). «Сифилис в истории» . Центр Пойнтера по изучению этики и американских институтов при Университете Индианы в Блумингтоне. Архивировано из оригинала 16 февраля 2005 года . Проверено 17 апреля 2005 г.
- ^ Перейти обратно: а б Мэйелл, Х. (17 июля 2007 г.). «Сделал ли Меркьюри в «Маленьких синих таблетках» Авраама Линкольна странным?» . Национальные географические новости . Архивировано из оригинала 22 мая 2008 года . Проверено 15 июня 2008 г.
- ^ «Что случилось с Меркурохромом?» . 23 июля 2004 г. Архивировано из оригинала 11 апреля 2009 г. Проверено 7 июля 2009 г.
- ^ «Зубные амальгамные пломбы» . Силвер-Спринг, Мэриленд: Управление по контролю за продуктами и лекарствами США (FDA). 29 сентября 2020 г.
- ^ Перейти обратно: а б «Тимеросал в вакцинах» . Управление по контролю за продуктами и лекарствами / Центр оценки и исследований биологических препаратов. 6 сентября 2007 года. Архивировано из оригинала 29 сентября 2007 года . Проверено 1 октября 2007 г.
- ^ Паркер С.К., Шварц Б., Тодд Дж., Пикеринг Л.К. (2004). «Вакцины, содержащие тимеросал, и расстройства аутистического спектра: критический обзор опубликованных оригинальных данных». Педиатрия . 114 (3): 793–804. CiteSeerX 10.1.1.327.363 . дои : 10.1542/пед.2004-0434 . ПМИД 15342856 . S2CID 1752023 .
Ошибка: Паркер С.К., Тодд Дж., Шварц Б., Пикеринг Л.К. (январь 2005 г.). «Вакцины, содержащие тимеросал, и расстройства аутистического спектра: критический обзор опубликованных оригинальных данных». Педиатрия . 115 (1): 200. doi : 10.1542/peds.2004-2402 . ПМИД 15630018 . S2CID 26700143 . - ^ «Количественный и качественный анализ соединений ртути из списка» . Федеральный закон о пищевых продуктах, лекарствах и косметике (Закон FD&C) . Управление по контролю за продуктами и лекарствами США . 30 апреля 2009 г.
- ^ Бейер К.Х. (сентябрь 1993 г.). «Хлоротиазид. Как тиазиды развивались в качестве антигипертензивной терапии» . Гипертония . 22 (3): 388–91. дои : 10.1161/01.hyp.22.3.388 . ПМИД 8349332 .
- ^ «Раздел 21 — Продукты питания и лекарства. Глава I — Управление по контролю за продуктами и лекарствами. Департамент здравоохранения и социальных служб. Подраздел D — Свод федеральных правил по лекарствам для использования человеком» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 13 марта 2007 года . Проверено 1 мая 2007 г.
- ^ «Ежегодник товаров CRB (ежегодный)». Ежегодник товаров CRB : 173. 2000. ISSN 1076-2906 .
- ^ Перейти обратно: а б Леопольд, БР (2002). «Глава 3: Производственные процессы с участием ртути. Использование и выбросы ртути в США » (PDF) . Национальная исследовательская лаборатория по управлению рисками, Управление исследований и разработок, Агентство по охране окружающей среды США, Цинциннати, Огайо. Архивировано из оригинала (PDF) 21 июня 2007 года . Проверено 1 мая 2007 г.
- ^ «Онлайн-схема процесса хлорирования ртутных элементов» . Евро хлор. Архивировано из оригинала 2 сентября 2006 года . Проверено 15 сентября 2006 г.
- ^ О'Брайен, Томас Ф.; Боммараджу, Тилак В.; Хайн, Фумио, ред. (2005). «История хлорщелочной промышленности» . Справочник по хлор-щелочной технологии . Бостон, Массачусетс: Спрингер. стр. 17–36. дои : 10.1007/0-306-48624-5_2 . ISBN 978-0-306-48624-1 . Проверено 5 октября 2020 г.
- ^ Миддлтон, ВЕК (1966). История термометра и его применение в метеорологии . Джонс Хопкинс Пресс. ISBN 9780801871535 .
- ^ Григулл, Ульрих (1966). Фаренгейт, пионер точной термометрии . (Материалы 8-й Международной конференции по теплопередаче, Сан-Франциско, 1966, том 1, стр. 9–18.)
- ^ «Протокол по тяжелым металлам» . ЕЭК ООН . Проверено 10 августа 2014 г.
- ^ «Закон о сокращении выбросов ртути 2003 года» . Соединенные Штаты. Конгресс. Сенат. Комитет по окружающей среде и общественным работам . Проверено 6 июня 2009 г.
- ^ «Альтернативы ртутному термометру: альтернативы ртутному термометру» . nist.gov . Национальный институт стандартов и технологий. 29 ноября 2021 г. Проверено 22 декабря 2023 г.
- ^ «Телескоп с жидким зеркалом, который придаст наблюдению за звездами новый взгляд» . Говерт Шиллинг. 14 марта 2003 г. Архивировано из оригинала 18 августа 2003 г. Проверено 11 октября 2008 г.
- ^ Гибсон, БК (1991). «Жидкозеркальные телескопы: история». Журнал Королевского астрономического общества Канады . 85 : 158. Бибкод : 1991JRASC..85..158G .
- ^ «Группа жидких зеркал и адаптивной оптики Университета Лаваля» . Архивировано из оригинала 18 сентября 2011 года . Проверено 24 июня 2011 г.
- ^ Бранс, Ю.В.; Хэй WW (1995). Физиологический мониторинг и инструментальная диагностика в перинатальной и неонатальной медицине . Архив Кубка. п. 175. ИСБН 978-0-521-41951-2 .
- ^ Зоски, Синтия Г. (7 февраля 2007 г.). Справочник по электрохимии . Эльзевир Наука. ISBN 978-0-444-51958-0 .
- ^ Киссинджер, Питер; Хейнеман, Уильям Р. (23 января 1996 г.). Лабораторные методы в электроаналитической химии, второе издание, исправленное и расширенное (2-е изд.). КПР. ISBN 978-0-8247-9445-3 .
- ^ Пайк, Эшли CW; Гарман, Элспет Ф.; Кройер, Тобиас; фон Делфт, Франк; Карпентер, Элизабет П. (1 марта 2016 г.). «Обзор производных тяжелых атомов белковых кристаллов» . Acta Crystallographica Раздел D. 72 (Часть 3): 303–318. Бибкод : 2016AcCrD..72..303P . дои : 10.1107/S2059798316000401 . ISSN 2059-7983 . ПМЦ 4784662 . ПМИД 26960118 .
- ^ Хопкинсон, Греция; Гудман, ТМ; Принц, СР (2004). Руководство по использованию и калибровке оборудования детекторной матрицы . СПАЙ Пресс. п. 125. Бибкод : 2004gucd.book.....H . ISBN 978-0-8194-5532-1 .
- ^ Ховатсон А.Х. (1965). «Глава 8». Введение в газовые разряды . Оксфорд: Пергамон Пресс. ISBN 978-0-08-020575-5 .
- ^ Майло Дж.Э.; Касто, Британская Колумбия (1990). Трансформация диплоидных фибробластов человека . ЦРК Пресс. п. 104. ИСБН 978-0-8493-4956-0 .
- ^ Сионоя, С. (1999). Справочник по фосфору . ЦРК Пресс. п. 363. ИСБН 978-0-8493-7560-6 .
- ^ Роберт Л. Тьёлкер; и др. (2016). «Ионные часы ртути для демонстрационной миссии технологий НАСА». Транзакции IEEE по ультразвуку, сегнетоэлектрике и контролю частоты . 63 (7): 1034–1043. Бибкод : 2016ITUFF..63.1034T . дои : 10.1109/TUFFC.2016.2543738 . ПМИД 27019481 . S2CID 3245467 .
- ^ Мохаммед, Терри; Мохаммед, Элизабет; Баскомб, Шермель (9 октября 2017 г.). «Оценка общего содержания ртути и мышьяка в кремах для отбеливания кожи, обычно используемых в Тринидаде и Тобаго, и их потенциального риска для жителей Карибского бассейна» . Журнал исследований общественного здравоохранения . 6 (3): 1097. doi : 10.4081/Jphr.2017.1097 . ПМК 5736993 . ПМИД 29291194 .
- ^ Мира Сентилингам, «Кремы для отбеливания кожи, содержащие высокий уровень ртути, продолжают продаваться на крупнейших в мире сайтах электронной коммерции, говорится в новом отчете», 9 марта 2022 г., CNN https://www.cnn.com/2022/03/ 09/world/zmwg-skin-whitening-creams-mercury-ecommerce-sites-intl-cmd/index.html
- ^ Вишняк, Хайме (2012). «Эдвард Чарльз Ховард. Взрывчатка, метеориты и сахар» . Химическое образование . 23 (2). Национальный автономный университет Мексики: 230–239. дои : 10.1016/s0187-893x(17)30114-3 . ISSN 0187-893X .
- ^ Хили, Пол Ф.; Блейни, Марк Г. (2011). «Древние мозаичные зеркала майя: функция, символика и значение». Древняя Мезоамерика . 22 (2): 229–244 (241). дои : 10.1017/S0956536111000241 . S2CID 162282151 .
- ^ Лью К. (2008). Меркурий . Издательская группа Розен. п. 10. ISBN 978-1-4042-1780-5 .
- ^ Пирсон Л.Ф. (2003). Маяки . Издательство Оспри. п. 29. ISBN 978-0-7478-0556-4 .
- ^ Раманатан Э. Химия AIEEE . Книги Суры. п. 251. ИСБН 978-81-7254-293-1 .
- ^ Шелтон, К. (2004). Электромонтажные работы . Нельсон Торнс. п. 260. ИСБН 978-0-7487-7979-6 .
- ^ Эккерт, JP (октябрь 1953 г.). «Обзор систем цифровой компьютерной памяти». Труды ИРЭ . 41 (10): 1393–1406. дои : 10.1109/JRPROC.1953.274316 .
- ^ ван Делфт, Дирк; Кес, Питер (1 сентября 2010 г.). «Открытие сверхпроводимости» . Физика сегодня . Архивировано из оригинала 14 ноября 2023 года . Проверено 6 декабря 2023 г.
- ^ Треска, Чезаре; Пророк, Джон; Марини, Джованни; Бачелет, Джованни Б.; Санна, Антонио; Каландра, Маттео; Боэри, Лилия (3 ноября 2022 г.). «Почему ртуть является сверхпроводником» . Физический обзор Б. 106 (18). arXiv : 2111.13867 . Бибкод : 2022PhRvB.106r0501T . doi : 10.1103/PhysRevB.106.L180501 . hdl : 11573/1659661 . ISSN 2469-9950 . S2CID 244715089 .
- ^ Берлинкур, Т.Г. и Хейк, Р.Р. (1962). «Исследование сверхпроводящих сплавов переходных металлов в импульсном магнитном поле при высоких и низких плотностях тока». Бюллетень Американского физического общества . II-7 : 408.
- ^ «Популярная наука» . Научно-популярный ежемесячник . 118 (3). Bonnier Corporation: 40. 1931. ISSN 0161-7370 .
- ^ Мюллер, Гровер К. (сентябрь 1929 г.). Дешевая мощность от Quicksilver . Популярная наука.
- ^ «Ртуть как рабочее тело» . Музей ретро-техники . 13 ноября 2008 г. Архивировано из оригинала 21 февраля 2011 г.
- ^ Джеймс Коллиер; Джеффри Ф. Хьюитт (1987). Введение в ядерную энергетику . Тейлор и Фрэнсис. п. 64. ИСБН 978-1-56032-682-3 .
- ^ «Вклад Гленна в Deep Space 1» . НАСА. 21 мая 2008 г. Архивировано из оригинала 1 октября 2009 г. Проверено 7 июля 2009 г.
- ^ «Электрическая космическая двигательная установка» . Интернет-энциклопедия науки . Дэвид Дарлинг. Архивировано из оригинала 30 мая 2009 года . Проверено 7 июля 2009 г.
- ^ «Информационный бюллетень IMERC: Использование ртути в батареях» . Северо-восточная ассоциация чиновников по управлению отходами. Январь 2010 г. Архивировано из оригинала 29 ноября 2012 г. Проверено 20 июня 2013 г.
- ^ Меркурий Серебрение , заархивировано из оригинала 4 марта 2005 года , получено 12 февраля 2010 года .
- ^ «Оловоорганические соединения в окружающей среде» . Открытый химик . Архивировано из оригинала 10 марта 2007 года.
- ^ Смарт, Н.А. (1968). «Использование и остатки соединений ртути в сельском хозяйстве». Обзоры остатков / Rückstands-Berichte . Том. 23. стр. 1–36. дои : 10.1007/978-1-4615-8437-7_1 . ISBN 978-1-4615-8439-1 . ПМИД 4875698 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Грей, Т. (22 сентября 2004 г.). «Удивительный ржавеющий алюминий» . Популярная наука . Архивировано из оригинала 20 июля 2009 года . Проверено 7 июля 2009 г.
- ^ Фрэнсис, GW (1849). Химические эксперименты . Д. Фрэнсис. п. 62.
- ^ Замки, WT; Кимбалл, В.Ф. (2005). Огнестрельное оружие и его использование . Издательство Кессинджер. п. 104. ИСБН 978-1-4179-8957-7 .
- ^ Ли, доктор юридических наук (1999). Краткая неорганическая химия . Уайли-Блэквелл. ISBN 978-0-632-05293-6 .
- ^ Уолдрон, ХА (1983). «Безумный Шляпник отравился ртутью?» . Бр. Мед. Дж. (Клин. Рес. Ред.) . 287 (6409): 1961. doi : 10.1136/bmj.287.6409.1961 . ПМК 1550196 . ПМИД 6418283 .
- ^ Альперс, Китай; Хунерлах, член парламента; Мэй, JY; Хотем, Р.Л. «Загрязнение ртутью в результате исторической добычи золота в Калифорнии» . Геологическая служба США. Архивировано из оригинала 22 февраля 2008 года . Проверено 26 февраля 2008 г.
- ^ «Амальгамация ртути» . Коррозионные врачи . Архивировано из оригинала 19 мая 2009 года . Проверено 7 июля 2009 г.
- ^ «Меркурий 294594» . Сигма-Олдрич .
- ^ АЦДР. 1999. Токсикологический профиль ртути. Атланта, Джорджия: Агентство по регистрации токсичных веществ и заболеваний. «Архивная копия» (PDF) . Архивировано (PDF) из оригинала 21 июля 2011 года . Проверено 22 февраля 2011 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ Перейти обратно: а б Макфарланд, Р.Б. и Рейгель, Х. (1978). «Хроническое отравление ртутью в результате однократного кратковременного воздействия». Дж. Оккуп. Мед . 20 (8): 532–4. дои : 10.1097/00043764-197808000-00003 . ПМИД 690736 .
- ^ Перейти обратно: а б Ртуть , монография № 001 «Критерии гигиены окружающей среды», Женева: Всемирная организация здравоохранения, 1976, ISBN. 92-4-154061-3
- ^ «Керны ледникового льда демонстрируют рекорд естественного и антропогенного осаждения ртути в атмосфере за последние 270 лет» . Геологическая служба США (USGS). Архивировано из оригинала 4 июля 2007 года . Проверено 1 мая 2007 г.
- ^ «Воздушный Меркурий в помещении» (PDF) . Северо-восточная ассоциация чиновников по управлению отходами. Май 2003 г. Архивировано из оригинала (PDF) 25 марта 2009 г. . Проверено 7 июля 2009 г.
- ^ Перейти обратно: а б с Пацина Е.Г.; Пацина Дж. М.; Стенхейзен Ф; Уилсон С. (2006). «Глобальный кадастр антропогенных выбросов ртути за 2000 год». Атмос Энвайрон . 40 (22): 4048. Бибкод : 2006AtmEn..40.4048P . дои : 10.1016/j.atmosenv.2006.03.041 .
- ^ Мапрани, Анту К.; Ал, Том А.; МакКуорри, Керри Т.; Далзил, Джон А.; Шоу, Шон А.; Йейтс, Филипп А. (2005). «Определение уклонения ртути в загрязненном верховье реки». Экологические науки и технологии . 39 (6): 1679–87. Бибкод : 2005EnST...39.1679M . дои : 10.1021/es048962j . ПМИД 15819225 .
- ^ Перейти обратно: а б «Болезнь Минамата: история и меры» . Министерство окружающей среды, правительство Японии. Архивировано из оригинала 24 июня 2009 года . Проверено 7 июля 2009 г.
- ^ Перейти обратно: а б Деннис Нормил (27 сентября 2013 г.). «В Минамате Меркурий все еще делится». Наука . 341 (6153): 1446–7. Бибкод : 2013Sci...341.1446N . дои : 10.1126/science.341.6153.1446 . ПМИД 24072902 .
- ^ Чириминна, Розария; Фаллетта, Эрмелинда; Делла Пина, Кристина; Телес, Хоаким Энрике; Пальяро, Марио (2016). «Промышленное применение золотого катализа». Angewandte Chemie, международное издание . 55 (46): 1433–7851. дои : 10.1002/anie.201604656 . hdl : 2434/463818 . ПМИД 27624999 . S2CID 28730917 .
- ^ «Ртутьсодержащая продукция» . Агентство по охране окружающей среды США (EPA). Архивировано из оригинала 12 февраля 2007 года . Проверено 1 мая 2007 г.
- ^ «Информационный бюллетень IMERC: Использование ртути в термостатах» (PDF) . Северо-восточная ассоциация чиновников по управлению отходами. Январь 2010 г. Архивировано из оригинала (PDF) 17 июня 2012 г.
- ^ Пурхаббаз, А.; Пурхаббаз, Х. (2012). «Исследование токсичных металлов в табаке различных марок иранских сигарет и связанных с этим проблем со здоровьем» . Иранский журнал фундаментальных медицинских наук . 15 (1): 636–644. ПМЦ 3586865 . ПМИД 23493960 .
- ^ Тальхаут, Рейнске; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхейзен, Антон (2011). «Опасные соединения в табачном дыме» . Международный журнал экологических исследований и общественного здравоохранения . 8 (12): 613–628. дои : 10.3390/ijerph8020613 . ISSN 1660-4601 . ПМК 3084482 . ПМИД 21556207 .
- ^ Бернхард Д., Россманн А., Вик Дж. (2005). «Металлы в сигаретном дыме» . ИУБМБ Жизнь . 57 (12): 805–809. дои : 10.1080/15216540500459667 . ПМИД 16393783 . S2CID 35694266 .
- ^ Шен, Хуажен; Цай, Ченг-Моу; Юань, Чунг-Шин; Джен, И-Сю; То есть, Иау-Рен (2017). «Как сжигание благовоний и благовоний во время богослужений влияет на концентрацию ртути в помещении и на открытом воздухе азиатского храма?» . Хемосфера . 167 : 530–540. Бибкод : 2017Chmsp.167..530S . doi : 10.1016/j.chemSphere.2016.09.159 . ПМИД 27764746 .
- ^ Линь, Чуньшуй; Хуан, Жу-Цзинь; Дуань, Цзин; Чжун, Хаобин; Сюй, Вэй; Ву, Юнфэй; Чжан, Жэньцзянь (2022). «Большой вклад богослужений в атмосферные частицы сажи на северо-западе Китая» . Загрязнение окружающей среды . 299 : 118907. Бибкод : 2022EPoll.29918907L . дои : 10.1016/j.envpol.2022.118907 . ПМИД 35091017 . S2CID 246355499 .
- ^ «Болезнь Паркинсона при профессиональном воздействии бумаги, отчет о двух случаях» .
- ^ Аззиз-Баумгартнер, Э; Любер, Г; Шурц-Роджерс, Х; Бэкер, Л; Белсон, М; Кесак, С; Колдуэлл, К; Ли, Б; Джонс, Р. (2007). «Оценка воздействия разлива ртути в школе Невады - 2004 г.». Клин Токсикол . 45 (4): 391–395. дои : 10.1080/15563650601031569 . ПМИД 17486480 . S2CID 33770481 .
- ^ «Ртуть: разливы, утилизация и очистка территории» . Агентство по охране окружающей среды. Архивировано из оригинала 13 мая 2008 года . Проверено 11 августа 2007 г.
- ^ «Уровни действий при разливах элементарной ртути» (PDF) . www.atsdr.cdc.gov . 22 марта 2012 г.
- ^ Ю, Джин-Ганг; Юэ, Бао-Ю; У, Сюн-Вэй; Лю, Ци; Цзяо, Фей-Пэн; Цзян, Синь-Юй; Чен, Сяо-Цин (1 декабря 2015 г.). «Удаление ртути адсорбцией: обзор». Наука об окружающей среде и исследования загрязнения . 23 (6): 5056–5076. дои : 10.1007/s11356-015-5880-x . ПМИД 26620868 . S2CID 28365564 .
- ^ Перейти обратно: а б с Вейн, Швейцария; Бериро, диджей; Тернер, GH (2015). «Взлет и падение уровня загрязнения ртутью (Hg) в кернах отложений устья Темзы, Лондон, Великобритания» . Труды Королевского общества Эдинбурга по наукам о Земле и окружающей среде . 105 (4): 285–296. дои : 10.1017/S1755691015000158 . ISSN 1755-6910 .
- ^ Вейн, Швейцария; Джонс, Д.Г.; Листер, ТР (2009). «Загрязнение ртутью в поверхностных отложениях и кернах отложений устья Мерси, Великобритания» (PDF) . Бюллетень о загрязнении морской среды . 58 (6): 940–946. Бибкод : 2009МарПБ..58..940В . дои : 10.1016/j.marpolbul.2009.03.006 . ISSN 0025-326X . ПМИД 19356771 .
- ^ Вейн, Швейцария; Харрисон, И.; Ким, AW; Мосс-Хейс, В.; Викерс, BP; Хортон, BP (2008). «Состояние органических загрязнителей в поверхностных отложениях залива Барнегат-Литл-Эгг-Харбор, штат Нью-Джерси, США» (PDF) . Бюллетень о загрязнении морской среды . 56 (10): 1802–1808. Бибкод : 2008МарПБ..56.1802В . doi : 10.1016/j.marpolbul.2008.07.004 . ISSN 0025-326X . ПМИД 18715597 .
- ^ Вейн, Швейцария; Харрисон, И.; Ким, AW; Мосс-Хейс, В.; Викерс, BP; Хонг, К. (2009). «Загрязнение органическими веществами и металлами в поверхностных отложениях мангровых зарослей Южного Китая» (PDF) . Бюллетень о загрязнении морской среды . 58 (1): 134–144. Бибкод : 2009МарПБ..58..134В . doi : 10.1016/j.marpolbul.2008.09.024 . ISSN 0025-326X . ПМИД 18990413 .
- ^ «Меркурий и здоровье» . Всемирная организация здравоохранения . 31 марта 2017 года . Проверено 22 декабря 2023 г.
- ^ «1910.1000 ТАБЛИЦА Z-2» . Управление по охране труда. 23 июня 2006 года . Проверено 22 декабря 2023 г.
- ^ «Соединения ртути [кроме (органо)алкилов] (в виде Hg)» . Центры по контролю и профилактике заболеваний . Национальный институт охраны труда и здоровья . 30 октября 2019 года . Проверено 22 декабря 2023 г.
- ^ Кокорос, Гленн; Кан, Филлис Х.; Силер, Уильям (ноябрь 1973 г.). «Концентрация ртути в рыбе, планктоне и воде трех эстуариев Западной Атлантики». Журнал биологии рыб . 5 (6): 641–647. Бибкод : 1973JFBio...5..641C . дои : 10.1111/j.1095-8649.1973.tb04500.x .
- ^ «Как мы работаем в IISD-ELA: сбор биопсии мышц рыбы» . МИСР . 30 сентября 2015 года . Проверено 7 июля 2020 г.
- ^ Моул, Бет (20 декабря 2019 г.). «У женщины в результате использования крема для кожи уровень ртути в крови был в 524 раза выше нормального» . АрсТехника . Проверено 20 июля 2021 г.
- ^ Мудан, Анита, Копан Л., Ван Р. и др. (20 декабря 2019 г.). «Заметки с мест: токсичность метилртути в креме для осветления кожи, полученном из Мексики — Калифорния, 2019» . Еженедельный отчет о заболеваемости и смертности . 68 (50): 1166–1167. дои : 10.15585/mmwr.mm6850a4 . ПМК 6936160 . ПМИД 31856147 .
- ^ МакКелви В; Джеффри Н; Кларк Н; Касс Д; Парсонс П.Дж. 2010 (2011). «Популяционный биомониторинг неорганической ртути и идентификация продуктов по уходу за кожей как источника воздействия в Нью-Йорке» . Перспектива здоровья окружающей среды . 119 (2): 203–9. дои : 10.1289/ehp.1002396 . ПМК 3040607 . ПМИД 20923743 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Нгим, Швейцария; Фу, Южная Каролина; Бой, КВ; Кьяратнам, Дж (1992). «Хронические нейроповеденческие эффекты элементарной ртути у стоматологов» . Британский журнал промышленной медицины . 49 (11): 782–90. дои : 10.1136/oem.49.11.782 . ПМЦ 1039326 . ПМИД 1463679 .
- ^ Лян, YX; ВС, РК; Сан, Ю.; Чен, ZQ; Ли, Л.Х. (1993). «Психологические эффекты низкого воздействия паров ртути: применение компьютерной системы нейроповеденческой оценки». Экологические исследования . 60 (2): 320–7. Бибкод : 1993ER.....60..320L . дои : 10.1006/enrs.1993.1040 . ПМИД 8472661 .
- ^ Неорганическая ртуть , монография № 118 «Критерии гигиены окружающей среды», Женева: Всемирная организация здравоохранения, 1991, ISBN. 92-4-157118-7
- ^ Перейти обратно: а б Блюм, Р.Э.; Боббитт, Р.Г.; Уэлч, ЛВ; Вуд, AJJ; Бонфильо, Дж. Ф.; Сарзен, К; Хит, Эй Джей; Филиал, РА (1992). «Токсичность паров элементарной ртути, лечение и прогноз после острого, интенсивного воздействия на рабочих хлорщелочных заводов. Часть I: История, нейропсихологические данные и эффекты хелаторов». Hum Exp Токсикол . 11 (3): 201–10. Бибкод : 1992HETox..11..201B . дои : 10.1177/096032719201100308 . ПМИД 1352115 . S2CID 43524794 .
- ^ «Минаматская конвенция, согласованная странами» . Программа ООН по окружающей среде . Архивировано из оригинала 30 января 2013 года . Проверено 19 января 2013 г.
- ^ Секция Службы новостей Организации Объединенных Наций (19 января 2013 г.). «Новости ООН — Правительства на форуме ООН согласовывают юридически обязательный договор по ограничению ртутного загрязнения» . Секция службы новостей ООН . Архивировано из оригинала 16 октября 2016 года . Проверено 22 ноября 2016 г.
- ^ «Меркурий: Законы и постановления» . Агентство по охране окружающей среды США . 16 апреля 2008 г. Архивировано из оригинала 13 мая 2008 г. Проверено 30 мая 2008 г.
- ^ «Сокращение выбросов ртути» . Международная совместная комиссия по Великим озерам . Архивировано из оригинала 28 августа 2008 года . Проверено 21 июля 2008 г.
- ^ «Правило чистого воздуха, связанное с ртутью» . Агентство по охране окружающей среды США (EPA). Архивировано из оригинала 30 июня 2007 года . Проверено 1 мая 2007 г.
- ^ «Штат Нью-Джерси и др., Истцы против Агентства по охране окружающей среды (дело № 05-1097)» (PDF) . Апелляционный суд США по округу Колумбия. Обсуждено 6 декабря 2007 г., принято решение 8 февраля 2008 г. Архивировано (PDF) из оригинала 3 февраля 2011 г. Проверено 30 мая 2008 г.
- ^ Кастро М.С., Шервелл Дж. (2015). «Эффективность контроля выбросов для снижения концентрации ртути в атмосфере». Экологические науки и технологии . 49 (24): 14000–14007. Бибкод : 2015EnST...4914000C . дои : 10.1021/acs.est.5b03576 . ПМИД 26606506 .
- ^ «Самые старые и грязные электростанции приказали очистить» . Бостон Глобус . 22 декабря 2011 года. Архивировано из оригинала 14 июля 2014 года . Проверено 2 января 2012 г.
- ^ Говард Беркс (10 ноября 2011 г.). «Правила EPA разрешают печам загрязнять окружающую среду» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР. Архивировано из оригинала 17 ноября 2011 года . Проверено 2 января 2012 г.
- ^ «Директива 2002/95/EC об ограничении использования некоторых опасных веществ в электрическом и электронном оборудовании» . 27 января 2003 г. Статья 4, абзац 1. Например: «Государства-члены должны обеспечить, чтобы с 1 июля 2006 г. новое электрическое и электронное оборудование, поступившее на рынок, не содержало свинца, ртути, кадмия, шестивалентного хрома, полибромированных дифенилов (ПБД) или полибромдифениловые эфиры (ПБДЭ)».
- ^ «Соединения ртути в Европейском Союзе» . Трек ОВОС. 2007. Архивировано из оригинала 28 апреля 2008 года . Проверено 30 мая 2008 г.
- ^ Джонс Х. (10 июля 2007 г.). «ЕС запрещает использование ртути в барометрах и термометрах» . Рейтер. Архивировано из оригинала 3 января 2009 года . Проверено 12 сентября 2017 г.
- ^ «Норвегия запретит ртуть» . Бизнес ЕС. 21 декабря 2007 г. Архивировано из оригинала 21 января 2008 г. Проверено 30 мая 2008 г.
- ^ Берг, Т; Фьельд, Э; Стейннес, Э. (2006). «Атмосферная ртуть в Норвегии: вклад из разных источников». Наука об общей окружающей среде . 368 (1): 3–9. Бибкод : 2006ScTEn.368....3B . doi : 10.1016/j.scitotenv.2005.09.059 . ПМИД 16310836 .
- ^ Эдлих, Ричард Ф; Роудс, Саманта К.; Кантрелл, Холли С.; Азаведо, Сабрина М.; Ньюкирк, Энтони Т. Запрет ртутной амальгамы в США (PDF) (Отчет). США: Управление по контролю за продуктами и лекарствами . Архивировано из оригинала (PDF) 1 ноября 2013 года.
- ^ «Швеция запретит ртуть» . Местный . 14 января 2009 года. Архивировано из оригинала 28 августа 2016 года . Проверено 22 ноября 2016 г.
- ^ «Швецию могут заставить снять запрет на ртуть» . Местный . 21 апреля 2012 года. Архивировано из оригинала 28 августа 2016 года . Проверено 22 ноября 2016 г.
- ^ «Обзор ртути и ртутных соединений» (PDF) . Мильёстирельсен . 2014 . Проверено 21 декабря 2023 г.
Дальнейшее чтение
- Джонстон, Эндрю Скотт (15 сентября 2013 г.). Меркурий и создание Калифорнии: горное дело, ландшафт и гонка, 1840–1890 гг . ТоталБокс, ТВХ. Университетское издательство Колорадо . ISBN 978-1-4571-8399-7 . OCLC 969039240 .
Внешние ссылки
- Подкаст «Химия в своем элементе» (MP3) от химического общества химии Королевского Мира : Меркурий
- Меркьюри в Периодической таблице видео (Ноттингемский университет)
- Центры по контролю и профилактике заболеваний – Mercury Topic
- Рекомендации EPA по потреблению рыбы
- Ртуть 80 Ртуть
- Паспорт безопасности материала – Меркурий ICSC 0056
- Остановить загрязнение: Меркурий – Oceana
- Совет по защите природных ресурсов (NRDC): Руководство по загрязнению ртутью рыбы – NRDC
- Банк данных по опасным веществам NLM – Меркурий
- BBC – Новости Земли – Меркурий «превращает» водно-болотных птиц, таких как ибисы, в гомосексуалистов
- Изменение моделей использования, переработки и замены ртути в США Геологическая служба США
- Термодинамические данные о жидкой ртути.
- . Британская энциклопедия (11-е изд.). 1911.






