Молярная теплоемкость
Молярная теплоемкость химического вещества — это количество энергии , которое необходимо присоединить в виде тепла к одному молю вещества, чтобы вызвать повышение его температуры на одну единицу . Альтернативно, это теплоемкость образца вещества, деленная на количество вещества в образце; или также удельную теплоемкость вещества, умноженную на его молярную массу . Единица системе СИ молярной теплоемкости в — джоуль на кельвин на моль , Дж⋅К. −1 ⋅mol −1 .
Как и удельная теплоемкость, измеренная молярная теплоемкость вещества, особенно газа, может быть значительно выше, когда образцу позволяют расширяться при нагревании ( давлении при постоянном или изобарном ), чем при нагревании в закрытом сосуде. что предотвращает расширение ( при постоянном объеме или изохорное ). Однако соотношение между ними представляет собой то же соотношение теплоемкостей, полученное из соответствующих удельных теплоемкостей.
Это свойство наиболее актуально в химии , где количества веществ часто указывают в молях, а не в массе или объёме. Молярная теплоемкость обычно увеличивается с увеличением молярной массы, часто меняется в зависимости от температуры и давления и различна для каждого состояния вещества . Например, при атмосферном давлении (изобарная) молярная теплоемкость воды чуть выше точки плавления составляет около 76 Дж⋅К. −1 ⋅mol −1 , но энергия льда чуть ниже этой точки составляет около 37,84 Дж⋅К. −1 ⋅mol −1 . Пока вещество претерпевает фазовый переход , например плавление или кипение, его молярная теплоемкость технически бесконечна , поскольку тепло идет на изменение его состояния, а не на повышение температуры. Эта концепция не подходит для веществ, точный состав которых неизвестен или молярная масса которых не определена четко, например, полимеров и олигомеров с неопределенным молекулярным размером.
Тесно связанным свойством вещества является теплоемкость на моль атомов , или атомо-молярная теплоемкость , при которой теплоемкость образца делится на количество молей атомов, а не на количество молей молекул. Так, например, атомо-молярная теплоемкость воды составляет 1/3 ее молярной теплоемкости, а именно 25,3 Дж⋅К. −1 ⋅mol −1 .
В неофициальном контексте химии молярную теплоемкость можно назвать просто «теплоемкостью» или «удельной теплоемкостью». Однако международные стандарты теперь рекомендуют, чтобы «удельная теплоемкость» всегда относилась к мощности на единицу массы, чтобы избежать возможной путаницы. [1] Поэтому для этой величины всегда следует использовать слово «молярный», а не «специфический».
Определение
[ редактировать ]Молярная теплоемкость вещества, которую можно обозначить , см представляет собой теплоемкость С образца вещества, деленную на количество (моль) n вещества в образце:
- см
где Q — количество тепла, необходимое для повышения температуры образца на ΔT . Очевидно, что этот параметр невозможно вычислить, если n не известно или не определено.
Подобно теплоемкости объекта, молярная теплоемкость вещества может изменяться, иногда существенно, в зависимости от начальной температуры Т образца и давления Р. приложенного к нему функцию cm Следовательно, его следует рассматривать как ( P , T ) этих двух переменных.
Эти параметры обычно указывают при указании молярной теплоемкости вещества. Например, «H 2 O: 75,338 Дж⋅К −1 ⋅mol −1 (25 °С, 101,325 кПа)" [2] указано иное, опубликованные значения молярной теплоемкости см Если не обычно действительны для некоторых стандартных условий температуры и давления .
Однако зависимость cm ) от начальной температуры и давления часто можно игнорировать в практических контекстах, например , ( P , T при работе в узких диапазонах этих переменных. В этих контекстах обычно можно опустить квалификатор ( P , T ) и аппроксимировать молярную теплоемкость константой cm , подходящей для этих диапазонов.
Поскольку молярная теплоемкость вещества равна удельной теплоемкости c , умноженной на молярную массу вещества M / N, ее числовое значение обычно меньше, чем удельная теплоемкость. парафин Например, имеет удельную теплоту около 2500 Дж⋅К. −1 ⋅kg −1 но молярная теплоемкость около 600 Дж⋅К. −1 ⋅mol −1 .
Молярная теплоемкость — это «интенсивное» свойство вещества, внутренняя характеристика, не зависящая от размера или формы рассматриваемого количества. (Определитель «специфический» перед экстенсивным свойством часто указывает на производное от него интенсивное свойство. [3] )
Вариации
[ редактировать ]Введение тепловой энергии в вещество, помимо повышения его температуры, обычно вызывает увеличение его объема или давления, в зависимости от того, как удерживается образец. Выбор последнего влияет на измеренную молярную теплоемкость даже для тех же начального давления P и начальной температуры T . Широко используются два конкретных варианта:
- Если давление поддерживается постоянным (например, при атмосферном давлении окружающей среды) и позволяет образцу расширяться, расширение генерирует работу , поскольку сила давления смещает оболочку. Эта работа должна происходить за счет предоставленной тепловой энергии. Полученное таким образом значение называется молярной теплоемкостью при постоянном давлении (или изобарном ) и часто обозначается cP д ,m , cp . ,m , cP ,m и т.
- С другой стороны, если расширение предотвращается — например, с помощью достаточно жесткой оболочки или увеличения внешнего давления для противодействия внутреннему — работа не генерируется, и тепловая энергия, которая бы пошла в него, вместо этого должна способствовать внутренняя энергия объекта, включая дополнительное повышение его температуры. называется молярной теплоемкостью при постоянном объеме (или изохорной ) и обозначается cV Значение , ,m , cv полученное таким образом , ,m , cv ,m и т. д.
Значение c V ,m всегда меньше значения c P ,m . Эта разница особенно заметна для газов, где значения при постоянном давлении обычно на 30–66,7% выше, чем при постоянном объеме. [4]
Все методы измерения удельной теплоемкости применимы и к молярной теплоемкости.
Единицы
[ редактировать ]Единицей молярной теплоемкости в системе СИ является джоуль на кельвин на моль (Дж/(К⋅моль), Дж/(Кмоль), ДжК. −1 моль −1 , и т. д.). Поскольку приращение температуры на один градус Цельсия эквивалентно приращению на один кельвин, это то же самое, что джоуль на градус Цельсия на моль (Дж/(°C⋅моль)).
В химии количество тепла до сих пор часто измеряется в калориях . Как ни странно, две единицы с таким названием, обозначаемые «кал» или «Кал», обычно использовались для измерения количества тепла:
- «малая калория» (или «грамм-калория», «кал») равна ровно 4,184 Дж.
- «Большая калория» (также «килокалория», «килограмм-калория» или «пищевая калория»; «ккал» или «Кал») составляет 1000 малых калорий, то есть ровно 4184 Дж.
Когда тепло измеряется в этих единицах, единицей удельной теплоты обычно является
- 1 кал/(°С⋅моль) («малая калория») = 4,184 Дж⋅К −1 ⋅mol −1
- 1 ккал/(°С⋅моль) («большая калория») = 4184 Дж⋅К −1 ⋅mol −1 .
Молярная теплоемкость вещества имеет ту же размерность , что и теплоемкость объекта; а именно, Л 2 ⋅M⋅T −2 ⋅Θ −1 , или М(Л/Т) 2 /Θ. (Действительно, именно теплоемкость объекта состоит из числа Авогадро молекул вещества.) Следовательно, единица СИ Дж⋅К −1 ⋅mol −1 эквивалентен килограмму-метру в квадрате на секунду в квадрате на кельвин (кг⋅м 2 ⋅K −1 ⋅s −2 ).
Физическая основа
[ редактировать ]Одноатомные газы
[ редактировать ]Температура образца вещества отражает среднюю кинетическую энергию составляющих его частиц (атомов или молекул) относительно его центра масс. Квантовая механика предсказывает, что при комнатной температуре и обычном давлении изолированный атом газа не может хранить сколько-нибудь значительное количество энергии, кроме как в форме кинетической энергии. Следовательно, когда определенное число N атомов одноатомного газа получает вход Q тепловой энергии, в контейнере фиксированного объема кинетическая энергия каждого атома увеличится на Q / N независимо от массы атома. Это предположение лежит в основе теории идеальных газов .
Другими словами, эта теория предсказывает, что молярная теплоемкость при постоянном объеме c V ,m всех одноатомных газов будет одинаковой; конкретно,
- с V ,м = 3 / 2 R
где R — постоянная идеального газа , около 8,31446 Дж⋅К. −1 ⋅mol −1 (которая является произведением постоянной Больцмана k B и постоянной Авогадро ). И действительно, экспериментальные значения c V ,m для благородных газов гелия , неона , аргона , криптона и ксенона (при 1 атм и 25 °C) составляют 12,5 Дж⋅К. −1 ⋅mol −1 , что 3/2 Р ; хотя их атомный вес колеблется от 4 до 131.
Та же теория предсказывает, что молярная теплоемкость одноатомного газа при постоянном давлении будет равна
- c P ,m = c V ,m + R = 5 / 2 R
Это предсказание соответствует экспериментальным значениям, которые для гелия через ксенон составляют 20,78, 20,79, 20,85, 20,95 и 21,01 Дж⋅К. −1 ⋅mol −1 , соответственно; [5] [6] очень близко к теоретическому 5 / 2 R = 20.78 J⋅K −1 ⋅mol −1 .
не на моль) одноатомного газа будет обратно пропорциональна его (аразмерной) относительной атомной массе A. Следовательно, удельная теплоемкость (на единицу массы, а То есть примерно
- c В = (12470 Дж⋅К −1 ⋅kg −1 )/ A c P = (20786 Дж⋅К −1 ⋅kg −1 )/ А
Многоатомные газы
[ редактировать ]
Степени свободы
[ редактировать ]Многоатомная молекула (состоящая из двух или более атомов, связанных вместе) может хранить тепловую энергию в других формах помимо своей кинетической энергии. Эти формы включают вращение молекулы и вибрацию атомов относительно ее центра масс.
Эти дополнительные степени свободы способствуют молярной теплоемкости вещества. А именно, когда тепловая энергия вводится в газ с многоатомными молекулами, только часть ее пойдет на увеличение их кинетической энергии, а значит, и температуры; остальное перейдет в другие степени свободы. Таким образом, чтобы добиться такого же повышения температуры, молю этого вещества придется сообщить больше тепловой энергии, чем молю одноатомного газа. Таким образом , вещества с высоким числом атомов на молекулу, такие как октан , могут иметь очень большую теплоемкость на моль и при этом относительно небольшую удельную теплоемкость (на единицу массы). [7] [8] [9]
Если бы молекулу можно было полностью описать с помощью классической механики, то с помощью теоремы о равнораспределении энергии можно было бы предсказать, что каждая степень свободы будет иметь среднюю энергию, равную величине 1/2 — T kT , где k — постоянная Больцмана, а температура . Если число степеней свободы молекулы равно f , то каждая молекула будет обладать в среднем полной энергией, равной 1/2 фкТ . Тогда молярная теплоемкость (при постоянном объеме) будет равна
- с V ,м = 1 / 2 fR
где R — постоянная идеального газа. Согласно соотношению Майера , молярная теплоемкость при постоянном давлении будет равна
- c P ,m = c V ,m + R = 1 / 2 fR + R = 1/2 ) ( ж + 2 Р
Таким образом, каждая дополнительная степень свободы будет способствовать 1/2 так R c к молярной теплоемкости газа (как c V ,m, и P , m ).
В частности, каждая молекула одноатомного газа имеет лишь f = 3 степени свободы, а именно компоненты ее вектора скорости; следовательно, c V ,m = 3/2 m R и c P , = 5 / 2 R . [10]
Режимы вращения двухатомной молекулы
[ редактировать ]Например, молярная теплоемкость азота N
2 при постоянном объеме составляет 20,6 Дж⋅К. −1 ⋅mol −1 (при 15°С, 1 атм), что составляет Р. 2,49 [11] Из теоретического уравнения c V ,m = 1/2 5 = fR , можно сделать вывод, что каждая молекула имеет f степеней свободы. Это три градуса вектора скорости молекулы плюс два градуса ее вращения вокруг оси, проходящей через центр масс и перпендикулярной линии двух атомов. Степени свободы, обусловленные перемещением и вращением, называются жесткими степенями свободы, поскольку они не вызывают какой-либо деформации молекулы.
Из-за этих двух дополнительных степеней свободы молярная теплоемкость c V , m N
2 (20.6 J⋅K −1 ⋅mol −1 ) больше, чем у гипотетического одноатомного газа (12,5 Дж⋅К −1 ⋅mol −1 ) в раз 5 / 3 .
Замороженные и активные степени свободы.
[ редактировать ]Согласно классической механике, двухатомная молекула, такая как азот, должна иметь больше степеней внутренней свободы, что соответствует вибрации двух атомов, которые растягивают и сжимают связь между ними.
Для термодинамических целей каждое направление, в котором атом может независимо вибрировать относительно остальной части молекулы, вводит две степени свободы: одну, связанную с потенциальной энергией искажения связей, и одну, связанную с кинетической энергией движения атома. В двухатомной молекуле, такой как N
2 , существует только одно направление вибрации, и движения двух атомов должны быть противоположными, но равными; поэтому существует только две степени колебательной свободы. Это увеличило бы f до 7, а c V ,m до 3,5 R .
Причина, по которой эти вибрации не поглощают ожидаемую долю тепловой энергии, кроется в квантовой механике . Согласно этой теории, энергия, запасенная в каждой степени свободы, должна увеличиваться или уменьшаться только в определенных количествах (квантах). Следовательно, если температура системы T недостаточно высока, средняя энергия, которая будет доступна для некоторых теоретических степеней свободы ( kT / f ), может быть меньше соответствующего минимального кванта. Если температура достаточно низкая, это может иметь место практически для всех молекул. Тогда говорят, что эти степени свободы «заморожены». Тогда молярная теплоемкость газа будет определяться только «активными» степенями свободы — которые для большинства молекул могут получить достаточно энергии, чтобы преодолеть этот квантовый порог. [12]

Для каждой степени свободы существует приблизительная критическая температура, при которой она «оттаивает» («размораживается») и становится активной, способной удерживать тепловую энергию. Для трех поступательных степеней свободы молекул газа эта критическая температура чрезвычайно мала, поэтому можно считать, что они всегда активны. Для вращательных степеней свободы температура оттаивания обычно составляет несколько десятков Кельвинов (хотя в случае очень легкой молекулы, такой как водород, уровни вращательной энергии будут расположены так широко, что вращательная теплоемкость не может полностью «разморозиться» до тех пор, пока не будут значительно более высокие температуры). достигаются). Моды колебаний двухатомных молекул обычно начинают активироваться только при температуре значительно выше комнатной.
В случае азота вращательные степени свободы полностью активны уже при -173 ° C (100 К, всего на 23 К выше точки кипения). С другой стороны, моды вибрации начинают становиться активными только около 350 К (77 °C). Соответственно, молярная теплоемкость c P ,m почти постоянна и составляет 29,1 Дж⋅К. −1 ⋅mol −1 от 100 К до примерно 300°С. Примерно при этой температуре она начинает быстро увеличиваться, затем снова замедляется. Это 35,5 Дж⋅К. −1 ⋅mol −1 при 1500 °С, 36,9 при 2500 °С и 37,5 при 3500 °С. [13] [14] Последнее значение почти точно соответствует предсказанному значению для f = 7.

Ниже приводится таблица некоторых молярных теплоемкостей c P ,m различных двухатомных газов при постоянном давлении при стандартной температуре (25 °C = 298 K), при 500 °C и при 5000 °C, а также кажущееся количество градусов. свободы ж * оценивается по формуле f * = 2 c P ,m / R - 2:
| 25 °С | 500 °С | 5000 °С | |||||
|---|---|---|---|---|---|---|---|
| Газ | сП м , J⋅K −1 ⋅mol −1 | ж * | сП м , J⋅K −1 ⋅mol −1 | ж * | сП м , J⋅K −1 ⋅mol −1 | ж * | |
| Ч 2 | 28.9 | 5.0 | 29.6 | 5.1 | 41.2 | 7.9 | Не насыщенный. [15] |
| СО | 29.1 | 5.0 | 31.7 | 5.6 | 38.1 | 7.2 | Насыщенный. [16] |
| № 2 | 29.1 | 5.0 | 31.3 | 5.5 | 38.0 | 7.1 | Насыщенный. [13] |
| кл 2 | 34.0 | 6.2 | 37.0 | 6.9 | 39.6 | 7.5 | Макс. 41,3 при ~3700 С. [17] |
| Бр 2 (пар) | (*)36.4 | 6.8 | 37.5 | 7.0 | 39.2 | 7.4 | Макс. 41,6 при ~3000 С. [18] |
(*) При 59°C (точка кипения)
Приближение квантового гармонического осциллятора предполагает, что расстояние между уровнями энергии колебательных мод обратно пропорционально квадратному корню из приведенной массы атомов, составляющих двухатомную молекулу. Этот факт объясняет, почему колебательные моды более тяжелых молекул, таких как Br
2 активны при более низких температурах. Молярная теплоемкость Br
2 при комнатной температуре соответствует f = 7 степеням свободы, максимуму для двухатомной молекулы. При достаточно высоких температурах все двухатомные газы приближаются к этому значению.
Режимы вращения одиночных атомов
[ редактировать ]Квантовая механика также объясняет, почему удельная теплоемкость одноатомных газов хорошо предсказывается теорией идеального газа при предположении, что каждая молекула представляет собой точечную массу, имеющую только f = 3 поступательные степени свободы.
Согласно классической механике, поскольку атомы имеют ненулевой размер, они также должны иметь три степени свободы вращения, или f всего = 6. Аналогично, двухатомная молекула азота должна иметь дополнительный режим вращения, а именно вокруг линии двух атомов; и, таким образом, также имеем f = 6. С классической точки зрения каждый из этих режимов должен сохранять равную долю тепловой энергии.
Однако, согласно квантовой механике, разность энергий между разрешенными (квантованными) состояниями вращения обратно пропорциональна моменту инерции относительно соответствующей оси вращения. Поскольку момент инерции отдельного атома чрезвычайно мал, температура активации его вращательных мод чрезвычайно высока. То же самое относится и к моменту инерции двухатомной молекулы (или линейной многоатомной) относительно межъядерной оси, поэтому этот режим вращения вообще не активен.
С другой стороны, электроны и ядра могут существовать в возбужденном состоянии и в некоторых исключительных случаях могут быть активными даже при комнатной температуре или даже при криогенных температурах.
Многоатомные газы
[ редактировать ]Совокупность всех возможных способов бесконечно малого смещения n атомов многоатомной молекулы газа представляет собой линейное пространство размерности 3 n , поскольку каждый атом может независимо перемещаться в каждом из трех направлений ортогональных осей. Однако некоторые три из этих измерений представляют собой просто перемещение молекулы на бесконечно малый вектор смещения, а другие — просто жесткое вращение ее на бесконечно малый угол вокруг некоторой оси. Третьи могут соответствовать относительному вращению двух частей молекулы вокруг соединяющей их одинарной связи.
Независимые моды деформации — линейно независимые способы реальной деформации молекулы, которые напрягают ее связи — являются лишь остальными измерениями этого пространства. Как и в случае двухатомных молекул, каждая из этих мод деформации считается двумя колебательными степенями свободы с целью накопления энергии: одна для потенциальной энергии, запасенной в напряженных связях, и одна для дополнительной кинетической энергии атомов, когда они колеблются вокруг остальная конфигурация молекулы.
В частности, если молекула линейна (все атомы расположены на прямой линии), она имеет только два нетривиальных режима вращения, поскольку вращение вокруг собственной оси не смещает ни один атом. Следовательно, он имеет 3 n − 5 реальных мод деформации. Тогда число степеней свободы, сохраняющих энергию, составит f = 3 + 2 + 2(3 n - 5) = 6 n - 5.
Например, линейная закиси азота молекула N≡N=O (при n = 3) имеет 3 n − 5 = 4 независимых бесконечно малых моды деформации. Два из них можно описать как растяжение одной из связей, в то время как другая сохраняет свою нормальную длину. Можно определить два других, которые молекула изгибает у центрального атома в двух направлениях, ортогональных ее оси. В каждом режиме следует предположить, что атомы смещаются так, что центр масс остается неподвижным и вращения нет. Тогда молекула имеет f = 6 n - 5 = 13 полных степеней свободы, сохраняющих энергию (3 поступательных, 2 вращательных, 8 колебательных). При достаточно высокой температуре его молярная теплоемкость должна составлять c P ,m = 7,5 R = 62,63 Дж⋅К. −1 ⋅mol −1 . Для цианогена N≡C−C≡N и ацетилен H−C≡C−H ( n = 4) тот же анализ дает f = 19 и предсказывает c P ,m = 10,5 R = 87,3 Дж⋅К −1 ⋅mol −1 .
Молекула с n атомами, которая является жесткой и нелинейной, имеет 3 режима трансляции и 3 нетривиальных режима вращения, следовательно, только 3 n - 6 режимов деформации. Следовательно, он имеет f = 3 + 3 + 2(3 n - 6) = 6 n - 6 поглощающих энергию степеней свободы (на одну меньше, чем у линейной молекулы с тем же количеством атомов). Вода H 2 O ( n = 3) в ненапряженном состоянии изгибается, поэтому прогнозируется, что он будет иметь f = 12 степеней свободы. [19] Метан CH 4 ( n = 5) является трехмерным, и формула предсказывает f = 24.
Этан H 3 C-CH 3 ( n = 8) имеет 4 степени свободы вращения: две относительно оси, перпендикулярной центральной связи, и еще две, поскольку каждая метильная группа может вращаться независимо вокруг этой связи с незначительным сопротивлением. Следовательно, число независимых мод деформации равно 3 n − 7, что дает f = 3 + 4 + 2(3 n − 7) = 6n − 7 = 41.
В следующей таблице показаны экспериментальные молярные теплоемкости при постоянном давлении c P ,m вышеуказанных многоатомных газов при стандартной температуре (25 ° C = 298 K), при 500 ° C и при 5000 ° C, а также кажущееся количество градусов. свободы ж * оценивается по формуле f * = 2 c P ,m / R - 2:
| 25 °С | 500 °С | 5000 °С | ||||||
|---|---|---|---|---|---|---|---|---|
| Газ | сП м , J⋅K −1 ⋅mol −1 | ж * | сП м , J⋅K −1 ⋅mol −1 | ж * | сП м , J⋅K −1 ⋅mol −1 | ж * | ж | Примечания |
| Н≡Н=О | 38.6 | 7.3 | 51.8 | 10.5 | 62.0 | 12.9 | 13 | [20] |
| N≡C–C≡N | 56.7 | 11.6 | 72.3 | 15.4 | 86.7 | 18.9 | 19 | [21] |
| H–C≡C–N | 44.0 | 8.6 | 63.2 | 13.2 | 92.9 | 20.3 | 19 | [22] |
| Н 2 О | — | — | 38.4 | 7.2 | 59.7 | 12.4 | 12 | [23] |
| СН 4 | 35.7 | 6.6 | 61.6 | 12.8 | 105.7 | 23.4 | 24 | [24] |
| Н 3 С–СН 3 | 52.5 | 10.6 | 105.6 | 23.4 | 168.7 | (*)38.6 | 41 | [25] |
(*) При 3000С
Удельная теплоемкость твердых тел
[ редактировать ]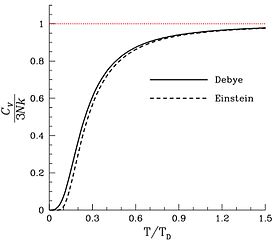
В большинстве твердых тел (но не во всех) молекулы имеют фиксированное среднее положение и ориентацию, поэтому единственными доступными степенями свободы являются колебания атомов. [26] Таким образом, удельная теплоемкость пропорциональна числу атомов (не молекул) на единицу массы, что соответствует закону Дюлонга-Пти . Другой вклад могут вносить магнитные степени свободы в твердых телах, но они редко вносят существенный вклад. [27] и электронный [28] Поскольку каждый атом твердого тела вносит свой вклад в одну независимую моду колебаний, число степеней свободы у n атомов равно 6 n . Поэтому теплоемкость образца твердого вещества ожидается равной 3 РН а , или (24,94 Дж/К) Н а , где Н а — число молей атомов в образце, а не молекул. Другими словами, ожидается, что атомо-молярная теплоемкость твердого вещества составит 3 R = 24,94 Дж⋅К. −1 ⋅mol −1 , где «амол» обозначает количество твердого вещества, которое содержит число атомов Авогадро. [29]
Отсюда следует, что в молекулярных твердых телах теплоемкость на моль молекул обычно будет близка к 3 nR , где n — число атомов на молекулу.
Таким образом, n атомов твердого тела в принципе должны запасать в два раза больше энергии, чем n атомов одноатомного газа. Один из способов взглянуть на этот результат — заметить, что одноатомный газ может хранить энергию только в виде кинетической энергии атомов, тогда как твердое тело может хранить ее также в виде потенциальной энергии связей, напряженных вибрациями. Атомо-молярная теплоемкость многоатомного газа приближается к теплоемкости твердого тела по мере увеличения числа n атомов на молекулу.
Как и в случае с газами, некоторые из мод колебаний будут «заморожены» при низких температурах, особенно в твердых телах с легкими и прочно связанными атомами, в результате чего атомо-молярная теплоемкость будет меньше этого теоретического предела. Действительно, атомо-молярная (или удельная) теплоемкость твердого вещества стремится к нулю по мере приближения температуры к абсолютному нулю.
Закон Дюлонга – Пти
[ редактировать ]Как и было предсказано приведенным выше анализом, теплоемкость на моль атомов , а не на моль молекул, оказывается удивительно постоянной для всех твердых веществ при высоких температурах. Эта зависимость была замечена эмпирически в 1819 году и названа законом Дюлонга-Пти по имени двух ее первооткрывателей. [30] [31] Это открытие стало важным аргументом в поддержку атомной теории материи.
Действительно, для твердых металлических химических элементов при комнатной температуре атомо-молярная теплоемкость колеблется от примерно 2,8 R до 3,4 R . Большие исключения в нижней части составляют твердые тела, состоящие из относительно маломассивных, прочно связанных атомов, такие как бериллий (2,0 R , только 66% от теоретического значения) и алмаз (0,735 R , только 24%). Эти условия подразумевают большее расстояние между квантовыми колебательными энергиями, поэтому многие колебательные моды «замораживаются» при комнатной температуре. Водяной лед, близкий к температуре плавления, также имеет аномально низкую теплоемкость на атом (1,5 R , всего 50% от теоретического значения).
На более высоком уровне возможной теплоемкости теплоемкость может превышать R незначительно из-за вклада ангармонических колебаний в твердых телах, а иногда и скромного вклада электронов проводимости в металлах. Это не степени свободы, рассматриваемые в теориях Эйнштейна или Дебая.
Удельная теплоемкость твердых элементов
[ редактировать ]С объемная плотность твердого химического элемента сильно зависит от его молярной массы, существует заметная обратная корреляция между плотностью твердого тела и его удельной теплоемкостью в пересчете на массу. Это связано с очень приблизительной тенденцией атомов большинства элементов иметь примерно одинаковый размер, несмотря на гораздо более широкие различия в плотности и атомном весе. Эти два фактора (постоянство атомного объема и постоянство мольной удельной теплоемкости) приводят к хорошей корреляции между объемом любого данного твердого химического элемента и его общей теплоемкостью.
Другой способ выразить это заключается в том, что объемная удельная теплоемкость ( объемная теплоемкость ) твердых элементов примерно постоянна. Молярный объем твердых элементов примерно постоянен, как и (что еще более достоверно) молярная теплоемкость большинства твердых веществ. Эти два фактора определяют объемную теплоемкость, которая как объемное свойство может поразительно постоянна. Например, элемент уран — это металл, плотность которого почти в 36 раз превышает плотность металлического лития, но удельная теплоемкость урана в объемном выражении (т. е. на данный объем металла) всего на 18% больше, чем у лития.
Однако средний атомный объем в твердых элементах не совсем постоянен, поэтому наблюдаются отклонения от этого принципа. Например, мышьяк , который всего на 14,5% менее плотный, чем сурьма , имеет почти на 59% большую удельную теплоемкость по массе. Другими словами; хотя слиток мышьяка всего лишь примерно на 17% больше, чем слиток сурьмы той же массы, он поглощает примерно на 59% больше тепла при данном повышении температуры. Соотношение теплоемкостей двух веществ точно соответствует соотношению их молярных объемов (отношению числа атомов в одном и том же объеме каждого вещества); отход от корреляции к простым объемам в данном случае обусловлен тем, что более легкие атомы мышьяка упакованы значительно плотнее, чем атомы сурьмы, а не аналогичного размера. Другими словами, атомы одинакового размера привели бы к тому, что моль мышьяка был бы на 63% больше, чем моль сурьмы, с соответственно более низкой плотностью, что позволило бы его объему более точно отражать его теплоемкость.
Влияние примесей
[ редактировать ]Иногда небольшие концентрации примесей могут сильно влиять на теплоемкость, например в полупроводниковых ферромагнитных сплавах. [32]
Удельная теплоемкость жидкостей
[ редактировать ]Общая теория теплоемкости жидкостей еще не создана и все еще является активной областью исследований. Долгое время считалось, что фононная теория не способна объяснить теплоемкость жидкостей, поскольку жидкости поддерживают только продольные, но не поперечные фононы, которые в твердых телах отвечают за 2/3 теплоемкости. Однако по рассеянию Бриллюэна эксперименты с нейтронами и рентгеновскими лучами , подтверждающие интуицию Якова Френкеля , [33] показали, что поперечные фононы действительно существуют в жидкостях, хотя и ограничены частотами выше порога, называемого частотой Френкеля . Поскольку большая часть энергии содержится в этих высокочастотных модах, простой модификации модели Дебая достаточно, чтобы получить хорошее приближение к экспериментальным значениям теплоемкости простых жидкостей. [34]
Из-за высоких энергий связи кристаллов эффекты замерзания колебательных мод наблюдаются в твердых телах чаще, чем в жидкостях: например, теплоемкость жидкой воды в два раза выше, чем у льда при почти той же температуре, и снова близка к 3 R на единицу. моль атомов теоретического максимума Дюлонга–Пти.
Аморфные материалы можно считать разновидностью жидкости при температуре выше температуры стеклования . Ниже температуры стеклования аморфные материалы находятся в твердом (стеклообразном) состоянии. Теплоемкость имеет характерные скачки при температуре стеклования, обусловленные отсутствием в стеклообразном состоянии перколяционных кластеров из разорванных связей (конфигуронов), присутствующих только в жидкой фазе. [35] Выше температуры стеклования перколяционные кластеры, образованные разорванными связями, обеспечивают более гибкую структуру и, следовательно, большую степень свободы для движения атомов, что приводит к более высокой теплоемкости жидкостей. Ниже температуры стеклования нет протяженных кластеров разорванных связей, а теплоемкость меньше, поскольку твердотельная (стекловидная) структура аморфного материала более жесткая.Прерывистость теплоемкости обычно используется для определения температуры стеклования, при которой переохлажденная жидкость превращается в стекло.
Влияние водородных связей
[ редактировать ]Водородсодержащие полярные молекулы, такие как этанол , аммиак и вода имеют мощные межмолекулярные водородные связи , в жидкой фазе . Эти связи обеспечивают еще одно место, где тепло может сохраняться в виде потенциальной энергии вибрации даже при сравнительно низких температурах. Водородные связи объясняют тот факт, что жидкая вода сохраняет почти теоретический предел в 3 R на моль атомов даже при относительно низких температурах (т.е. вблизи точки замерзания воды).
См. также
[ редактировать ]- Квантовая статистическая механика
- Коэффициент теплоемкости
- Статистическая механика
- Термодинамические уравнения
- Термодинамические базы данных чистых веществ
- Уравнение теплопроводности
- Коэффициент теплопередачи
- Теплота смешивания
- Скрытое тепло
- Свойства материала (термодинамика)
- Метод Джобака (Оценка теплоемкостей)
- Удельная теплота плавления (Энтальпия плавления)
- Удельная теплота парообразования (Энтальпия парообразования)
- Объемная теплоемкость
- Термальная масса
- R-значение (изоляция)
- Накопительный обогреватель
- линия Френкеля
Ссылки
[ редактировать ]- ^ Международное бюро мер и весов (2006 г.), Международная система единиц (СИ) (PDF) (8-е изд.), ISBN 92-822-2213-6 , заархивировано (PDF) из оригинала 04 июня 2021 г. , получено 16 декабря 2021 г.
- ^ В. Вагнер, Дж. Р. Купер, А. Диттманн, Дж. Кидзима, Х.-Дж. Кречмар, А. Крузе, Р. Маре, К. Огучи, Х. Сато, И. Штекер, О. Шифнер, Ю. Такаиси, И. Танисита, Дж. Трюбенбах и Т. Виллкоммен (2000): «Промышленная формула IAPWS 1997 года для термодинамических свойств воды и пара», ASME J. Eng. Газовые турбины и энергетика , том 122, страницы 150–182.
- ^ Международный союз теоретической и прикладной химии, Отделение физической химии. «Количества, единицы и символы в физической химии» (PDF) . Блэквеллские науки. п. 7.
Прилагательное видовое перед названием обширной величины часто употребляется в значении разделенного на массу.
- ^ Справочник Ланге по химии, 10-е изд. п. 1524 г.
- ^ Шуен-Чен Хван, Роберт Д. Лейн, Дэниел А. Морган (2005). «Благородные газы». Энциклопедия химической технологии Кирка Отмера. Уайли. стр. 343–383. |doi=10.1002/0471238961.0701190508230114.a01.pub2
- ^ Хван, Шуен-Ченг; Велтмер, Уильям Р. (2000). «Газы гелиевой группы». Энциклопедия химической технологии Кирка-Отмера . Уайли. стр. 343–383. дои : 10.1002/0471238961.0701190508230114.a01 . ISBN 0-471-23896-1 .
- ^ Фейнман Р., Лекции по физике, том. I, глава 40, стр. 7–8.
- ^ Рейф, Ф. (1965). Основы статистической и теплофизики . МакГроу-Хилл. стр. 253–254 . ISBN 9780070518001 .
- ^ Чарльз Киттель; Герберт Кремер (2000). Теплофизика . Фриман. п. 78. ИСБН 978-0-7167-1088-2 .
- ^ Учебник: Физика Колледжа Янга и Геллера, 8e, Pearson Education, 2008 г.
- ^ Стивен Т. Торнтон и Эндрю Рекс (1993): Современная физика для ученых и инженеров , Издательство Saunders College Publishing, 1993
- ^ Квантовая физика и физика больших систем, Часть 1A Физика, Кембриджский университет, К. Г. Смит, 2008.
- ^ Jump up to: а б Интернет-книга NIST по химии « Азот », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ MW Чейз-младший (1998) Темохимические таблицы NIST-JANAF, четвертое издание , Журнал физических и химических справочных данных , Монография 9, страницы 1–1951.
- ^ Интернет-книга NIST по химии « Водород », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ « Угарный газ » Веб-книга NIST по химии, SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ « Хлор » Веб-книга NIST по химии, SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ Интернет-книга NIST по химии « Бром », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ Смит, К.Г. (2008). Квантовая физика и физика больших систем. Часть 1А Физика . Кембриджский университет.
- ^ « Закись азота » Веб-книга NIST по химии, SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ Интернет-книга NIST по химии « Цианоген », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ Интернет-книга NIST по химии « Ацетилен », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ Интернет-книга NIST по химии « Вода », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ Интернет-книга NIST по химии « Метан », SRD 69, онлайн. Доступ 18 мая 2019 г.
- ^ « Этан » Интернет-книга NIST по химии, SRD 69
- ^ Киттель, Чарльз (2005). Введение в физику твердого тела (8-е изд.). Хобокен, Нью-Джерси, США: John Wiley & Sons . п. 141 . ISBN 978-0-471-41526-8 .
- ^ Бланделл, Стивен (2001). Магнетизм в конденсированном состоянии . Оксфордская магистерская серия по физике конденсированного состояния (1-е изд.). Хобокен, Нью-Джерси, США: Издательство Оксфордского университета . п. 27 . ISBN 978-0-19-850591-4 .
- ^ Киттель, Чарльз (2005). Введение в физику твердого тела (8-е изд.). Хобокен, Нью-Джерси, США: John Wiley & Sons . п. 141 . ISBN 978-0-471-41526-8 .
- ^ «Теплоемкость твердого тела» (PDF) . Архивировано из оригинала (PDF) 11 февраля 2014 г.
- ^ Пети А.-Т.; Дюлонг П.-Л. (1819). «Исследование некоторых важных моментов теории теплоты» . Анналы химии и физики . 10 : 395–413.
- ^ Пети А.-Т., Дюлонг П.-Л.: Исследование некоторых важных моментов теории тепла . В: Annales de Chimie et de Physique 10, 395–413 (1819) ( перевод )
- ^ Хоган, К. (1969). «Плотность состояний изоляционного ферромагнитного сплава». Физический обзор . 188 (2): 870. Бибкод : 1969PhRv..188..870H . дои : 10.1103/PhysRev.188.870 .
- ^ В своем учебнике «Кинетическая теория жидкостей» (англ. 1947).
- ^ Болматов Д.; Бражкин В.В.; Траченко, К. (2012). «Фононная теория термодинамики жидкости» . Научные отчеты . 2 : 421. arXiv : 1202.0459 . Бибкод : 2012НатСР...2Е.421Б . дои : 10.1038/srep00421 . ПМЦ 3359528 . ПМИД 22639729 .
- Хэмиш Джонстон (13 июня 2012 г.). «Теория фононов проливает свет на термодинамику жидкости» . Мир физики .
- ^ Оджован, Майкл И.; Ли, Уильям Э. (2006). «Топологически неупорядоченные системы при стекловании» (PDF) . Физический журнал: конденсированное вещество . 18 (50): 11507–11520. Бибкод : 2006JPCM...1811507O . дои : 10.1088/0953-8984/18/50/007 . S2CID 96326822 .
