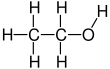
Этанол
| |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Произношение | / ˈ ɛ θ ə n ɒ l / | ||
| Предпочтительное название ИЮПАК Этанол [1] | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 3DMeet | |||
| 1718733 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.000.526 | ||
| 787 | |||
| КЕГГ | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
| Число | И 1170 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 2 Н 6 О | |||
| Молярная масса | 46.069 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | винный, острый [2] | ||
| Плотность | 0,78945 г/см 3 (при 20 °С) [3] | ||
| Температура плавления | −114.14 ± 0.03 [3] ° C (-173,45 ± 0,05 ° F; 159,01 ± 0,03 К) | ||
| Точка кипения | 78.23 ± 0.09 [3] ° С (172,81 ± 0,16 ° F; 351,38 ± 0,09 К) | ||
| смешивается | |||
| войти P | −0.18 | ||
| Давление пара | 5,95 кПа (при 20 °C) | ||
| Кислотность ( pKa ) | 15,9 (H2O ) , 29,8 (ДМСО) [4] [5] | ||
| −33.60·10 −6 см 3 /моль | |||
Показатель преломления ( n D ) | 1.3611 [3] | ||
| Вязкость | 1,2 мПа·с (при 20 °C), 1,074 мПа·с (при 25 °C) [6] | ||
| 1,69 Д [7] | |||
| Опасности | |||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х225 , Х319 , Х360Д | |||
| П210 , П233 , П240 , П241 , П242 , П305+П351+П338 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 14 °С (абсолютное) [9] | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) |
| ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | TWA 1000 частей на миллион (1900 мг/м 3 ) [10] | ||
РЕЛ (рекомендуется) | TWA 1000 частей на миллион (1900 мг/м 3 ) [10] | ||
IDLH (Непосредственная опасность) | 3300 частей на миллион [11] | ||
| Паспорт безопасности (SDS) | [8] | ||
| Родственные соединения | |||
Родственные соединения | |||
| Страница дополнительных данных | |||
| Этанол (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Этанол (также называемый этиловым спиртом , зерновым спиртом , питьевым спиртом или просто спиртом ) представляет собой органическое соединение с химической формулой СН 3 СН 2 ОН . Это спирт , формула которого также записывается как С 2 Н 5 ОН , C 2 H 6 O или EtOH, где Et означает этил . Этанол — летучая , легковоспламеняющаяся , бесцветная жидкость с характерным винным запахом и острым вкусом. [13] [14] Будучи психоактивным депрессантом , он является активным ингредиентом алкогольных напитков и вторым наиболее потребляемым наркотиком в мире после кофеина . [15]
Этанол естественным образом производится в ферментации процессе сахаров дрожжами процессов , или в результате нефтехимических таких как этилена гидратация . Исторически он использовался в качестве общего анестетика и имеет современное медицинское применение в качестве антисептика , дезинфицирующего средства , растворителя для некоторых лекарств и противоядия при отравлении метанолом и этиленгликолем . [16] [17] Его используют как химический растворитель и при синтезе органических соединений , а также как источник топлива . Этанол также можно обезвоживать для получения этилена , важного химического сырья. По состоянию на 2006 год мировое производство этанола составляло 51 гигалитр (1,3 × 10 10 галлонов США), поступающих в основном из Бразилии и США. [18]
Этимология [ править ]
Этанол — систематическое название, определенное Международным союзом теоретической и прикладной химии для соединения, состоящего из алкильной группы углерода с двумя атомами (префикс «эт-»), имеющей между собой одинарную связь (инфикс «-ан-») и присоединенная функциональная группа -OH (суффикс «-ол»). [19]
Префикс «eth-» и уточнение «этил» в слове «этиловый спирт» первоначально произошли от названия «этил», присвоенного в 1834 году группе C.
22Ч
5 – Юстус Либих . Он придумал слово от немецкого названия Aether соединения C.
22Ч
5 -О- С
22Ч
5 обычно называемый «эфиром» (на английском языке , точнее, « диэтиловым эфиром »). [20] Согласно Оксфордскому словарю английского языка , Этил является сокращением древнегреческого αἰθήρ ( aithḗr , «верхний воздух») и греческого слова ὕλη ( hýlē , «дерево, сырье», отсюда «материя, вещество»). [21]
Название этанол было придумано в результате резолюции о наименовании спиртов и фенолов, принятой на Международной конференции по химической номенклатуре , проходившей в апреле 1892 года в Женеве , Швейцария. [22]
Термин «спирт» теперь относится к более широкому классу веществ в химической номенклатуре, но в просторечии он остается названием этанола. Это средневековое заимствование из арабского языка al-kuḥl , порошкообразной руды сурьмы, используемой с древности в качестве косметического средства, и сохранившей это значение в среднелатинском языке . [23] Использование слова «спирт» вместо этанола (полностью «винный спирт») является современным и впервые было зарегистрировано в 1753 году. До конца 18 века термин «спирт» обычно относился к любому сублимированному веществу. [24]
Использует [ править ]
Медицинский [ править ]
Анестетик [ править ]
Этанол – старейшее из известных седативных средств , использовавшееся в качестве общего анестетика для перорального применения во время хирургических операций в древней Месопотамии и в средневековые времена . [16] [17] Легкая интоксикация начинается при концентрации алкоголя в крови 0,03-0,05 % и вызывает анестезиологическую кому при 0,4 %. [25] Однако такое использование сопряжено с высоким риском смертельной алкогольной интоксикации и аспирации легких при рвоте, что привело к использованию альтернатив в древности, таких как опиум и каннабис , а затем, диэтилового эфира . начиная с 1840-х годов, [26]
Антисептик [ править ]
Этанол используется в медицинских салфетках и чаще всего в антибактериальных дезинфицирующих гелях для рук в качестве антисептика, обладающего бактерицидным и противогрибковым действием. [27] Этанол убивает микроорганизмы , растворяя их липидный бислой мембраны и денатурируя их белки , и эффективен против большинства бактерий , грибков и вирусов . Однако он неэффективен против бактериальных спор , но эту проблему можно облегчить с помощью перекиси водорода . [28]
Раствор 70% этанола более эффективен, чем чистый этанол, поскольку этанол обеспечивает оптимальную антимикробную активность за счет молекул воды. Абсолютный этанол может инактивировать микробы, не уничтожая их, поскольку спирт не может полностью проникнуть через мембрану микроба. [29] [30] Этанол также можно использовать в качестве дезинфицирующего и антисептического средства, поскольку он вызывает обезвоживание клеток, нарушая осмотический баланс клеточной мембраны, в результате чего вода покидает клетку, что приводит к ее гибели. [31]
Противоядие [ править ]
Этанол можно применять в качестве противоядия при отравлении этиленгликолем. [32] и отравление метанолом . [33] действуя как конкурентный ингибитор против метанола и этиленгликоля алкогольдегидрогеназы Этанол служит этому процессу , . [34] Хотя этанол имеет больше побочных эффектов, он дешевле и более доступен, чем фомепизол , который также используется в качестве противоядия при отравлении метанолом и этиленгликолем. [35]
Медицинский растворитель [ править ]
Этанол, часто в высоких концентрациях, используется для растворения многих водонерастворимых лекарств и родственных соединений. жидкие препараты обезболивающих , лекарств от кашля и простуды , а также жидкости для полоскания рта могут содержать до 25% этанола. Например, [36] и его, возможно, следует избегать у лиц с побочными реакциями на этанол, такими как респираторные реакции, вызванные алкоголем . [37] Этанол присутствует главным образом в качестве антимикробного консерванта в более чем 700 жидких лекарственных препаратах, включая ацетаминофен , добавки железа , ранитидин , фуросемид , маннитол , фенобарбитал , триметоприм/сульфаметоксазол и отпускаемые без рецепта лекарства от кашля . [38]
Фармакология [ править ]
У млекопитающих этанол метаболизируется преимущественно в печени и желудке ферментами алкогольдегидрогеназы (АДГ). [39] Эти ферменты катализируют окисление этанола в ацетальдегид (этаналь): [40]
- СН 3 СН 2 ОН + НАД + → СН 3 СНО + НАДН + Н +
При наличии в значительных концентрациях этому метаболизму этанола дополнительно способствует цитохрома P450 фермент CYP2E1 у людей, тогда как следовые количества также метаболизируются каталазой . [41]
Полученный промежуточный продукт, ацетальдегид, является известным канцерогеном и представляет для человека значительно большую токсичность, чем сам этанол. Многие из симптомов, обычно связанных с алкогольной интоксикацией, а также многие опасности для здоровья, обычно связанные с длительным употреблением этанола, могут быть связаны с токсичностью ацетальдегида для человека. [42]
Последующее окисление ацетальдегида в ацетат осуществляется ферментами альдегиддегидрогеназы (АЛДГ). Мутация гена ALDH2, который кодирует неактивную или дисфункциональную форму этого фермента, затрагивает примерно 50% населения Восточной Азии, способствуя развитию характерной реакции алкогольного прилива , которая может вызвать временное покраснение кожи, а также ряд связанных с этим, и часто неприятные симптомы отравления ацетальдегидом. [43] Эта мутация обычно сопровождается другой мутацией алкогольдегидрогеназы фермента ADH1B примерно у 80% жителей Восточной Азии, что повышает каталитическую эффективность превращения этанола в ацетальдегид. [43]
Рекреационный [ править ]
Будучи центральной нервной системы депрессантом , этанол является одним из наиболее часто употребляемых психоактивных веществ . [44]
свойства алкоголя Несмотря на психоактивные, вызывающие привыкание и канцерогенные , он легко доступен и законен для продажи в большинстве стран. Существуют законы, регулирующие продажу, экспорт/импорт, налогообложение, производство, потребление и хранение алкогольных напитков. Наиболее распространенным правилом является запрет для несовершеннолетних.
Топливо [ править ]

Топливо для двигателя [ править ]
| Тип топлива | МДж/л | МДж/кг | Исследовать октановое число число |
|---|---|---|---|
| Сухая древесина (20% влажности) | ~19.5 | ||
| Метанол | 17.9 | 19.9 | 108.7 [45] |
| Этанол | 21.2 [46] | 26.8 [46] | 108.6 [45] |
| Е85 (85% этанол, 15% бензин) | 25.2 | 33.2 | 105 |
| Сжиженный природный газ | 25.3 | ~55 | |
| Автогаз ( СУГ ) (60% пропан + 40% бутан ) | 26.8 | 50 | |
| Авиационный бензин (высококтановый бензин, а не авиакеросин) | 33.5 | 46.8 | 100/130 (худой/богатый) |
| Газохол (90% бензин + 10% этанол) | 33.7 | 47.1 | 93/94 |
| Обычный бензин/бензин | 34.8 | 44.4 [47] | мин. 91 |
| Премиальный бензин/бензин | макс. 104 | ||
| Дизель | 38.6 | 45.4 | 25 |
| Уголь древесный экструдированный | 50 | 23 |
Наибольшее применение этанола приходится на моторное топливо и топливную присадку . Бразилия , в частности, во многом зависит от использования этанола в качестве моторного топлива, отчасти из-за своей роли одного из ведущих мировых производителей этанола. [48] [49] Бензин , продаваемый в Бразилии, содержит не менее 25% безводного этанола. Водный этанол (около 95% этанола и 5% воды) может использоваться в качестве топлива более чем в 90% новых бензиновых автомобилей, продаваемых в стране.
В США и многих других странах в основном используются смеси этанола и бензина E10 (10% этанол, иногда известный как бензоспирт) и E85 (85% этанол). Считается, что со временем значительная часть запасов в ≈150 миллиардов галлонов США (570 000 000 м3) 3 ) в год рынок бензина начнет замещаться топливным этанолом. [50]

Австралийский закон ограничивает использование чистого этанола из отходов сахарного тростника до 10 % в автомобилях. В старых автомобилях (и старинных автомобилях, предназначенных для использования более медленно сгорающего топлива) следует модернизировать или заменить клапаны двигателя. [51]
По данным отраслевой правозащитной группы , этанол в качестве топлива снижает вредные выбросы из выхлопных труб угарного газа, твердых частиц, оксидов азота и других загрязняющих веществ, образующих озон. [52] Аргоннская национальная лаборатория проанализировала выбросы парниковых газов от многих различных комбинаций двигателей и топлива и обнаружила, что смесь биодизеля и нефтедизеля ( B20 ) показала снижение на 8%, обычная смесь этанола E85 — на 17%, а целлюлозный этанол — на 64% по сравнению с чистым топливом. бензин. [53] Этанол имеет гораздо большее октановое число по исследовательскому методу (RON), чем бензин, что означает, что он менее склонен к преждевременному зажиганию, что обеспечивает лучшее опережение зажигания, что означает больший крутящий момент и эффективность в дополнение к более низким выбросам углерода. [54]
этанола Сгорание в двигателе внутреннего сгорания приводит к образованию многих продуктов неполного сгорания, производимых бензином, а также значительно большего количества формальдегида и родственных ему соединений, таких как ацетальдегид. [55] Это приводит к значительно большей фотохимической активности и большему количеству приземного озона . [56] Эти данные были собраны в отчете о чистом топливе, в котором сравниваются выбросы топлива. [57] и показать, что выхлопы этанола производят в 2,14 раза больше озона, чем выхлопы бензина. [58] Когда это добавляется в специальный индекс локализованного загрязнения Отчета о чистом топливе, локальное загрязнение этанолом (загрязнение, которое способствует образованию смога) оценивается 1,7, где бензин равен 1,0, а более высокие цифры означают большее загрязнение. [59] Калифорнийский совет по воздушным ресурсам формализовал этот вопрос в 2008 году, признав стандарты контроля формальдегидов группой контроля выбросов, во многом аналогично обычным NOx и химически активным органическим газам (ROG). [60]
Более 20% бразильских автомобилей могут использовать в качестве топлива 100% этанол, включая двигатели, работающие только на этаноле, и двигатели, работающие на гибком топливе . [61] Двигатели с гибким топливом в Бразилии могут работать на любом этаноле, бензине или любой смеси того и другого. В Соединенных Штатах автомобили с гибким топливом могут работать на этаноле с содержанием от 0% до 85% (15% бензина), поскольку смеси с более высоким содержанием этанола пока не разрешены или не эффективны. Бразилия поддерживает этот парк автомобилей, работающих на этаноле, благодаря развитой национальной инфраструктуре, которая производит этанол из выращенного внутри страны сахарного тростника.
этанола Высокая смешиваемость с водой делает его непригодным для транспортировки по современным трубопроводам, как и жидкие углеводороды. [62] Механики отмечают участившиеся случаи повреждения двигателей малой мощности (в частности, карбюратора ) и связывают эти повреждения с повышенным удержанием воды этанолом в топливе. [63]
Ракетное топливо [ править ]
Этанол обычно использовался в качестве топлива в первых двухкомпонентных ракетных транспортных средствах (с жидкостным двигателем) в сочетании с окислителем, таким как жидкий кислород. Немецкая баллистическая ракета А-4 времен Второй мировой войны (более известная под пропагандистским названием Фау-2 ), [64] который считается началом космической эры, использовал этанол в качестве основного компонента B-Stoff . По такой номенклатуре этанол смешивали с 25% воды для снижения температуры в камере сгорания. [65] [66] Команда разработчиков Фау -2 , работающей на этаноле участвовала в разработке американских ракет после Второй мировой войны, в том числе ракеты Redstone , которая запустила первый американский спутник. [67] Спирты вышли из употребления по мере разработки более энергоемкого ракетного топлива. [66] хотя этанол в настоящее время используется в легких гоночных самолетах с ракетными двигателями . [68]
Топливные элементы [ править ]
Коммерческие топливные элементы работают на риформированном природном газе, водороде или метаноле. Этанол является привлекательной альтернативой из-за его широкой доступности, низкой стоимости, высокой чистоты и низкой токсичности. Существует широкий спектр концепций топливных элементов, которые прошли испытания, включая топливные элементы с прямым этанолом , системы автотермического риформинга и термически интегрированные системы. Большая часть работ проводится на исследовательском уровне, хотя ряд организаций находится в начале коммерциализации этаноловых топливных элементов. [69]
Бытовое отопление и приготовление пищи [ править ]
Этаноловые камины можно использовать для отопления дома или для украшения. Этанол также можно использовать в качестве топлива для приготовления пищи. [70] [71]
Сырье [ править ]
Этанол является важным промышленным ингредиентом. Он широко используется в качестве предшественника других органических соединений, таких как этилгалогениды , этиловые эфиры , диэтиловый эфир, уксусная кислота и этиламины .
Растворитель [ править ]
Этанол считается универсальным растворителем , так как его молекулярная структура позволяет растворять как полярные гидрофильные , так и неполярные гидрофобные . соединения Поскольку этанол также имеет низкую температуру кипения , его легко удалить из раствора, который использовался для растворения других соединений, что делает его популярным экстрагентом растительных масел. В методах экстракции масла каннабиса в качестве растворителя для экстракции часто используется этанол. [72] а также в качестве растворителя после обработки для удаления масел, воска и хлорофилла из раствора в процессе, известном как подготовка к зиме .
Этанол содержится в красках , настойках , маркерах и средствах личной гигиены, таких как жидкости для полоскания рта, духи и дезодоранты. Полисахариды осаждаются из водного раствора в присутствии спирта, поэтому осаждение этанолом применяют по этой причине при очистке ДНК и РНК .
Низкотемпературная жидкость [ править ]
Из-за низкой температуры замерзания -114 ° C (-173 ° F) и низкой токсичности этанол иногда используется в лабораториях (с сухим льдом или другими охлаждающими жидкостями) в качестве охлаждающей ванны для поддержания сосудов при температуре ниже точки замерзания воды. . По той же причине он также используется в качестве активной жидкости в спиртовых термометрах .
Химия [ править ]
Химическая формула [ править ]
Этанол представляет собой двухуглеродный спирт . Его молекулярная формула CH 3 CH 2 OH. Молекула этанола имеет строение: CH 3 -CH 2 -OH ( этильная группа , связанная с гидроксильной группой ), что указывает на то, что углерод метильной группы (CH 3 -) присоединен к углероду метиленовой группы (-CH 2 -), что является присоединен к кислороду гидроксильной группы (-OH). Это конституционный изомер диметилового эфира . Этанол иногда сокращают как EtOH , используя общепринятые в органической химии обозначения, обозначающие этильную группу (C 2 H 5 -) с помощью Et .
Физические свойства [ править ]

Этанол — летучая бесцветная жидкость со слабым запахом. Он горит бездымным синим пламенем, которое не всегда видно при обычном освещении. Физические свойства этанола обусловлены прежде всего наличием его гидроксильной группы и короткостью его углеродной цепи. Гидроксильная группа этанола способна участвовать в образовании водородных связей, что делает его более вязким и менее летучим, чем менее полярные органические соединения с аналогичной молекулярной массой, такие как пропан .
этанола Адиабатическая температура пламени при горении на воздухе составляет 2082 °C или 3779 °F. [73]
Этанол немного более преломляющ, чем вода, его показатель преломления составляет 1,36242 (при λ = 589,3 нм и 18,35 °C или 65,03 °F). [74] Тройная точка этанола составляет ± 20 К. 150 [75]
Свойства растворителя [ править ]
Этанол — универсальный растворитель, смешивающийся с водой и многими органическими растворителями, включая уксусную кислоту , ацетон , бензол , четыреххлористый углерод , хлороформ , диэтиловый эфир , этиленгликоль, глицерин , нитрометан , пиридин и толуол . Его основное применение в качестве растворителя — при изготовлении настойки йода, сиропов от кашля и т. д. [74] [76] Он также смешивается с легкими алифатическими углеводородами, такими как пентан и гексан , и с алифатическими хлоридами, такими как трихлорэтан и тетрахлорэтилен . [76]
Смешиваемость этанола с водой контрастирует с несмешиваемостью спиртов с более длинной цепью (пять и более атомов углерода), смешиваемость которых с водой резко снижается с увеличением числа атомов углерода. [77] Смешиваемость этанола с алканами ограничена алканами вплоть до ундекана : смеси с додеканом и высшими алканами демонстрируют разрыв смешиваемости ниже определенной температуры (около 13 ° C для додекана). [78] ). Разрыв смешиваемости имеет тенденцию расширяться с высшими алканами, а температура полной смешиваемости увеличивается.
Смеси этанола и воды имеют меньший объем, чем сумма их отдельных компонентов в данных фракциях. При смешивании равных объемов этанола и воды получается всего 1,92 объема смеси. [74] [79] Смешивание этанола и воды является экзотермическим , с энергией до 777 Дж/моль. [80] выпускается по цене 298 тыс.
Смеси этанола и воды образуют азеотроп при содержании около 89 мольных % этанола и 11 мольных % воды. [81] или смесь 95,6% этанола по массе (или около 97% спирта по объему ) при нормальном давлении, которая кипит при 351 К (78 °С). Этот азеотропный состав сильно зависит от температуры и давления и исчезает при температуре ниже 303 К. [82]

Водородные связи делают чистый этанол гигроскопичным до такой степени, что он легко поглощает воду из воздуха. Полярная природа гидроксильной группы заставляет этанол растворять многие ионные соединения, особенно гидроксиды натрия и калия , хлорид магния , хлорид кальция , хлорид аммония , бромид аммония и бромид натрия . [76] Хлориды натрия и калия мало растворимы в этаноле. [76] Поскольку молекула этанола также имеет неполярный конец, она также растворяет неполярные вещества, включая большинство эфирных масел. [83] и многочисленные ароматизаторы, красители и лекарственные вещества.
Добавление в воду даже нескольких процентов этанола резко снижает поверхностное натяжение воды. Это свойство частично объясняет феномен « винных слез ». Когда вино перемешивают в бокале, этанол быстро испаряется из тонкой пленки вина на стенках бокала. По мере того как содержание этанола в вине уменьшается, его поверхностное натяжение увеличивается, и тонкая пленка «скатывается» и стекает по стеклу по каналам, а не по гладкому листу.
Горючесть [ править ]
Водно-этанольный раствор загорится, если его нагреть выше температуры, называемой температурой вспышки , и затем к нему приложить источник воспламенения. [84] Для 20% спирта по массе (около 25% по объему) это произойдет при температуре около 25 °C (77 °F). Температура вспышки чистого этанола составляет 13 ° C (55 ° F). [85] но на него может очень незначительно влиять состав атмосферы, такой как давление и влажность. Смеси этанола могут воспламениться при температуре ниже средней комнатной температуры. Этанол считается легковоспламеняющейся жидкостью (опасный материал 3-го класса) в концентрациях выше 2,35% по массе (3,0% по объему; 6 доказательство ). [86] [87] [88]
| Этанол мольная доля , % | Температура | |
|---|---|---|
| °С | °Ф | |
| 1 | 84.5 | 184.1 [87] |
| 2 | 64 | 147 [87] |
| 2.35 | 60 | 140 [87] [86] |
| 3 | 51.5 | 124.7 [87] |
| 5 | 43 | 109 [89] |
| 6 | 39.5 | 103.1 [87] |
| 10 | 31 | 88 [89] |
| 20 | 25 | 77 [87] |
| 30 | 24 | 75 [89] |
| 50 | 20 | 68 [89] [87] |
| 70 | 16 | 61 [89] |
| 80 | 15.8 | 60.4 [87] |
| 90 | 14 | 57 [89] |
| 100 | 12.5 | 54.5 [89] [87] [85] |
Блюда, в которых для кулинарных эффектов используется жгучий спирт, называются фламбе .
Естественное явление [ править ]
Этанол является побочным продуктом метаболического процесса дрожжей. Таким образом, этанол будет присутствовать в любой среде обитания дрожжей. Этанол обычно можно найти в перезрелых фруктах. [91] Этанол, вырабатываемый симбиотическими дрожжами, можно найти в цветах бертамской пальмы . Хотя некоторые виды животных, такие как пятихвостая землеройка , демонстрируют поведение, связанное с поиском этанола, большинство из них не проявляют интереса или избегают источников пищи, содержащих этанол. [92] Этанол также образуется при прорастании многих растений в результате естественного анаэробиоза . [93] Этанол был обнаружен в космическом пространстве , образуя ледяной покров вокруг пылинок в межзвездных облаках . [94] Незначительные количества (в среднем 196 частей на миллиард ) эндогенного этанола и ацетальдегида были обнаружены в выдыхаемом воздухе здоровых добровольцев. [95] Синдром автопивоварни , также известный как синдром кишечной ферментации, представляет собой редкое заболевание, при котором опьяняющие количества этанола производятся в результате эндогенного брожения в пищеварительной системе . [96]
Производство [ править ]

Этанол производится как в нефтехимическом производстве гидратации этилена , так и посредством биологических процессов путем ферментации сахаров дрожжами , путем . [97] Какой процесс является более экономичным, зависит от преобладающих цен на нефть и зерновое сырье.
Источники [ править ]
Мировое производство этанола в 2006 году составило 51 гигалитр (1,3 × 10 10 галлонов США), при этом 69% мировых поставок приходится на Бразилию и США. [18] Бразильский этанол производится из сахарного тростника, урожайность которого относительно высока (на 830% больше топлива, чем ископаемого топлива, используемого для его производства) по сравнению с некоторыми другими энергетическими культурами . [98] Сахарный тростник не только имеет большую концентрацию сахарозы, чем кукуруза (примерно на 30%), но его также гораздо легче извлечь. Полученный в результате этого процесса жом не выбрасывается, а сжигается на электростанциях для производства электроэнергии. На сжигание жома приходится около 9% электроэнергии, производимой в Бразилии. [99]
В 1970-х годах большая часть промышленного этанола в США производилась в результате нефтехимической продукции, но в 1980-х годах США ввели субсидии на производство этанола на основе кукурузы . [100] По данным Ассоциации возобновляемых источников топлива, по состоянию на 30 октября 2007 г. 131 завод по биопереработке зернового этанола в США имеет мощность для производства 7 × 10 9 Галлон США (26 000 000 м 3 ) этанола в год. Еще 72 строительных проекта, находящихся в стадии реализации (в США), могут добавить 6,4 миллиарда галлонов США (24 000 000 м3). 3 ) новых мощностей в ближайшие 18 месяцев. [50]
В Индии этанол производят из сахарного тростника. [101] Сахарное сорго является еще одним потенциальным источником этанола и подходит для выращивания в засушливых условиях. Международный научно-исследовательский институт сельскохозяйственных культур полузасушливых тропиков изучает возможность выращивания сорго в качестве источника топлива, продуктов питания и корма для животных в засушливых частях Азии и Африки . [102] Сладкое сорго требует в три раза меньше воды, чем сахарный тростник за тот же период. Ему также требуется примерно на 22% меньше воды, чем кукурузе. Первый в мире завод по производству этанола из сладкого сорго начал коммерческое производство в 2007 году в Андхра-Прадеше , Индия . [103]
Гидратация [ править ]
Этанол можно производить из нефтехимического сырья, главным образом, кислотно - катализируемой гидратации этилена путем . Его часто называют синтетическим этанолом.
- С 2 Н 4 + Н 2 О → С 2 Н 5 ОН
Катализатором чаще всего является фосфорная кислота . [104] [105] адсорбируется на пористой подложке, такой как силикагель или диатомит . Этот катализатор был впервые использован для крупномасштабного производства этанола компанией Shell Oil в 1947 году. [106] Реакцию проводят в присутствии пара высокого давления при температуре 300 °C (572 °F), при этом поддерживается соотношение этилена к пару 5:3. [107] [108] Этот процесс использовался в промышленных масштабах Union Carbide Corporation и другими. В США это больше не практикуется, поскольку этанол, полученный путем ферментации из кукурузы, более экономичен. [109]
В более старом процессе, впервые примененном в промышленном масштабе в 1930 году компанией Union Carbide. [110] но теперь почти полностью устаревший, этилен гидратировался косвенно, реагируя с концентрированной серной кислотой с образованием этилсульфата , который гидролизовался с получением этанола и регенерации серной кислоты: [111]
- C 2 H 4 + H 2 SO 4 → C 2 H 5 HSO 4
- C 2 H 5 HSO 4 + H 2 O → H 2 SO 4 + C 2 H 5 OH
Из углекислого газа [ править ]
Этанол получают в лаборатории путем преобразования углекислого газа посредством биологических и электрохимических реакций. [112] [113]
2 О → СН
3 СН
2 O H + побочные продукты
Ферментация [ править ]
Этанол в алкогольных напитках и топливе получают путем брожения. Некоторые виды дрожжей (например, Saccharomyces cerevisiae ) метаболизируют сахар (а именно полисахариды ), производя этанол и углекислый газ. Приведенные ниже химические уравнения суммируют преобразование:
66Ч
12 О
6 → 2 СН
3 СН
2 О Н + 2 СО 2
Ферментация — это процесс культивирования дрожжей при благоприятных температурных условиях для производства спирта. Этот процесс осуществляется при температуре около 35–40 ° C (95–104 ° F). Токсичность этанола для дрожжей ограничивает концентрацию этанола, которую можно получить при пивоварении; поэтому более высокие концентрации получаются путем обогащения или перегонки . Наиболее толерантные к этанолу штаммы дрожжей могут выдерживать содержание этанола примерно до 18% по объему.
Чтобы произвести этанол из крахмалистых материалов, таких как зерновые , крахмал сначала необходимо превратить в сахара. В пивоварении это традиционно достигается за счет прорастания зерна или солода , который производит фермент амилазу . Когда солодовое зерно затирают , амилаза превращает оставшиеся крахмалы в сахара.
Целлюлоза [ править ]
Сахара для этанолового брожения можно получить из целлюлозы . Внедрение этой технологии могло бы превратить ряд целлюлозосодержащих побочных продуктов сельского хозяйства, таких как кукурузные початки , солома и опилки , в возобновляемые источники энергии. Другие сельскохозяйственные отходы, такие как жом сахарного тростника и энергетические культуры, такие как просо, также могут быть источниками сбраживаемого сахара. [114]
Тестирование [ править ]


Пивоварни и заводы по производству биотоплива используют два метода измерения концентрации этанола. Инфракрасные датчики этанола измеряют частоту колебаний растворенного этанола, используя полосу C-H на длине волны 2900 см. −1 . В этом методе используется относительно недорогой твердотельный датчик, который сравнивает полосу C-H с эталонной полосой для расчета содержания этанола. В расчете используется закон Бера-Ламберта . Альтернативно, измеряя плотность исходного материала и плотность продукта с помощью ареометра , изменение удельного веса во время ферментации указывает на содержание спирта. Этот недорогой и непрямой метод имеет долгую историю в пивоваренной промышленности.
Очищение [ править ]
Дистилляция [ править ]
Гидратация или пивоварение этилена дает смесь этанола и воды. Для большинства промышленных и топливных целей этанол необходимо очищать. Фракционная перегонка при атмосферном давлении позволяет сконцентрировать этанол до 95,6% по массе (89,5 мольных%). Эта смесь представляет собой азеотроп с температурой кипения 78,1 ° C (172,6 ° F) и не подлежит дальнейшей очистке путем перегонки. Добавление азеотропа, такого как бензол , циклогексан или гептан , позволяет образовать новый тройной азеотроп, включающий этанол, воду и азеотроп. Этот тройной азеотроп с более низкой температурой кипения предпочтительно удаляется, что приводит к получению безводного этанола. [105]
и осушители сита Молекулярные
Помимо дистилляции, этанол можно сушить добавлением влагопоглотителя , такого как молекулярные сита , целлюлоза или кукурузная мука . Осушители можно сушить и использовать повторно. [105] Молекулярные сита можно использовать для избирательного поглощения воды из 95,6% раствора этанола. [115] Молекулярные сита с размером пор 3 ангстрема , тип цеолита , эффективно изолируют молекулы воды, исключая при этом молекулы этанола. Нагревание влажных сит вытесняет воду, позволяя восстановить их влагопоглощающую способность. [116]
и осмос обратный Мембраны
Мембраны также можно использовать для разделения этанола и воды. Мембранное разделение не подпадает под ограничения азеотропа вода-этанол, поскольку разделение не основано на равновесии пар-жидкость. Мембраны часто используются в так называемом процессе гибридной мембранной дистилляции. В этом процессе в качестве первой стадии разделения используется дистилляционная колонна предварительного концентрирования. Дальнейшее разделение затем осуществляют с помощью мембраны, работающей либо в режиме паропроницаемости, либо в режиме первапорации. Для паропроницаемости используется подача паровой мембраны, а для первапорации - подача жидкой мембраны.
Другие методы [ править ]
Обсуждались различные другие методы, в том числе следующие: [105]
- Засолка с использованием карбоната калия с целью использования его нерастворимости приведет к разделению фаз на этанол и воду. Это обеспечивает очень небольшую примесь карбоната калия к спирту, которую можно удалить перегонкой. Этот метод очень полезен при очистке этанола перегонкой, поскольку этанол образует азеотроп с водой.
- Прямое электрохимическое восстановление диоксида углерода до этанола в условиях окружающей среды с использованием наночастиц меди на пленке из углеродных наношипов в качестве катализатора; [117]
- Экстракция этанола из зернового сусла сверхкритическим диоксидом углерода ;
- Первапорация ;
- Фракционное замораживание также используется для концентрирования сброженных спиртовых растворов, таких как традиционно приготовленный «Эпплджек» (напиток) ;
- Адсорбция при переменном давлении . [118]
Марки этанола [ править ]
Денатурированный спирт [ править ]
Чистый этанол и алкогольные напитки облагаются высокими налогами как психоактивные вещества, но этанол имеет множество применений, не связанных с его потреблением. Чтобы облегчить налоговое бремя для этих видов использования, большинство юрисдикций отменяют налог, если в этанол был добавлен агент, делающий его непригодным для питья. К ним относятся придающие горечь вещества , такие как бензоат денатониума , и токсины, такие как метанол, нафта и пиридин . Продукты такого рода называются денатурированным спиртом. [119] [120]
Абсолютный алкоголь [ править ]
Абсолютный или безводный спирт относится к этанолу с низким содержанием воды. Существуют различные сорта с максимальным содержанием воды от 1% до нескольких частей на миллион (ppm). Если для удаления воды используется азеотропная перегонка , она будет содержать следовые количества агента разделения материалов (например, бензола). [121] Абсолютный алкоголь не предназначен для употребления человеком. Абсолютный этанол используется в качестве растворителя в лабораторных и промышленных целях, где вода вступает в реакцию с другими химическими веществами, а также в качестве топливного спирта. Спектроскопический этанол — абсолютный этанол с низким поглощением в ультрафиолетовом и видимом свете, пригодный для использования в качестве растворителя в ультрафиолетово-видимой спектроскопии . [122]
Чистый этанол классифицируется как 200 градусов в США, что эквивалентно 175 градусам в британской системе. [123]
Ректифицированные спиртные напитки [ править ]
Вместо безводного этанола для различных целей используют спирт-ректификат — азеотропную композицию 96% этанола, содержащую 4% воды. Винные спирты состоят примерно на 94% из этанола (крепость 188). Примеси отличаются от примесей в 95% (190 доказательство) лабораторном этаноле. [124]
Реакция [ править ]
Этанол классифицируется как первичный спирт, а это означает, что к углероду, к которому присоединена его гидроксильная группа, также присоединены как минимум два атома водорода. Многие реакции этанола происходят по его гидроксильной группе.
Образование эфира [ править ]
В присутствии кислотных катализаторов этанол реагирует с карбоновыми кислотами с образованием этиловых эфиров и воды:
- RCOOH + HOCH 2 CH 3 → RCOOCH 2 CH 3 + H 2 O
Эта реакция, которая проводится в промышленных масштабах, требует удаления воды из реакционной смеси по мере ее образования. Эфиры реагируют в присутствии кислоты или основания с возвратом спирта и соли. Эта реакция известна как омыление , поскольку ее используют при приготовлении мыла. Этанол также может образовывать сложные эфиры с неорганическими кислотами. Диэтилсульфат и триэтилфосфат получают обработкой этанола триоксидом серы и пятиокисью фосфора соответственно. Диэтилсульфат является полезным этилирующим агентом в органическом синтезе . Этилнитрит , полученный в результате реакции этанола с нитритом натрия и серной кислотой, раньше использовался как мочегонное средство .
Обезвоживание [ править ]
В присутствии кислотных катализаторов спирты могут превращаться в алкены, например этанол в этилен. Обычно твердые кислоты , такие как оксид алюминия . используются [125]
- СН 3 СН 2 ОН → Н 2 С=СН 2 + Н 2 О
Поскольку вода удаляется из той же молекулы, реакция известна как внутримолекулярная дегидратация . Внутримолекулярная дегидратация спирта требует высокой температуры и присутствия кислотного катализатора, такого как серная кислота . [126]
Этилен, производимый из этанола, полученного из сахара (в основном в Бразилии), конкурирует с этиленом, производимым из нефтехимического сырья, такого как нафта и этан.
При более низкой температуре, чем при внутримолекулярной дегидратации, может происходить межмолекулярная дегидратация спирта с образованием симметричного эфира. Это реакция конденсации . В следующем примере диэтиловый эфир получают из этанола:
- 2 СН 3 СН 2 ОН → СН 3 СН 2 ОСН 2 СН 3 + Н 2 О [127]
Горение [ править ]
При полном сгорании этанола образуются углекислый газ и вода:
- C 2 H 5 OH (ж) + 3 O 2 (г) → 2 CO 2 (г) + 3 H 2 O (ж); −Δ c H = 1371 кДж/моль [128] = 29,8 кДж/г = 327 ккал/моль = 7,1 ккал/г
- C 2 H 5 OH (ж) + 3 O 2 (г) → 2 CO 2 (г) + 3 H 2 O (г); −Δ c H = 1236 кДж/моль = 26,8 кДж/г = 295,4 ккал/моль = 6,41 ккал/г [129]
Удельная теплоемкость = 2,44 кДж/(кг·К)
Кислотно-основная химия [ править ]
Этанол является нейтральной молекулой, и pH раствора этанола в воде составляет около 7,00. Этанол можно количественно преобразовать в сопряженное с ним основание , этоксид- ион (CH 3 CH 2 O − ), по реакции с щелочным металлом, например натрием : [77]
- 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 CH 2 ONa + H 2
или очень сильное основание, такое как гидрид натрия :
- CH 3 CH 2 OH + NaH → CH 3 CH 2 ONa + H 2
Кислотность воды и этанола почти одинакова, о чем свидетельствует их рКа , равный 15,7 и 16 соответственно. Таким образом, этоксид натрия и гидроксид натрия существуют в близко сбалансированном равновесии:
- CH 3 CH 2 OH + NaOH ⇌ CH 3 CH 2 ONa + H 2 O
Галогенирование [ править ]
Этанол не используется в промышленности в качестве предшественника этилгалогенидов, но реакции являются показательными. Этанол реагирует с галогеноводородами с образованием этилгалогенидов, как этилхлорид и этилбромид, посредством реакции SN таких 2 :
- CH 3 CH 2 OH + HCl → CH 3 CH 2 Cl + H 2 O
HCl требует катализатора, такого как хлорид цинка . [111] HBr требует кипячения с серной кислотой в качестве катализатора. [111] Этилгалогениды, в принципе, также можно получать путем обработки этанола более специализированными галогенирующими агентами , такими как тионилхлорид или трибромид фосфора . [77] [111]
- CH 3 CH 2 OH + SOCl 2 → CH 3 CH 2 Cl + SO 2 + HCl
При обработке галогенами в присутствии основания этанол дает соответствующую галоформу (CHX 3 , где X = Cl, Br, I). Это превращение называется галоформной реакцией . [130] Промежуточным продуктом реакции с хлором является альдегид хлорал при реакции , который образует хлоралгидрат : с водой [131]
- 4 Cl 2 + CH 3 CH 2 OH → CCl 3 CHO + 5 HCl
- CCl 3 CHO + H 2 O → CCl 3 C(OH) 2 H
Окисление [ править ]
Этанол может окисляться до ацетальдегида и далее окисляться до уксусной кислоты , в зависимости от реагентов и условий. [111] Это окисление не имеет промышленного значения, но в организме человека эти реакции окисления катализируются ферментом алкогольдегидрогеназой печени . Продукт окисления этанола, уксусная кислота, является питательным веществом для человека, являясь предшественником ацетил-КоА , где ацетильная группа может расходоваться в качестве энергии или использоваться для биосинтеза.
Метаболизм [ править ]
Этанол похож на макроэлементы , такие как белки, жиры и углеводы, в том, что он обеспечивает калории. При потреблении и метаболизме он дает 7 килокалорий на грамм посредством метаболизма этанола . [132]
Безопасность [ править ]
Этанол очень легко воспламеняется, и его нельзя использовать вблизи открытого огня.
Чистый этанол вызывает раздражение кожи и глаз. [133] Тошнота, рвота и интоксикация являются симптомами приема внутрь. Длительное применение внутрь может привести к серьезному повреждению печени. [134] Концентрации в атмосфере выше одной части на тысячу превышают пределы профессионального воздействия Европейского Союза . [134]
История [ править ]
Ферментация сахара в этанол — одна из самых ранних биотехнологий, используемых человеком. Этанол исторически называли по-разному: винным спиртом или пылким спиртом. [135] и как аквавита или аквавита. Опьяняющее действие его употребления известно с древних времен. Этанол использовался людьми с доисторических времен в качестве опьяняющего ингредиента алкогольных напитков . Засохшие остатки 9000-летней глиняной посуды, найденной в Китае, позволяют предположить, что люди неолита употребляли алкогольные напитки. [136]
Огнеопасная природа испарений вина уже была известна древним натурфилософам, таким как Аристотель (384–322 гг. до н.э.), Теофраст ( ок. 371–287 гг. до н.э.) и Плиний Старший (23/24–79 гг. н.э.). [137] Однако это не привело к немедленному выделению этанола, даже несмотря на развитие более совершенных методов дистилляции в Римском Египте второго и третьего веков . [138] Важным признанием, впервые обнаруженным в одном из сочинений, приписываемых Джабиру ибн Хайяну (девятый век нашей эры), было то, что добавление соли вина в кипящее вино, что увеличивает относительную летучесть , может повысить воспламеняемость образующихся паров. [139] Дистилляция вина засвидетельствована в арабских работах, приписываемых аль-Кинди ( ок. 801–873 гг. Н. Э.) и аль-Фараби ( ок. 872–950 ), а также в 28-й книге аз-Захрави (лат. Абулкасис). , 936–1013) Китаб ат-Тасриф (позже переведенный на латынь как Liber servatoris ). [140] В двенадцатом веке рецепты получения aqua ardens («горящей воды», т. е. этанола) путем перегонки вина с солью стали появляться в ряде латинских сочинений, а к концу тринадцатого века они получили широкое распространение. известное вещество среди западноевропейских химиков. [141]
В работах Таддео Альдеротти (1223–1296) описан метод концентрирования этанола, включающий повторную фракционную перегонку с водяным охлаждением через перегонный куб , с помощью которого можно было получить этанол чистотой 90%. [142] Лечебные свойства этанола изучали Арнальд Вилланова (1240–1311 гг. н. э.) и Иоанн Рупескисса ( ок. 1310–1366 ), последний из которых считал его жизнесохраняющим веществом, способным предотвратить все болезни ( вода жизни). или «вода жизни», также названная Иоанном квинтэссенцией вина). [143]
Археологические данные показывают, что в Китае настоящая перегонка алкоголя началась во времена династий Цзинь (1115–1234) или Южная Сун (1127–1279). [144] На месте археологических раскопок в Цинлуне, Хэбэй , был найден перегонный куб, датируемый 12 веком. [144] В Индии настоящая перегонка алкоголя была завезена с Ближнего Востока и широко использовалась в Делийском султанате к 14 веку. [145]
В 1796 году немецкий химик Иоганн Тобиас Ловиц получил чистый этанол, смешав частично очищенный этанол (азеотроп спирт-вода) с избытком безводной щелочи и затем перегнав смесь на слабом огне. [146] Французский химик Антуан Лавуазье описал этанол как соединение углерода, водорода и кислорода, а в 1807 году Николя-Теодор де Соссюр определил химическую формулу этанола. [147] [148] Пятьдесят лет спустя Арчибальд Скотт Купер опубликовал структурную формулу этанола. Это была одна из первых структурных формул. [149]
Этанол был впервые получен синтетически в 1825 году Майклом Фарадеем . Он обнаружил, что серная кислота может поглощать большие объемы угольного газа . [150] Полученный раствор он передал Генри Хеннелу , британскому химику, который в 1826 году обнаружил, что он содержит «сульфовиновую кислоту» ( этилгидросульфат ). [151] В 1828 году Хеннелл и французский химик Жорж-Симон Серуллас независимо друг от друга обнаружили, что сульфовиновая кислота может разлагаться до этанола. [152] [153] Так, в 1825 году Фарадей невольно обнаружил, что этанол можно производить из этилена (компонента угольного газа) путем кислотно-катализируемой гидратации, процесса, подобного современному промышленному синтезу этанола. [154]
Этанол использовался в качестве топлива для ламп в США еще в 1840 году, но налог, взимаемый с технического спирта во время Гражданской войны, сделал это использование неэкономичным. Налог был отменен в 1906 году. [155] Использование в качестве автомобильного топлива началось в 1908 году, когда модель Ford T могла работать на бензине (бензине) или этаноле. [156] Он питает некоторые спиртовки .
Этанол, предназначенный для промышленного использования, часто производят из этилена. [157] Этанол широко используется в качестве растворителя веществ, предназначенных для контакта или потребления человеком, включая ароматизаторы, ароматизаторы, красители и лекарства. В химии это одновременно растворитель и сырье для синтеза других продуктов. Он имеет долгую историю использования в качестве топлива для обогрева и освещения, а в последнее время — в качестве топлива для двигателей внутреннего сгорания.
См. также [ править ]
Ссылки [ править ]
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж, Великобритания: Королевское химическое общество . 2014. с. 30. дои : 10.1039/9781849733069-00001 . ISBN 978-0-85404-182-4 .
- ^ «Этанол» . ПабХим . Проверено 29 декабря 2022 г.
- ^ Jump up to: а б с д Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 3.246. ISBN 1-4398-5511-0 .
- ^ Баллинджер П., Лонг Ф.А. (1960). «Кислотные константы ионизации спиртов. II. Кислотность некоторых замещенных метанолов и родственных соединений1,2». Журнал Американского химического общества . 82 (4): 795–798. дои : 10.1021/ja01489a008 .
- ^ Арнетт Э.М., Венкатасубраманиам К.Г. (1983). «Термохимические кислотности в трех суперосновных системах». Дж. Орг. Хим . 48 (10): 1569–1578. дои : 10.1021/jo00158a001 .
- ^ Лиде ДР, изд. (2012). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press/Тейлор и Фрэнсис. стр. 6–232.
- ^ Лиде ДР, изд. (2008). Справочник CRC по химии и физике (89-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 9–55.
- ^ «Паспорт безопасности этанола» . Проверено 12 января 2023 г.
- ^ «Этанол» . webwiser.nlm.nih.gov . Проверено 25 июня 2021 г.
- ^ Jump up to: а б Карманный справочник NIOSH по химическим опасностям. «#0262» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Этиловый спирт» . Проверено 23 декабря 2023 г.
- ^ «Этиловый спирт» . 2 ноября 2018 года . Проверено 23 декабря 2023 г.
- ^ «Этанол» . ПабХим. Национальная медицинская библиотека . Проверено 28 сентября 2021 г.
- ^ «Этиловый спирт» (PDF) . Информационный бюллетень об опасных веществах. Департамент здравоохранения штата Нью-Джерси . Проверено 28 сентября 2021 г.
- ^ Сонг, Фрэнк; Уокер, Мэтью П. (8 ноября 2023 г.). «Сон, алкоголь и кофеин у финансовых трейдеров» . ПЛОС ОДИН . 18 (11): e0291675. дои : 10.1371/journal.pone.0291675 . ISSN 1932-6203 . ПМЦ 10631622 . ПМИД 37939019 .
- ^ Jump up to: а б Пауэлл М.А. (2004). «9: Вино и виноградная лоза в древней Месопотамии: клинописные свидетельства» . В McGovern PE, Fleming SJ, Katz SH (ред.). Происхождение и древняя история вина . Еда и питание в истории и антропологии. Том. 11 (1-е изд.). Амстердам: Тейлор и Фрэнсис. стр. 96–124. ISBN 978-0-203-39283-6 . ISSN 0275-5769 . Проверено 15 сентября 2010 г.
- ^ Jump up to: а б Шнелле, Норберт (август 1965 г.). «Алкоголь, вводимый внутривенно для общей анестезии» . Хирургические клиники Северной Америки . 45 (4): 1041–1049. дои : 10.1016/S0039-6109(16)37650-2 . ПМИД 14312998 . Проверено 30 декабря 2022 г.
- ^ Jump up to: а б «Мировое производство топливного этанола, 2008 г.» . Эллисвилл, штат Миссури: Ассоциация возобновляемых источников топлива. Архивировано из оригинала 24 сентября 2015 года . Проверено 21 февраля 2011 г.
- ^ «Этанол – Краткое описание соединений» . Проект ПабХим . Бетесда, Мэриленд: Национальный центр биотехнологической информации.
- ^ Либих Дж. (1834 г.). «О строении эфира и его соединений» . Анналы аптеки (на немецком языке). 9 (22): 1–39. Бибкод : 1834АнП...107..337Л . дои : 10.1002/andp.18341072202 .
Со стр. 18: « +10Н радикалом эфира с Е 2 и назовем его этилом...). Назовем углеводородное соединение 4С
- ^ Харпер, Дуглас. «этил» . Интернет-словарь этимологии .
- ^ Отчет о Международной конференции по химической номенклатуре 1892 года см.:
- Армстронг Х (1892 г.). «Международная конференция по химической номенклатуре» . Природа . 46 (1177): 56–59. Бибкод : 1892Natur..46...56A . дои : 10.1038/046056c0 .
- Отчет Армстронга перепечатан с резолюциями на английском языке в: Армстронг Х (1892 г.). «Международная конференция по химической номенклатуре» . Журнал аналитической и прикладной химии . 6 (1177): 390–400 (398). Бибкод : 1892Natur..46...56A . дои : 10.1038/046056c0 .
Спирты и фенолы будут называться по названию углеводорода, из которого они получены, оканчивающемуся суффиксом ол (например, пентанол, пентинол и т. д.).
- ^ Мультауф, Роберт П. (1966). Истоки химии . Лондон: Олдборн. ISBN 9782881245947 . п. 205; ВОЗРАСТ ; etymonline.com
- ^ Berthelot, Marcellin ; Houdas, Octave V. (1893). La Chimie au Moyen Âge . Vol. I. Paris: Imprimerie nationale. p. 136.
- ^ Каве, Энтони. «Три натуральных, древних анестетика, о которых никто не говорит: опиум, алкоголь и марихуана» . Доктор Энтони Каве, доктор медицинских наук . Проверено 30 декабря 2022 г.
- ^ Граттан, Н. «Лечение маточного кровотечения». Провинциальный медико-хирургический журнал . Том. 1, № 6 (7 ноября 1840 г.), с. 107.
- ^ Погорецкий, Лариса А.; Брик, Джон (январь 1988 г.). «Фармакология этанола». Фармакология и терапия . 36 (2–3): 335–427. дои : 10.1016/0163-7258(88)90109-X . ПМИД 3279433 .
- ^ Макдоннелл Дж., Рассел А.Д. (январь 1999 г.). «Антисептики и дезинфицирующие средства: активность, действие и резистентность» . Обзоры клинической микробиологии . 12 (1): 147–179. дои : 10.1128/CMR.12.1.147 . ПМЦ 88911 . ПМИД 9880479 .
- ^ «Химические дезинфицирующие средства | Рекомендации по дезинфекции и стерилизации | Библиотека руководств | Инфекционный контроль | CDC» . www.cdc.gov . Проверено 29 января 2018 г.
- ^ «Почему для протирания микробиологических рабочих зон используют 70-процентный этанол?» . Исследовательские ворота . Проверено 29 января 2018 г.
- ^ «Этанол» . www.drugbank.ca . Проверено 28 января 2019 г.
- ^ Скалли Р. (сентябрь 2002 г.). «Лечение отравления этиленгликолем» . Американский семейный врач . 66 (5): 807–813. ПМИД 12322772 . Проверено 15 января 2018 г.
- ^ Бошан, Джорджия; Валенто, М. (сентябрь 2016 г.). «Токсическое употребление алкоголя: быстрое распознавание и лечение в отделении неотложной помощи». Практика неотложной медицинской помощи . 18 (9): 1–20. ПМИД 27538060 .
- ^ Сасанами, Миса; Ямада, Тайхэй; Обара, Такафуми; Накао, Ацунори; Наито, Хиромичи (2020). «Пероральное лечение этанолом при интоксикации этиленгликолем» . Куреус . 12 (12): e12268. дои : 10.7759/cureus.12268 . ISSN 2168-8184 . ПМЦ 7827791 . ПМИД 33510981 .
- ^ Ансиу, Курт; Саббе, Марк Б.; Легран, Аннеми (апрель 2008 г.). «Отравление метанолом: двойственность между «быстро и дешево» и «медленно и дорого » . Европейский журнал неотложной медицины . 15 (2): 107–109. дои : 10.1097/MEJ.0b013e3282f3c13b . ISSN 0969-9546 . ПМИД 18446077 . S2CID 23861841 .
- ^ «Содержание алкоголя в обычных препаратах» (PDF) . Медицинское общество штата Нью-Йорк. Архивировано из оригинала (PDF) 29 апреля 2021 года . Проверено 8 октября 2019 г.
- ^ Адамс К.Э., Ранс Т.С. (декабрь 2013 г.). «Побочные реакции на алкоголь и алкогольные напитки». Анналы аллергии, астмы и иммунологии . 111 (6): 439–445. дои : 10.1016/j.anai.2013.09.016 . ПМИД 24267355 .
- ^ Зуккотти Г.В., Фабиано В. (июль 2011 г.). «Проблемы безопасности этанола в качестве вспомогательного вещества в лекарствах, предназначенных для педиатрического применения». Экспертное заключение о безопасности лекарственных средств . 10 (4): 499–502. дои : 10.1517/14740338.2011.565328 . ПМИД 21417862 . S2CID 41876817 .
- ^ Фаррес Дж., Морено А., Кросас Б., Перальба Дж.М., Аллали-Хассани А., Хьельмквист Л. и др. (сентябрь 1994 г.). «Алкогольдегидрогеназа класса IV (сигма-сигма-АДГ) из желудка человека. Последовательность кДНК и взаимоотношения структура/функция» . Европейский журнал биохимии . 224 (2): 549–557. дои : 10.1111/j.1432-1033.1994.00549.x . ПМИД 7925371 .
- ^ Эденберг Х.Дж., МакКлинтик Дж.Н. (декабрь 2018 г.). «Алкогольдегидрогеназы, альдегиддегидрогеназы и расстройства, связанные с употреблением алкоголя: критический обзор» . Алкоголизм: клинические и экспериментальные исследования . 42 (12): 2281–2297. дои : 10.1111/acer.13904 . ПМК 6286250 . ПМИД 30320893 .
- ^ Хейт, К.; Донг, Х.; Чен, Ю.; Томпсон, округ Колумбия; Дитрих, РА; Василев, В.К. (2013). «Роль CYP2E1 в метаболизме алкоголя и чувствительности центральной нервной системы». Цитохром P450 2E1: его роль в заболеваниях и метаболизме лекарств . Субклеточная биохимия. Том. 67. С. 235–237. дои : 10.1007/978-94-007-5881-0_8 . ISBN 978-94-007-5880-3 . ПМК 4314297 . ПМИД 23400924 .
- ^ «Алкогольный метаболизм: обновление» . Публикации НИАА . Национальный институт здоровья. Архивировано из оригинала 28 февраля 2021 года . Проверено 10 марта 2021 г.
- ^ Jump up to: а б Энг М.Ю., Лузак С.Е., Уолл Т.Л. (2007). «Генотипы ALDH2, ADH1B и ADH1C у азиатов: обзор литературы» . Исследования алкоголя и здоровье . 30 (1): 22–27. ПМЦ 3860439 . ПМИД 17718397 .
- ^ «Употребление алкоголя и безопасное употребление алкоголя: Медицинская энциклопедия MedlinePlus» . medlineplus.gov . Проверено 11 марта 2023 г.
- ^ Jump up to: а б Эйдоган М., Озсезен А.Н., Чанакчи М., Тюрккан А. (2010). «Влияние топливных смесей спирта и бензина на производительность и характеристики сгорания двигателя SI». Топливо . 89 (10): 2713–2720. doi : 10.1016/j.fuel.2010.01.032 .
- ^ Jump up to: а б Томас, Джордж (2000). «Обзор программы развития водородных систем Министерства энергетики США» (PDF) . Ливермор, Калифорния: Национальные лаборатории Сандии. Архивировано из оригинала (PDF) 21 февраля 2007 года.
- ^ Томас Дж. (2000). «Обзор программы развития водородных систем Министерства энергетики США» (PDF) . Сандианские национальные лаборатории . Проверено 1 августа 2009 г.
- ^ «Наличие источников Е85» . Фонд чистого воздуха . Проверено 27 июля 2015 г.
- ^ «Производство топливного этанола в мире» . Статистика . Проверено 2 июня 2021 г.
- ^ Jump up to: а б «Объявлено о первом коммерческом заводе по биопереработке целлюлозного этанола в США» . Ассоциация возобновляемых источников топлива. 20 ноября 2006 г. Проверено 31 мая 2011 г.
- ^ Грин Р. «Модель Т Ford Club Australia (Inc.)» . Архивировано из оригинала 14 января 2014 года . Проверено 24 июня 2011 г.
- ^ «Этанол 101» . Американская коалиция за этанол. Архивировано из оригинала 14 ноября 2020 года . Проверено 26 марта 2011 г.
- ^ Коалиция энергетического будущего. «Часто задаваемые вопросы по биотопливу» . Справочник по биотопливу . Фонд ООН . Архивировано из оригинала 19 февраля 2011 года.
- ^ Малакиас, Аугусто Сезар Тейшейра; Нетто, Нилтон Антонио Диниз; Фильо, Фернандо Антонио Родригес; да Коста, Роберто Берлини Родригес; Лангеани, Маркос; Баэта, Хосе Гильерме Коэльо (18 ноября 2019 г.). «Вводящая в заблуждение полная замена двигателей внутреннего сгорания электродвигателями и исследование важности бразильского этанола для устойчивого будущего мобильности: обзор» . Журнал Бразильского общества механических наук и инженерии . 41 (12): 567. doi : 10.1007/s40430-019-2076-1 . ISSN 1806-3691 .
- ^ Калифорнийский совет по воздушным ресурсам (октябрь 1989 г.). «Определение транспортного средства с низким уровнем выбросов в соответствии с требованиями Кодекса охраны труда и техники безопасности, раздел 39037.05, вторая версия» . Архивировано из оригинала 18 февраля 2018 года . Проверено 18 февраля 2018 г.
- ^ Лоуи А., Картер В.П. (март 1990 г.). Метод оценки воздействия на атмосферный озон реальных выбросов транспортных средств . Уоррендейл, Пенсильвания.
{{cite book}}:|work=игнорируется ( помощь ) CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Джонс Т.Т. (2008). «Отчет о чистом топливе: количественное сравнение моторного топлива, связанных с ним загрязнений и технологий» . www.researchandmarkets.com . Архивировано из оригинала 9 сентября 2012 года.
- ^ Тао Р. (16–20 августа 2010 г.). Электрореологические жидкости и магнитореологические суспензии . Филадельфия: World Scientific. ISBN 9789814340229 .
{{cite book}}:|work=игнорируется ( помогите ) - ^ Бьелло Д. «Хотите уменьшить загрязнение воздуха? Не обязательно полагайтесь на этанол» . Научный американец . Проверено 11 июля 2017 г.
- ^ «Принятие мер по ограничению выбросов формальдегида из композитных древесных материалов» . Чикаго и Вашингтон, округ Колумбия: Ассоциация производителей окон и дверей. 30 июля 2008 г. Архивировано из оригинала 9 марта 2010 г.
- ^ «Гибкие технологии привлекают иностранцев» (на бразильском португальском языке). Государственное агентство.
- ^ Хорн М., Крупп Ф. (16 марта 2009 г.). Земля: Продолжение: Гонка за новое изобретение энергетики и остановку глобального потепления . Том. 62. С. 63–65. Бибкод : 2009ФТ....62д..63К . дои : 10.1063/1.3120901 . ISBN 978-0-393-06810-8 . S2CID 153892198 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ «Механики видят, что этанол повреждает малые двигатели». Архивировано 23 сентября 2020 г. в Wayback Machine , NBC News , 8 января 2008 г.
- ^ Кларк, Джон Д. (2017). Зажигание! Неофициальная история жидкого ракетного топлива . Нью-Брансуик, Нью-Джерси: Издательство Университета Рутгерса. п. 9. ISBN 978-0-8135-9583-2 .
- ^ Дарлинг Д. «Интернет-энциклопедия науки: Т-2» .
- ^ Jump up to: а б «Основы космического полета: ракетное топливо» . braeunig.us . Проверено 11 марта 2023 г.
- ^ «Краткая история ракетной техники» . Архивировано 5 августа 2006 года в Историческом архиве НАСА Wayback Machine .
- ^ Чоу Д. (26 апреля 2010 г.). «Лига ракетных гонок представляет новый летающий хот-род» . Space.com . Проверено 27 апреля 2010 г.
- ^ Бадвал С.П., Гиддей С., Кулкарни А., Гоэл Дж., Басу С. (май 2015 г.). «Эноловые топливные элементы прямого действия для транспорта и стационарного применения – комплексный обзор» . Прикладная энергетика . 145 : 80–103. Бибкод : 2015ApEn..145...80B . doi : 10.1016/j.apenergy.2015.02.002 .
- ^ Иммергут, Дебра Джо (3 декабря 2015 г.). «Могут ли камины на этаноле быть уютными?» . Уолл Стрит Джорнал . Проверено 2 марта 2016 г.
- ^ Раджванши А.К., Патил С.М., Мендонка Б. (март 2007 г.). «Печь на этаноле низкой концентрации для сельских районов Индии» . Энергия для устойчивого развития . 11 (1): 94–99. CiteSeerX 10.1.1.142.5846 . дои : 10.1016/S0973-0826(08)60568-2 .
- ^ «Ваш путеводитель по экстракции этанола» . Каннабис Бизнес Таймс . Проверено 9 апреля 2019 г.
- ^ «Анализ температуры пламени и выбросов NOx для различных видов топлива» . Департамент химической инженерии штата Миссисипи.
- ^ Jump up to: а б с Лиде ДР, изд. (2000). Справочник CRC по химии и физике, 81-е издание . ЦРК Пресс. ISBN 978-0-8493-0481-1 .
- ^ «Этанол» . Интернет-книга NIST по химии, SRD 69 . 2023 . Проверено 23 декабря 2023 г.
- ^ Jump up to: а б с д Виндхольц М (1976). Индекс Merck: энциклопедия химических веществ и лекарств (9-е изд.). Рэуэй, Нью-Джерси: Мерк. ISBN 978-0-911910-26-1 . [ нужна страница ]
- ^ Jump up to: а б с Моррисон RT, Бойд Р.Н. (1972). Органическая химия (2-е изд.). Аллин и Бэкон, Inc. ISBN 978-0-205-08452-4 . [ нужна страница ]
- ^ Дальманн У, Шнайдер ГМ (1989). «Фазовые равновесия (жидкость + жидкость) и критические кривые (этанол + додекан или тетрадекан или гексадекан или 2,2,4,4,6,8,8-гептаметилнонан) от 0,1 МПа до 120,0 МПа». Дж. Чем Термодин . 21 (9): 997–1004. дои : 10.1016/0021-9614(89)90160-2 .
- ^ «Этанол». Энциклопедия химической технологии . Том. 9. 1991. с. 813.
- ^ Костиган М.Дж., Ходжес Л.Дж., Марш К.Н., Стоукс Р.Х., Таксфорд К.В. (1980). «Калориметр изотермического смещения: модификации конструкции для измерения экзотермической энтальпии смешения». Ауст. Дж. Чем . 33 (10): 2103. Бибкод : 1982AuJCh..35.1971I . дои : 10.1071/CH9802103 .
- ^ Лей З, Ван Х, Чжоу Р, Дуань З (2002). «Влияние соли, добавленной к растворителю, на экстрактивную дистилляцию». хим. англ. Дж . 87 (2): 149–156. дои : 10.1016/S1385-8947(01)00211-X .
- ^ Пембертон Р.К., Маш С.Дж. (1978). «Термодинамические свойства водных неэлектролитных смесей II. Давление паров и избыточная энергия Гиббса для воды + этанола при температурах от 303,15 до 363,15 К, определенные точным статическим методом». Дж. Чем Термодин . 10 (9): 867–888. дои : 10.1016/0021-9614(78)90160-X .
- ^ Индекс химических веществ и лекарств Merck , 9-е изд.; монографии с 6575 по 6669
- ^ «Температура вспышки и точка воспламенения» . Nttworldwide.com . Архивировано из оригинала 14 декабря 2010 года.
- ^ Jump up to: а б NFPA 325: Руководство по пожароопасным свойствам легковоспламеняющихся жидкостей, газов и летучих твердых веществ . Куинси, Массачусетс: Национальная ассоциация противопожарной защиты (NFPA). 1 января 1994 года.
- ^ Jump up to: а б «49 CFR § 173.120 – Класс 3 – Определения» . Институт правовой информации.
легковоспламеняющаяся жидкость (класс 3) означает жидкость с температурой вспышки не более 60 °C (140 °F).
- ^ Jump up to: а б с д и ж г час я дж к Мартинес, П.Дж.; Русь, Э.; Компания, JM «Определение температуры вспышки бинарных смесей спиртов, кетонов и воды» . Кафедра химической инженерии, факультет естественных наук . п. 3, таблица 4.
- ^ «49 CFR § 172.101 – Назначение и использование таблицы опасных материалов» . Институт правовой информации Корнелльского университета.
Описания опасных материалов и правильные наименования для перевозки: Этанол или этиловый спирт, или растворы этанола, или растворы этилового спирта; Класс опасности или категория: 3; Идентификационные номера: UN1170; ПГ: II; Коды этикеток: 3;
- ^ Jump up to: а б с д и ж г час Ха, Дон Мён; Пак, Сан Хун; Ли, Сонджин (апрель 2015 г.). «Измерение температуры вспышки систем вода-метанол и вода-этанол с помощью тестера в закрытом тигле Seta Flash» . Пожарная наука и инженерия . 29 (2): 39–43. дои : 10.7731/KIFSE.2015.29.2.039 .
Стр. 4, Таблица 3
- ^ «Температуры вспышки водных растворов на основе этанола» . Engineeringtoolbox.com . Проверено 23 июня 2011 г.
- ^ Дадли Р. (август 2004 г.). «Этанол, созревание фруктов и исторические истоки человеческого алкоголизма у плодоядных приматов» . Интегративная и сравнительная биология . 44 (4): 315–323. дои : 10.1093/icb/44.4.315 . ПМИД 21676715 .
- ^ Грабер С (2008). «Факт или вымысел?: Животные любят напиться» . Научный американец . Проверено 23 июля 2010 г.
- ^ Леблова С, Синецка Е, Ваничкова В (1974). «Обмен пирувата в прорастающих семенах при естественном анаэробиозе». Биология Плантарум . 16 (6): 406–411. дои : 10.1007/BF02922229 . S2CID 34605254 .
- ^ Шривер А., Шривер-Маццуоли Л., Эренфройнд П., д'Хендекур Л. (2007). «Одно возможное происхождение этанола в межзвездной среде: фотохимия смешанных пленок CO 2 –C 2 H 6 при 11 К. FTIR-исследование». Химическая физика . 334 (1–3): 128–137. Бибкод : 2007CP....334..128S . doi : 10.1016/j.chemphys.2007.02.018 .
- ^ Тернер С., Спэнел П., Смит Д. (2006). «Продольное исследование этанола и ацетальдегида в выдыхаемом воздухе здоровых добровольцев с использованием масс-спектрометрии с проточной трубкой с выбранными ионами». Быстрая связь в масс-спектрометрии . 20 (1): 61–68. Бибкод : 2006RCMS...20...61T . дои : 10.1002/rcm.2275 . ПМИД 16312013 .
- ^ Дуклефф М. (17 сентября 2013 г.). «Синдром автопивоварни: очевидно, пиво можно сварить в кишечнике» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР.
- ^ Миллс Г.А., Эклунд Э.Э. (1987). «Спирты как компоненты транспортного топлива» . Ежегодный обзор энергетики . 12 : 47–80. дои : 10.1146/annurev.eg.12.110187.000403 .
- ^ Reel M (19 августа 2006 г.). «Путь Бразилии к энергетической независимости» . Вашингтон Пост .
- ^ Росси, Лиана М.; Галло, Жан Марсель Р.; Маттосо, Луис ХК; Бакеридж, Маркос С.; Лицензия, Питер; Аллен, Дэвид Т. (29 марта 2021 г.). «Этанол из сахарного тростника и бразильский энергетический и химический сектор, основанный на биомассе» . ACS Устойчивая химия и инженерия . 9 (12): 4293–4295. doi : 10.1021/acssuschemeng.1c01678 . ISSN 2168-0485 . S2CID 233676614 .
- ^ Виткофф Х.А., Рубен Б.Г., Плоткин Дж.С. (2004). Промышленные органические химикаты . Джон Уайли и сыновья. стр. 136–. ISBN 978-0-471-44385-8 .
- ^ Свами, В.Н. (2020). Руководство по экзамену Бхарти Центрального кооперативного банка района Видьябхарати [ Руководство по экзамену для приема на работу в кооперативный банк района Видьябхарти (экзамен на оценку банковского служащего) ] (на маратхи). Латур , Махараштра, Индия: Публикация Видьябхарти. п. 119.
- ^ «Сладкое сорго для продуктов питания, кормов и топлива» (PDF) . Новый земледельец . Январь 2008 г. Архивировано из оригинала (PDF) 4 сентября 2015 г. . Проверено 11 марта 2023 г.
- ^ «Разработка цепочки создания стоимости этанола из сладкого сорго». Архивировано 23 февраля 2014 года в Wayback Machine . ИКРИСАТ , 2013 г.
- ^ Робертс Джей Ди , Казерио MC (1977). Основные принципы органической химии . В. А. Бенджамин. ISBN 978-0-8053-8329-4 . [ нужна страница ]
- ^ Jump up to: а б с д Косарик Н., Дувняк З., Фаркас А., Сам Х., Брингер-Мейер С., Гебель О., Майер Д. (2011). «Этанол». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. стр. 1–72. дои : 10.1002/14356007.a09_587.pub2 . ISBN 978-3-527-30673-2 . (требуется подписка)
- ^ «Этанол». Энциклопедия химической технологии . Том. 9. 1991. с. 82.
- ^ «Этанол» . Архивировано 13 января 2015 года в Wayback Machine . Основная химическая промышленность .
- ^ Харрисон, Тим (май 2014 г.). «Веб-страницы катализа для студентов довузовской подготовки, V1_0» (PDF) . Бристольские химические лаборатории, Химическая школа . Бристольский университет. Архивировано из оригинала (PDF) 5 марта 2021 года.
- ^ Тулло, Александр (26 августа 2021 г.). «Последний завод по производству синтетического этанола в США закрывается» . cen.acs.org . Проверено 22 ноября 2022 г.
- ^ Лоджсдон Дж. Э. (1991). «Этанол». В книге Хоу-Грант М., Кирк Р.Э., Отмер Д.Ф., Крошвиц Дж.И. (ред.). Энциклопедия химической технологии . Том. 9 (4-е изд.). Нью-Йорк: Уайли. п. 817. ИСБН 978-0-471-52669-8 .
- ^ Jump up to: а б с д и Стрейтвизер А. , Хиткок CH (1976). Введение в органическую химию . Макмиллан. ISBN 978-0-02-418010-0 .
- ^ Лью Ф., Хенстра А.М., Кёпке М., Винцер К., Симпсон С.Д., Минтон Н.П. (март 2017 г.). «Метаболическая инженерия Clostridium autoethanogenum для селективного производства алкоголя» . Метаболическая инженерия . 40 : 104–114. дои : 10.1016/j.ymben.2017.01.007 . ПМЦ 5367853 . ПМИД 28111249 .
- ^ «Система «солнечная энергия в топливо» перерабатывает CO2 для получения этанола и этилена» . Центр новостей . 18 сентября 2017 года . Проверено 19 сентября 2017 г.
- ^ Клайнс Т. (июль 2006 г.). «Сварите лучше этанол» . Научно-популярная информация в Интернете. Архивировано из оригинала 3 ноября 2007 года.
- ^ Химики, Американская ассоциация зерновых (1986). Достижения в области науки и технологий в области зерновых культур . Американская ассоциация химиков-зерновиков. ISBN 978-0-913250-45-7 .
- ^ Дейл Каллахам, Информация о молекулярных ситах
- ^ Сонг Ю, Пэн Р., Хенсли Д.К., Боннесен П.В., Лян Л., Ву З, Мейер Х.М., Чи М., Ма С., Самптер Б.Г., Рондиноне А.Дж. (2016). «Высокоселективное электрохимическое преобразование CO2 в этанол с использованием медных наночастиц/графенового электрода, легированного азотом» . ХимияВыбрать . 1 (Препринт): 6055–6061. дои : 10.1002/slct.201601169 .
- ^ Чон Дж.С., Чон Х., Ко Км, Чунг Б., Чхве Г.В. (2012). «Производство безводного этанола с использованием различных процессов PSA (адсорбции при переменном давлении) на пилотной установке». Возобновляемая энергия . 42 : 41–45. doi : 10.1016/j.renene.2011.09.027 .
- ^ «Программа UM по сокращению потребления необлагаемого налогом алкоголя; денатурированный спирт — более безопасная и менее дорогая альтернатива» (PDF) . Мичиганский университет. Архивировано из оригинала (PDF) 27 ноября 2007 года . Проверено 29 сентября 2007 г.
- ^ Великобритания (2005). Положения о денатурированном спирте 2005 г. Архивировано 9 декабря 2009 г. в Wayback Machine . Постановление 2005 г. № 1524.
- ^ Бансал Р.К., Бернтсен А. (2003). Учебник органической химии . Нью Эйдж Интернэшнл Лимитед. стр. 402–. ISBN 978-81-224-1459-2 .
- ^ Кристиан Г.Д. (2004). «Растворители для спектрометрии» . Аналитическая химия . Том. 1 (6-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons. п. 473 . ISBN 978-0-471-21472-4 .
- ^ Эндрюс С. (1 августа 2007 г.). Учебник по управлению продуктами питания и напитками . Тата МакГроу-Хилл Образование. стр. 268–. ISBN 978-0-07-065573-7 .
- ^ Кунки Р.Э., Америн М.А. (июль 1968 г.). «Сахарно-спиртовая стабилизация дрожжей в сладком вине» . Прикладная микробиология . 16 (7): 1067–1075. дои : 10.1128/АЕМ.16.7.1067-1075.1968 . ПМК 547590 . ПМИД 5664123 .
- ^ Циммерманн, Хайнц; Вальц, Роланд (2008). «Этилен». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a10_045.pub3 . ISBN 978-3-527-30673-2 .
- ^ «14.4: Реакции дегидратации спиртов» . Химия LibreTexts . 9 февраля 2016 года . Проверено 9 мая 2022 г.
- ^ «Алкены дегидратации спиртов» . Химия LibreTexts . 2 октября 2013 года . Проверено 9 мая 2022 г.
- ^ Россини Ф.Д. (1937). «Теплоты образования простых органических молекул». Индийский англ. Хим . 29 (12): 1424–1430. дои : 10.1021/ie50336a024 .
- ^ Рассчитано на основе теплоты образования из Справочника CRC по химии и физике, 49-е издание, 1968–1969.
- ^ Чакрабартти С.К. (1978). Трахановский В.С. (ред.). Окисление в органической химии . Нью-Йорк: Академическая пресса. стр. 343–370.
- ^ Рейнхард Дж., Копп Э., МакКьюсик Б.К., Рёдерер Г., Бош А., Флейшманн Г. (2007). «Хлороацетальдегиды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a06_527.pub2 . ISBN 978-3-527-30673-2 .
- ^ Седербаум, Артур I (16 ноября 2012 г.). «Обмен алкоголя» . Клиники заболеваний печени . 16 (4): 667–685. дои : 10.1016/j.cld.2012.08.002 . ISSN 1089-3261 . ПМЦ 3484320 . ПМИД 23101976 .
- ^ Протокол встречи. Архивировано 16 апреля 2021 года в Wayback Machine . Технический комитет по классификации и свойствам опасных химических веществ (12–13 января 2010 г.).
- ^ Jump up to: а б «Данные по безопасности спирта этилового» . Оксфордский университет. 9 мая 2008 г. Архивировано из оригинала 14 июля 2011 г. . Проверено 3 января 2011 г.
- ^ Оттли, Уильям Кэмпбелл (1826). Словарь по химии и связанной с ней минералогии . Мюррей.
- ^ Роуч Дж. (18 июля 2005 г.). «Пиво 9000-летней давности, воссозданное по китайскому рецепту» . Национальные географические новости . Архивировано из оригинала 22 июля 2005 года . Проверено 3 сентября 2007 г.
- ^ Бертло и Удас 1893 , том. я, с. 137.
- ^ Бертло и Удас 1893 , том. я, стр. 138-139.
- ^ аль-Хасан, Ахмад Ю. (2009). «Алкоголь и перегонка вина в арабских источниках VIII века». Исследования аль-Кимья: критические проблемы латинской и арабской алхимии и химии . Хильдесхайм: Георг Олмс Верлаг. стр. 283–298. (тот же контент также доступен на сайте автора. Архивировано 29 декабря 2015 г. на Wayback Machine ).
- ^ аль-Хассан, 2009 г. (тот же контент также доступен на веб-сайте автора. Архивировано 29 декабря 2015 г. на Wayback Machine ); ср. Бертло и Гудас 1893 , т. 1, с. I, стр. 141, 143. Иногда в вино добавляли также серу (см. Berthelot & Houdas 1893 , т. I, стр. 143).
- ^ Мультхауф 1966 , стр. 204–206.
- ^ Холмьярд, Эрик Джон (1957). Алхимия . Хармондсворт: Книги Пингвинов. ISBN 978-0-486-26298-7 . стр. 51–52.
- ^ Принсипи, Лоуренс М. (2013). Тайны алхимии . Чикаго: Издательство Чикагского университета. ISBN 978-0-226-10379-2 . стр. 69-71.
- ^ Jump up to: а б Хау С.Г. (2006). «Вино, женщины и яд» . Марко Поло в Китае . Рутледж. стр. 147–148. ISBN 978-1-134-27542-7 . Проверено 10 июля 2016 г.
Самым ранним возможным периодом, по-видимому, является династия Восточная Хань... наиболее вероятный период начала настоящей дистилляции спиртных напитков для питья в Китае приходится на времена династий Цзинь и Южная Сун.
- ^ Хабиб, Ирфан (2011). Экономическая история средневековой Индии, 1200–1500 гг . Пирсон Образовательная Индия. стр. 55–. ISBN 978-81-317-2791-1 .
- ^ Ловиц Т. (1796). «Отчет о задании, которое необходимо выполнить для полного обезвоживания винных спиртов [т. е. спиртово-водного азеотропа])]. Химические летописи для любителей естествознания, медицины, бытовых знаний и мануфактур (на немецком языке). 1 : 195-204.
См. стр. 197–198: Ловиц обезвоживал азеотроп, смешивая его с избытком безводной щелочи в соотношении 2:1, а затем перегоняя смесь на слабом огне.
- ^ Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 1 (11-е изд.). Издательство Кембриджского университета. стр. 525–527.
- ^ Соссюра Т. (1807 г.). «Меморандум о составе спирта и серного эфира» . Журнал физики, химии, естествознания и искусств . 64 : 316–354. В своей статье 1807 года Соссюр лишь приблизительно определил состав этанола; более точный анализ этанола представлен на странице 300 его статьи 1814 года: де Соссюр, Теодор (1814). «Новые наблюдения о составе спирта и серного эфира» . Анналы химии и физики . 89 : 273–305.
- ^ Купер А.С. (1858 г.). «О новой химической теории» (интернет-перепечатка) . Философский журнал . 16 (104–116) . Проверено 3 сентября 2007 г.
- ^ Фарадей М. (1825 г.). «О новых соединениях углерода и водорода и о некоторых других продуктах, полученных при термическом разложении нефти» . Философские труды Лондонского королевского общества . 115 : 440–466. дои : 10.1098/rstl.1825.0022 . В сноске на стр. 448 Фарадей отмечает действие серной кислоты на угольный газ и его дистиллят; в частности, «[серная] кислота соединяется непосредственно с углеродом и водородом; и я обнаружил, что когда [полученное соединение] соединяется с основаниями, [оно] образует своеобразный класс солей, чем-то напоминающих сульфовинаты [т.е. этилсульфаты], но все еще отличается от них».
- ^ Хеннелл Х (1826 г.). «О взаимном действии серной кислоты и спирта, с наблюдениями над составом и свойствами образующегося соединения» . Философские труды Лондонского королевского общества . 116 : 240–249. дои : 10.1098/rstl.1826.0021 . S2CID 98278290 . На странице 248 Хеннелл упоминает, что Фарадей дал ему немного серной кислоты, в которой растворился угольный газ, и что он (Хеннелл) обнаружил, что она содержит «сульфовиновую кислоту» (этилгидросульфат).
- ^ Хеннелл Х (1828 г.). «О взаимном действии серной кислоты и спирта и о природе процесса образования эфира» . Философские труды Лондонского королевского общества . 118 : 365–371. дои : 10.1098/rstl.1828.0021 . S2CID 98483646 . На странице 368 Хеннелл производит этанол из «сульфовиновой кислоты» ( этилгидросульфата ).
- ^ Серуллас Г.С. (1828 г.). Гайтон де Морво Л.Б., Гей-Люссак Ж.Л., Араго Ф., Мишель Эжен Шеврёль, Марселлен Бертло, Элетер Эли Николя Маскар, Альбин Халлер (ред.). «О действии серной кислоты на спирт и образующиеся из него продукты» . Анналы химии и физики . 39 : 152–186. На странице 158 Серуллас упоминает производство спирта из «сульфата углеводородной кислоты».
- ↑ В 1855 году французский химик Марселлен Бертело подтвердил открытие Фарадея, получив этанол из чистого этилена. Бертло М. (1855 г.). Араго Ф., Гей-Люссак Дж.Л. (ред.). «Sur la formation de l'alcool au moyen du bicarbure d'Hydrogène (Об образовании спирта с помощью этилена)» . Annales de Chimie et de Physique . 43 : 385–405. (Примечание: химические формулы в статье Бертло неверны, потому что химики того времени использовали неправильные атомные массы элементов; например, углерода (6 вместо 12), кислорода (8 вместо 16) и т. д.)
- ^ Сигел Р. (15 февраля 2007 г.). «Этанол, который когда-то был обойден, теперь стремительно набирает обороты» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Проверено 22 сентября 2007 г.
- ^ ДиПардо Дж. «Перспективы производства и спроса на этанол из биомассы» (PDF) . Министерство энергетики США. Архивировано из оригинала (PDF) 24 сентября 2015 года . Проверено 22 сентября 2007 г.
- ^ Майерс Р.Л., Майерс Р.Л. (2007). 100 важнейших химических соединений: справочник . Вестпорт, Китай: Greenwood Press. п. 122. ИСБН 978-0-313-33758-1 .
Дальнейшее чтение [ править ]
- Бойс Дж. М., Питтет Д. (2003). «Гигиена рук в медицинских учреждениях» . Атланта, Джорджия: Центры по контролю заболеваний . .
- Онуки С., Козиел Дж.А., ван Леувен Дж., Дженкс В.С., Гревелл Д., Кай Л. (июнь 2008 г.). Методы производства, очистки и анализа этанола: обзор . 2008 Ежегодное международное собрание ASABE. Провиденс, Род-Айленд . Проверено 16 февраля 2013 г.
- «Разъяснение обозначений денатурированного спирта в США» . Научные игрушки .
- Ланге, Норберт Адольф (1967). Джон Ори Дин (ред.). Справочник Ланге по химии (10-е изд.). МакГроу-Хилл.
Внешние ссылки [ править ]
- Алкоголь (этанол) в Периодической таблице видео (Ноттингемский университет)
- Международной организации труда Информация о безопасности этанола
- Национальный реестр загрязнителей – Информационный бюллетень по этанолу
- CDC - Карманный справочник NIOSH по химическим опасностям - Этиловый спирт
- Химические данные Национального института стандартов и технологий по этанолу
- Новости Чикагской торговой палаты и рыночные данные по фьючерсам на этанол
- Расчет давления пара , плотности жидкости , динамической вязкости жидкости , поверхностного натяжения этанола
- История этанола Взгляд в историю этанола
- ChemSub Online: Этиловый спирт
- Технологическая схема производства промышленного этанола с использованием этилена и серной кислоты