Катализ


Катализ ( / k ə ˈ t æ l ə s ɪ s / ) — это увеличение скорости химической реакции за счет добавленного вещества, известного как катализатор. [1] [2] ( / ˈ k æ t əl ɪ s t / ). Катализаторы не расходуются в реакции и остаются после нее в неизмененном виде. [3] Если реакция протекает быстро и катализатор быстро рециркулируется, часто бывает достаточно очень небольшого количества катализатора; [4] смешивание, площадь поверхности и температура являются важными факторами скорости реакции. Катализаторы обычно реагируют с одним или несколькими реагентами с образованием промежуточных продуктов , которые впоследствии дают конечный продукт реакции в процессе регенерации катализатора.
Увеличение скорости происходит потому, что катализатор позволяет реакции протекать по альтернативному механизму, который может быть намного быстрее, чем некаталитический механизм. Однако некаталитический механизм остается возможным, так что общая скорость (катализируемая и некаталитическая) может только увеличиваться в присутствии катализатора и никогда не уменьшаться. [5]
Катализ можно разделить на гомогенный , компоненты которого диспергированы в той же фазе (обычно газообразной или жидкой), что и реагент, или гетерогенный , компоненты которого находятся в разных фазах. Ферменты и другие биокатализаторы часто относят к третьей категории.
Катализ широко распространен во химической промышленности . всех видах [6] По оценкам, 90% всех промышленных химических продуктов на каком-то этапе процесса производства используют катализаторы.
Термин «катализатор» происходит от греческого καταλύειν , kataluein , что означает «ослаблять» или «развязывать». Идея катализа была изобретена химиком Элизабет Фулхэм на основе ее новых работ по окислительно-восстановительным экспериментам. [7] [8]
Общие принципы [ править ]
Пример [ править ]
Показательным примером является влияние катализаторов на ускорение разложения перекиси водорода на воду и кислород :
- 2 Ч 2 О 2 → 2 Ч 2 О + О 2
Эта реакция протекает, поскольку продукты реакции более стабильны, чем исходное соединение, но это разложение происходит настолько медленно, что растворы перекиси водорода коммерчески доступны. В присутствии катализатора, такого как диоксид марганца, эта реакция протекает гораздо быстрее. Этот эффект легко увидеть по вскипанию кислорода. [9] Катализатор не расходуется в реакции и может быть восстановлен в неизмененном виде и повторно использован в течение неопределенного времени. Соответственно, говорят, что диоксид марганца катализирует эту реакцию. В живых организмах эта реакция катализируется ферментами (белками, служащими катализаторами), такими как каталаза .
Другой пример — влияние катализаторов на загрязнение воздуха и снижение количества угарного газа. Разработка активных и селективных катализаторов для превращения монооксида углерода в желаемые продукты является одной из важнейших задач катализаторов. Использование катализаторов гидрирования окиси углерода помогает удалить этот токсичный газ, а также получить полезные материалы. [10]
Единицы [ править ]
катал Производной единицей измерения каталитической активности катализатора в системе СИ является , который количественно выражается в молях в секунду. Производительность катализатора можно описать числом оборотов (или TON), а каталитическую активность - частотой оборотов (TOF), которая равна количеству тонн в единицу времени. Биохимическим эквивалентом является ферментная единица . Подробнее об эффективности ферментативного катализа см. в статье о ферментах .
Механизмы каталитических реакций [ править ]
В общем, химические реакции происходят быстрее в присутствии катализатора, поскольку катализатор обеспечивает альтернативный механизм реакции (путь реакции), имеющий более низкую энергию активации, чем некаталитический механизм. В катализированных механизмах катализатор регенерируется. [11] [12] [13] [14]
В качестве простого примера, происходящего в газовой фазе, реакция 2 SO 2 + O 2 → 2 SO 3 может быть катализирована добавлением оксида азота . Реакция происходит в две стадии:
- 2 NO + O 2 → 2 NO 2 (скоростноопределяющие)
- NO 2 + SO 2 → NO + SO 3 (быстро)
Катализатор NO регенерируется. Общая скорость – это скорость медленного шага. [14]
- v = 2k 1 [NO] 2 [Около 2 ].
Примером гетерогенного катализа является реакция кислорода и водорода на поверхности диоксида титана (TiO 2 , или титана ) с образованием воды. Сканирующая туннельная микроскопия показала, что молекулы подвергаются адсорбции и диссоциации . Диссоциированные, связанные с поверхностью атомы O и H диффундируют вместе. Промежуточными состояниями реакции являются: HO 2 , H 2 O 2 , затем H 3 O 2 и продукт реакции ( димеры молекул воды ), после чего молекула воды десорбируется с поверхности катализатора. [15] [16]
Энергетика реакций [ править ]

Катализаторы открывают пути, отличные от некатализируемых реакций. Эти пути имеют более низкую энергию активации . Следовательно, большее количество молекулярных столкновений имеет энергию, необходимую для достижения переходного состояния. Следовательно, катализаторы могут способствовать реакциям, которые в противном случае были бы заблокированы или замедлены кинетическим барьером. Катализатор может увеличить скорость реакции или селективность или обеспечить возможность реакции при более низких температурах. Этот эффект можно проиллюстрировать диаграммой энергетического профиля .
В катализируемой элементарной реакции катализаторы не изменяют степень реакции: они не влияют на химическое равновесие реакции. Соотношение скоростей прямой и обратной реакции не изменяется (см. также Термодинамика ). Второй закон термодинамики описывает, почему катализатор не меняет химическое равновесие реакции. Предположим, существовал такой катализатор, который сместил равновесие. Введение катализатора в систему приведет к тому, что реакция перейдет к новому равновесию, производя энергию. Производство энергии является необходимым результатом, поскольку реакции являются самопроизвольными только в том случае, если образуется свободная энергия Гиббса , а если нет энергетического барьера, нет необходимости в катализаторе. Тогда удаление катализатора также приведет к реакции, производящей энергию; т.е. и добавление, и его обратный процесс, удаление, будут производить энергию. Таким образом, катализатором, который мог бы изменить равновесие, стал бы вечный двигатель , что противоречит законам термодинамики. [17] Таким образом, катализаторы не изменяют константу равновесия. (Однако катализатор может изменить равновесные концентрации в результате реакции на последующей стадии. Затем он расходуется по мере протекания реакции и, таким образом, также является реагентом. Показательным является гидролиз сложных эфиров , катализируемый основаниями, при котором образующаяся карбоновая кислота немедленно вступает в реакцию с основным катализатором и, таким образом, равновесие реакции смещается в сторону гидролиза.)
Катализатор стабилизирует переходное состояние больше, чем исходный материал. Он уменьшает кинетический барьер за счет уменьшения разницы в энергии между исходным материалом и переходным состоянием. Он не меняет разницу в энергии между исходными материалами и продуктами (термодинамический барьер) или доступную энергию (она обеспечивается окружающей средой в виде тепла или света).
Связанные понятия [ править ]
Некоторые так называемые катализаторы на самом деле являются предкатализаторами . Прекатализаторы превращаются в катализаторы реакции. Например, катализатор Уилкинсона RhCl(PPh 3 ) 3 теряет один трифенилфосфиновый лиганд перед тем, как войти в настоящий каталитический цикл. Прекатализаторы легче хранить, но они легко активируются на месте . Из-за этой стадии предварительной активации многие каталитические реакции включают индукционный период .
В кооперативном катализе химические вещества, улучшающие каталитическую активность, называются сокатализаторами или промоторами .
В тандемном катализе два или более разных катализатора соединяются в реакции в одном котле.
В автокатализе катализатор является продуктом общей реакции, в отличие от всех других видов катализа, рассмотренных в этой статье. Простейшим примером автокатализа является реакция типа А + В → 2 В, протекающая в одну или несколько стадий. Общая реакция — это просто A → B, так что B является продуктом. Но поскольку B также является реагентом, он может присутствовать в уравнении скорости и влиять на скорость реакции. По мере протекания реакции концентрация B увеличивается и может ускорить реакцию в качестве катализатора. Фактически реакция ускоряется сама по себе или автокатализируется. Примером является гидролиз сложного эфира, такого как аспирин, до карбоновой кислоты и спирта . В отсутствие добавленных кислотных катализаторов продукт карбоновой кислоты катализирует гидролиз.
Настоящий катализатор может работать в тандеме с жертвенным катализатором . Настоящий катализатор расходуется в элементарной реакции и превращается в дезактивированную форму.Жертвенный катализатор регенерирует настоящий катализатор для следующего цикла. Жертвенный катализатор расходуется в реакции и поэтому на самом деле является не катализатором, а реагентом. Например, четырехокись осмия (OsO 4 ) — хороший реагент для дигидроксилирования, но он высокотоксичен и дорог. При дигидроксилировании Апджона жертвенный катализатор N-метилморфолин N-оксид (NMMO) регенерирует OsO 4 только каталитические количества OsO 4 , и необходимы .
Классификация [ править ]
Катализ можно разделить на гомогенный и гетерогенный . — Гомогенный катализ это катализ, компоненты которого диспергированы в той же фазе (обычно газообразной или жидкой), что и молекулы реагента . Гетерогенный катализ – это катализ, в котором компоненты реакции находятся в разных фазах. Ферменты и другие биокатализаторы часто относят к третьей категории. Аналогичные механистические принципы применимы к гетерогенному, гомогенному и биокатализу.
Гетерогенный катализ [ править ]


Гетерогенные катализаторы действуют в другой фазе, чем реагенты . Большинство гетерогенных катализаторов представляют собой твердые вещества , которые действуют на подложки в жидкой или газообразной реакционной смеси . Важные гетерогенные катализаторы включают цеолиты , оксид алюминия , [18] оксиды высших порядков, графитовый углерод, переходных металлов оксиды , такие металлы, как никель Ренея для гидрирования и оксид ванадия (V) для окисления диоксида серы в триоксид серы контактным процессом . [19]
разнообразные механизмы реакций на поверхностях Известны в зависимости от того, как происходит адсорбция ( Лэнгмюр-Хиншелвуд , Элей-Ридил и Марсван Кревелен ). [20] Общая площадь поверхности твердого тела оказывает важное влияние на скорость реакции. Чем меньше размер частиц катализатора, тем больше площадь поверхности для данной массы частиц.
Гетерогенный катализатор имеет активные центры , которые представляют собой атомы или грани кристалла, с которыми фактически связывается подложка. Активные центры представляют собой атомы, но их часто описывают как грань (край, поверхность, ступеньку и т. д.) твердого тела. Большая часть объема, а также большая часть поверхности гетерогенного катализатора могут быть каталитически неактивными. Выяснить природу активного сайта технически сложно.
Например, катализатор процесса Габера синтеза аммиака из азота и водорода часто называют железом . Но детальные исследования и многочисленные оптимизации привели к созданию катализаторов, представляющих собой смесь оксидов железа, калия, кальция и алюминия. [21] Реагирующие газы адсорбируются на активных центрах частиц железа. После физической адсорбции реагенты частично или полностью диссоциируют и образуют новые связи. При этом разрывается особенно прочная тройная связь в азоте, что крайне редко встречается в газовой фазе из-за его высокой энергии активации. Таким образом, энергия активации общей реакции снижается, а скорость реакции увеличивается. [22] Другое место применения гетерогенного катализатора — окисление диоксида серы оксидом ванадия (V) для производства серной кислоты . [19] Многие гетерогенные катализаторы на самом деле являются наноматериалами.
Гетерогенные катализаторы обычно имеют « подложку », что означает, что катализатор диспергирован на втором материале, что повышает эффективность или минимизирует его стоимость. Носители предотвращают или минимизируют агломерацию и спекание мелких частиц катализатора, обнажая большую площадь поверхности, таким образом, катализаторы имеют более высокую удельную активность (на грамм) на носителе. Иногда носитель представляет собой просто поверхность, на которую наносят катализатор для увеличения площади поверхности. Чаще всего носитель и катализатор взаимодействуют, влияя на каталитическую реакцию. Носители также можно использовать в синтезе наночастиц, обеспечивая места для химического связывания отдельных молекул катализатора. Носители представляют собой пористые материалы с большой площадью поверхности, чаще всего оксид алюминия , цеолиты или различные виды активированного угля . Специализированные носители включают диоксид кремния , диоксид титана , карбонат кальция и сульфат бария . [23]
Электрокатализаторы [ править ]
В контексте электрохимии , особенно в технике топливных элементов , различные металлосодержащие катализаторы используются для повышения скорости полуреакций , из которых состоит топливный элемент. Один из распространенных типов электрокатализаторов топливных элементов основан на наночастицах платины , которые поддерживаются немного более крупными частицами углерода . При контакте с одним из электродов топливного элемента эта платина увеличивает скорость восстановления кислорода либо до воды, либо до гидроксида или перекиси водорода .
Гомогенный катализ [ править ]
Гомогенные катализаторы функционируют в той же фазе, что и реагенты. Обычно гомогенные катализаторы растворяют в растворителе вместе с субстратами. Один из примеров гомогенного катализа включает влияние H + на этерификацию карбоновых кислот, например образование метилацетата из уксусной кислоты и метанола . [24] К крупнообъемным процессам, требующим гомогенного катализатора, относятся гидроформилирование , гидросилилирование , гидроцианирование . Для химиков-неоргаников гомогенный катализ часто является синонимом металлоорганических катализаторов . [25] Однако многие гомогенные катализаторы не являются металлоорганическими, о чем свидетельствует использование солей кобальта, которые катализируют окисление п-ксилола до терефталевой кислоты .
Органокатализ [ править ]
Хотя переходные металлы иногда привлекают наибольшее внимание при изучении катализа, небольшие органические молекулы, не содержащие металлов, также могут проявлять каталитические свойства, о чем свидетельствует тот факт, что во многих ферментах переходные металлы отсутствуют. Обычно органические катализаторы требуют более высокой загрузки (количество катализатора на единицу количества реагента, выраженное в мольных % количества вещества ), чем катализаторы на основе (-ионов) переходных металлов, но эти катализаторы обычно коммерчески доступны в больших количествах, что помогает снизить затраты. В начале 2000-х годов эти органокатализаторы считались «новым поколением» и могли конкурировать с традиционными металлосодержащими (-ионами) катализаторами. Предполагается, что органокатализаторы действуют аналогично ферментам, не содержащим металлов, используя, например, нековалентные взаимодействия, такие как водородные связи . Дисциплина органокатализа делится на применение ковалентных (например, пролин , DMAP ) и нековалентных (например, тиомочевинный органокализ ) органокатализаторов в зависимости от предпочтительного катализатора- субстрата. связывание и взаимодействие соответственно. Нобелевская премия по химии 2021 года была присуждена совместно Бенджамину Листу и Дэвиду Макмиллану «за разработку асимметричного органокатализа». [26]
Фотокатализаторы [ править ]
Фотокатализ — это явление, при котором катализатор может получать свет для создания возбужденного состояния , вызывающего окислительно-восстановительные реакции. [27] Синглетный кислород обычно получают фотокатализом. Фотокатализаторы являются компонентами солнечных элементов, сенсибилизированных красителями .
Ферменты и биокатализаторы [ править ]
В биологии ферменты представляют собой белковые катализаторы метаболизма и катаболизма . Большинство биокатализаторов являются ферментами, но другие небелковые классы биомолекул также проявляют каталитические свойства, включая рибозимы и синтетические дезоксирибозимы . [28]
Биокатализаторы можно рассматривать как промежуточное звено между гомогенными и гетерогенными катализаторами, хотя, строго говоря, растворимые ферменты являются гомогенными катализаторами, а мембраносвязанные ферменты - гетерогенными. На активность ферментов (и других катализаторов) влияют несколько факторов, включая температуру, pH, концентрацию ферментов, субстрата и продуктов. Особенно важным реагентом в ферментативных реакциях является вода, которая является продуктом многих реакций образования связей и реагентом во многих процессах разрыва связей.
В биокатализе ферменты используются для получения многих химических веществ, включая кукурузный сироп с высоким содержанием фруктозы и акриламид .
Некоторые моноклональные антитела, мишенью связывания которых является стабильная молекула, напоминающая переходное состояние химической реакции, могут действовать как слабые катализаторы этой химической реакции, снижая ее энергию активации. [29] Такие каталитические антитела иногда называют « абзимами ».
Значение [ править ]

По оценкам, 90% всех промышленных химических продуктов на каком-то этапе процесса производства используют катализаторы. [31] В 2005 году каталитические процессы произвели продукции по всему миру на сумму около 900 миллиардов долларов. [32] Катализ настолько распространен, что подобласти сложно классифицировать. Некоторые области особой концентрации рассмотрены ниже.
Переработка энергии [ править ]
В нефтепереработке интенсивно используются катализы для алкилирования , каталитического крекинга (разрыв длинноцепочечных углеводородов на более мелкие фрагменты), риформинга нафты и парового риформинга (конверсия углеводородов в синтез-газ ). Даже выхлопы от сжигания ископаемого топлива очищаются с помощью катализа: каталитические нейтрализаторы , обычно состоящие из платины и родия , расщепляют некоторые из наиболее вредных побочных продуктов автомобильных выхлопов.
- 2 СО + 2 НО → 2 СО 2 + Н 2
Что касается синтетического топлива, то старым, но все еще важным процессом является Фишера-Тропша синтез углеводородов из синтез-газа , который сам обрабатывается посредством реакций конверсии вода-газ , катализируемых железом. Реакция Сабатье производит метан из углекислого газа и водорода. Биодизель и родственное ему биотопливо требуют переработки как с помощью неорганических, так и биокатализаторов.
Топливные элементы используют катализаторы как для анодных, так и для катодных реакций.
Каталитические обогреватели генерируют беспламенное тепло за счет подачи горючего топлива.
Массовые химикаты [ править ]

Некоторые из наиболее крупномасштабных химических веществ производятся путем каталитического окисления, часто с использованием кислорода . Примеры включают азотную кислоту (из аммиака), серную кислоту (из диоксида серы в триоксид серы контактным способом ), терефталевую кислоту из п-ксилола, акриловую кислоту из пропилена или пропана и акрилонитрил из пропана и аммиака. [20]
Производство аммиака является одним из наиболее масштабных и энергоемких процессов. В процессе Габера азот соединяется с водородом на катализаторе из оксида железа. [33] Метанол получают из оксида углерода или диоксида углерода, но с использованием медно-цинковых катализаторов.
Объемные полимеры, полученные из этилена и пропилена, часто получают с помощью катализа Циглера-Натта . Полиэфиры, полиамиды и изоцианаты получают посредством кислотно-основного катализа .
Для большинства процессов карбонилирования требуются металлические катализаторы, примеры включают процесс с уксусной кислотой Monsanto и гидроформилирование .
Тонкая химия [ править ]
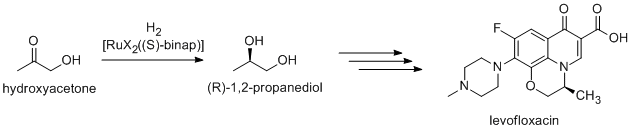
Многие тонкие химикаты получают посредством катализа; К методам относятся методы тяжелой промышленности, а также более специализированные процессы, которые в больших масштабах были бы непомерно дорогими. Примеры включают реакцию Хека и реакции Фриделя-Крафтса . Поскольку большинство биологически активных соединений являются хиральными , многие фармацевтические препараты производятся с помощью энантиоселективного катализа (каталитический асимметричный синтез ). (R)-1,2-Пропандиол, предшественник антибактериального левофлоксацина , может быть эффективно синтезирован из гидроксиацетона с использованием катализаторов на основе комплексов BINAP -рутения в асимметричном гидрировании Нойори : [34]
Пищевая промышленность [ править ]
Одним из наиболее очевидных применений катализа является гидрирование (реакция с газообразным водородом ) жиров с использованием никелевого катализатора для производства маргарина . [35] Многие другие продукты питания готовятся посредством биокатализа (см. ниже).
Окружающая среда [ править ]
Катализ влияет на окружающую среду, повышая эффективность промышленных процессов, но катализ также играет непосредственную роль в окружающей среде. Ярким примером является каталитическая роль хлора свободных радикалов в распаде озона . Эти радикалы образуются при действии ультрафиолетового излучения на хлорфторуглероды (ХФУ).
- кл. · + О 3 → ClO · + Около 2
- ClO · + О · → Кл · + Около 2
История [ править ]
Термин «катализатор», в широком смысле определяемый как все, что увеличивает скорость процесса, происходит от греческого καταλύειν , что означает «аннулировать», «развязывать» или «поднимать». Концепция катализа была изобретена химиком Элизабет Фулхэм и описана в книге 1794 года, основанной на ее новой работе в области окислительно-восстановительных реакций. [7] [8] [36] Первую химическую реакцию в органической химии, в которой сознательно использовался катализатор, изучил в 1811 году Готлиб Кирхгоф , открывший катализируемое кислотой превращение крахмала в глюкозу. Термин катализ позже был использован Йонсом Якобом Берцелиусом в 1835 году. [37] для описания реакций, ускоряющихся веществами, остающимися после реакции неизмененными. Фулхэм , которая предшествовала Берцелиусу, в своих экспериментах по восстановлению работала с водой, а не с металлами. Другими химиками XVIII века, работавшими в области катализа, были Эйльхард Мичерлих. [38] который называл это контактными процессами, и Иоганн Вольфганг Дёберейнер. [39] [40] который говорил о контактном действии. Он разработал лампу Дёберейнера , зажигалку на основе водорода и платиновой губки, которая имела коммерческий успех в 1820-х годах и живет по сей день. Хамфри Дэви открыл использование платины в катализе. [41] В 1880-х годах Вильгельм Оствальд из Лейпцигского университета начал систематическое исследование реакций, катализируемых присутствием кислот и оснований, и обнаружил, что химические реакции протекают с конечной скоростью и что эти скорости можно использовать для определения силы кислот и оснований. . За эту работу Оствальд был удостоен Нобелевской премии по химии 1909 года . [42] Владимир Ипатьев выполнил некоторые из первых реакций промышленного масштаба, включая открытие и коммерциализацию олигомеризации и разработку катализаторов гидрирования. [43]
и , яды промоторы Ингибиторы
Добавленное вещество, снижающее скорость реакции, называется ингибитором реакции, если реакция обратима, и каталитическим ядом, если реакция необратима. [1] Промоторы — это вещества, которые повышают каталитическую активность, хотя сами по себе они не являются катализаторами. [44]
Ингибиторы иногда называют «отрицательными катализаторами», поскольку они снижают скорость реакции. [45] Однако термин «ингибитор» является предпочтительным, поскольку они не действуют, вводя путь реакции с более высокой энергией активации; это не приведет к снижению скорости, поскольку реакция будет продолжать протекать по некатализируемому пути. Вместо этого они действуют либо путем дезактивации катализаторов, либо путем удаления промежуточных продуктов реакции, таких как свободные радикалы. [45] [11] При гетерогенном катализе коксование ингибирует катализатор, который покрывается полимерными побочными продуктами.
Ингибитор может изменять не только скорость, но и селективность. Например, при гидрировании алкинов в алкены палладиевый (Pd) катализатор , частично «отравленный» ацетатом свинца (II) (Pb(CH 3 CO 2 ) 2 можно использовать ) ( катализатор Линдлара ). [46] Без дезактивации катализатора полученный алкен будет далее гидрироваться до алкана . [47] [48]
Ингибитор может оказывать такой эффект, например, избирательно отравляя только определенные типы активных центров. Другой механизм – изменение геометрии поверхности. Например, при операциях гидрирования большие плоскости поверхности металла функционируют как центры катализа гидрогенолиза, тогда как центры, катализирующие гидрирование ненасыщенных соединений, меньшие по размеру. Таким образом, яд, который покрывает поверхность случайным образом, будет иметь тенденцию уменьшать количество незагрязненных больших плоскостей, но оставлять свободными пропорционально меньшие участки, изменяя таким образом селективность гидрирования по сравнению с гидрогенолизом. Возможны также многие другие механизмы.
Промоутеры могут покрывать поверхность, чтобы предотвратить образование коксового мата, или даже активно удалять такой материал (например, рений на платине в платформинге ). Они могут способствовать диспергированию каталитического материала или связыванию реагентов.
См. также [ править ]
- Химическая реакция
- Абзим
- Кислотный катализ (включая основной катализ)
- Автокатализ
- BIG-NSE (Берлинская высшая школа естественных наук и инженерии)
- Catalesis Science & Technology (химический журнал)
- Теория каталитического резонанса
- Электрокатализатор
- Экологические триггеры
- Ферментативный катализ
- Промышленные катализаторы
- Силовой микроскоп с зондом Кельвина
- Ограничивающий реагент
- Концепция Мерберна
- Фармацевтический адъювант
- Фазово-граничный катализ
- Катализатор фазового переноса
- Фотокатализ
- Рибозим (биокатализатор РНК)
- СУМО ферменты
- Программируемое по температуре снижение
- Термодесорбционная спектроскопия
Ссылки [ править ]
- ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Катализатор ». doi : 10.1351/goldbook.C00876
- ^ Jump up to: Перейти обратно: а б «Катализатор» . Сборник химической терминологии ИЮПАК . Оксфорд: Научные публикации Блэквелла. 2009. doi : 10.1351/goldbook.C00876 . ISBN 978-0-9678550-9-7 .
- ^ Мазель, Ричард I (2001). Химическая кинетика и катализ . Нью-Йорк: Wiley-Interscience. ISBN 0-471-24197-0 .
- ^ Стейнфельд, Джеффри И.; Франциско, Джозеф С.; Хейс, Уильям Л. (1999). Химическая кинетика и динамика (2-е изд.). Прентис Холл. п. 147. ИСБН 0-13-737123-3 .
Катализатор определяется как химическое вещество, которое увеличивает скорость химической реакции, не расходуясь при этом сам.
- ^ Лернер, Луиза (2011). «7 вещей о катализе, которые вы, возможно, не знали» . Аргоннская национальная лаборатория .
- ^ Лейдлер, Кейт Дж.; Мейзер, Джон Х. (1982). Физическая химия . Бенджамин/Каммингс. п. 425. ИСБН 0-8053-5682-7 .
Ингибиторы не действуют, вводя более высокий путь реакции; это не приведет к снижению скорости, поскольку реакция будет продолжать происходить по альтернативному механизму.
- ^ Кэрролл, Грегори Т.; Киршман, Дэвид Л. (23 января 2023 г.). «Установка каталитической хирургической фильтрации дыма снижает уровень формальдегида в условиях, моделирующих операционную» . ACS Химическое здоровье и безопасность . 30 (1): 21–28. дои : 10.1021/acs.chas.2c00071 . ISSN 1871-5532 . S2CID 255047115 .
- ^ Jump up to: Перейти обратно: а б Лейдлер, Кейт Дж.; Корниш-Боуден, Атель (1997). « Элизабет Фулхэм и открытие катализа: за 100 лет до Бюхнера» (PDF) . В Корниш-Боудене, Атель (ред.). Новое пиво в старой бутылке: Эдуард Бюхнер и рост биохимических знаний . Валенсия: Universitat de Валенсия, стр. 123–126 . 9788437033280 . Архивировано из оригинала (PDF) 23 января 2015 года . Проверено 14 марта 2021 г.
- ^ Jump up to: Перейти обратно: а б Рейнер-Кэнхэм, Марелин; Рейнер-Кэнхэм, Джеффри Уильям (2001). Женщины в химии: их меняющиеся роли от времен алхимии до середины двадцатого века . Американское химическое общество. ISBN 978-0-8412-3522-9 .
- ^ «Джинн в бутылке» . Университет Миннесоты . 2 марта 2005 г. Архивировано из оригинала 5 апреля 2008 г.
- ^ Торкашванд, Мостафа; Сарабадани Тафреши, Саида; де Леу, Нора Х. (май 2023 г.). «Исследование гидрирования монооксида углерода на поверхности Co (001) теорией функционала плотности: последствия для процесса Фишера-Тропша» . Катализаторы . 13 (5): 837. doi : 10.3390/catal13050837 . ISSN 2073-4344 .
- ^ Jump up to: Перейти обратно: а б Лейдлер К.Дж. и Мейзер Дж.Х. (1982) Физическая химия , Бенджамин/Каммингс, с. 425. ISBN 0-618-12341-5 .
- ^ Лейдлер, Кейт Дж.; Мейзер, Джон Х. (1982). Физическая химия . Бенджамин/Каммингс. стр. 424–425. ISBN 0-8053-5682-7 .
- ^ Аткинс, Питер; де Паула, Хулио (2006). Физическая химия Аткинса (8-е изд.). У.Х.Фриман. п. 839. ИСБН 0-7167-8759-8 .
Катализатор снижает энергию активации реакции, обеспечивая альтернативный путь, который позволяет избежать медленной, определяющей скорость стадии некаталитической реакции.
- ^ Jump up to: Перейти обратно: а б Стейнфельд, Джеффри И.; Франциско, Джозеф С.; Хейс, Уильям Л. (1999). Химическая кинетика и динамика (2-е изд.). Прентис Холл. стр. 147–150. ISBN 0-13-737123-3 .
Концентрация катализатора [C] появляется в выражении скорости, но не в равновесном соотношении.
- ^ Джейкоби, Митч (16 февраля 2009 г.). «Делаем воду шаг за шагом» . Новости химии и техники . п. 10.
- ^ Маттисен Дж, Вендт С, Хансен Йо, Мэдсен Г.К., Лира Е, Галликер П., Вестергаард Е.К., Шауб Р., Лаегсгаард Е., Хаммер Б., Безенбахер Ф. (2009). «Наблюдение всех промежуточных стадий химической реакции на поверхности оксида методом сканирующей туннельной микроскопии». АСУ Нано . 3 (3): 517–26. CiteSeerX 10.1.1.711.974 . дои : 10.1021/nn8008245 . ISSN 1520-605X . ПМИД 19309169 .
- ^ Робертсон, AJB (1970) Катализ газовых реакций металлами . Логос Пресс, Лондон.
- ^ Шафик, Икраш; Шафик, Шумер; Ахтер, Парвин; Ян, Вэньшу; Хусейн, Мюрид (23 июня 2020 г.). «Последние разработки в области катализаторов гидрообессеривания для производства бессернистых продуктов нефтепереработки: технический обзор». Обзоры катализа . 64 (1): 1–86. дои : 10.1080/01614940.2020.1780824 . ISSN 0161-4940 . S2CID 225777024 .
- ^ Jump up to: Перейти обратно: а б Хаускрофт, Кэтрин Э.; Шарп, Алан Г. (2005). Неорганическая химия (2-е изд.). Пирсон Прентис-Холл. п. 805. ИСБН 0130-39913-2 .
- ^ Jump up to: Перейти обратно: а б Ульмана Кноцингер, Хельмут и Кохлёфл, Карл (2002) «Гетрогенный катализ и твердые катализаторы» в Энциклопедии промышленной химии , Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a05_313
- ^ Аппл, Макс (2006). «Аммиак». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a02_143.pub2 . ISBN 3527306730 .
- ^ «Химия ванадия» . Химия LibreTexts . 3 октября 2013 года . Проверено 8 июля 2022 г.
- ^ Чадха, Уткарш; Сельварадж, Сентил Кумаран; Ашокан, Хридья; Харихаран, Сай П.; Мэтью Пол, В.; Венкатаранган, Вишал; Парамасивам, Велмуруган (8 февраля 2022 г.). «Сложные наноматериалы в катализе для химически важных применений: от синтеза и переработки углеводородов до использования возобновляемых источников энергии» . Достижения в области материаловедения и инженерии . 2022 : e1552334. дои : 10.1155/2022/1552334 . ISSN 1687-8434 .
- ^ Ульмана Бер, Арно (2002) «Металлоорганические соединения и гомогенный катализ» в Энциклопедии промышленной химии , Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a18_215
- ^ Эльшенбройх, К. (2006) Металлоорганические соединения . Wiley-VCH: Вайнхайм. ISBN 978-3-527-29390-2
- ^ «Нобелевская премия по химии 2021» . NobelPrize.org .
- ^ Мельхиорре, Паоло (2022). «Введение: Фотохимические каталитические процессы» . Химические обзоры . 122 (2): 1483–1484. doi : 10.1021/acs.chemrev.1c00993 . ПМИД 35078320 . S2CID 246287799 .
- ^ Нельсон, Д.Л. и Кокс, М.М. (2000) Ленинджер, Принципы биохимии, 3-е изд. Стоит публикации: Нью-Йорк. ISBN 1-57259-153-6 .
- ^ Простое объяснение каталитических антител . Documentroot.com (06 марта 2010 г.). Проверено 11 ноября 2015 г.
- ^ Соловьев Александр Александрович; Санчес, Сэмюэл; Мэй, Юнфэн; Шмидт, Оливер Г. (2011). «Настраиваемые каталитические трубчатые микронасосы, работающие при низких концентрациях перекиси водорода» (PDF) . Физическая химия Химическая физика . 13 (21): 10131–35. Бибкод : 2011PCCP...1310131S . дои : 10.1039/C1CP20542K . ПМИД 21505711 . Архивировано (PDF) из оригинала 28 марта 2019 г.
- ^ «Признание лучших в инновациях: катализатор прорыва». Журнал R&D , сентябрь 2005 г., стр. 20.
- ^ 1.4.3 «Эффективность промышленных процессов». Архивировано 17 мая 2008 г. в Wayback Machine . ClimateTechnology.gov
- ^ Смиль, Вацлав (2004). Обогащение Земли: Фриц Хабер, Карл Бош и трансформация мирового производства продуктов питания (1-е изд.). Кембридж, Массачусетс: Массачусетский технологический институт. ISBN 9780262693134 .
- ^ Дуб, Павел А.; Гордон, Джон К. (2018). «Роль связанной с металлом функциональности N – H в молекулярных катализаторах типа Нойори». Обзоры природы Химия . 2 (12): 396–408. дои : 10.1038/s41570-018-0049-z . S2CID 106394152 .
- ^ Кларк, Джим (октябрь 2013 г.). «Виды катализа» . Химгид.
- ^ Борд Линдстрем и Ларс Дж. Петтерсон (2003) « Краткая история катализа » Cattech , 7 (4): 130–38.
- ^ Берцелиус, JJ (1835) Årsberättelsen om framsteg i fysik och kemi [Ежегодный отчет о прогрессе в физике и химии]. Стокгольм, Швеция: Шведская королевская академия наук. Изучив исследования Эйльхарда Мичерлиха по образованию эфира, Берцелиус на стр . 245 :
Оригинал: Поэтому я буду, пользуясь известным химическим выводом, называть это каталитической силой тел, разложением посредством этой силы катализа, подобно тому, как словом анализ мы обозначаем разделение составных частей тел посредством обычное химическое родство.
Перевод : Поэтому я буду использовать хорошо известный вывод из химии, назову [каталитические] тела [т. е. вещества] каталитической силой , а разложение [других] тел под действием этой силы катализом , точно так же, как мы обозначаем термином словесный анализ — разделение составляющих тел по обычному химическому сродству.
- ^ Мичерлих, Э. (1834). «Об образовании эфира». Анналы физики и химии . 31 (18): 273–82. Бибкод : 1834АнП...107..273М . дои : 10.1002/andp.18341071802 .
- ^ Дёберейнер (1822 г.). «Накаленное горение спирта различными нагретыми металлами и оксидами металлов » . Журнал химии и физики . 34 :91-92.
- ^ Дёберейнер (1823 г.). «Недавно открыты замечательные свойства субоксида платины, окисленного сульфида платины и металлической платиновой пыли » . Журнал химии и физики . 38 :321–26.
- ^ Дэви, Хамфри (1817). «Некоторые новые опыты и наблюдения по горению газовых смесей с изложением способа сохранения непрерывного света в смесях горючих газов и воздуха без пламени» . Философские труды Лондонского королевского общества . 107 : 77–85. дои : 10.1098/rstl.1817.0009 . S2CID 97988261 .
- ^ Робертс, М.В. (2000). «Рождение каталитической концепции (1800–1900)». Письма о катализе . 67 (1): 1–4. дои : 10.1023/А:1016622806065 . S2CID 91507819 .
- ^ Николас, Кристофер П. (21 августа 2018 г.). «Обезвоживание, диены, высокое октан и высокое давление: вклад Владимира Николаевича Ипатьева, отца катализа» . АКС-катализ . 8 (9): 8531–39. дои : 10.1021/acscatal.8b02310 .
- ^ Дхара СС; Умаре СС (2018). Учебник инженерной химии . Индия: Издательство С. Чанд. п. 66. ИСБН 9789352830688 .
- ^ Jump up to: Перейти обратно: а б Лейдлер, К.Дж. (1978) Физическая химия с биологическими применениями , Бенджамин/Каммингс. стр. 415–17. ISBN 0-8053-5680-0 .
- ^ Линдлар Х.; Дюбюи Р. (2016). «Палладиевый катализатор частичного восстановления ацетиленов». Органические синтезы . дои : 10.15227/orgsyn.046.0089 ; Сборник томов , т. 5, с. 880 .
- ^ Дженкс, WP (1969) Катализ в химии и энзимологии МакГроу-Хилл, Нью-Йорк. ISBN 0-07-032305-4
- ^ Бендер, Майрон Л; Комияма, Макото и Бержерон, Раймонд Дж. (1984) Биоорганическая химия ферментативного катализа Wiley-Interscience, Хобокен, США ISBN 0-471-05991-9
Внешние ссылки [ править ]
- Научная помощь: страница катализаторов для науки на уровне средней школы
- Презентация Технического университета WA Herrmann. Архивировано 28 октября 2005 г., в Wayback Machine.
- Алюмитовый катализатор, лаборатория Камеяма-Сакурай, Япония
- Группа неорганической химии и катализа, Утрехтский университет, Нидерланды
- Центр химии поверхности и катализа
- Группа углерода и катализаторов, Университет Консепсьона, Чили
- Центр внедрения новых технологий посредством катализа, Центр химических инноваций NSF, США
- «Пузыри включают химические катализаторы». Архивировано 22 июля 2012 г. в онлайн-журнале Wayback Machine , Science News, 6 апреля 2009 г.
