Теория каталитического резонанса
В химии для была разработана теория каталитического резонанса описания кинетики ускорения реакции с использованием динамических поверхностей катализатора . Каталитические реакции происходят на поверхностях, которые претерпевают изменения в поверхностной энергии связи и/или энтропии , демонстрируя общее увеличение скорости реакции, когда частоты поверхностной энергии связи сравнимы с собственными частотами поверхностной реакции, адсорбции и десорбции.
История
[ редактировать ]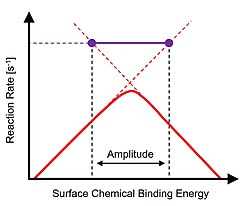
Теория каталитического резонанса построена на Сабатье принципе катализа , разработанном французским химиком Полем Сабатье . В пределах максимальной каталитической эффективности поверхность катализатора не является ни слишком прочной, ни слишком слабой. Сильное связывание приводит к общему ограничению скорости каталитической реакции из-за десорбции продукта, тогда как катализаторы со слабым связыванием ограничивают скорость химического состава поверхности. Оптимальные характеристики катализатора изображаются в виде «вулканического» пика с использованием дескриптора химической реакции, определяющего различные каталитические материалы. Экспериментальное подтверждение принципа Сабатье было впервые продемонстрировано Баландином в 1960 году. [1] [2]
Концепция каталитического резонанса была предложена на основе динамической интерпретации графика реакции вулкана Сабатье. [3] Как описано, расширение любой стороны графика вулкана над пиком определяет временные рамки двух ограничивающих скорость явлений, таких как поверхностные реакции или десорбция. [4] Для амплитуд колебаний энергии связи, которые простираются через вершину вулкана, конечные точки амплитуды пересекают временно доступные более быстрые временные рамки независимых реакционных явлений. В условиях достаточно быстрых колебаний энергии связи частота изменения переходной энергии связи соответствует собственным частотам реакции, а скорость общей реакции достигает частот оборота, значительно превышающих пик графика вулкана. [5] Единая резонансная частота (1/с) реакции и катализатора при выбранной температуре и амплитуде колебаний обозначена фиолетовой соединительной линией; все остальные применяемые частоты либо медленнее, либо менее эффективны.
Теория
[ редактировать ]В основе теории каталитического резонанса лежит переходное поведение адсорбции , поверхностных реакций и десорбции, поскольку энергия поверхностной связи и переходные состояния поверхности колеблются со временем. Энергия связи одного вида, i , описывается через временной функционал, включающий прямоугольные или синусоидальные волны частоты, fi , и амплитуды, dU i :
Другие химические вещества на поверхности j связаны с колеблющимися частицами i постоянным линейным параметром gamma γ i-j :

Эти две поверхностные частицы также имеют общую энтальпию адсорбции , delta δ i-j . Определение частоты и амплитуды колебаний частиц i и соотношение γ i-j и δ i-j для всех других видов поверхности j позволяет определить энтальпию адсорбции всех химических поверхностных частиц с течением времени.Энергия переходного состояния поверхностной реакции между любыми двумя видами i и j прогнозируется с помощью линейного масштабного соотношения принципа Белла-Эванса-Полани , которое относится к энтальпии поверхностной реакции, ΔH i-j , к энергии переходного состояния , E a , по параметрам α и β со следующей зависимостью:
Колеблющаяся поверхность и энергия переходного состояния химических веществ изменяют кинетические константы скорости, связанные с поверхностными реакциями, адсорбцией и десорбцией. Константа скорости поверхностной реакции перехода частиц i в поверхностные частицы j включает динамическую энергию активации :
Полученная кинетика химии поверхности затем описывается с помощью выражения скорости поверхностной реакции, содержащего динамические кинетические параметры, реагирующие на колебания энергии поверхностной связи:
- ,
с k реакциями с динамической энергией активации. Константа скорости десорбции также изменяется в зависимости от колеблющейся энергии связи поверхности по формуле:
- .
Реализация динамической поверхностной энергии связи обратимой реакции A-B на гетерогенном катализаторе в реакторе с мешалкой непрерывного действия, работающем при конверсии A 1%, приводит к синусоидальной энергии связи в виде B, как показано. [8] При переходе между конечными точками амплитуды поверхностной энергии связи мгновенная скорость реакции (т. е. частота оборотов) колеблется на порядок величины как решение предельного цикла .
Последствия для химии
[ редактировать ]
Колеблющиеся энергии связи всех поверхностных химических веществ приводят к периодическим явлениям переходного поведения каталитической поверхности. Для медленных частот колебаний переходный период составляет лишь небольшую часть шкалы времени колебаний, и поверхностная реакция достигает нового устойчивого состояния. Однако по мере увеличения частоты колебаний поверхностный переходный период приближается к временной шкале колебаний , и каталитическая поверхность остается в постоянном переходном состоянии. График усредненной частоты оборота реакции относительно приложенной частоты колебаний определяет «резонансный» диапазон частот , для которого переходные условия поверхности катализатора соответствуют приложенным частотам. [9] «Резонансная полоса» существует выше максимума графика вулкана Сабатье статической системы со средней скоростью реакции на пять порядков выше, чем та, которая достижима с помощью обычного катализа.
энергии поверхностной связи Колебания также происходят в разной степени с различными видами химической поверхности, что определяется параметром γ ij . не имеющей единицы Для любой системы γ ij, , асимметрия профиля поверхностной энергии приводит к проведению работы по смещению реакции к устойчивому состоянию от равновесия. [10] Подобно контролируемой направленности молекулярных машин , получающийся в результате энергетический механизм храпового механизма (устройства) избирательно перемещает молекулы через каталитическую реакцию против градиента свободной энергии. [11]
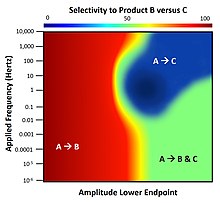
Применение динамической энергии связи к поверхности с множественными каталитическими реакциями демонстрирует сложное поведение, обусловленное различиями в собственных частотах каждого химического вещества; эти частоты идентифицируются обратными параметрами скорости адсорбции, десорбции и поверхностной кинетической скорости. Учитывая систему двух параллельных элементарных реакций A-B и A-C, которые происходят только на поверхности, работа катализатора в динамических условиях приведет к различной способности выбирать любой продукт реакции (B или C). . [12] Для изображенной системы обе реакции имеют одинаковую общую термодинамику будут производить B и C в равных количествах (селективность 50%) и при химическом равновесии . При нормальной работе статического катализатора только продукт B может быть получен с селективностью более 50%, а продукт C никогда не является предпочтительным. Однако, как было показано, применение динамики поверхностного связывания в форме прямоугольной волны с различной частотой и фиксированной амплитудой колебаний , но с различными конечными точками, демонстрирует полный диапазон возможной селективности реагентов. В диапазоне 1–10 Гц существует небольшой островок параметров, для которых продукт С обладает высокой селективностью; это состояние доступно только через динамику. [13]
Эксперименты и доказательства
[ редактировать ]Увеличение каталитической скорости за счет динамического возмущения поверхностных активных центров было продемонстрировано экспериментально с помощью динамического электрокатализа и динамического фотокатализа. Эти результаты можно объяснить в рамках теории каталитического резонанса, но убедительных доказательств до сих пор нет:
- В 1978 году было изучено электроокисление муравьиной кислоты на платиновом электроде при приложении постоянных потенциалов и прямоугольных импульсных потенциалов. Было обнаружено, что последний увеличивает плотность тока (и, следовательно, каталитическую активность) до 20 раз по сравнению с потенциостатическими условиями с оптимальной амплитудой и частотой волны 600 мВ и 2000 Гц соответственно. [14] В 1988 году окисление метанола на платиновом электроде проводилось при импульсных потенциалах от 0,4 до 1,18 В, в результате чего средний ток почти в 100 раз превышал установившийся ток при 0,4 В. [15]
- Используя реакцию электроокисления муравьиной кислоты, колебания приложенного электродинамического потенциала от 0 до 0,8 вольт ускорили скорость образования углекислого газа более чем на порядок выше (в 20 раз), чем это было достижимо на платине, лучшем из существующих катализаторов. [16] Максимальная каталитическая скорость экспериментально наблюдалась при частоте 100 Гц; более медленные каталитические скорости наблюдались при более высоких и более низких электродинамических частотах. Резонансную частоту интерпретировали как колебание между условиями, благоприятными для разложения муравьиной кислоты (0 В), и условиями, благоприятными для образования CO 2 (0,8 В). [17]
- Идея применения периодического освещения для улучшения квантового выхода типичной фотокаталитической реакции была впервые предложена в 1964 году Миллером и др . В этой работе они показали повышенную эффективность фотосинтеза при преобразовании CO 2 в O 2 , когда культуру водорослей подвергали периодическому освещению в вихревом реакторе Тейлора. [18] Щеховский и др. позже применили тот же подход для гетерогенного фотокатализа в 1993 году, где они продемонстрировали 5-кратное увеличение фотоэффективности разложения формиата за счет циклического переключения между светлыми и темновыми условиями с периодами 72 мс и 1,45 с соответственно. [19] Они предположили, что при освещении катализатора существует критическое время освещения, в течение которого поглощенные фотоны генерируют окислительные частицы (h vb + ) на поверхности катализатора. Образовавшиеся виды или их промежуточные соединения вступают в реакцию с субстратами на поверхности или в объеме. В темное время суток адсорбция, десорбция и диффузия обычно происходят в отсутствие фотонов. После критического периода восстановления в темноте фотокатализатор может снова эффективно использовать фотоны, когда фотоны снова вводятся. Краткое изложение работ по «динамическому» фотокатализу было предоставлено Токоде и др. в 2016 году. [20]
- Динамическое стимулирование разложения метанола было продемонстрировано на наночастицах Pt размером 2 нм с использованием импульсного света. [21] Ускорение скорости образования H 2 относительно статического освещения было объяснено избирательным ослаблением адсорбированного монооксида углерода, тем самым также увеличивая квантовую эффективность приложенного света.
- В 2021 году Сорделло и др. [22] экспериментально продемонстрировал 50%-ное увеличение квантового выхода реакции выделения водорода (HER) по сравнению с наночастицами Pt/TiO 2 посредством фотореформинга муравьиной кислоты при освещении контролируемого периода (CPI).
Было предложено реализовать динамику катализатора дополнительными методами с использованием колеблющегося света, электрического потенциала и физических возмущений. [23]
Ссылки
[ редактировать ]- ^ Хельмут Кноцингер; Карл Кохлёфл (2005). «Гетерогенный катализ и твердые катализаторы». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ Верлаг. дои : 10.1002/14356007.a05_313 . ISBN 3527306730 .
- ^ Баландин, А. (1969). «Современное состояние мультиплетной теории гетерогенного катализа1». Адв. Катал. Отн. Тема . Достижения в области катализа. 19 :1–210. дои : 10.1016/S0360-0564(08)60029-2 . ISBN 9780120078196 .
- ^ «Исследователи-энергетики преодолевают каталитический предел скорости» . НИОКР Ежедневно . 2019.
- ^ М. А. Арда; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2019). «Принципы динамического гетерогенного катализа: поверхностный резонанс и частотная характеристика оборота» . ChemRxiv . дои : 10.26434/chemrxiv.7790009.v1 .
- ^ «Исследователи открывают новую технологию, которая может ускорить химические реакции в 10 000 раз» . Азоматериалы . 2019.
- ^ М. А. Арда; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2019). «Принципы динамического гетерогенного катализа: поверхностный резонанс и частотная характеристика оборота» . АКС-катализ . 9 (8): 6929–6937. дои : 10.1021/acscatal.9b01606 . S2CID 182444068 .
- ^ М. А. Арда; Туран Бирол; Ц. Чжан; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2019). «Теория каталитического резонанса: супервулканы, каталитические молекулярные насосы и колебательное устойчивое состояние» . Катализная наука и технология . дои : 10.1021/acscatal.9b01606 . S2CID 182444068 .
- ^ «Преодоление каталитического ограничения скорости» . Физическая орг . 2019.
- ^ М. А. Арда; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2019). «Принципы динамического гетерогенного катализа: поверхностный резонанс и частотная характеристика оборота» . АКС-катализ . 9 (8): 6929–6937. дои : 10.1021/acscatal.9b01606 . S2CID 182444068 .
- ^ М. А. Арда; Туран Бирол; Ц. Чжан; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2019). «Теория каталитического резонанса: супервулканы, каталитические молекулярные насосы и колебательное устойчивое состояние» . Катализная наука и технология . дои : 10.1021/acscatal.9b01606 . S2CID 182444068 .
- ^ Хоффманн, Питер (30 октября 2012 г.). Храповик жизни: как молекулярные машины извлекают порядок из хаоса . Основные книги. ISBN 978-0465022533 .
- ^ М. А. Арда; М. Шетти; А. Кузнецов; Ц. Чжан; П. Кристофер; Д.Г. Влахос; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2020). «Теория каталитического резонанса: управление параллельным путем реакции» . Химическая наука . 11 (13): 3501–3510. дои : 10.1039/C9SC06140A . ПМЦ 8152411 . ПМИД 34109022 .
- ^ М. А. Арда; М. Шетти; А. Кузнецов; Ц. Чжан; П. Кристофер; Д.Г. Влахос; О.А. Абдельрахман; П. Дж. Дауэнхауэр (2019). «Теория каталитического резонанса: управление параллельным путем реакции» . ChemRxiv . doi : 10.26434/chemrxiv.10271090.v1 .
- ^ Аджич, Радослав Р.; Попов Константин Игоревич; Памич, Мирна А. (1 ноября 1978 г.). «Ускорение электрокаталитических реакций пульсацией потенциала: окисление муравьиной кислоты на Pt и Pt/Pbads электродах» . Электрохимика Акта . 23 (11): 1191–1196. дои : 10.1016/0013-4686(78)85071-3 . ISSN 0013-4686 .
- ^ Федкив, Питер С.; Трайнелис, Кристиан Л.; Ван, Шинг-Ру (1 октября 1988 г.). «Импульсно-потенциальное окисление метанола» . Журнал Электрохимического общества . 135 (10): 2459. Бибкод : 1988JElS..135.2459F . дои : 10.1149/1.2095358 . ISSN 1945-7111 .
- ^ Дж. Гописингх; М. А. Арда; М. Шетти; С. Т. Берк; П. Дж. Дауэнхауэр; О.А. Абдельрахман (2020). «Резонансно-стимулированное окисление муравьиной кислоты посредством динамической электрокаталитической модуляции» . АКС-катализ . 9 (8): 6929–6937. дои : 10.1021/acscatal.0c02201 .
- ^ Дж. Гописингх; М. А. Арда; М. Шетти; С. Т. Берк; П. Дж. Дауэнхауэр; О.А. Абдельрахман (2020). «Резонансно-стимулированное окисление муравьиной кислоты посредством динамической электрокаталитической модуляции» . ChemRxiv . дои : 10.26434/chemrxiv.11972031.v1 .
- ^ Миллер, РЛ; Фредриксон, АГ; Браун, АХ; Цучия, HM (1 апреля 1964 г.). «Гидромеханический метод повышения эффективности фотосинтеза водорослей» . Проектирование и разработка процессов промышленной и инженерной химии . 3 (2): 134–143. дои : 10.1021/i260010a008 . ISSN 0196-4305 .
- ^ Щеховский, Джеффри Г.; Коваль, Карл А.; Ноубл, Ричард Д. (1 сентября 1993 г.). «Доказательства критического освещения и времени восстановления в темноте для повышения фотоэффективности водного гетерогенного фотокатализа» . Журнал фотохимии и фотобиологии A: Химия . 74 (2): 273–278. дои : 10.1016/1010-6030(93)80126-Т . ISSN 1010-6030 .
- ^ Токоде, Олуватосин; Прабху, Радхакришна; Лоутон, Линда А.; Робертсон, Питер К.Дж. (15 марта 2016 г.). «Управляемое периодическое освещение в полупроводниковом фотокатализе» . Журнал фотохимии и фотобиологии A: Химия . 319–320: 96–106. doi : 10.1016/j.jphotochem.2015.12.002 . hdl : 10059/1675 . ISSN 1010-6030 . S2CID 53345148 .
- ^ Дж. Ци; Дж. Ресаско; Х. Робатжази; И. Барраса; О.А. Абдельрахман; П. Дж. Дауэнхауэр; П. Кристофер (2020). «Динамическое управление энергетикой элементарных шагов с помощью импульсного освещения усиливает фотокатализ на металлических наночастицах» . Энергетические письма ACS . 5 (11): 3518–3525. дои : 10.1021/acscatal.0c02201 .
- ^ Сорделло, Ф.; Пеллегрино, Ф.; Процци, М.; Минеро, К.; Маурино, В. (4 июня 2021 г.). «Контролируемое периодическое освещение увеличивает производство водорода более чем на 50% на Pt/TiO 2» . АКС-катализ . 11 (11): 6484–6488. дои : 10.1021/acscatal.1c01734 . ПМК 8294008 . ПМИД 34306809 .
- ^ Шетти, Маниш; Уолтон, Эмбер; Гатманн, Салли Р.; Арда, М. Александр; Гописингх, Джошуа; Ресаско, Хоакин; Бироль, Туран; Чжан, Ци; Цапацис, Майкл; Влахос, Дионисиос Г.; Кристофер, Филипп; Фрисби, К. Дэниел; Абдельрахман, Омар А.; Дауэнхауэр, Пол Дж. (2020). «Каталитическая механика динамических поверхностей: методы стимулирования каталитического резонанса» . АКС-катализ . 10 (21). Американское химическое общество: 12666–12695. дои : 10.1021/acscatal.0c03336 .





