Химия атмосферы
 |
| Метеорология |
|---|
| Климатология |
| Аэрономия |
| Глоссарии |
Химия атмосферы — раздел науки об атмосфере , изучающий химию атмосферы Земли и других планет. [1] Это междисциплинарный подход к исследованиям, основанный на химии окружающей среды , физике , метеорологии , компьютерном моделировании , океанографии , геологии , вулканологии и других дисциплинах. Исследования все больше связаны с другими областями изучения, такими как климатология .
Состав и химия атмосферы Земли важны по нескольким причинам, но в первую очередь из-за взаимодействия между атмосферой и живыми организмами . Состав атмосферы Земли меняется в результате природных процессов, таких как выбросы вулканов , молнии и бомбардировка солнечными частицами короны . Он также изменился в результате деятельности человека, и некоторые из этих изменений вредны для здоровья человека, сельскохозяйственных культур и экосистем. Примеры проблем, которые решаются с помощью химии атмосферы, включают кислотные дожди , разрушение озонового слоя , фотохимический смог , парниковые газы и глобальное потепление . Химики атмосферы стремятся понять причины этих проблем и, получив теоретическое понимание их, позволяют проверить возможные решения и оценить последствия изменений в государственной политике.
Состав атмосферы [ править ]


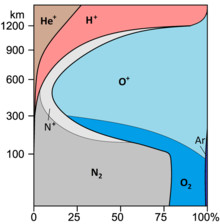
| Средний состав сухой атмосферы ( мольные доли ) | ||
|---|---|---|
| Газ | Сухой воздух по данным НАСА | Сухой чистый воздух вблизи уровня моря (стандарт ISO 2533 – 1975) |
| Азот , N 2 | 78.084% | 78.084% |
| Кислород , О 2 [3] | 20.946% | 20.946% |
| Второстепенные компоненты (молярные доли в ppm ) | ||
| Аргон , Ар | 9340 | 9340 |
| Углекислый газ * [а] , СО 2 | 415 | 314 [б] |
| Neon , Ne | 18.18 | 18.18 |
| Гелий , Он | 5.24 | 5.24 |
| Метан [а] , СН 4 | 1.7 | 2.0 |
| Криптон , Кр | 1.14 | 1.14 |
| Водород , H 2 | 0.55 | 0.5 |
| Закись азота , N 2 O | 0.5 | |
| Ксенон , Хе | 0.087 | |
| Диоксид азота , NO 2 | до 0,02 | |
| Озон *, O 3 , летом | до 0,07 | |
| Озон *, О 3 , зимой | до 0,02 | |
| Диоксид серы *, SO 2 | до 1 | |
| Йод *, I 2 | 0.01 | |
| Вода | ||
| Водяной пар * | Сильно варьирует (около 0–3%); обычно составляет около 1% | |
| Примечания | ||
| Средняя молекулярная масса сухого воздуха составляет 28,97 г/моль. *Содержание газа может существенно меняться время от времени или от места к месту. [а] Концентрация варьируется в зависимости CO 2 и CH 4 от сезона и местоположения. [б] CO 2 здесь с 1975 года, но ежегодно увеличивается примерно на 2–3 ppm (см. Углекислый газ в атмосфере Земли ). | ||
Состав следовых газов [ править ]
Помимо более важных компонентов, перечисленных выше, атмосфера Земли также содержит множество видов газовых примесей, которые значительно различаются в зависимости от близлежащих источников и поглотителей. Эти следовые газы могут включать такие соединения, как CFC/HCFC, которые особенно вредны для озонового слоя, и H.
2 S , который имеет характерный неприятный запах тухлых яиц и может чувствоваться в концентрации всего 0,47 частей на миллиард. некоторые приблизительные Ниже перечислены количества некоторых дополнительных газов у поверхности. Помимо газов, атмосфера содержит частицы в виде аэрозолей , к которым относятся, например, капли, кристаллы льда, бактерии и пыль.
| Состав (объемные доли, если не указано иное) | ||
|---|---|---|
| Газ | Чистый континентальный, Сейнфельд и Пандис (2016) [4] | Симпсон и др. (2010) [5] |
| Окись углерода , CO | 40-200 частей на миллиард стр.39 | 97 частей на миллиард |
| Оксид азота , НЕТ | 16 | |
| Этан , C 2 H 6 | 781 | |
| Пропан , С 3 Н 8 | 200 | |
| Изопрен , С 5 Н 8 | 311 | |
| Бензол , С 6 Н 6 | 11 | |
| Метанол , CH 3 OH | 1967 | |
| Этанол , C 2 H 5 OH | 75 | |
| Трихлорфторметан , CCl 3 F | 237 стр. 41 | 252.7 |
| Дихлордифторметан , CCl 2 F 2 | 530 стр. 41 | 532.3 |
| Хлорметан , CH 3 Cl | 503 | |
| Бромметан , CH 3 Br | 9–10 стр. 44 | 7.7 |
| Йодометан , CH 3 I | 0.36 | |
| Карбонилсульфид , OCS | 510 стр.26 | 413 |
| Диоксид серы , SO 2 | 70–200 стр.26 | 102 |
| Сероводород , H 2 S | 15–340 стр.26 | |
| Сероуглерод , CS 2 | 15–45 стр.26 | |
| Формальдегид , H 2 CO | 9,1 частей на миллиард p37, загрязненный | |
| Ацетилен , C 2 H 2 | 8,6 частей на миллиард p37, загрязненный | |
| Этен , C 2 H 4 | 11,2 частей на миллиард p37, загрязненный | 20 |
| Гексафторид серы , SF 6 | 7.3 стр. 41 | |
| Четырехфтористый углерод , CF 4 | 79 стр. 41 | |
| общая газообразная Ртуть , Hg | 0.209 стр55 | |
История [ править ]
Первые научные исследования состава атмосферы начались в 18 веке, когда такие химики, как Джозеф Пристли , Антуан Лавуазье и Генри Кавендиш, провели первые измерения состава атмосферы. [ нужна ссылка ]
В конце 19 - начале 20 веков интерес сместился в сторону микроэлементов с очень небольшими концентрациями. Одним из особенно важных открытий для химии атмосферы было открытие озона Кристианом Фридрихом Шёнбейном в 1840 году. [6]
В XX веке наука об атмосфере перешла от изучения состава воздуха к рассмотрению того, как концентрации малых газов в атмосфере менялись с течением времени, а также химических процессов, которые создают и разрушают соединения в воздухе. Двумя особенно важными примерами этого являются объяснения Сиднея Чепмена и Гордона Добсона того, как создается и поддерживается озоновый слой , а также объяснение фотохимического смога Ари Яна Хааген-Смита . Дальнейшие исследования по вопросам озона привели к Нобелевской премии по химии 1995 года, которую разделили Пол Крутцен , Марио Молина и Фрэнк Шервуд Роуленд . [7]
В 21 веке фокус снова смещается. Химию атмосферы все чаще изучают как часть земной системы . Вместо того, чтобы концентрироваться на химии атмосферы изолированно, сейчас основное внимание уделяется рассмотрению ее как части единой системы с остальной атмосферой , биосферой и геосферой . Особенно важным фактором для этого являются связи между химией и климатом, такие как влияние изменения климата на восстановление озоновой дыры и наоборот, а также взаимодействие состава атмосферы с океанами и наземными экосистемами . [ нужна ссылка ]
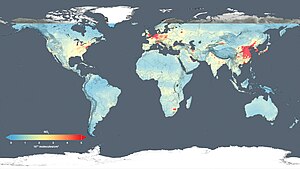
( НАСА Моделирование ; 9 ноября 2015 г.)
Методология [ править ]
Наблюдения, лабораторные измерения и моделирование — три центральных элемента химии атмосферы. Прогресс в химии атмосферы часто обусловлен взаимодействием между этими компонентами, и они образуют единое целое. Например, наблюдения могут сказать нам, что существует больше химических соединений, чем считалось ранее. Это будет стимулировать новое моделирование и лабораторные исследования, которые повысят наше научное понимание до такой степени, что наблюдения можно будет объяснить. [ нужна ссылка ]
Наблюдение [ править ]
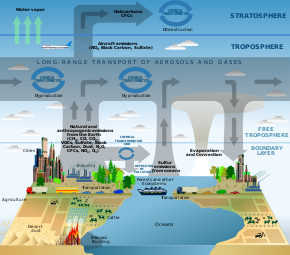
Наблюдения за химией атмосферы необходимы для нашего понимания. Регулярные наблюдения за химическим составом говорят нам об изменениях состава атмосферы с течением времени. Одним из важных примеров этого является кривая Килинга – серия измерений с 1958 года по сегодняшний день, которые показывают устойчивый рост концентрации углекислого газа (см. также текущие измерения содержания CO 2 в атмосфере ). Наблюдения за химией атмосферы проводятся в обсерваториях, например, на Мауна-Лоа , а также на мобильных платформах, таких как самолеты (например, Британская установка для воздушных измерений атмосферы ), корабли и воздушные шары. Наблюдения за составом атмосферы все чаще проводятся со спутников с помощью таких важных инструментов, как GOME и MOPITT, которые дают глобальную картину загрязнения воздуха и химического состава. Преимущество наземных наблюдений заключается в том, что они обеспечивают долгосрочные записи с высоким временным разрешением, но ограничены в вертикальном и горизонтальном пространстве, из которого они обеспечивают наблюдения. Некоторые наземные инструменты, например ЛИДАР может предоставлять профили концентрации химических соединений и аэрозолей, но его возможности по-прежнему ограничены горизонтальной областью, которую они могут охватить. Многие наблюдения доступны в режиме онлайн в базах данных наблюдений за химией атмосферы . [ нужна ссылка ]
Лабораторные исследования [ править ]
Измерения, проводимые в лаборатории, необходимы для понимания источников и поглотителей загрязняющих веществ и соединений природного происхождения. Эти эксперименты проводятся в контролируемых средах, что позволяет индивидуально оценить конкретные химические реакции или оценить свойства конкретного компонента атмосферы. [11] Типы анализа, представляющие интерес, включают как анализы газофазных реакций, так и гетерогенные реакции, имеющие отношение к образованию и росту аэрозолей . Также большое значение имеет изучение фотохимии атмосферы , которое позволяет количественно определить скорость расщепления молекул под действием солнечного света и какие продукты получаются в результате. Кроме того, термодинамические данные, такие как коэффициенты закона Генри . также можно получить [ нужна ссылка ]
Моделирование [ править ]
Чтобы синтезировать и проверить теоретическое понимание химии атмосферы, компьютерные модели (например, модели химического переноса используются ). Численные модели решают дифференциальные уравнения, определяющие концентрацию химических веществ в атмосфере. Они могут быть очень простыми или очень сложными. Одним из распространенных компромиссов в численных моделях является соотношение количества моделируемых химических соединений и химических реакций по сравнению с представлением переноса и смешивания в атмосфере. Например, блочная модель может включать сотни или даже тысячи химических реакций, но будет иметь лишь очень грубое представление о смешивании в атмосфере. Напротив, 3D-модели отражают многие физические процессы в атмосфере, но из-за ограничений компьютерных ресурсов в них будет гораздо меньше химических реакций и соединений. Модели можно использовать для интерпретации наблюдений, проверки понимания химических реакций и прогнозирования будущих концентраций химических соединений в атмосфере. Эти модели могут быть глобальными (имитирующими всю Землю) или региональными (ориентированными только на конкретный регион). Компромиссом между этими двумя подходами является их разрешающая способность, а также количество деталей, которые они могут предоставить; глобальные модели обычно имеют более низкое горизонтальное разрешение и представляют менее сложные химические механизмы, но моделируют большую территорию, в то время как региональные модели не моделируют весь земной шар, а фокусируются на одной области с более высоким разрешением и большей детализацией. Одной из важных текущих тенденций является то, что модули химии атмосферы станут частью моделей земной системы, в которых можно изучать связи между климатом, составом атмосферы и биосферой. Эти типы моделей позволяют объединить различные части Земли, такие как атмосфера, биосфера и гидросфера; позволяя пользователям анализировать сложные взаимодействия между ними.
Некоторые модели создаются автоматическими генераторами кода (например, Autochem или Kinetic PreProcessor ). В этом подходе выбирается набор компонентов, а затем автоматический генератор кода выбирает реакции с участием этих компонентов из набора баз данных реакций. После выбора реакций обыкновенные дифференциальные уравнения можно автоматически построить , описывающие их эволюцию во времени.
См. также [ править ]
| Часть серии о |
| Погода |
|---|
- Кислородный цикл
- Озоно-кислородный цикл
- Палеоклиматология
- Научная оценка разрушения озона
- События истощения тропосферного озона
Ссылки [ править ]
- ^ «Химия атмосферы - Последние исследования и новости | Природа» . www.nature.com . Проверено 06 октября 2022 г.
- ^ Кэрнс, Айвер (23 сентября 1999 г.). «Атмосфера Земли» . Сиднейский университет . Проверено 7 апреля 2021 г.
- ^ Циммер, Карл (3 октября 2013 г.). «Кислород Земли: загадка, которую легко принять как должное» . Нью-Йорк Таймс . Проверено 3 октября 2013 г.
- ^ Сейнфельд, Джон; Пандис, Спирос (2016). Химия и физика атмосферы – от загрязнения воздуха до изменения климата, 3-е изд . Хобокен, Нью-Джерси: Уайли . ISBN 9781119221173 .
- ^ Симпсон, Ай-Джей; Блейк, Нью-Джерси; Барлетта, Б.; Дискин, Г.С.; Фельберг, HE; Горэм, К.; Хьюи, LG; Мейнарди, С.; Роуленд, ФС; Вэй, ЮАР; Вайнхаймер, AJ; Ян, М.; Блейк, доктор медицинских наук (2010). «Характеристика малых газовых примесей, измеренных на предприятиях по добыче нефтеносных песков Альберты: 76 летучих органических соединений C 2 –C 10 (ЛОС), CO 2 , CH 4 , CO, NO, NO 2 , NO, O 3 и SO 2 » . Химия и физика атмосферы . 10 (23): 11931–11954. Бибкод : 2010ACP....1011931S . дои : 10.5194/acp-10-11931-2010 . ISSN 1680-7324 . S2CID 62782723 .
- ^ Шенбейн, К. (1 января 1843 г.). О получении озона химическим путем . Королевское общество Лондона.
- ^ «Пресс-релиз – Нобелевская премия по химии 1995 года» . Нобелевская премия . Нобелевская премия. 11 октября 1995 г.
- ^ Сен-Флер, Николас (10 ноября 2015 г.). «Уровень парниковых газов в атмосфере побил рекорд, говорится в докладе» . Нью-Йорк Таймс . Проверено 11 ноября 2015 г.
- ^ Риттер, Карл (9 ноября 2015 г.). «Великобритания: Во-первых, средняя глобальная температура может быть на 1 градус Цельсия выше» . АП Новости . Проверено 11 ноября 2015 г.
- ^ Коул, Стив; Грей, Эллен (14 декабря 2015 г.). «Новые спутниковые карты НАСА показывают влияние человека на качество воздуха в мире» . НАСА . Проверено 14 декабря 2015 г.
- ^ Национальные академии наук, техники и медицины (2016 г.). Будущее атмосферных исследований: вспоминая вчера, понимая сегодня, предвидя завтра . Вашингтон, округ Колумбия: Издательство национальных академий. п. 15. ISBN 978-0-309-44565-8 .
Дальнейшее чтение [ править ]
- Брассер, Гай П.; Орландо, Джон Дж.; Тиндалл, Джеффри С. (1999). Химия атмосферы и глобальные изменения . Издательство Оксфордского университета. ISBN 0-19-510521-4 .
- Финлейсон-Питтс, Барбара Дж.; Питтс, Джеймс Н. младший (2000). Химия верхней и нижней атмосферы . Академическая пресса. ISBN 0-12-257060-X .
- Сейнфельд, Джон Х.; Пандис, Спирос Н. (2006). Химия и физика атмосферы: от загрязнения воздуха до изменения климата (2-е изд.). Джон Уайли и сыновья, Inc. ISBN 0-471-82857-2 .
- Варнек, Питер (2000). Химия природной атмосферы (2-е изд.). Академическая пресса. ISBN 0-12-735632-0 .
- Уэйн, Ричард П. (2000). Химия атмосфер (3-е изд.). Издательство Оксфордского университета. ISBN 0-19-850375-X .
- СП Ирибарн, Х.Р. Чо, Физика атмосферы , Издательство Д. Рейделя, 1980 г.
Внешние ссылки [ править ]
- Научная оценка ВМО разрушения озона: 2006 г.
- IGAC Международный проект по глобальной химии атмосферы
- Интервью Пола Круцена - бесплатное видео Пола Крутцена, лауреата Нобелевской премии за его работу по разложению озона, беседующего с нобелевским лауреатом Гарри Крото , Vega Science Trust
- Кембриджская база данных по химии атмосферы представляет собой крупную базу данных наблюдений в общем формате.
- Наука об окружающей среде опубликована для всех на Земле
- Химическая кинетика и фотохимические данные НАСА-Лаборатории реактивного движения для использования в исследованиях атмосферы
- Кинетические и фотохимические данные оценены Подкомитетом IUPAC по оценке кинетических данных газа.
- Глоссарий по химии атмосферы в Государственном университете Сэма Хьюстона
- Тропосферная химия
- Калькуляторы для использования в химии атмосферы. Архивировано 9 декабря 2010 г. на Wayback Machine.
- Иллюстрированная элементарная оценка состава воздуха