Магнитохимия
Магнитохимия занимается изучением магнитных свойств химических соединений . Магнитные свойства возникают из-за спина и орбитального углового момента электронов, содержащихся в соединении. Соединения диамагнитны, если они не содержат неспаренных электронов . Молекулярные соединения, содержащие один или несколько неспаренных электронов, являются парамагнитными . Величина парамагнетизма выражается как эффективный магнитный момент μ eff . первого ряда Для переходных металлов величина μ eff в первом приближении является простой функцией количества неспаренных электронов (формула только для спина). В общем, спин-орбитальное взаимодействие приводит к отклонению μ eff от формулы только для спина. Для более тяжелых переходных металлов, лантаноидов и актинидов , нельзя игнорировать спин-орбитальное взаимодействие. Обменное взаимодействие может происходить в кластерах и бесконечных решетках, что приводит к ферромагнетизму , антиферромагнетизму или ферримагнетизму в зависимости от взаимной ориентации отдельных спинов.
Магнитная восприимчивость [ править ]
Основным измерением в магнитохимии является магнитная восприимчивость. Это измеряет силу взаимодействия при помещении вещества в магнитное поле. Объемная магнитная восприимчивость , обозначаемая символом определяется отношением
где, - намагниченность материала ( магнитный дипольный момент на единицу объема), измеряемая в амперах на метр ( единицы СИ ), и — напряженность магнитного поля , также измеряемая в амперах на метр. Восприимчивость – безразмерная величина . Для химических применений молярная магнитная восприимчивость (χ моль предпочтительной величиной является ). Измеряется в м 3 ·моль −1 (СИ) или см 3 ·моль −1 (CGS) и определяется как
где ρ — плотность в кг·м −3 (СИ) или г·см −3 (CGS) и M — молярная масса в кг·моль. −1 (СИ) или г·моль −1 (ЦГС).

Существует множество методов измерения магнитной восприимчивости.
- С помощью весов Гуи изменение веса образца измеряется с помощью аналитических весов , когда образец помещается в однородное магнитное поле. Измерения калибруются по известному стандарту, например, по тиоцианату ртути-кобальта HgCo(NCS) 4 . Калибровка устраняет необходимость знать плотность образца. Измерения переменной температуры можно проводить, помещая образец в криостат между полюсными наконечниками магнита. [1]
- Баланс Эванса . [2] представляет собой торсионные весы , в которых образец находится в фиксированном положении, а переменный вторичный магнит возвращает магниты в исходное положение. Он также калибруется по HgCo(NCS) 4 .
- С помощью весов Фарадея образец помещают в магнитное поле постоянного градиента и взвешивают на крутильных весах. Этот метод может дать информацию о магнитной анизотропии . [3]
- СКВИД — очень чувствительный магнитометр.
- Для веществ в растворе ЯМР можно использовать для измерения чувствительности. [4] [5]
Типы магнитного поведения [ править ]
Когда изолированный атом помещается в магнитное поле, происходит взаимодействие, поскольку каждый электрон в атоме ведет себя как магнит, то есть электрон обладает магнитным моментом . Существует два типа взаимодействия.
- Диамагнетизм. Помещенный в магнитное поле атом становится магнитно поляризованным, то есть у него появляется индуцированный магнитный момент. Сила взаимодействия стремится вытолкнуть атом из магнитного поля. По соглашению диамагнитной восприимчивости присваивается отрицательный знак. Очень часто диамагнитные атомы не имеют неспаренных электронов , т.е. каждый электрон спарен с другим электроном на той же атомной орбитали . Моменты двух электронов компенсируют друг друга, поэтому атом не имеет чистого магнитного момента. Однако для иона Eu 3+ у которого есть шесть неспаренных электронов, орбитальный угловой момент уравновешивает угловой момент электрона, и этот ион диамагнитен при нуле Кельвина.
- Парамагнетизм. По крайней мере один электрон не спарен с другим. Атом обладает постоянным магнитным моментом. Помещенный в магнитное поле, атом притягивается к этому полю. По соглашению парамагнитной восприимчивости присваивается положительный знак.
Когда атом присутствует в химическом соединении, его магнитное поведение изменяется в зависимости от химического окружения. Измерение магнитного момента может дать полезную химическую информацию.
В некоторых кристаллических материалах отдельные магнитные моменты могут быть совмещены друг с другом (магнитный момент имеет как величину, так и направление). Это приводит к ферромагнетизму , антиферромагнетизму или ферримагнетизму . Это свойства кристалла в целом, мало влияющие на химические свойства.
Диамагнетизм [ править ]
Диамагнетизм — универсальное свойство химических соединений, поскольку все химические соединения содержат электронные пары. Соединение, в котором нет неспаренных электронов, называется диамагнитным. Эффект слабый, поскольку зависит от величины индуцированного магнитного момента. Это зависит от числа электронных пар и химической природы атомов, которым они принадлежат. таблицу «диамагнитных вкладов» или констант Паскаля . Это означает, что эффекты аддитивны, и можно составить [6] [7] [8] В случае парамагнитных соединений наблюдаемую восприимчивость можно корректировать, добавляя к ней так называемую диамагнитную поправку, которая представляет собой диамагнитную восприимчивость, рассчитанную по значениям из таблицы. [9]
Парамагнетизм [ править ]
Механизм и температурная зависимость [ править ]

Ион металла с одним неспаренным электроном, например Cu 2+ , в координационном комплексе дает простейшую иллюстрацию механизма парамагнетизма. Отдельные ионы металлов удерживаются лигандами на большом расстоянии друг от друга, поэтому между ними нет магнитного взаимодействия. Говорят, что система магнитно-разбавленная. Магнитные диполи атомов направлены в случайных направлениях. При приложении магнитного поля зеемановское расщепление происходит первого порядка. Атомов со спинами, ориентированными по полю, немного больше, чем атомов с неориентированными спинами. В эффекте Зеемана первого порядка разница энергий между двумя состояниями пропорциональна напряженности приложенного поля. Обозначая разницу энергий как Δ E , распределение Больцмана дает соотношение двух популяций как , где k — постоянная Больцмана , а T — температура в кельвинах . В большинстве случаев Δ E намного меньше kT , и экспоненту можно разложить до 1 – Δ E/kT . Из наличия в этом выражении 1/ Т следует , что восприимчивость обратно пропорциональна температуре. [10]
Это известно как закон Кюри , а константа пропорциональности C известна как константа Кюри , значение которой для молярной восприимчивости рассчитывается как [11]
где N — постоянная Авогадро , g — g-фактор Ланде , а μ B — магнетон Бора . В этой трактовке предполагалось, что основное электронное состояние не вырождено, что магнитная восприимчивость обусловлена только спином электрона и что только основное состояние является термически заселенным.
Некоторые вещества подчиняются закону Кюри, другие подчиняются закону Кюри-Вейсса .
T c – температура Кюри . Закон Кюри-Вейсса будет применяться только тогда, когда температура значительно превышает температуру Кюри. При температурах ниже температуры Кюри вещество может стать ферромагнитным . Более сложное поведение наблюдается с более тяжелыми переходными элементами.
Эффективный магнитный момент [ править ]
При соблюдении закона Кюри произведение молярной восприимчивости и температуры остается постоянным. Тогда эффективный магнитный момент , μ eff определяется [12] как
Где C имеет единицы CGS см 3 моль −1 , µэфф K
Где C имеет единицы СИ м 3 моль −1 , µэфф K
Величина μ eff фактически безразмерна, но часто выражается в единицах магнетона Бора (μ B ). [12]
Для веществ, подчиняющихся закону Кюри, эффективный магнитный момент не зависит от температуры. Для других веществ µ эфф зависит от температуры, но эта зависимость мала, если выполняется закон Кюри-Вейсса и температура Кюри мала.
парамагнетизм Независимый от температуры
Соединения, которые, как ожидается, будут диамагнитными, могут проявлять такой слабый парамагнетизм. Оно возникает из-за эффекта Зеемана второго порядка, при котором происходит дополнительное расщепление, пропорциональное квадрату напряженности поля. Это трудно наблюдать, поскольку соединение неизбежно также взаимодействует с магнитным полем в диамагнитном смысле. Тем не менее, имеются данные по перманганат- иону. [13] Это легче наблюдать в соединениях более тяжелых элементов, например в соединениях уранила .
Взаимодействие по обмену [ править ]



Обменные взаимодействия возникают, когда вещество не магнитно разбавлено и имеются взаимодействия между отдельными магнитными центрами. Одной из простейших систем, проявляющих результат обменных взаимодействий, является кристаллический ацетат меди(II) Cu 2 (OAc) 4 (H 2 O) 2 . Как видно из формулы, он содержит два иона меди(II). Cu 2+ Ионы удерживаются вместе четырьмя ацетатными лигандами, каждый из которых связывается с обоими ионами меди. Каждый Cu 2+ у ion есть реклама 9 электронная конфигурация, поэтому он должен иметь один неспаренный электрон. Если бы между ионами меди существовала ковалентная связь, электроны образовали бы пары, и соединение было бы диамагнитным. Вместо этого происходит обменное взаимодействие, при котором спины неспаренных электронов частично выравниваются друг с другом. Фактически создаются два состояния: одно с параллельными спинами, а другое с противоположными спинами. Разница в энергии между двумя состояниями настолько мала, что их численность значительно меняется в зависимости от температуры. В результате магнитный момент изменяется с температурой по сигмоидальному закону. Состояние с противоположными спинами имеет меньшую энергию, поэтому взаимодействие в этом случае можно отнести к антиферромагнитному. [14] Считается, что это пример сверхобмена , опосредованного атомами кислорода и углерода ацетатных лигандов. [15] Другие димеры и кластеры проявляют обменное поведение. [16]
Обменные взаимодействия могут действовать на бесконечные цепочки в одном измерении, на плоскости в двух измерениях или на весь кристалл в трех измерениях. Это примеры дальнего магнитного упорядочения. Они порождают ферромагнетизм , антиферромагнетизм или ферримагнетизм , в зависимости от природы и взаимной ориентации отдельных спинов. [17]
Соединения при температурах ниже температуры Кюри обладают дальним магнитным порядком в виде ферромагнетизма. Другая критическая температура — температура Нееля , ниже которой возникает антиферромагнетизм. Шестигидрат хлорида никеля NiCl 2 ·6H 2 O имеет температуру Нееля 8,3 К. При этой температуре восприимчивость максимальна. Ниже температуры Нееля восприимчивость уменьшается и вещество становится антиферромагнитным. [18]
Комплексы ионов переходных металлов [ править ]
Эффективный магнитный момент соединения, содержащего ион переходного металла с одним или несколькими неспаренными электронами, зависит от общего орбитального и спинового углового момента неспаренных электронов: и , соответственно. «Итого» в данном контексте означает « векторная сумма ». В приближении, когда электронные состояния ионов металлов определяются связью Рассела-Сондерса и что спин-орбитальная связь пренебрежимо мала, магнитный момент определяется выражением [19]
Формула только для вращения [ править ]
Орбитальный угловой момент генерируется, когда электрон на орбитали вырожденного набора орбиталей перемещается на другую орбиталь в наборе путем вращения. В комплексах низкой симметрии некоторые повороты невозможны. В этом случае говорят, что орбитальный угловой момент «погашен» и меньше, чем можно было бы ожидать (частичное гашение), или равно нулю (полное гашение). Полное тушение наблюдается в следующих случаях. Заметим, что электрон в вырожденной паре d x 2 -и 2 или д з 2 орбитали не могут вращаться в другую орбиталь из-за симметрии. [20]
Погашенный орбитальный угловой момент д н Октаэдрический Тетраэдрический высокоспиновый низкоспиновый д 1 и 1 д 2 и 2 д 3 т 2г 3 д 4 т 2г 3 например г 1 д 5 т 2г 3 например г 2 д 6 т 2г 6 и 3 т 2 3 д 7 т 2г 6 например г 1 и 4 т 2 3 д 8 т 2г 6 например г 2 д 9 т 2г 6 например г 3
- легенда: t 2g , t 2 = (d xy , d xz , d yz ). е г , е знак равно (d x 2 -и 2 , д з 2 ).
Когда орбитальный угловой момент полностью погашен, и парамагнетизм можно объяснить только спином электрона. Полный спиновый угловой момент составляет просто половину числа неспаренных электронов, и в результате получается формула только для спина.
где n — число неспаренных электронов. Формула только спина является хорошим первым приближением для высокоспиновых комплексов переходных металлов первого ряда . [21]
Ион Количество
непарный
электроныТолько вращение
момент / мкБнаблюдал
момент / мкБИз 3+ 1 1.73 1.73 V 4+ 1 1.73 1.68–1.78 С 2+ 1 1.73 1.70–2.20 V 3+ 2 2.83 2.75–2.85 В 2+ 2 2.83 2.8–3.5 V 2+ 3 3.87 3.80–3.90 Кр 3+ 3 3.87 3.70–3.90 Ко 2+ 3 3.87 4.3–5.0 Мин. 4+ 3 3.87 3.80–4.0 Кр 2+ 4 4.90 4.75–4.90 Фе 2+ 4 4.90 5.1–5.7 Мин. 2+ 5 5.92 5.65–6.10 Фе 3+ 5 5.92 5.7–6.0
Небольшие отклонения от формулы только для спина могут быть результатом пренебрежения орбитальным угловым моментом или спин-орбитальным взаимодействием. Например, тетраэдр d 3 , д 4 , д 8 и д 9 комплексы имеют тенденцию демонстрировать большие отклонения от формулы только спина, чем октаэдрические комплексы того же иона, поскольку «гашение» орбитального вклада менее эффективно в тетраэдрическом случае. [22]
Низкоспиновые комплексы [ править ]
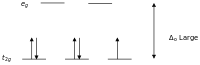
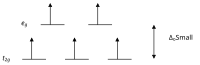
Согласно теории кристаллического поля, d -орбитали иона переходного металла в октаэдрическом комплексе расщепляются на две группы в кристаллическом поле. Если расщепление достаточно велико, чтобы преодолеть энергию, необходимую для помещения электронов на одну и ту же орбиталь с противоположным спином, в результате образуется низкоспиновый комплекс.
Высоко- и низкоспиновые октаэдрические комплексы d-счет Количество неспаренных электронов примеры высокоспиновый низкоспиновый д 4 4 2 Кр 2+ , Мн 3+ д 5 5 1 Мин. 2+ , Фе 3+ д 6 4 0 Фе 2+ , Ко 3+ д 7 3 1 Ко 2+
При одном неспаренном электроне значения µ eff составляют от 1,8 до 2,5 µB , а при двух неспаренных электронах - от 3,18 до 3,3 µB . Отметим, что низкоспиновые комплексы Fe 2+ и Ко 3+ являются диамагнитными. Другая группа диамагнитных комплексов — это плоскоквадратные комплексы d 8 ионы, такие как Ni 2+ и резус + и Ау 3+ .
Спин-кроссовер [ править ]
Когда разность энергий между высокоспиновым и низкоспиновым состояниями сравнима с kT ( k - постоянная Больцмана , а T - температура), между спиновыми состояниями устанавливается равновесие, включающее так называемые «электронные изомеры». Трисдитиокарбамато 2 железа(III), Fe(S 3 CNR 2 ) . , является хорошо документированным примером Эффективный момент варьируется от типичного d 5 низкоспиновое значение от 2,25 мкБ при 80 К до более 4 мкБ выше 300 К. [23]
Переходные металлы 2-го и 3 ряда - го
Расщепление кристаллического поля больше для комплексов более тяжелых переходных металлов, чем для переходных металлов, обсуждавшихся выше. Следствием этого является то, что низкоспиновые комплексы встречаются гораздо чаще. Константы спин-орбитального взаимодействия ζ также больше, и их нельзя игнорировать даже при элементарных подходах. Магнитное поведение было обобщено, как показано ниже, вместе с обширной таблицей данных. [24]
d-счет кТ/ζ=0,1
μ эффкТ/ζ=0
μ эффПоведение при большой константе спин-орбитального взаимодействия ζ nd д 1 0.63 0 μ eff меняется в зависимости от T 1/2 д 2 1.55 1.22 μ eff меняется в зависимости от T, примерно д 3 3.88 3.88 Независимость от температуры д 4 2.64 0 μ eff меняется в зависимости от T 1/2 д 5 1.95 1.73 μ eff меняется в зависимости от T, примерно
Лантаниды и актиниды [ править ]
Связь Рассела-Сондерса , LS-связь, применима к ионам лантаноидов, эффектами кристаллического поля можно пренебречь, но спин-орбитальной связью нельзя пренебречь. Следовательно, спиновые и орбитальные угловые моменты должны быть объединены.
а рассчитанный магнитный момент равен
Магнитные свойства соединений трехвалентных лантаноидов [25] лантаноид Этот Пр Нд вечера см Евросоюз Б-г Тб Те К Является Тм Ыб Лу Количество неспаренных электронов 1 2 3 4 5 6 7 6 5 4 3 2 1 0 расчетный момент / мкБ 2.54 3.58 3.62 2.68 0.85 0 7.94 9.72 10.65 10.6 9.58 7.56 4.54 0 наблюдаемый момент /μ B 2.3–2.5 3.4–3.6 3.5–3.6 1.4–1.7 3.3–3.5 7.9–8.0 9.5–9.8 10.4–10.6 10.4–10.7 9.4–9.6 7.1–7.5 4.3–4.9 0
В актинидах спин-орбитальная связь сильная и приближается к j j -связи.
Это означает, что трудно рассчитать эффективный момент. Например, уран(IV), f 2 , в комплексе [UCl 6 ] 2− имеет измеренный эффективный момент 2,2 мкм B , который включает вклад независимого от температуры парамагнетизма. [26]
Элементы основной группы и органические соединения [ править ]


Очень немногие соединения элементов основной группы являются парамагнитными. Известные примеры включают: кислород , O 2 ; оксид азота , NO; диоксид азота NO 2 и диоксид хлора ClO 2 . В органической химии соединения с неспаренным электроном называются свободными радикалами . Свободные радикалы, за некоторыми исключениями, недолговечны, поскольку один свободный радикал быстро реагирует с другим, поэтому их магнитные свойства трудно изучать. Однако если радикалы хорошо отделены друг от друга в разбавленном растворе в твердой матрице, то при низкой температуре их можно изучать методом электронного парамагнитного резонанса (ЭПР). Такие радикалы образуются при облучении. Обширные исследования ЭПР многое рассказали о делокализации электронов в свободных радикалах. Смоделированный спектр радикала CH 3 • демонстрирует сверхтонкое расщепление вследствие взаимодействия электрона с тремя эквивалентными ядрами водорода, каждое из которых имеет спин 1/2. [27] [28]
Спиновые метки представляют собой долгоживущие свободные радикалы, которые можно внедрять в органические молекулы, чтобы их можно было изучать методом ЭПР. [29] Например, нитроксид MTSL , функционализированное производное TEtra метилпиперидиноксида, TEMPO , используется в сайт-направленном спин-мечении .
Приложения [ править ]
Ион гадолиния , Gd 3+ , имеет f 7 электронная конфигурация, в которой все спины параллельны. Соединения Б-га 3+ ионы наиболее подходят для использования в качестве контрастного вещества при МРТ . [30] Магнитные моменты соединений гадолиния больше, чем у любого иона переходного металла. Гадолинийпредпочтительнее других ионов лантаноидов, некоторые из которых имеют более высокие эффективные моменты, из-за того, что они имеют невырожденное основное электронное состояние . [31]
В течение многих лет природа оксигемоглобина Hb -O 2 оставалась весьма спорной. Экспериментально было обнаружено, что он диамагнитен. Принято считать, что дезоксигемоглобин представляет собой комплекс железа в степени окисления +2 , т.е. 6 система с высокоспиновым магнитным моментом, близким к только спиновому значению 4,9 мкм B . Было высказано предположение, что железо окисляется, а кислород восстанавливается до супероксида.
- Fe(II)Hb (высокоспиновый) + O 2 ⇌ [Fe(III)Hb]O 2 −
Спаривание электронов из Fe 3+ и О 2 − Тогда было предложено осуществить это посредством механизма обмена. Теперь было показано, что на самом деле железо(II) меняется с высокоспинового на низкоспиновое, когда молекула кислорода отдает пару электронов железу. Если в дезоксигемоглобине атом железа лежит выше плоскости гема, то в низкоспиновом комплексе эффективный ионный радиус уменьшен и атом железа лежит в плоскости гема. [32]
- Fe(II)Hb + O 2 ⇌ [Fe(II)Hb]O 2 (низкоспиновый)
Эта информация имеет важное значение для исследований по поиску искусственных переносчиков кислорода .
Соединения галлия(II) до недавнего времени были неизвестны. Поскольку атомный номер галлия нечетное число (31), Ga 2+ должен иметь неспаренный электрон. Предполагалось, что он будет действовать как свободный радикал и иметь очень короткое время жизни. Отсутствие соединений Ga(II) было частью так называемого эффекта инертной пары . Когда соли аниона с брутто-формулой, например [GaCl 3 ] − были синтезированы, они оказались диамагнитными. Это подразумевало образование связи Ga-Ga и димерной формулы [Ga 2 Cl 6 ] 2− . [33]
См. также [ править ]
- Магнитная минералогия
- Магнитоэлектрохимия
- Магнитная ионная жидкость
- Вращение льда
- Спиновое стекло
- Супердиамагнетизм , Суперпарамагнетизм , Суперферромагнетизм
- Одномолекулярный магнетизм
Ссылки [ править ]
- ^ Эрншоу, с. 89
- ^ Балансы магнитной восприимчивости
- ^ О'Коннор, CJ (1982). Липпард, С.Дж. (ред.). Измерения магнитной восприимчивости . Прогресс неорганической химии. Том. 29. Уайли. п. 203. ИСБН 978-0-470-16680-2 .
- ^ Эванс, Д.Ф. (1959). «Определение парамагнитной восприимчивости веществ в растворах методом ядерного магнитного резонанса». Дж. Хим. Соц. : 2003–2005 гг. дои : 10.1039/JR9590002003 .
- ^ Орчард, с. 15. Эрншшоу, с. 97
- ^ Фиггис и Льюис, с. 403
- ^ Карлин, с. 3
- ^ Бэйн, Гордон А.; Берри, Джон Ф. (2008). «Диамагнитные поправки и константы Паскаля». Дж. Хим. Образование . 85 (4): 532. Бибкод : 2008JChEd..85..532B . дои : 10.1021/ed085p532 .
- ^ Фиггис и Льюис, с. 417
- ^ Фиггис и Льюис, с. 419
- ^ Орчард, с. 48
- ↑ Перейти обратно: Перейти обратно: а б Хоппе, Дж.И. (1972). «Эффективный магнитный момент». Дж. Хим. Образование . 49 (7): 505. Бибкод : 1972JChEd..49..505H . дои : 10.1021/ed049p505 .
- ^ Орчард, с. 53
- ↑ Перейти обратно: Перейти обратно: а б Лоуренс Ку (март 2000 г.). Физические методы в бионеорганической химии: спектроскопия и магнетизм . Университетские научные книги. стр. 345–348. ISBN 978-1-891389-02-3 . Проверено 22 февраля 2011 г.
- ^ Фиггис и Льюис, с. 435. Фруктовый сад, с. 67
- ^ Карлин, разделы 5.5–5.7
- ^ Карлин, главы 6 и 7, стр. 112–225.
- ^ Карин, стр. 264.
- ^ Фиггис и Льюис, с. 420
- ^ Фиггис и Льюис, стр. 424, 432
- ^ Фиггис и Льюис, с. 406
- ^ Фиггис и Льюис, Раздел 3, «Орбитальный вклад»
- ^ Орчард, с. 125. Карлин, с. 270
- ^ Фиггис и Льюис, стр. 443–451
- ^ Гринвуд и Эрншоу, с. 1243
- ^ Орчард, с. 106
- ^ Вейл, Джон А.; Болтон, Джеймс Р.; Вертц, Джон Э. (1994). Электронный парамагнитный резонанс: элементарная теория и практические приложения . Уайли. ISBN 0-471-57234-9 .
- ^ Аткинс, П.В.; Саймонс, MCR (1967). Строение неорганических радикалов; применение электронного спинового резонанса к изучению молекулярной структуры . Эльзевир.
- ^ Берлинер, ЖЖ (1976). Спиновая маркировка: теория и приложения I. Академическая пресса. ISBN 0-12-092350-5 . Берлинер, ЖЖ (1979). Спиновая маркировка II: теория и приложения . Академическая пресса. ISBN 0-12-092352-1 .
- ^ Краузе, В. (2002). Контрастные вещества I: Магнитно-резонансная томография: Pt. 1 . Спрингер. ISBN 3540422471 .
- ^ Караван, Питер; Эллисон, Джеффри Дж.; Макмерри, Томас Дж.; Лауффер, Рэндалл Б., Джеффри Дж.; Макмерри, Томас Дж.; Лауффер, Рэндалл Б. (1999). «Хелаты гадолиния (III) как контрастные вещества для МРТ: структура, динамика и применение». хим. Преподобный . 99 (9): 2293–2352. дои : 10.1021/cr980440x . ПМИД 11749483 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Гринвуд и Эрншоу, стр. 1099–1011.
- ^ Гринвуд и Эрншоу, с. 240
Библиография [ править ]
- Карлин, Р.Л. (1986). Магнитохимия . Спрингер . ISBN 978-3-540-15816-5 .
- Эрншоу, Алан (1968). Введение в магнитохимию . Академическая пресса .
- Фиггис, Б.Н.; Льюис, Дж. (1960). «Магнитохимия сложных соединений». В Льюисе. Дж. и Уилкинс. РГ (ред.). Современная координационная химия . Нью-Йорк: Уайли .
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Орчард, AF (2003). Магнитохимия . Оксфордские учебники по химии. Издательство Оксфордского университета . ISBN 0-19-879278-6 .
- Селвуд, военнопленный (1943). Магнитохимия . Издательство Интерсайенс, Инк.
- Вульфсон, Сергей (1998). Молекулярная магнитохимия . Тейлор и Фрэнсис . ISBN 90-5699-535-9 .





















