Неорганическая химия

Неорганическая химия занимается синтезом и поведением неорганических и металлоорганических соединений. Эта область охватывает химические соединения , не содержащие углерода, которые являются предметом органической химии . Различие между этими двумя дисциплинами далеко не абсолютное, поскольку в рамках дисциплины металлоорганической химии существует много совпадений . Он находит применение во всех аспектах химической промышленности, включая катализ , материаловедение , пигменты , поверхностно-активные вещества , покрытия , лекарства , топливо и сельское хозяйство . [1]
Происшествие [ править ]
Многие неорганические соединения встречаются в природе в виде минералов . [2] Почва может содержать сульфид железа в виде пирита или сульфат кальция в виде гипса . [3] [4] Неорганические соединения также выполняют многозадачные функции в качестве биомолекул : в качестве электролитов ( хлорид натрия ), в качестве накопителя энергии ( АТФ ) или в строительстве ( полифосфатный остов ДНК ).
Связывание [ править ]
Неорганические соединения проявляют ряд связующих свойств. Некоторые из них представляют собой ионные соединения , состоящие из очень простых катионов и анионов, соединенных ионной связью . Примерами солей (которые являются ионными соединениями) являются хлорид магния MgCl 2 , который состоит из магния Mg. катионов 2+ и хлорид- анионы Cl − ; или гидроксид натрия NaOH, который состоит из натрия Na катионов + и гидроксид- анионы OH − . Некоторые неорганические соединения обладают высокой ковалентностью, например диоксид серы и пентакарбонил железа . Многие неорганические соединения имеют полярную ковалентную связь, которая представляет собой промежуточную форму связи между ковалентной и ионной связью. Это описание применимо ко многим оксидам , карбонатам и галогенидам . Многие неорганические соединения характеризуются высокими температурами плавления . Некоторые соли (например, NaCl ) хорошо растворимы в воде.
Когда один реагент содержит атомы водорода, реакция может происходить путем обмена протонами в кислотно-щелочной химии . В более общем определении любое химическое соединение, способное связываться с электронными парами, называется кислотой Льюиса ; и наоборот, любая молекула, которая имеет тенденцию отдавать электронную пару, называется основанием Льюиса . [5] В качестве уточнения кислотно-основных взаимодействий теория HSAB учитывает поляризуемость и размер ионов.
Подразделы неорганической химии [ править ]
Подразделы неорганической химии многочисленны, но включают:
- металлоорганическая химия , соединения со связями металл-углерод. Эта область затрагивает органический синтез , в котором используется множество металлоорганических катализаторов и реагентов.
- кластерная химия , соединения нескольких металлов, связанных между собой связями металл-металл или мостиковыми лигандами .
- бионеорганическая химия , биомолекулы, содержащие металлы. Эта область затрагивает медицинскую химию .
- химия материалов и химия твердого тела , протяженные (т.е. полимерные) твердые тела, обладающие свойствами, не наблюдаемыми у простых молекул. С этими направлениями связано множество практических тем, в том числе керамика .
Промышленная неорганическая химия [ править ]
Неорганическая химия – весьма практическая область науки. Традиционно масштаб экономики страны можно было оценить по производству серной кислоты .
Важным искусственным неорганическим соединением является нитрат аммония , используемый для внесения удобрений. Аммиак производится посредством процесса Габера . [6] [7] [8] Азотную кислоту получают из аммиака окислением. Еще одним крупномасштабным неорганическим материалом является портландцемент . используются неорганические соединения В качестве катализаторов , такие как оксид ванадия (V) для окисления диоксида серы и хлорид титана (III) для полимеризации алкенов . Многие неорганические соединения используются в качестве реагентов в органической химии, например, литийалюминийгидрид . [ нужна ссылка ]
Описательная неорганическая химия [ править ]
Описательная неорганическая химия фокусируется на классификации соединений на основе их свойств. Частично классификация фокусируется на положении в периодической таблице самого тяжелого элемента (элемента с наибольшим атомным весом) в соединении, частично путем группировки соединений по их структурному сходству.
Координационные соединения [ править ]

В классических координационных соединениях металлы связаны с « неподеленными парами » электронов, находящихся на атомах основной группы лигандов, таких как H 2 O, NH 3 , Cl. − и CN − . В современных координационных соединениях в качестве лигандов могут использоваться практически все органические и неорганические соединения. «Металлом» обычно является металл из групп 3–13, а также транс - лантаниды и транс - актиниды , но с определенной точки зрения все химические соединения можно описать как координационные комплексы.
Стереохимия координационных комплексов может быть весьма богатой, на что указывает разделение Вернером двух [ энантиомеров Co((OH) 2 Co(NH 3 ) 4 ) 3 ] 6+ , ранняя демонстрация того, что хиральность не присуща органическим соединениям. Актуальной темой в рамках этой специализации является супрамолекулярная координационная химия. [9]
- Примеры: [Co( ЭДТА )] − , [Co(NH 3 ) 6 ] 3+ , TiCl 4 ( ТГФ ) 2 .
Координационные соединения демонстрируют богатое разнообразие структур: от тетраэдрической для титана (например, TiCl 4 ) до плоскоквадратной для некоторых комплексов никеля и октаэдрической для координационных комплексов кобальта. Ряд переходных металлов можно найти в биологически важных соединениях, таких как железо в гемоглобине.
- Примеры: пентакарбонил железа , тетрахлорид титана , цисплатин.
Соединения основной группы [ править ]

Эти виды содержат элементы из групп I, II, III, IV, V, VI, VII, 0 (исключая водород) таблицы Менделеева. Из-за часто схожей реакционной способности элементы группы 3 ( Sc , Y и La ) и группы 12 ( Zn , Cd и Hg ) также обычно включаются, а лантаноиды и актиниды . иногда также включаются [10]
Соединения основной группы были известны с зарождения химии, например, элементарная сера и перегоняемый белый фосфор . с кислородом O 2 Эксперименты Лавуазье газ, но и открыли и Пристли не только выявили важный двухатомный путь для описания соединений и реакций в соответствии со стехиометрическими соотношениями. Открытие в начале 1900-х годов практического синтеза аммиака с использованием железных катализаторов Карлом Бошем и Фрицем Габером глубоко повлияло на человечество, продемонстрировав значение неорганического химического синтеза.Типичными соединениями основной группы являются SiO 2 , SnCl 4 и N 2 O. Многие соединения основной группы также можно классифицировать как «металлоорганические», поскольку они содержат органические группы, например, B( CH 3 ) 3 ). Соединения основной группы также встречаются в природе, например фосфаты в ДНК , и поэтому могут быть классифицированы как бионеорганические. И наоборот, органические соединения, лишенные (многих) водородных лигандов, можно классифицировать как «неорганические», такие как фуллерены, бакитрубки и бинарные оксиды углерода.
- Примеры: тетранитрид тетрасеры S 4 N 4 , диборан B 2 H 6 , силиконы , бакминстерфуллерен C 60 .
Соединения благородных газов включают несколько производных ксенона и криптона .
- Примеры: гексафторид ксенона XeF 6 , триоксид ксенона XeO 3 и дифторид криптона KrF 2 .
Металлоорганические соединения [ править ]

Обычно считается, что металлоорганические соединения содержат группу MCH. [11] Металл (М) в этих видах может быть либо элементом основной группы, либо переходным металлом. С практической точки зрения определение металлоорганического соединения является более мягким и включает также высоколипофильные комплексы , такие как карбонилы металлов и даже алкоксиды металлов .
Металлоорганические соединения в основном считаются особой категорией, поскольку органические лиганды часто чувствительны к гидролизу или окислению, что требует использования в металлоорганической химии более специализированных препаративных методов, чем это было традиционно в комплексах типа Вернера. Синтетическая методология, особенно способность манипулировать комплексами в растворителях с низкой координирующей способностью, позволила исследовать очень слабо координирующие лиганды, такие как углеводороды, H 2 и N 2 . Поскольку лиганды в некотором смысле являются нефтехимическими продуктами, область металлоорганической химии получила большую выгоду от ее актуальности для промышленности.
- Примеры: димер дикарбонила циклопентадиенилирона (C 5 H 5 )Fe(CO) 2 CH 3 , ферроцен Fe(C 5 H 5 ) 2 , гексакарбонил молибдена Mo(CO) 6 , триэтилборан Et 3 B, трис(дибензилиденацетон)дипалладий(0). Pd 2 (дБА) 3 )
Кластерные соединения [ править ]
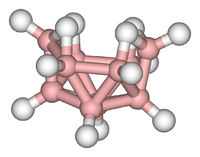

Кластеры можно найти во всех классах химических соединений . Согласно общепринятому определению, кластер состоит как минимум из треугольного набора атомов, непосредственно связанных друг с другом. Но диметаллические комплексы, связанные металл-металл, весьма актуальны для этой области. Кластеры встречаются в «чистых» неорганических системах, металлоорганической химии, химии основной группы и бионеорганической химии. Различие между очень большими кластерами и сыпучими твердыми веществами становится все более размытым. Этот интерфейс является химической основой нанонауки или нанотехнологий и, в частности, возникает в результате изучения квантово-размерных эффектов в селенида кадмия кластерах . Таким образом, большие кластеры можно описать как массив связанных атомов, промежуточных по характеру между молекулой и твердым телом.
- Примеры: Fe 3 (CO) 12 , B 10 H 14 , [Mo 6 Cl 14 ] 2− , 4Fe-4S
Бионеорганические соединения [ править ]

По определению, эти соединения встречаются в природе, но подполе включает антропогенные виды, такие как загрязнители (например, метилртуть ) и лекарства (например, цисплатин ). [12] Эта область, которая включает в себя многие аспекты биохимии, включает в себя множество видов соединений, например, фосфаты в ДНК, а также комплексы металлов, содержащие лиганды, которые варьируются от биологических макромолекул, обычно пептидов , до плохо определенных видов, таких как гуминовые кислоты , и вода (например, связанная с комплексами гадолиния , используемыми для МРТ ). Традиционно бионеорганическая химия фокусируется на переносе электронов и энергии в белках, связанных с дыханием. Медицинская неорганическая химия включает изучение как несущественных, так и незаменимых элементов с применением в диагностике и терапии.
- Примеры: гемоглобин , метилртуть , карбоксипептидаза.
Твердотельные соединения [ править ]
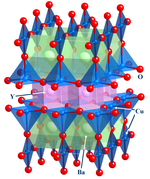
Эта важная область фокусируется на структуре , [13] связь и физические свойства материалов. На практике неорганическая химия твердого тела использует такие методы, как кристаллография, чтобы понять свойства, возникающие в результате коллективных взаимодействий между субъединицами твердого тела. В химию твердого тела входят металлы и их сплавы или интерметаллические производные. Смежными областями являются физика конденсированного состояния , минералогия и материаловедение .
- Примеры: кремниевая крошка , цеолиты , YBa 2 Cu 3 O 7.
Спектроскопия и магнетизм [ править ]
В отличие от большинства органических соединений , многие неорганические соединения обладают магнитными свойствами и/или окрашены. Эти свойства предоставляют информацию о связях и структуре. Магнетизм неорганических соединений может быть сложным. Например, большинство соединений меди (II) парамагнитны, но Cu II 2 (OAc) 4 (H 2 O) 2 при температуре ниже комнатной почти диамагнитен. Объяснение связано с магнитной связью между парами центров Cu(II) в ацетате.
теории Качественные

Неорганическая химия получила большую пользу от качественных теорий. Такие теории легче изучить, поскольку они не требуют особых знаний в квантовой теории. Что касается соединений основной группы, теория VSEPR убедительно предсказывает или, по крайней мере, рационализирует структуры соединений основной группы, например, объясняет, почему NH 3 имеет пирамидальную форму, тогда как ClF 3 имеет Т-образную форму. Что касается переходных металлов, теория кристаллического поля позволяет понять магнетизм многих простых комплексов, например, почему [Fe III (CN) 6 ] 3− имеет только один неспаренный электрон, тогда как [Fe III (Н 2 О) 6 ] 3+ имеет пять. Особенно мощный качественный подход к оценке структуры и реакционной способности начинается с классификации молекул в соответствии с подсчетом электронов , уделяя особое внимание количеству валентных электронов , обычно у центрального атома молекулы. [ нужна ссылка ]
Теория молекулярной групп симметрии
Понятием в химии является молекулярная симметрия , воплощенная в теории групп . Неорганические соединения обладают особенно разнообразной симметрией, поэтому логично, что теория групп тесно связана с неорганической химией. [14] Теория групп предоставляет язык для описания форм молекул в соответствии с симметрией их точечной группы . Теория групп также обеспечивает факторизацию и упрощение теоретических расчетов.
Спектроскопические особенности анализируются и описываются с учетом свойств симметрии, в частности , колебательных или электронных состояний. Знание свойств симметрии основного и возбужденного состояний позволяет прогнозировать количество и интенсивность поглощений в колебательных и электронных спектрах. Классическим применением теории групп является предсказание количества колебаний CO в карбонильных комплексах замещенных металлов. Наиболее распространенные применения симметрии в спектроскопии включают колебательные и электронные спектры.
Теория групп подчеркивает сходства и различия в связях совершенно разных видов. Например, орбитали на основе металлов трансформируются одинаково для WF 6 и W(CO) 6 , но энергии и населенности этих орбиталей существенно различаются. Аналогичная связь существует с CO 2 и молекулярным дифторидом бериллия .
Термодинамика и неорганическая химия [ править ]
Альтернативный количественный подход к неорганической химии фокусируется на энергиях реакций. Этот подход является весьма традиционным и эмпирическим , но он также полезен. Широкие понятия, выраженные в термодинамических терминах, включают окислительно-восстановительный потенциал , кислотность , фазовые изменения. Классической концепцией неорганической термодинамики является цикл Борна-Габера , который используется для оценки энергий элементарных процессов, таких как сродство к электрону , некоторые из которых невозможно наблюдать напрямую.
Механистическая неорганическая химия [ править ]
Важный аспект неорганической химии сосредоточен на путях реакций, то есть механизмах реакций .
Элементы основной группы и лантаноиды [ править ]
Механизмы действия соединений основной группы 13-18 обычно обсуждаются в контексте органической химии (в конце концов, органические соединения являются соединениями основной группы). Элементы тяжелее C, N, O и F часто образуют соединения с большим количеством электронов, чем предсказывает правило октета , как объяснено в статье о гипервалентных молекулах. По этой причине механизмы их реакций отличаются от органических соединений. Элементы легче углерода ( B , Be , Li ), а также Al и Mg часто образуют электронодефицитные структуры, электронно близкие к карбокатионам . Такие электронодефицитные виды склонны реагировать по ассоциативным путям. Химический состав лантаноидов отражает многие аспекты химии алюминия.
Комплексы переходных металлов [ править ]
Соединения переходных металлов и основной группы часто реагируют по-разному. [15] Важная роль d-орбиталей в связывании сильно влияет на пути и скорость замещения и диссоциации лигандов. Эти темы освещены в статьях по координационной химии и лигандам . Наблюдаются как ассоциативные, так и диссоциативные пути.
Главным аспектом механистической химии переходных металлов является кинетическая лабильность комплекса, иллюстрируемая обменом свободной и связанной воды в прототипных комплексах [M(H 2 O) 6 ] п+ :
- [М(Н 2 О) 6 ] п+ + 6 Н 2 О* → [М(Н 2 О*) 6 ] п+ + 6 Н 2 О
- где H 2 O* обозначает изотопно- обогащенную воду, например H 2 17 ТО
Скорость водообмена в периодической таблице варьируется на 20 порядков, при этом комплексы лантаноидов находятся на одном полюсе, а виды Ir (III) являются самыми медленными.
Окислительно-восстановительные реакции [ править ]
Для переходных элементов преобладают окислительно-восстановительные реакции. Рассмотрены два класса окислительно-восстановительных реакций: реакции переноса атома, такие как окислительное присоединение/восстановительное отщепление, и перенос электрона . Фундаментальной окислительно-восстановительной реакцией является «самообмен», который включает в себя вырожденную реакцию между окислителем и восстановителем. Например, перманганат и его одноэлектронно восстановленный относительный манганат обменивают один электрон:
- [МnО 4 ] − + [Mn*O 4 ] 2− → [MnO 4 ] 2− + [Mn*O 4 ] −
Реакции на лигандах [ править ]
Координированные лиганды проявляют реакционную способность, отличную от свободных лигандов. Например, кислотность аммиачных лигандов в [Co(NH 3 ) 6 ] 3+ повышен относительно самого NH 3 . Алкены, связанные с катионами металлов, реакционноспособны по отношению к нуклеофилам, тогда как алкены обычно этого не делают. Большая и промышленно важная область катализа зависит от способности металлов изменять реакционную способность органических лигандов. Гомогенный катализ происходит в растворе, а гетерогенный катализ происходит при взаимодействии газообразных или растворенных субстратов с поверхностями твердых тел. Традиционно гомогенный катализ считается частью металлоорганической химии, а гетерогенный катализ обсуждается в контексте науки о поверхности , раздела химии твердого тела. Но основные принципы неорганической химии одни и те же. Переходные металлы почти однозначно реагируют с небольшими молекулами, такими как CO, H 2 , O 2 и C 2 H 4 . Промышленное значение этого сырья стимулирует активную область катализа. Лиганды также могут подвергаться реакциям переноса лиганда, таким как трансметаллирование .
Характеристика неорганических соединений [ править ]
Из-за разнообразия набора элементов и соответственно разнообразных свойств образующихся производных неорганическая химия тесно связана со многими методами анализа. Старые методы, как правило, исследовали объемные свойства, такие как электропроводность растворов, точки плавления , растворимость и кислотность . С появлением квантовой теории и соответствующим расширением электронной аппаратуры появились новые инструменты для исследования электронных свойств неорганических молекул и твердых тел. Часто эти измерения дают понимание, имеющее отношение к теоретическим моделям. Часто встречающиеся методы:
- Рентгеновская кристаллография : этот метод позволяет определять молекулярные структуры в 3D .
- Различные формы спектроскопии :
- Ультрафиолетово-видимая спектроскопия : исторически это был важный инструмент, поскольку многие неорганические соединения сильно окрашены.
- ЯМР-спектроскопия : Кроме того 1 Рука 13 C многие другие ЯМР-активные ядра (например, 11 Б , 19 Ф , 31 П и 195 Pt ) может дать важную информацию о свойствах и структуре соединений. ЯМР парамагнитных частиц может предоставить важную структурную информацию. Протон ( 1 H ) ЯМР также важен, потому что легкое ядро водорода нелегко обнаружить с помощью рентгеновской кристаллографии.
- Инфракрасная спектроскопия : в основном для поглощения карбонильных лигандов.
- двойного электронного ядерного резонанса (ДЭДОР) Спектроскопия
- Мессбауэровская спектроскопия
- Электронно-спиновый резонанс : ЭПР (или ЭПР) позволяет измерять окружение парамагнитных металлических центров.
- Электрохимия : циклическая вольтамперометрия и связанные с ней методы исследуют окислительно-восстановительные характеристики соединений.
Синтетическая неорганическая химия [ править ]
Хотя некоторые неорганические соединения можно получить в чистом виде из природы, большинство из них синтезируются на химических заводах и в лабораториях.
Методы неорганического синтеза можно грубо классифицировать в зависимости от летучести или растворимости компонентов-реагентов. [16] Растворимые неорганические соединения получают методами органического синтеза . Для металлосодержащих соединений, реакционноспособных по отношению к воздуху, линии Шленка и перчаточного бокса применяются методы . Летучие соединения и газы обрабатываются в «вакуумных коллекторах», состоящих из стеклянных труб, соединенных между собой клапанами, весь объем которых можно откачивать до давления 0,001 мм рт. ст. или меньше. Соединения конденсируют с использованием жидкого азота (т. кип. 78 К) или других криогенов . Твердые вещества обычно готовят с использованием трубчатых печей, при этом реагенты и продукты герметизируют в контейнерах, часто изготовленных из плавленого кварца (аморфного SiO 2 ), но иногда и из более специализированных материалов, таких как сварные та-трубки или платиновые «лодочки». Продукты и реагенты транспортируются между температурными зонами для запуска реакций.
См. также [ править ]
Ссылки [ править ]
- ^ «Карьера в области химии: неорганическая химия» . Американское химическое общество. Архивировано из оригинала 29 октября 2012 г.
- ^ Бернс, ПК (1 декабря 2005 г.). «Минералы U6 + и неорганические соединения: понимание расширенной структурной иерархии кристаллических структур» . Канадский минералог . 43 (6): 1839–1894. Бибкод : 2005CaMin..43.1839B . дои : 10.2113/gscanmin.43.6.1839 . ISSN 0008-4476 .
- ^ Шайнберг И.; Самнер, Мэн; Миллер, В.П.; Фарина, MPW; Паван, Массачусетс; Фей, MV (1989), Лал, Ротанг; Стюарт, Б.А. (ред.), «Использование гипса в почвах: обзор» , Восстановление почвы , том. 17, Нью-Йорк, штат Нью-Йорк: Springer New York, стр. 1–111, doi : 10.1007/978-1-4612-3532-3_1 , ISBN. 978-1-4612-7684-5 , получено 21 августа 2022 г.
- ^ Хаайер, Сюзанна CM; Ламерс, Леон ПМ; Смолдерс, Альфонс Дж. П.; Джеттен, Майк С.М.; Оп-ден-Кэмп, Хууб Дж. М. (14 августа 2007 г.). «Сульфид железа и пирит как потенциальные доноры электронов для микробного восстановления нитратов в пресноводных водно-болотных угодьях» . Геомикробиологический журнал . 24 (5): 391–401. дои : 10.1080/01490450701436489 . hdl : 2066/34570 . ISSN 0149-0451 . S2CID 97227345 .
- ^ Дженсен, Уильям Б. (1978). «Определения кислотно-основного состояния Льюиса: отчет о состоянии» . Химические обзоры . 78 (1): 1–22. дои : 10.1021/cr60311a002 . ISSN 0009-2665 .
- ^ Го, Цзяньпин; Чен, Пин (2021). «История аммиака в процессе создания» . Природный катализ . 4 (9): 734–735. дои : 10.1038/s41929-021-00676-0 . ISSN 2520-1158 . S2CID 237588318 .
- ^ Ли, Дж.Дж. (2004), Смит, Барри Э.; Ричардс, Раймонд Л.; Ньютон, Уильям Э. (ред.), «Хабер-Бош и другие промышленные процессы» , Катализаторы азотфиксации , Дордрехт: Springer Нидерланды, стр. 33–54, номер документа : 10.1007/978-1-4020-3611-8_2 , ISBN 978-90-481-6675-6 , получено 21 августа 2022 г.
- ^ Витчи, Х. (1 мая 2000 г.). «Фриц Габер: 1868-1934» . Токсикологические науки . 55 (1): 1–2. дои : 10.1093/toxsci/55.1.1 . ПМИД 10788553 .
- ^ Лен, Дж. М. (1995). Супрамолекулярная химия: понятия и перспективы . Вайнхайм: ВЧ. ISBN 978-3-527-29311-7 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Эльшенбройх, К.; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH. ISBN 978-3-527-28164-0 .
- ^ С. Дж. Липпард; Дж. М. Берг (1994). Основы бионеорганической химии . Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 978-0-935702-73-6 .
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия . Оксфорд: Кларендон Пресс.
- ^ Коттон, ФА (1990). Химические приложения теории групп (3-е изд.). Нью-Йорк: Джон Уайли и сыновья. ISBN 978-0-471-51094-9 .
- ^ Р. Г. Уилкинс (1991). Кинетика и механизм реакций комплексов переходных металлов (2-е изд.). Вайли-ВЧ. ISBN 978-3-527-28389-7 .
- ^ Джиролами, Г.С.; Раухфус, ТБ; Анжеличи, Р.Дж. (1999). Синтез и техника в неорганической химии (3-е изд.). Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 978-0-935702-48-4 .