ДНК

| Часть серии о |
| Генетика |
|---|
 |
Дезоксирибонуклеиновая кислота ( / d iː ˈ ɒ k s ɪ ˌ r aɪ b oʊ nj uː ˌ k l iː ɪ k , - ˌ k l eɪ -/ ; [1] ДНК ) — полимер, состоящий из двух полинуклеотидных цепей, которые скручиваются друг вокруг друга, образуя двойную спираль . Полимер несет в себе генетические инструкции для развития, функционирования, роста и размножения всех известных организмов и многих вирусов . ДНК и рибонуклеиновая кислота (РНК) являются нуклеиновыми кислотами . Наряду с белками , липидами и сложными углеводами ( полисахаридами ) нуклеиновые кислоты являются одним из четырех основных типов макромолекул , необходимых для всех известных форм жизни .
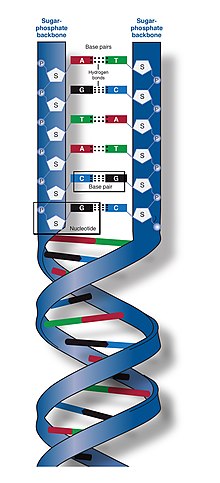
Две цепи ДНК известны как полинуклеотиды, поскольку они состоят из более простых мономерных единиц, называемых нуклеотидами . [2] [3] Каждый нуклеотид состоит из одного из четырех азотсодержащих азотистых оснований ( цитозин [C], гуанин [G], аденин [А] или тимин [Т]), сахара , называемого дезоксирибозой , и фосфатной группы . Нуклеотиды соединяются друг с другом в цепь ковалентными связями (известными как фосфодиэфирная связь ) между сахаром одного нуклеотида и фосфатом следующего, в результате чего образуется чередующийся сахарофосфатный остов . Азотистые основания двух отдельных цепей полинуклеотида соединяются вместе в соответствии с правилами спаривания оснований (А с Т и С с G) водородными связями , образуя двухцепочечную ДНК. Дополнительные азотистые основания делятся на две группы: однокольцевые пиримидины и двухкольцевые пурины . В ДНК пиримидинами являются тимин и цитозин; пурины – аденин и гуанин.
Обе цепи двухцепочечной ДНК хранят одну и ту же биологическую информацию . Эта информация реплицируется , когда две нити разделяются. Большая часть ДНК (более 98% у человека) некодирует , а это означает, что эти участки не служат образцом для белковых последовательностей . Две нити ДНК идут в противоположных направлениях друг к другу и, таким образом, антипараллельны . К каждому сахару прикреплен один из четырех типов нуклеиновых оснований (или оснований ). Именно последовательность этих четырех нуклеиновых оснований вдоль основной цепи кодирует генетическую информацию. Нити РНК создаются с использованием нитей ДНК в качестве матрицы в процессе, называемом транскрипцией , при котором основания ДНК заменяются соответствующими основаниями, за исключением тимина (Т), в котором РНК заменяет урацил (U). [4] В соответствии с генетическим кодом эти нити РНК определяют последовательность аминокислот в белках в процессе, называемом трансляцией .
Внутри эукариотических клеток ДНК организована в длинные структуры, называемые хромосомами . Перед типичным делением клетки эти хромосомы дублируются в процессе репликации ДНК, обеспечивая полный набор хромосом для каждой дочерней клетки. Эукариотические организмы ( животные , растения , грибы и протисты ) хранят большую часть своей ДНК внутри ядра клетки в виде ядерной ДНК , а часть — в митохондриях в виде митохондриальной ДНК или в хлоропластах в виде хлоропластной ДНК . [5] Напротив, прокариоты ( бактерии и археи ) хранят свою ДНК только в цитоплазме , в кольцевых хромосомах . Внутри эукариотических хромосом белки хроматина , такие как гистоны , уплотняют и организуют ДНК. Эти уплотняющие структуры управляют взаимодействием между ДНК и другими белками, помогая контролировать, какие части ДНК транскрибируются.
Характеристики

ДНК представляет собой длинный полимер , состоящий из повторяющихся единиц, называемых нуклеотидами . [6] [7] Структура ДНК динамична по всей длине и способна скручиваться в плотные петли и принимать другие формы. [8] У всех видов он состоит из двух спиральных цепочек, связанных друг с другом водородными связями . Обе цепочки намотаны вокруг одной оси и имеют одинаковый шаг 34 ангстрема (3,4 нм ). Пара цепей имеет радиус 10 Å (1,0 нм). [9] Согласно другому исследованию, при измерении в другом растворе ширина цепи ДНК составляла 22–26 Å (2,2–2,6 нм), а длина одной нуклеотидной единицы - 3,3 Å (0,33 нм). [10] Плавучая плотность большинства ДНК составляет 1,7 г/см. 3 . [11]
ДНК обычно существует не в виде одной цепи, а в виде пары нитей, плотно скрепленных вместе. [9] [12] Эти две длинные нити скручиваются друг вокруг друга в форме двойной спирали . Нуклеотид содержит как сегмент основной цепи молекулы (который удерживает цепь вместе), так и азотистое основание (которое взаимодействует с другой цепью ДНК в спирали). Нуклеиновое основание, связанное с сахаром, называется нуклеозидом , а основание, связанное с сахаром и одной или несколькими фосфатными группами, называется нуклеотидом . Биополимер , содержащий несколько связанных нуклеотидов (как в ДНК), называется полинуклеотидом . [13]
Основа цепи ДНК состоит из чередующихся фосфатных и сахарных групп. [14] Сахаром в ДНК является 2-дезоксирибоза , которая представляет собой пентозный ( пятиуглеродный ) сахар. Сахара соединены фосфатными группами, которые образуют фосфодиэфирные связи между третьим и пятым атомами углерода соседних сахарных колец. Они известны как атомы углерода на 3'-конце (три простых конца) и 5'-конце (пять простых концов), причем штриховой символ используется для отличия этих атомов углерода от атомов основания, с которым дезоксирибоза образует гликозидную связь. . [12]
Следовательно, любая цепь ДНК обычно имеет один конец, на котором имеется фосфатная группа, присоединенная к 5'-углероду рибозы (5'-фосфорил), и другой конец, на котором имеется свободная гидроксильная группа, присоединенная к 3'-углероду рибозы. рибоза (3'-гидроксил). Ориентация 3'- и 5'-углеродов вдоль сахарофосфатного остова придает направленность (иногда называемую полярностью) каждой цепи ДНК. В двойной спирали нуклеиновой кислоты направление нуклеотидов в одной цепи противоположно их направлению в другой цепи: нити антипараллельны . Говорят, что асимметричные концы нитей ДНК имеют направленность из пяти простых концов (5') и трех простых концов (3'), причем 5'-конец имеет концевую фосфатную группу, а 3'-конец - концевую гидроксильную группу. Одним из основных различий между ДНК и РНК является сахар: 2-дезоксирибоза в ДНК заменена родственным пентозным сахаром рибозой в РНК. [12]
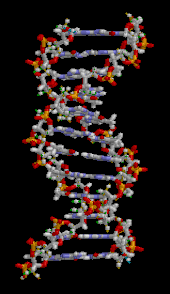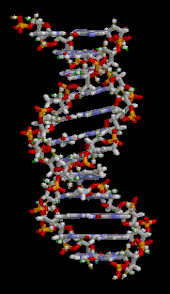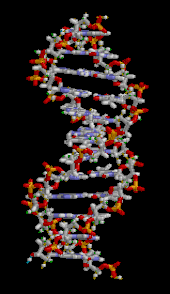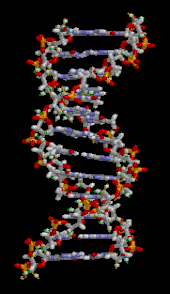
Двойная спираль ДНК стабилизируется в первую очередь двумя силами: водородными связями между нуклеотидами и укладки оснований взаимодействиями между ароматическими азотистыми основаниями. [16] Четыре основания, обнаруженные в ДНК, представляют собой аденин ( А ), цитозин ( С ), гуанин ( G ) и тимин ( Т ). Эти четыре основания присоединяются к сахарофосфату, образуя полный нуклеотид, как показано для аденозинмонофосфата . Пары аденина с тимином и пары гуанина с цитозином, образуя АТ и GC- пары оснований . [17] [18]
Классификация азотистых оснований
Нуклеиновые основания делятся на два типа: пурины , А и G , представляющие собой конденсированные пяти- и шестичленные гетероциклические соединения , и пиримидины , шестичленные кольца. С и Т. [12] Пятое пиримидиновое азотистое основание, урацил ( U ), обычно заменяет тимин в РНК и отличается от тимина отсутствием метильной группы в кольце. Помимо РНК и ДНК, множество искусственных аналогов нуклеиновых кислот для изучения свойств нуклеиновых кислот или для использования в биотехнологии. создано [19]
Неканонические базы
Модифицированные основания встречаются в ДНК. Первым из них был признан 5-метилцитозин , который был обнаружен в геноме микобактерии туберкулеза в 1925 году. [20] Причина присутствия этих неканонических оснований в бактериальных вирусах ( бактериофагах ) заключается в том, чтобы избежать присутствия ферментов рестрикции, присутствующих в бактериях. Эта ферментная система действует, по крайней мере частично, как молекулярная иммунная система, защищающая бактерии от заражения вирусами. [21] Модификации оснований цитозина и аденина, наиболее распространенных и модифицированных оснований ДНК, играют жизненно важную роль в эпигенетическом контроле экспрессии генов у растений и животных. [22]
Известно, что в ДНК встречается ряд неканонических оснований. [23] Большинство из них представляют собой модификации канонических оснований плюс урацил.
- Модифицированный аденин
- N6-карбамоилметиладенин
- N6-метиаденин
- Модифицированный гуанин
- 7-деазагуанины
- 7-метилгуанин
- Модифицированный цитозин
- N4-Метилцитозин
- 5-карбоксилцитозин
- 5-формилцитозин
- 5-гликозилгидроксиметилцитозин
- 5-гидроксицитозин
- 5-метилцитозин
- Модифицированный тимидин
- α-глутамитимидин
- α-путресцинилтимин
- Урацил и модификации
- База J
- Урацил
- 5-дигидроксипентаурацил
- 5-гидроксиметилдезоксиурацил
- Другие
- Деоксиархеозин
- 2,6-Диаминопурин (2-аминоаденин)
Канавки

Двойные спиральные нити образуют основу ДНК. Еще одну двойную спираль можно обнаружить в промежутках или бороздках между нитями. Эти пустоты примыкают к парам оснований и могут обеспечивать место связывания . Поскольку пряди расположены несимметрично друг относительно друга, канавки имеют неодинаковый размер. Ширина основной бороздки составляет 22 ангстрема (2,2 нм), а ширина малой бороздки — 12 Å (1,2 нм). [24] Из-за большей ширины основной канавки кромки оснований более доступны в основной канавке, чем в малой. В результате белки, такие как факторы транскрипции , которые могут связываться со специфическими последовательностями двухцепочечной ДНК, обычно вступают в контакт со сторонами оснований, выступающими в большой бороздке. [25] Эта ситуация варьируется в зависимости от необычных конформаций ДНК внутри клетки (см. ниже) , но названия больших и малых борозд всегда отражают различия в ширине, которые можно было бы увидеть, если бы ДНК была скручена обратно в обычную форму B.
Базовое соединение
 |
 |
В двойной спирали ДНК каждый тип нуклеиновых оснований на одной цепи связан только с одним типом нуклеиновых оснований на другой цепи. Это называется комплементарным спариванием оснований . Пурины образуют водородные связи с пиримидинами, при этом аденин связывается только с тимином двумя водородными связями, а цитозин - только с гуанином тремя водородными связями. Такое расположение двух нуклеотидов, связывающихся вместе поперек двойной спирали (от шестиуглеродного кольца к шестиуглеродному кольцу), называется парой оснований Уотсона-Крика. ДНК с высоким содержанием GC более стабильна, чем ДНК с низким содержанием GC -контент. Пара оснований Хугстина (водородная связь между 6-углеродным кольцом и 5-углеродным кольцом) представляет собой редкий вариант спаривания оснований. [26] Поскольку водородные связи не являются ковалентными , их можно относительно легко разорвать и воссоединить. Таким образом, две нити ДНК в двойной спирали можно разорвать, как молнию, под действием механической силы или высокой температуры . [27] В результате комплементарности пар оснований вся информация в двухцепочечной последовательности спирали ДНК дублируется на каждой нити, что жизненно важно для репликации ДНК. Это обратимое и специфическое взаимодействие между комплементарными парами оснований имеет решающее значение для всех функций ДНК в организмах. [7]
оцДНК против дцДНК
Большинство молекул ДНК на самом деле представляют собой две полимерные цепи, связанные вместе спирально нековалентными связями; эта двухцепочечная структура (дцДНК) поддерживается в основном за счет взаимодействий внутрицепочечной укладки оснований, которые наиболее сильны для G, C складываются. Две нити могут расходиться — процесс, известный как плавление, — с образованием двух одноцепочечных молекул ДНК (оцДНК). Плавление происходит при высоких температурах, низком уровне соли и высоком pH (низкий pH также плавит ДНК, но поскольку ДНК нестабильна из-за кислотного депуринирования, низкий pH используется редко).
Стабильность формы дцДНК зависит не только от GC -содержание (% пары оснований G, C ), но также и по последовательности (поскольку укладка зависит от последовательности), а также по длине (более длинные молекулы более стабильны). Стабильность можно измерить различными способами; распространенным способом является температура плавления (также называемая значением T m ), которая представляет собой температуру, при которой 50% двухцепочечных молекул превращаются в одноцепочечные молекулы; температура плавления зависит от ионной силы и концентрации ДНК. В результате это и процент Пары оснований GC и общая длина двойной спирали ДНК, которая определяет силу связи между двумя цепями ДНК. Длинные спирали ДНК с высокой GC -содержащие цепи имеют более прочно взаимодействующие цепи, тогда как короткие спирали с высокой Содержание АТ имеет более слабо взаимодействующие нити. [28] В биологии части двойной спирали ДНК, которые необходимо легко разделить, например Коробка TATAAT Pribnow у некоторых промоутеров , как правило, имеет высокий уровень Содержание АТ , благодаря чему пряди легче расчесывать. [29]
В лаборатории силу этого взаимодействия можно измерить, найдя температуру плавления Tm , необходимую для разрыва половины водородных связей. Когда все пары оснований двойной спирали ДНК плавятся, нити разделяются и существуют в растворе как две совершенно независимые молекулы. Эти одноцепочечные молекулы ДНК не имеют единой общей формы, но некоторые конформации более стабильны, чем другие. [30]
Количество

У человека общий женский диплоидный ядерный геном на клетку простирается на 6,37 пар гигабаз (Гбп), имеет длину 208,23 см и вес 6,51 пикограмма (пг). [31] Мужские значения: 6,27 Гб, 205,00 см, 6,41 стр. [31] Каждый полимер ДНК может содержать сотни миллионов нуклеотидов, например, в хромосоме 1 . Хромосома 1 — самая крупная хромосома человека, насчитывающая примерно 220 миллионов пар оснований , и в выпрямленном виде ее длина составляла бы 85 мм . [32]
У эукариот , помимо ядерной ДНК , имеется еще митохондриальная ДНК (мтДНК), которая кодирует определенные белки, используемые митохондриями. МтДНК обычно относительно мала по сравнению с ядерной ДНК. Например, митохондриальная ДНК человека образует замкнутые кольцевые молекулы, каждая из которых содержит 16 569 [33] [34] пары оснований ДНК, [35] при этом каждая такая молекула обычно содержит полный набор митохондриальных генов. Каждая митохондрия человека содержит в среднем около 5 таких молекул мтДНК. [35] Каждая клетка человека содержит около 100 митохондрий, что дает общее количество молекул мтДНК на клетку человека около 500. [35] Однако количество митохондрий на клетку также варьируется в зависимости от типа клеток: яйцеклетка может содержать 100 000 митохондрий, что соответствует до 1 500 000 копий митохондриального генома (составляющего до 90% ДНК клетки). [36]
Смысл и антисмысл
Последовательность ДНК называется «смысловой» последовательностью, если она совпадает с копией информационной РНК , которая транслируется в белок. [37] Последовательность на противоположной цепи называется «антисмысловой» последовательностью. Как смысловые, так и антисмысловые последовательности могут существовать в разных частях одной и той же цепи ДНК (т.е. обе цепи могут содержать как смысловые, так и антисмысловые последовательности). Как у прокариот, так и у эукариотов образуются антисмысловые последовательности РНК, однако функции этих РНК не совсем ясны. [38] Одно из предположений состоит в том, что антисмысловые РНК участвуют в регуляции экспрессии генов посредством спаривания оснований РНК-РНК. [39]
Некоторые последовательности ДНК у прокариот и эукариот, а также в плазмидах и вирусах стирают различие между смысловыми и антисмысловыми цепями из-за наличия перекрывающихся генов . [40] В этих случаях некоторые последовательности ДНК выполняют двойную функцию: кодируют один белок при чтении по одной цепи и второй белок при чтении в противоположном направлении по другой цепи. У бактерий это перекрытие может участвовать в регуляции транскрипции генов. [41] в то время как у вирусов перекрывающиеся гены увеличивают объем информации, которая может быть закодирована в небольшом вирусном геноме. [42]
Суперспирализация
ДНК можно скручивать, как веревку, в процессе, называемом суперспирализацией ДНК . Когда ДНК находится в «расслабленном» состоянии, нить обычно обходит ось двойной спирали каждые 10,4 пары оснований, но если ДНК скручена, нити становятся более тугими или более свободными. [43] Если ДНК скручена в направлении спирали, это положительная сверхспирализация, и основания более плотно скрепляются друг с другом. Если их скрутить в противоположную сторону, это отрицательная сверхспирализация, и основания легче распадаются. В природе большая часть ДНК имеет небольшую отрицательную сверхспирализацию, вызываемую ферментами, называемыми топоизомеразами . [44] Эти ферменты также необходимы для снятия скручивающих напряжений, возникающих в цепях ДНК во время таких процессов, как транскрипция и репликация ДНК . [45]
Альтернативные структуры ДНК

ДНК существует во многих возможных конформациях , включая формы A-ДНК , B-ДНК и Z-ДНК , хотя непосредственно в функциональных организмах наблюдались только B-ДНК и Z-ДНК. [14] Конформация, которую принимает ДНК, зависит от уровня гидратации, последовательности ДНК, величины и направления сверхспирализации, химических модификаций оснований, типа и концентрации ионов металлов , а также присутствия полиаминов в растворе. [46]
В первых опубликованных отчетах о рентгенограммах A-ДНК , а также B-ДНК, использовался анализ, основанный на функциях Паттерсона , который предоставил лишь ограниченное количество структурной информации для ориентированных волокон ДНК. [47] [48] Альтернативный анализ был предложен Wilkins et al. в 1953 году для получения картин дифракционного рассеяния рентгеновских лучей B-ДНК in vivo высокогидратированных волокон ДНК в виде квадратов функций Бесселя . [49] В том же журнале Джеймс Уотсон и Фрэнсис Крик представили свой анализ молекулярного моделирования рентгенограмм ДНК, предполагающий, что структура представляет собой двойную спираль. [9]
Хотя форма B-ДНК наиболее распространена в условиях, встречающихся в клетках, [50] это не четко определенная конформация, а семейство родственных конформаций ДНК. [51] которые происходят при высоком уровне гидратации, присутствующем в клетках. Соответствующие им рентгенограммы и картины рассеяния характерны для молекулярных паракристаллов со значительной степенью беспорядка. [52] [53]
По сравнению с B-ДНК, форма A-ДНК представляет собой более широкую правостороннюю спираль с неглубокой широкой малой бороздкой и более узкой и глубокой большой бороздкой. Форма А встречается в нефизиологических условиях в частично обезвоженных образцах ДНК, а в клетке может образовываться в гибридных парах цепей ДНК и РНК, а также в комплексах фермент-ДНК. [54] [55] Сегменты ДНК, в которых основания были химически модифицированы путем метилирования, могут претерпеть большее изменение конформации и принять Z-форму . Здесь нити поворачиваются вокруг винтовой оси по левой спирали, что противоположно более распространенной форме B. [56] Эти необычные структуры могут распознаваться специфическими белками, связывающими Z-ДНК, и могут участвовать в регуляции транскрипции. [57]
Альтернативная химия ДНК
В течение многих лет экзобиологи предполагали существование теневой биосферы , постулируемой микробной биосферы Земли, которая использует радикально другие биохимические и молекулярные процессы, чем известная в настоящее время жизнь. Одним из предложений было существование форм жизни, использующих в ДНК мышьяк вместо фосфора . В 2010 году было объявлено о возможности существования бактерии GFAJ-1 . [58] [59] хотя исследование было оспорено, [59] [60] и данные свидетельствуют о том, что бактерия активно предотвращает включение мышьяка в основу ДНК и другие биомолекулы. [61]
Квадруплексные конструкции

На концах линейных хромосом расположены специализированные участки ДНК, называемые теломерами . Основная функция этих областей — позволить клетке реплицировать концы хромосом с помощью фермента теломеразы , поскольку ферменты, которые обычно реплицируют ДНК, не могут копировать крайние 3'-концы хромосом. [63] Эти специализированные хромосомные колпачки также помогают защитить концы ДНК и не позволяют системам репарации ДНК в клетке рассматривать их как повреждение, которое необходимо исправить. [64] В клетках человека теломеры обычно представляют собой отрезки одноцепочечной ДНК, содержащие несколько тысяч повторов простой последовательности TTAGGG. [65]
Эти богатые гуанином последовательности могут стабилизировать концы хромосом, образуя структуры из сложенных друг на друга наборов из четырех оснований, а не обычных пар оснований, обнаруженных в других молекулах ДНК. Здесь четыре гуаниновых основания, известные как гуаниновая тетрада , образуют плоскую пластинку. Эти плоские четырехосновные единицы затем складываются друг на друга, образуя стабильную структуру G-квадруплекса . [66] Эти структуры стабилизируются за счет водородных связей между краями оснований и хелатирования иона металла в центре каждой четырехосновной единицы. [67] Могут быть также сформированы другие структуры, при этом центральный набор из четырех оснований происходит либо из одной цепи, сложенной вокруг оснований, либо из нескольких различных параллельных цепей, каждая из которых вносит одно основание в центральную структуру.
В дополнение к этим сложенным структурам теломеры также образуют большие петлевые структуры, называемые теломерными петлями или Т-петлями. Здесь одноцепочечная ДНК закручивается в длинный круг, стабилизированный белками, связывающими теломеры. [68] В самом конце Т-петли одноцепочечная теломерная ДНК удерживается на участке двухцепочечной ДНК за счет того, что цепь теломер разрушает двухспиральную ДНК и спаривает основания с одной из двух цепей. Эта трехцепочечная структура называется петлей смещения или D-петлей . [66]
 |  |
| Отдельная ветка | Несколько филиалов |
Разветвленная ДНК
В ДНК изнашивание происходит, когда некомплементарные области существуют на конце комплементарной в остальном двухцепочечной ДНК. Однако разветвленная ДНК может возникнуть, если введена третья цепь ДНК, которая содержит прилегающие области, способные гибридизоваться с потертыми областями ранее существовавшей двухцепочечной ДНК. Хотя простейший пример разветвленной ДНК включает только три цепи ДНК, возможны также комплексы, включающие дополнительные цепи и несколько ветвей. [69] Разветвленная ДНК может использоваться в нанотехнологиях для создания геометрических фигур, см. раздел об использовании в технологиях ниже.
Искусственные основы
Было синтезировано несколько искусственных нуклеиновых оснований, которые успешно включены в аналог ДНК из восьми оснований, названный ДНК Хатимодзи . Эти искусственные основания, получившие название S, B, P и Z, способны связываться друг с другом предсказуемым образом (S-B и P-Z), поддерживать структуру двойной спирали ДНК и транскрибироваться в РНК. Их существование можно рассматривать как указание на то, что в четырех природных азотистых основаниях, возникших на Земле, нет ничего особенного. [70] [71] С другой стороны, ДНК тесно связана с РНК , которая не только действует как транскрипт ДНК, но и выполняет множество задач в клетках как молекулярные машины. Для этого его необходимо сложить в конструкцию. Было показано, что для создания всех возможных структур необходимо как минимум четыре основания для соответствующей РНК . [72] хотя возможно и большее число, но это противоречило бы естественному принципу наименьших усилий .
Кислотность
Фосфатные группы ДНК придают ей кислотные свойства, подобные фосфорной кислоте , и ее можно рассматривать как сильную кислоту . При нормальном клеточном pH он будет полностью ионизирован, высвобождая протоны , которые оставляют отрицательные заряды на фосфатных группах. Эти отрицательные заряды защищают ДНК от разрушения в результате гидролиза , отталкивая нуклеофилы , которые могут ее гидролизовать. [73]
Макроскопический вид

Чистая ДНК, извлеченная из клеток, образует белые тягучие комки. [74]
Химические модификации и измененная упаковка ДНК
 |  |  |
| цитозин | 5-метилцитозин | тимин |
Базовые модификации и упаковка ДНК
На экспрессию генов влияет то, как ДНК упакована в хромосомах, в структуре, называемой хроматином . Модификации оснований могут быть вовлечены в упаковку: области, которые имеют низкую экспрессию генов или вообще не экспрессируют ее, обычно содержат высокие уровни цитозиновых оснований метилирования . Упаковка ДНК и ее влияние на экспрессию генов могут также происходить за счет ковалентных модификаций ядра гистонового белка, вокруг которого ДНК обернута в структуре хроматина, или же за счет ремоделирования, осуществляемого комплексами ремоделирования хроматина (см. Ремоделирование хроматина ). Кроме того, между метилированием ДНК и модификацией гистонов существуют перекрестные помехи , поэтому они могут координировано влиять на хроматин и экспрессию генов. [75]
Например, метилирование цитозина приводит к образованию 5-метилцитозина , который важен для Х-инактивации хромосом. [76] Средний уровень метилирования варьируется между организмами: у червя Caenorhabditis elegans метилирование цитозина отсутствует, тогда как у позвоночных уровень метилирования выше: до 1% их ДНК содержит 5-метилцитозин. [77] Несмотря на важность 5-метилцитозина, он может дезаминироваться с образованием тиминового основания, поэтому метилированные цитозины особенно склонны к мутациям . [78] Другие модификации оснований включают метилирование аденина у бактерий, присутствие 5-гидроксиметилцитозина в мозге , [79] и гликозилирование урацила с образованием «J-основания» в кинетопластидах . [80] [81]
Повреждать

ДНК может быть повреждена многими видами мутагенов , которые изменяют последовательность ДНК . Мутагены включают окислители , алкилирующие агенты , а также высокоэнергетическое электромагнитное излучение, такое как ультрафиолетовое излучение и рентгеновские лучи . Тип повреждения ДНК зависит от типа мутагена. Например, ультрафиолетовый свет может повредить ДНК, образуя димеры тимина , которые представляют собой поперечные связи между пиримидиновыми основаниями. [83] С другой стороны, окислители, такие как свободные радикалы или перекись водорода, вызывают многочисленные формы повреждений, включая модификации оснований, особенно гуанозина, и двухцепочечные разрывы. [84] Типичная человеческая клетка содержит около 150 000 оснований, подвергшихся окислительному повреждению. [85] Из этих окислительных повреждений наиболее опасными являются двухцепочечные разрывы, поскольку их трудно восстановить и они могут вызывать точечные мутации , вставки , делеции последовательности ДНК и хромосомные транслокации . [86] Эти мутации могут вызвать рак . Из-за присущих механизмам восстановления ДНК ограничений, если бы люди жили достаточно долго, у всех них в конечном итоге развился бы рак. [87] [88] Повреждения ДНК, возникающие естественным образом из-за нормальных клеточных процессов, которые производят активные формы кислорода, гидролитической активности клеточной воды и т. д., также часто происходят. Хотя большинство этих повреждений восстанавливаются, в любой клетке могут оставаться некоторые повреждения ДНК, несмотря на действие процессов репарации. Эти оставшиеся повреждения ДНК накапливаются с возрастом в постмитотических тканях млекопитающих. Это накопление, по-видимому, является важной основной причиной старения. [89] [90] [91]
Многие мутагены помещаются в пространство между двумя соседними парами оснований, это называется интеркаляцией . Большинство интеркаляторов представляют собой ароматические и плоские молекулы; примеры включают бромид этидия , акридины , дауномицин и доксорубицин . Чтобы интеркалятор мог разместиться между парами оснований, основания должны разделиться, искажая цепи ДНК за счет раскручивания двойной спирали. Это ингибирует как транскрипцию, так и репликацию ДНК, вызывая токсичность и мутации. [92] В результате интеркаляторы ДНК могут оказаться канцерогенами , а в случае талидомида — тератогеном . [93] Другие, такие как бензо[ а эпоксид ]пирендиола и афлатоксин, образуют аддукты ДНК, вызывающие ошибки репликации. [94] Тем не менее, из-за их способности ингибировать транскрипцию и репликацию ДНК, другие подобные токсины также используются в химиотерапии для подавления быстрорастущих раковых клеток. [95]
Биологические функции

ДНК обычно встречается в виде линейных хромосом у эукариот и кольцевых хромосом у прокариот . Набор хромосом в клетке составляет ее геном ; Геном человека содержит около 3 миллиардов пар оснований ДНК, организованных в 46 хромосом. [96] Информация, которую несет ДНК, хранится в последовательности участков ДНК, называемых генами . Передача генетической информации в генах достигается за счет комплементарного спаривания оснований. Например, при транскрипции, когда клетка использует информацию, содержащуюся в гене, последовательность ДНК копируется в комплементарную последовательность РНК за счет притяжения между ДНК и правильными нуклеотидами РНК. Обычно эта копия РНК затем используется для создания соответствующей белковой последовательности в процессе, называемом трансляцией , который зависит от того же взаимодействия между нуклеотидами РНК. Альтернативным способом клетка может копировать свою генетическую информацию в процессе, называемом репликацией ДНК . Подробности этих функций описаны в других статьях; здесь основное внимание уделяется взаимодействиям между ДНК и другими молекулами, которые опосредуют функцию генома.
Гены и геномы
Геномная ДНК плотно и упорядоченно упаковывается в процессе, называемом конденсацией ДНК , чтобы соответствовать небольшим доступным объемам клетки. У эукариот ДНК расположена в ядре клетки , небольшое количество — в митохондриях и хлоропластах . У прокариот ДНК содержится в теле неправильной формы в цитоплазме, называемом нуклеоидом . [97] Генетическая информация в геноме хранится в генах, а полный набор этой информации в организме называется его генотипом . Ген — это единица наследственности и участок ДНК, влияющий на определенную характеристику организма. Гены содержат открытую рамку считывания , которую можно транскрибировать, а также регуляторные последовательности, такие как промоторы и энхансеры , которые контролируют транскрипцию открытой рамки считывания.
У многих видов только небольшая часть общей последовательности генома кодирует белок. Например, только около 1,5% генома человека состоит из экзонов , кодирующих белок , а более 50% ДНК человека состоит из некодирующих повторяющихся последовательностей . [98] Причины присутствия такого большого количества некодирующей ДНК в геномах эукариот и необычайные различия в размере генома или значении C среди видов представляют собой давнюю загадку, известную как « загадка значения C ». [99] Однако некоторые последовательности ДНК, которые не кодируют белок, все же могут кодировать функциональные некодирующие молекулы РНК, которые участвуют в регуляции экспрессии генов . [100]

Некоторые некодирующие последовательности ДНК играют структурную роль в хромосомах. Теломеры и центромеры обычно содержат мало генов, но важны для функционирования и стабильности хромосом. [64] [102] Распространенной формой некодирующей ДНК у людей являются псевдогены , которые представляют собой копии генов, отключенных в результате мутации. [103] Эти последовательности обычно представляют собой просто молекулярные окаменелости , хотя иногда они могут служить сырым генетическим материалом для создания новых генов посредством процесса дупликации и дивергенции генов . [104]
Транскрипция и перевод
Ген — это последовательность ДНК, которая содержит генетическую информацию и может влиять на фенотип организма. Внутри гена последовательность оснований на цепи ДНК определяет последовательность информационной РНК , которая затем определяет одну или несколько белковых последовательностей. Взаимосвязь между нуклеотидными последовательностями генов и аминокислотными последовательностями белков определяется правилами трансляции , известными под общим названием генетический код . Генетический код состоит из трехбуквенных «слов», называемых кодонами, образованных из последовательности трех нуклеотидов (например, ACT, CAG, TTT).
При транскрипции кодоны гена копируются в информационную РНК с помощью РНК-полимеразы . Эта копия РНК затем декодируется рибосомой , которая считывает последовательность РНК путем спаривания оснований информационной РНК с транспортной РНК , несущей аминокислоты. Поскольку в трехбуквенных комбинациях 4 основания, то возможных кодонов 64 (4 3 комбинации). Они кодируют двадцать стандартных аминокислот , что дает большинству аминокислот более одного возможного кодона. Есть также три «стоповых» или «бессмысленных» кодона, обозначающих конец кодирующей области; это кодоны TAG, TAA и TGA (UAG, UAA и UGA на мРНК).
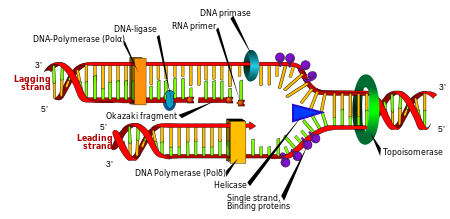
Репликация
Деление клеток необходимо для роста организма, но когда клетка делится, она должна реплицировать ДНК в своем геноме, чтобы две дочерние клетки имели ту же генетическую информацию, что и их родительская клетка. Двухцепочечная структура ДНК обеспечивает простой механизм репликации ДНК . Здесь две цепи разделяются, а затем комплементарная последовательность ДНК каждой цепи воссоздается с помощью фермента, называемого ДНК-полимеразой . Этот фермент создает комплементарную цепь, находя правильное основание посредством комплементарной пары оснований и связывая его с исходной цепью. Поскольку ДНК-полимеразы могут удлинять цепь ДНК только в направлении от 5' к 3', для копирования антипараллельных цепей двойной спирали используются разные механизмы. [105] Таким образом, основание старой цепи определяет, какое основание появится в новой цепи, и в результате клетка получает точную копию своей ДНК.
Внеклеточные нуклеиновые кислоты
Голая внеклеточная ДНК (эДНК), большая часть которой высвобождается в результате гибели клеток, практически повсеместно встречается в окружающей среде. Его концентрация в почве может достигать 2 мкг/л, а в естественных водных средах - до 88 мкг/л. [106] Для эДНК были предложены различные возможные функции: она может участвовать в горизонтальном переносе генов ; [107] он может обеспечивать питательные вещества; [108] и он может действовать как буфер для рекрутирования или титрования ионов или антибиотиков. [109] Внеклеточная ДНК действует как функциональный компонент внеклеточного матрикса в биопленках нескольких видов бактерий. Он может действовать как фактор узнавания, регулируя прикрепление и распространение определенных типов клеток в биопленке; [110] это может способствовать образованию биопленок; [111] и это может способствовать повышению физической силы биопленки и устойчивости к биологическому стрессу. [112]
Бесклеточная ДНК плода находится в крови матери и может быть секвенирована для получения большого количества информации о развивающемся плоде. [113]
Под названием ДНК окружающей среды эДНК получила все более широкое применение в естественных науках в качестве инструмента исследования экологии , мониторинга перемещения и присутствия видов в воде, воздухе или на суше, а также оценки биоразнообразия территории. [114] [115]
Нейтрофильные внеклеточные ловушки
Внеклеточные ловушки нейтрофилов (NET) представляют собой сети внеклеточных волокон, в основном состоящих из ДНК, которые позволяют нейтрофилам (типу лейкоцитов) убивать внеклеточные патогены, сводя к минимуму повреждение клеток-хозяев.
Взаимодействие с белками
Все функции ДНК зависят от взаимодействия с белками. Эти белковые взаимодействия могут быть неспецифичными, или белок может специфически связываться с одной последовательностью ДНК. Ферменты также могут связываться с ДНК, и из них особенно важны полимеразы, которые копируют последовательность оснований ДНК при транскрипции и репликации ДНК.
ДНК-связывающие белки

Структурные белки, связывающие ДНК, являются хорошо изученными примерами неспецифических взаимодействий ДНК-белок. Внутри хромосом ДНК содержится в комплексах со структурными белками. Эти белки организуют ДНК в компактную структуру, называемую хроматином . У эукариот эта структура включает связывание ДНК с комплексом небольших основных белков, называемых гистонами , тогда как у прокариот задействованы несколько типов белков. [116] [117] Гистоны образуют дискообразный комплекс, называемый нуклеосомой , который содержит два полных витка двухцепочечной ДНК, обернутых вокруг его поверхности. Эти неспецифические взаимодействия формируются посредством основных остатков в гистонах, образующих ионные связи с кислым сахарофосфатным остовом ДНК, и, таким образом, в значительной степени независимы от последовательности оснований. [118] Химические модификации этих основных аминокислотных остатков включают метилирование , фосфорилирование и ацетилирование . [119] Эти химические изменения изменяют силу взаимодействия между ДНК и гистонами, делая ДНК более или менее доступной для факторов транскрипции и изменяя скорость транскрипции. [120] Другие неспецифические ДНК-связывающие белки в хроматине включают белки группы с высокой подвижностью, которые связываются с изогнутой или искаженной ДНК. [121] Эти белки играют важную роль в изгибании массивов нуклеосом и их организации в более крупные структуры, из которых состоят хромосомы. [122]
Отдельной группой ДНК-связывающих белков являются ДНК-связывающие белки, которые специфически связывают одноцепочечную ДНК. У людей репликационный белок А является наиболее изученным членом этого семейства и используется в процессах разделения двойной спирали, включая репликацию ДНК, рекомбинацию и репарацию ДНК. [123] Эти связывающие белки, по-видимому, стабилизируют одноцепочечную ДНК и защищают ее от образования петель или разрушения нуклеазами .

Напротив, другие белки эволюционировали, чтобы связываться с определенными последовательностями ДНК. Наиболее интенсивно изучаются различные факторы транскрипции — белки, регулирующие транскрипцию. Каждый фактор транскрипции связывается с одним конкретным набором последовательностей ДНК и активирует или ингибирует транскрипцию генов, у которых эти последовательности расположены близко к их промоторам. Факторы транскрипции делают это двумя способами. Во-первых, они могут связываться с РНК-полимеразой, ответственной за транскрипцию, либо напрямую, либо через другие белки-медиаторы; это обнаруживает полимеразу у промотора и позволяет ей начать транскрипцию. [125] Альтернативно, факторы транскрипции могут связывать ферменты , которые модифицируют гистоны на промоторе. Это изменяет доступность матрицы ДНК для полимеразы. [126]
Поскольку эти ДНК-мишени могут встречаться по всему геному организма, изменения в активности одного типа транскрипционных факторов могут влиять на тысячи генов. [127] Следовательно, эти белки часто являются мишенями процессов передачи сигнала , которые контролируют реакцию на изменения окружающей среды или клеточную дифференцировку и развитие. Специфичность взаимодействия этих факторов транскрипции с ДНК обусловлена тем, что белки устанавливают множественные контакты с краями оснований ДНК, что позволяет им «читать» последовательность ДНК. Большинство этих взаимодействий с основаниями происходит в основной бороздке, где основания наиболее доступны. [25]

ДНК-модифицирующие ферменты
Нуклеазы и лигазы
Нуклеазы — это ферменты , которые разрезают цепи ДНК, катализируя гидролиз фосфодиэфирных связей . Нуклеазы, гидролизующие нуклеотиды с концов нитей ДНК, называются экзонуклеазами , а эндонуклеазы разрезают внутри нитей. Наиболее часто используемые нуклеазы в молекулярной биологии — это эндонуклеазы рестрикции , которые разрезают ДНК по определенным последовательностям. Например, фермент EcoRV, показанный слева, распознает последовательность из 6 оснований 5'-GATATC-3' и разрезает ее по горизонтальной линии. В природе эти ферменты защищают бактерии от фаговой инфекции, переваривая ДНК фага, когда он попадает в бактериальную клетку, действуя как часть системы модификации рестрикции . [129] В технологии эти специфичные для последовательности нуклеазы используются в молекулярном клонировании и снятии отпечатков пальцев ДНК .
Ферменты, называемые ДНК-лигазами, могут воссоединять разрезанные или разорванные цепи ДНК. [130] Лигазы особенно важны при репликации отстающей цепи ДНК, поскольку они соединяют короткие сегменты ДНК, образующиеся на репликационной вилке, в полную копию матрицы ДНК. Они также используются для восстановления ДНК и генетической рекомбинации . [130]
Топоизомеразы и геликазы
Топоизомеразы представляют собой ферменты, обладающие как нуклеазной, так и лигазной активностью. Эти белки изменяют степень сверхспирализации ДНК. Некоторые из этих ферментов работают, разрезая спираль ДНК и позволяя одной ее части вращаться, тем самым снижая уровень ее сверхспирализации; затем фермент запечатывает разрыв ДНК. [44] Другие типы этих ферментов способны разрезать одну спираль ДНК, а затем пропускать через этот разрыв вторую цепь ДНК, прежде чем снова присоединиться к спирали. [131] Топоизомеразы необходимы для многих процессов, связанных с ДНК, таких как репликация и транскрипция ДНК. [45]
Хеликазы — это белки, которые представляют собой тип молекулярного мотора . Они используют химическую энергию нуклеозидтрифосфатов , преимущественно аденозинтрифосфата (АТФ), для разрыва водородных связей между основаниями и раскручивания двойной спирали ДНК на одиночные нити. [132] Эти ферменты необходимы для большинства процессов, в которых ферментам необходим доступ к основаниям ДНК.
Полимеразы
Полимеразы — ферменты , синтезирующие полинуклеотидные цепи из нуклеозидтрифосфатов . Последовательность их продуктов создается на основе существующих полинуклеотидных цепей, которые называются матрицами . Эти ферменты действуют путем многократного добавления нуклеотида к 3'- гидроксильной группе на конце растущей полинуклеотидной цепи. Как следствие, все полимеразы действуют в направлении от 5’ к 3’. [133] В активном центре этих ферментов поступающие пары нуклеозидтрифосфатных оснований соединяются с матрицей: это позволяет полимеразам точно синтезировать комплементарную цепь своей матрицы. Полимеразы классифицируются в зависимости от типа матрицы, которую они используют.
При репликации ДНК ДНК-зависимые ДНК-полимеразы создают копии полинуклеотидных цепей ДНК. Для сохранения биологической информации важно, чтобы последовательность оснований в каждой копии точно дополняла последовательность оснований в цепи матрицы. Многие ДНК-полимеразы обладают корректурной активностью. Здесь полимераза распознает случайные ошибки в реакции синтеза из-за отсутствия спаривания оснований между несовпадающими нуклеотидами. Если обнаружено несоответствие, экзонуклеазная активность от 3' до 5' и неправильное основание удаляется. активируется [134] У большинства организмов ДНК-полимеразы функционируют в большом комплексе, называемом реплисомой , который содержит множество дополнительных субъединиц, таких как зажим ДНК или геликазы . [135]
РНК-зависимые ДНК-полимеразы представляют собой специализированный класс полимераз, которые копируют последовательность цепи РНК в ДНК. К ним относятся обратная транскриптаза , представляющая собой вирусный фермент, участвующий в инфицировании клеток ретровирусами , и теломераза , необходимая для репликации теломер. [63] [136] Например, обратная транскриптаза ВИЧ является ферментом репликации вируса СПИДа. [136] Теломераза — необычная полимераза, поскольку в ее структуре содержится собственная матрица РНК. Он синтезирует теломеры на концах хромосом. Теломеры предотвращают слияние концов соседних хромосом и защищают концы хромосом от повреждений. [64]
Транскрипция осуществляется ДНК-зависимой РНК-полимеразой , которая копирует последовательность цепи ДНК в РНК. Чтобы начать транскрипцию гена, РНК-полимераза связывается с последовательностью ДНК, называемой промотором, и разделяет цепи ДНК. Затем он копирует последовательность гена в транскрипт информационной РНК , пока не достигнет участка ДНК, называемого терминатором , где он останавливается и отделяется от ДНК. Как и ДНК-зависимые ДНК-полимеразы человека, РНК-полимераза II , фермент, который транскрибирует большинство генов в геноме человека, действует как часть большого белкового комплекса с множеством регуляторных и дополнительных субъединиц. [137]
Генетическая рекомбинация
 |
 |
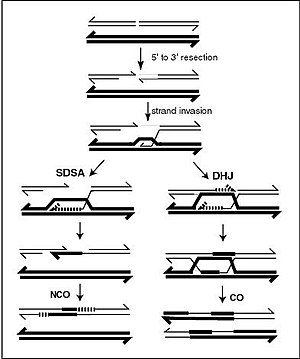
Спираль ДНК обычно не взаимодействует с другими сегментами ДНК, а в клетках человека разные хромосомы даже занимают отдельные области ядра, называемые « хромосомными территориями ». [139] Это физическое разделение различных хромосом важно для способности ДНК функционировать как стабильное хранилище информации, поскольку одним из немногих случаев взаимодействия хромосом является хромосомный кроссинговер , который происходит во время полового размножения , когда происходит генетическая рекомбинация . Хромосомный кроссовер – это когда две спирали ДНК разрываются, меняют местами участки и затем воссоединяются.
Рекомбинация позволяет хромосомам обмениваться генетической информацией и создавать новые комбинации генов, что повышает эффективность естественного отбора и может иметь важное значение для быстрой эволюции новых белков. [140] Генетическая рекомбинация также может участвовать в репарации ДНК, особенно в ответе клетки на двухцепочечные разрывы. [141]
Наиболее распространенной формой хромосомного кроссинговера является гомологичная рекомбинация , при которой две задействованные хромосомы имеют очень схожие последовательности. Негомологичная рекомбинация может быть разрушительной для клеток, поскольку может вызывать хромосомные транслокации и генетические аномалии. Реакция рекомбинации катализируется ферментами, известными как рекомбиназы , такими как RAD51 . [142] Первым шагом в рекомбинации является двухцепочечный разрыв, вызванный либо эндонуклеазой , либо повреждением ДНК. [143] Ряд стадий, частично катализируемых рекомбиназой, затем приводит к соединению двух спиралей по крайней мере с помощью одного соединения Холлидея , при котором сегмент одиночной цепи в каждой спирали отжигается с комплементарной цепью в другой спирали. Соединение Холлидея представляет собой тетраэдрическую структуру соединения, которую можно перемещать по паре хромосом, заменяя одну цепь другой. Затем реакция рекомбинации останавливается за счет расщепления соединения и повторного лигирования высвободившейся ДНК. [144] Только нити одинаковой полярности обмениваются ДНК во время рекомбинации. Существует два типа раскола: раскол с востока на запад и раскол с севера на юг. Расщепление север-юг разрывает обе цепи ДНК, тогда как расщепление восток-запад сохраняет одну цепь ДНК неповрежденной. Образование соединения Холлидея во время рекомбинации делает возможным генетическое разнообразие, обмен генами на хромосомах и экспрессию вирусных геномов дикого типа.
Эволюция
ДНК содержит генетическую информацию, которая позволяет всем формам жизни функционировать, расти и размножаться. Однако неясно, как долго в 4-миллиардной истории жизни ДНК выполняла эту функцию, поскольку было высказано предположение, что самые ранние формы жизни могли использовать РНК в качестве генетического материала. [145] [146] РНК, возможно, играла центральную роль в метаболизме ранних клеток , поскольку она может как передавать генетическую информацию, так и осуществлять катализ в составе рибозимов . [147] Этот древний мир РНК , где нуклеиновая кислота использовалась как для катализа, так и для генетики, возможно, повлиял на эволюцию нынешнего генетического кода, основанного на четырех нуклеотидных основаниях. Это может произойти, поскольку количество различных оснований в таком организме представляет собой компромисс между небольшим количеством оснований, повышающим точность репликации, и большим количеством оснований, повышающим каталитическую эффективность рибозимов. [148] Однако прямых доказательств существования древних генетических систем нет, поскольку восстановление ДНК из большинства окаменелостей невозможно, поскольку ДНК выживает в окружающей среде менее одного миллиона лет и медленно разлагается на короткие фрагменты в растворе. [149] Были сделаны заявления о более древней ДНК, в первую очередь сообщение об выделении жизнеспособной бактерии из кристалла соли возрастом 250 миллионов лет. [150] но эти утверждения спорны. [151] [152]
Строительные блоки ДНК ( аденин , гуанин и родственные им органические молекулы ) могли образоваться внеземно, в космическом пространстве . [153] [154] [155] Сложные ДНК и РНК органические соединения жизни , , включая урацил , цитозин и тимин , также были сформированы в лаборатории в условиях, имитирующих условия, обнаруженные в космическом пространстве , с использованием исходных химических веществ, таких как пиримидин , обнаруженный в метеоритах . Пиримидин, как и полициклические ароматические углеводороды (ПАУ), самое богатое углеродом химическое вещество во Вселенной , возможно, образовался в красных гигантах или в межзвездных космических пылевых и газовых облаках. [156]
Древняя ДНК была извлечена из древних организмов в масштабе времени, когда эволюцию генома можно непосредственно наблюдать, в том числе из вымерших организмов возрастом до миллионов лет, таких как шерстистый мамонт . [157] [158]
Использование в технологии
Генная инженерия
Были разработаны методы очистки ДНК организмов, такие как фенол-хлороформная экстракция , и манипулирования ею в лаборатории, такие как рестрикционные гидролизаты и полимеразная цепная реакция . Современная биология и биохимия интенсивно используют эти методы в технологии рекомбинантной ДНК. Рекомбинантная ДНК — это искусственная последовательность ДНК, собранная из других последовательностей ДНК. Их можно трансформировать в организмы в виде плазмид или в соответствующем формате с помощью вирусного вектора . [159] Полученные генетически модифицированные организмы могут быть использованы для производства таких продуктов, как рекомбинантные белки , используемые в медицинских исследованиях , [160] или выращиваться в сельском хозяйстве . [161] [162]
Профилирование ДНК
Судебно-медицинские эксперты могут использовать ДНК в крови , сперме , коже , слюне или волосах, найденных на месте преступления, чтобы идентифицировать совпадающую ДНК человека, например преступника. [163] Этот процесс формально называется профилированием ДНК , а также дактилоскопией ДНК . длины переменных участков повторяющейся ДНК, таких как короткие тандемные повторы и минисателлиты При профилировании ДНК у людей сравниваются . Этот метод обычно является чрезвычайно надежным методом идентификации совпадающей ДНК. [164] Однако идентификация может быть затруднена, если место происшествия загрязнено ДНК нескольких человек. [165] Профилирование ДНК было разработано в 1984 году британским генетиком сэром Алеком Джеффрисом . [166] и впервые использовался в судебной медицине для осуждения Колина Питчфорка по делу об убийствах в Эндерби в 1988 году . [167]
Развитие судебной медицины и возможность теперь получать генетическое соответствие на мельчайших образцах крови, кожи, слюны или волос привели к повторному исследованию многих случаев. Теперь могут быть обнаружены доказательства, которые были научно невозможны во время первоначального исследования. В сочетании с отменой в некоторых странах закона о двойной ответственности это может позволить возобновить рассмотрение дел, если предыдущие судебные разбирательства не смогли предоставить достаточных доказательств, чтобы убедить присяжных. От людей, обвиняемых в тяжких преступлениях, могут потребовать предоставить образец ДНК для целей сопоставления. Самая очевидная защита от совпадений ДНК, полученных судебно-медицинской экспертизой, - это утверждение о том, что имело место перекрестное загрязнение улик. Это привело к тщательным и строгим процедурам рассмотрения новых случаев серьезных преступлений.
ДНК-профилирование также успешно используется для точной идентификации жертв инцидентов с массовыми жертвами. [168] тела или части тел в результате серьезных несчастных случаев, а также отдельные жертвы в массовых военных могилах путем сопоставления с членами семьи.
Профилирование ДНК также используется при тестировании ДНК на отцовство, чтобы определить, является ли кто-либо биологическим родителем или дедушкой или бабушкой ребенка, при этом вероятность отцовства обычно составляет 99,99%, когда предполагаемый родитель биологически связан с ребенком. Обычные методы секвенирования ДНК применяются после рождения, но существуют новые методы проверки отцовства, пока мать еще беременна. [169]
ДНК-ферменты или каталитическая ДНК
Дезоксирибозимы , также называемые ДНКзимами или каталитической ДНК, были впервые обнаружены в 1994 году. [170] В основном это одноцепочечные последовательности ДНК, выделенные из большого пула случайных последовательностей ДНК с помощью комбинаторного подхода, называемого отбором in vitro или систематической эволюцией лигандов путем экспоненциального обогащения (SELEX). ДНКзимы катализируют различные химические реакции, включая расщепление РНК-ДНК, лигирование РНК-ДНК, фосфорилирование-дефосфорилирование аминокислот, образование углерод-углеродных связей и т. д. ДНКзимы могут увеличивать каталитическую скорость химических реакций до 100 000 000 000 раз по сравнению с некатализируемой реакцией. [171] Наиболее широко изученный класс ДНКзимов — это типы, расщепляющие РНК, которые используются для обнаружения ионов различных металлов и разработки терапевтических агентов. Сообщалось о нескольких металлоспецифичных ДНКзимах, включая ДНКзим GR-5 (свинцовоспецифичный), [170] ДНКзимы CA1-3 (специфичные для меди), [172] ДНКзим 39E (специфичный для уранила) и ДНКзим NaA43 (специфичный для натрия). [173] ДНКзим NaA43, который, как сообщается, более чем в 10 000 раз селективнее в отношении натрия по сравнению с ионами других металлов, был использован для создания датчика натрия в клетках в реальном времени.
Биоинформатика
Биоинформатика включает в себя разработку методов хранения, анализа данных , поиска и манипулирования биологическими данными, включая о последовательностях нуклеиновых кислот данные ДНК. Это привело к широко прикладным достижениям в области информатики , особенно в алгоритмах поиска строк , машинном обучении и теории баз данных . [174] Алгоритмы поиска или сопоставления строк, которые обнаруживают появление последовательности букв внутри более крупной последовательности букв, были разработаны для поиска определенных последовательностей нуклеотидов. [175] Последовательность ДНК может быть сопоставлена с другими последовательностями ДНК для идентификации гомологичных последовательностей и определения местоположения конкретных мутаций , которые отличают их. Эти методы, особенно множественное выравнивание последовательностей , используются при изучении филогенетических взаимоотношений и функций белков. [176] Наборы данных, представляющие собой последовательности ДНК целых геномов, например, созданные в рамках проекта «Геном человека» , трудно использовать без аннотаций, которые определяют расположение генов и регуляторных элементов на каждой хромосоме. Области последовательности ДНК, которые имеют характерные закономерности, связанные с генами, кодирующими белки или РНК, могут быть идентифицированы с помощью алгоритмов поиска генов , которые позволяют исследователям предсказывать присутствие определенных генных продуктов и их возможные функции в организме еще до того, как они будут изолированы. экспериментально. [177] Также можно сравнивать целые геномы, что может пролить свет на историю эволюции конкретного организма и позволить изучить сложные эволюционные события.
ДНК-нанотехнологии

Нанотехнология ДНК использует уникальные свойства молекулярного распознавания ДНК и других нуклеиновых кислот для создания самособирающихся разветвленных комплексов ДНК с полезными свойствами. [179] Таким образом, ДНК используется как структурный материал, а не как носитель биологической информации. Это привело к созданию двумерных периодических решеток (как на основе плиток, так и с использованием метода ДНК-оригами ) и трехмерных структур в форме многогранников . [180] наномеханические устройства и алгоритмическая самосборка . Также были продемонстрированы [181] и эти структуры ДНК использовались для определения расположения других молекул, таких как наночастицы золота и стрептавидина . белки [182] ДНК и другие нуклеиновые кислоты лежат в основе аптамеров — синтетических олигонуклеотидных лигандов для конкретных молекул-мишеней, используемых в ряде биотехнологических и биомедицинских приложений. [183]
История и антропология
Поскольку ДНК с течением времени собирает мутации, которые затем передаются по наследству, она содержит историческую информацию, и, сравнивая последовательности ДНК, генетики могут сделать вывод об эволюционной истории организмов, их филогении . [184] Эта область филогенетики является мощным инструментом эволюционной биологии . Если сравнивать последовательности ДНК внутри вида, популяционные генетики могут узнать историю конкретных популяций. Это может быть использовано в различных исследованиях – от экологической генетики до антропологии .
Хранение информации
ДНК как устройство хранения информации имеет огромный потенциал, поскольку ее плотность хранения гораздо выше, чем у электронных устройств. Однако высокая стоимость, медленное время чтения и записи ( задержка памяти ) и недостаточная надежность помешали его практическому использованию. [185] [186]
История

ДНК была впервые выделена швейцарским врачом Фридрихом Мишером , который в 1869 году обнаружил микроскопическое вещество в гное выброшенных хирургических повязок. Поскольку он находился в ядрах клеток, он назвал его «нуклеином». [187] [188] В 1878 году Альбрехт Коссель выделил небелковый компонент «нуклеина», нуклеиновую кислоту, а позже выделил пять ее основных нуклеиновых оснований . [189] [190]
В 1909 году Феб Левен определил основание, сахар и фосфатную нуклеотидную единицу РНК (тогда названную «дрожжевой нуклеиновой кислотой»). [191] [192] [193] В 1929 году Левен идентифицировал сахар дезоксирибозы в «нуклеиновой кислоте тимуса» (ДНК). [194] Левен предположил, что ДНК состоит из цепочки из четырех нуклеотидных единиц, связанных между собой фосфатными группами («тетрануклеотидная гипотеза»). Левен считал, что цепочка короткая и основания повторяются в фиксированном порядке. В 1927 году Николай Кольцов предположил, что наследственные признаки будут наследоваться через «гигантскую наследственную молекулу», состоящую из «двух зеркальных цепей, которые будут воспроизводиться полуконсервативным образом, используя каждую цепь в качестве шаблона». [195] [196] В 1928 году Фредерик Гриффит в своем эксперименте обнаружил, что черты «гладкой» формы пневмококка можно передать «шероховатой» форме тех же бактерий путем смешивания убитых «гладких» бактерий с живой «шероховатой» формой. [197] [198] Эта система дала первое четкое предположение о том, что ДНК несет генетическую информацию.
В 1933 году, изучая девственные яйца морских ежей , Жан Браше предположил, что ДНК находится в ядре клетки , а РНК присутствует исключительно в цитоплазме . В то время считалось, что «дрожжевая нуклеиновая кислота» (РНК) встречается только у растений, а «нуклеиновая кислота тимуса» (ДНК) — только у животных. Последний считался тетрамером, выполняющим функцию буферизации клеточного pH. [199] [200]
В 1937 году Уильям Эстбери получил первые рентгенограммы, показавшие, что ДНК имеет регулярную структуру. [201]
В 1943 году Освальд Эйвери вместе с коллегами Колином Маклаудом и Маклином Маккарти определил ДНК как трансформирующий принцип , поддержав предположение Гриффита ( эксперимент Эйвери-Маклаода-Маккарти ). [202] Эрвин Чаргафф разработал и опубликовал наблюдения, известные теперь как правила Чаргаффа , утверждающие, что в ДНК любого вида любого организма количество гуанина должно быть равно цитозину , а количество аденина должно быть равно тимину . [203] [204]

В конце 1951 года Фрэнсис Крик начал работать с Джеймсом Уотсоном в Кавендишской лаборатории университета Кембриджского . Роль ДНК в наследственности была подтверждена в 1952 году, когда Альфред Херши и Марта Чейз в эксперименте Херши-Чейза показали, что ДНК является генетическим материалом фага Т2 энтеробактерий . [205]
В мае 1952 года Рэймонд Гослинг , аспирант, работавший под руководством Розалинды Франклин , сделал рентгеновский дифракционный снимок, обозначенный как « Фото 51 ». [206] при высоких уровнях гидратации ДНК. Эта фотография была передана Уотсону и Крику Морисом Уилкинсом и сыграла решающую роль в получении ими правильной структуры ДНК. Франклин сказал Крику и Ватсону, что позвоночник должен быть снаружи. До этого у Лайнуса Полинга, Уотсона и Крика были ошибочные модели с цепями внутри, а основаниями наружу. Идентификация Франклином пространственной группы кристаллов ДНК открыла Крику, что две цепи ДНК антипараллельны . [207] В феврале 1953 года Лайнус Полинг и Роберт Кори предложили модель нуклеиновых кислот, содержащих три переплетающиеся цепи: фосфаты расположены вблизи оси, а основания — снаружи. [208] Уотсон и Крик завершили свою модель, которая сейчас считается первой правильной моделью двойной спирали ДНК . 28 февраля 1953 года Крик прервал обед посетителей в The Eagle пабе в Кембридже, Англия, чтобы объявить, что он и Ватсон «открыли секрет жизни». [209]
В выпуске журнала Nature от 25 апреля 1953 года была опубликована серия из пяти статей, в которых описывается структура ДНК Уотсона и Крика с двойной спиралью, а также доказательства, подтверждающие ее. [210] Об этой структуре было сообщено в письме, озаглавленном « МОЛЕКУЛЯРНАЯ СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ. Структура нуклеиновой кислоты дезоксирибозы » , в котором они сказали: «От нашего внимания не ускользнуло то, что специфическое спаривание, которое мы постулировали, сразу предполагает возможный механизм копирования генетической материал». [9] За этим письмом последовало письмо Франклина и Гослинга, которое стало первой публикацией их собственных данных дифракции рентгеновских лучей и их оригинального метода анализа. [48] [211] Затем последовало письмо Уилкинса и двух его коллег, в котором содержался анализ in vivo рентгеновских картин B-ДНК и которые подтверждали наличие in vivo структуры Уотсона и Крика. [49]
В апреле 2023 года ученые на основе новых данных пришли к выводу, что Розалинда Франклин внесла свой вклад и «равноправного игрока» в процесс открытия ДНК, а не наоборот, как могло быть представлено впоследствии, после момента открытия. [212] [213] [214]
В 1962 году, после смерти Франклина, Уотсон, Крик и Уилкинс совместно получили Нобелевскую премию по физиологии и медицине . [215] Нобелевские премии присуждаются только живым лауреатам. Продолжаются споры о том, кому следует отдать должное за это открытие. [216]
Во влиятельной презентации 1957 года Крик изложил центральную догму молекулярной биологии , которая предсказала взаимосвязь между ДНК, РНК и белками, и сформулировала «гипотезу адаптера». [217] Окончательное подтверждение механизма репликации, подразумеваемого двойной спиральной структурой, последовало в 1958 году в эксперименте Мезельсона-Шталя . [218] Дальнейшая работа Крика и его коллег показала, что генетический код основан на неперекрывающихся тройках оснований, называемых кодонами , что позволило Хар Гобинду Хоране , Роберту У. Холли и Маршаллу Уоррену Ниренбергу расшифровать генетический код. [219] Эти открытия символизируют рождение молекулярной биологии . [220]
В 1986 году анализ ДНК был впервые использован в целях уголовного расследования, когда полиция Великобритании обратилась к Алеку Джеффрису из Университета Лестера с просьбой подтвердить или опровергнуть «признание» подозреваемого в изнасиловании и убийстве. В данном конкретном случае подозреваемый признался в двух изнасилованиях и убийствах, но позже отказался от своих признаний. Анализ ДНК в университетских лабораториях вскоре опроверг правдивость первоначального «признания» подозреваемого, и с подозреваемого были сняты обвинения в убийстве и изнасиловании. [221]
См. также
- Аутосома – любая хромосома, кроме половой.
- Кристаллография - Научное исследование кристаллических структур.
- День ДНК – праздник, отмечаемый 25 апреля.
- Микроматрица ДНК - коллекция микроскопических пятен ДНК, прикрепленных к твердой поверхности.
- Секвенирование ДНК - процесс определения последовательности нуклеиновой кислоты.
- Генетическое заболевание – проблема со здоровьем, вызванная одним или несколькими отклонениями в геноме.
- Генетическая генеалогия - тестирование ДНК для определения родства
- Гаплотип - группа генов от одного родителя.
- Мейоз – деление клеток с образованием гаплоидных гамет.
- Обозначение нуклеиновой кислоты - универсальное обозначение с использованием римских символов A, C, G и T для обозначения четырех нуклеотидов ДНК.
- Последовательность нуклеиновой кислоты - последовательность нуклеотидов в нуклеиновой кислоте.
- Рибосомальная ДНК - конкретная область ДНК, которая кодирует рибосомальную РНК.
- Саузерн-блоттинг - метод анализа ДНК
- Методы рассеяния рентгеновских лучей - семейство неразрушающих аналитических методов.
- Ксенонуклеиновая кислота - синтетические аналоги нуклеиновой кислоты.
Ссылки
- ^ «дезоксирибонуклеиновая кислота» . Словарь Merriam-Webster.com .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2014). Молекулярная биология клетки (6-е изд.). Гирлянда. п. Глава 4: ДНК, хромосомы и геномы. ISBN 978-0-8153-4432-2 . Архивировано из оригинала 14 июля 2014 года.
- ^ Перселл А. «ДНК» . Базовая биология . Архивировано из оригинала 5 января 2017 года.
- ^ «Урацил» . Genome.gov . Проверено 21 ноября 2019 г.
- ^ Рассел П. (2001). iГенетика . Нью-Йорк: Бенджамин Каммингс. ISBN 0-8053-4553-1 .
- ^ Сенгер В. (1984). Принципы структуры нуклеиновых кислот . Нью-Йорк: Springer-Verlag. ISBN 0-387-90762-9 .
- ↑ Перейти обратно: Перейти обратно: а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Питер В. (2002). Молекулярная биология клетки (Четвертое изд.). Нью-Йорк и Лондон: Garland Science. ISBN 0-8153-3218-1 . OCLC 145080076 . Архивировано из оригинала 1 ноября 2016 года.
- ^ Иробалиева Р.Н., Фогг Дж.М., Catanese DJ, Catanese DJ, Sutthibutpong T, Chen M, Barker AK, Ludtke SJ, Harris SA, Schmid MF, Chiu W, Zechiedrich L (октябрь 2015 г.). «Структурное разнообразие суперспиральной ДНК» . Природные коммуникации . 6 : 8440. Бибкод : 2015NatCo...6.8440I . дои : 10.1038/ncomms9440 . ISSN 2041-1723 . ПМК 4608029 . ПМИД 26455586 .
- ↑ Перейти обратно: Перейти обратно: а б с д Уотсон Дж. Д., Крик Ф. Х. (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот; структура нуклеиновой кислоты дезоксирибозы» (PDF) . Природа . 171 (4356): 737–38. Бибкод : 1953Natur.171..737W . дои : 10.1038/171737a0 . ISSN 0028-0836 . ПМИД 13054692 . S2CID 4253007 . Архивировано (PDF) из оригинала 4 февраля 2007 г.
- ^ Манделькерн М., Элиас Дж.Г., Иден Д., Кротерс Д.М. (октябрь 1981 г.). «Размеры ДНК в растворе». Журнал молекулярной биологии . 152 (1): 153–61. дои : 10.1016/0022-2836(81)90099-1 . ISSN 0022-2836 . ПМИД 7338906 .
- ^ Арриги, Фрэнсис Э.; Мандель, Мэнли; Бергендал, Джанет; Сюй, TC (июнь 1970 г.). «Плавущая плотность ДНК млекопитающих». Биохимическая генетика . 4 (3): 367–376. дои : 10.1007/BF00485753 . ПМИД 4991030 . S2CID 27950750 .
- ↑ Перейти обратно: Перейти обратно: а б с д Берг Дж., Тимочко Дж., Страйер Л. (2002). Биохимия . WH Фриман и компания. ISBN 0-7167-4955-6 .
- ^ Комиссия IUPAC-IUB по биохимической номенклатуре (CBN) (декабрь 1970 г.). «Сокращения и символы нуклеиновых кислот, полинуклеотидов и их составляющих. Рекомендации 1970 г.» . Биохимический журнал . 120 (3): 449–54. дои : 10.1042/bj1200449 . ISSN 0306-3283 . ПМЦ 1179624 . ПМИД 5499957 . Архивировано из оригинала 5 февраля 2007 года.
- ↑ Перейти обратно: Перейти обратно: а б Гош А., Бансал М. (апрель 2003 г.). «Словарь структур ДНК от А до Я». Acta Crystallographica Раздел D. 59 (Часть 4): 620–26. Бибкод : 2003AcCrD..59..620G . дои : 10.1107/S0907444903003251 . ISSN 0907-4449 . ПМИД 12657780 .
- ^ Эдвардс К.Дж., Браун Д.Г., Спинк Н., Скелли Дж.В., Нидл С. «RCSB PDB – 1D65: Молекулярная структура додекамера B-ДНК d(CGCAAATTTGCG)2. Исследование скручивания пропеллера и структуры воды в малых канавках при разрешении 2,2 А. " . www.rcsb.org . Проверено 27 марта 2023 г.
- ^ Яковчук П., Протозанова Е., Франк-Каменецкий М.Д. (2006). «Вклад укладки оснований и спаривания оснований в термическую стабильность двойной спирали ДНК» . Исследования нуклеиновых кислот . 34 (2): 564–74. дои : 10.1093/nar/gkj454 . ISSN 0305-1048 . ПМЦ 1360284 . ПМИД 16449200 .
- ^ Тропп Б.Е. (2012). Молекулярная биология (4-е изд.). Садбери, Массачусетс: Джонс и Барлетт Лиринг. ISBN 978-0-7637-8663-2 .
- ^ Карр С. (1953). «Структура ДНК Уотсона-Крика» . Мемориальный университет Ньюфаундленда. Архивировано из оригинала 19 июля 2016 года . Проверено 13 июля 2016 г.
- ^ Верма С., Экстайн Ф (1998). «Модифицированные олигонуклеотиды: синтез и стратегия для пользователей» . Ежегодный обзор биохимии . 67 : 99–134. doi : 10.1146/annurev.biochem.67.1.99 . ISSN 0066-4154 . ПМИД 9759484 .
- ^ Джонсон Т.Б., Когхилл Р.Д. (1925). «Пиримидины. CIII. Открытие 5-метилцитозина в туберкулиновой кислоте, нуклеиновой кислоте туберкулезной палочки». Журнал Американского химического общества . 47 : 2838–44. дои : 10.1021/ja01688a030 . ISSN 0002-7863 .
- ^ Вейгеле П., Роли Э.А. (октябрь 2016 г.). «Биосинтез и функции модифицированных оснований у бактерий и их вирусов» . Химические обзоры . 116 (20): 12655–12687. doi : 10.1021/acs.chemrev.6b00114 . ISSN 0009-2665 . ПМИД 27319741 .
- ^ Кумар С., Чиннусами В., Мохапатра Т. (2018). «Эпигенетика модифицированных оснований ДНК: 5-метилцитозин и не только» . Границы генетики . 9 : 640. дои : 10.3389/fgene.2018.00640 . ISSN 1664-8021 . ПМК 6305559 . ПМИД 30619465 .
- ^ Карелл Т., Курц М.К., Мюллер М., Росса М., Спада Ф. (апрель 2018 г.). «Неканонические основания в геноме: регуляторный информационный слой в ДНК». Ангеванде Хеми . 57 (16): 4296–4312. дои : 10.1002/anie.201708228 . ПМИД 28941008 .
- ^ Уинг Р., Дрю Х., Такано Т., Брока С., Танака С., Итакура К., Дикерсон Р.Э. (октябрь 1980 г.). «Анализ кристаллической структуры полного оборота B-ДНК». Природа . 287 (5784): 755–58. Бибкод : 1980Natur.287..755W . дои : 10.1038/287755a0 . ПМИД 7432492 . S2CID 4315465 .
- ↑ Перейти обратно: Перейти обратно: а б Пабо CO, Sauer RT (1984). «Распознавание белка-ДНК». Ежегодный обзор биохимии . 53 : 293–321. дои : 10.1146/annurev.bi.53.070184.001453 . ПМИД 6236744 .
- ^ Николова Е.Н., Чжоу Х., Готтардо Ф.Л., Алви Х.С., Кимси И.Дж., Аль-Хашими Х.М. (2013). «Исторический отчет о парах оснований Хугстина в дуплексной ДНК» . Биополимеры . 99 (12): 955–68. дои : 10.1002/bip.22334 . ПМЦ 3844552 . ПМИД 23818176 .
- ^ Клаузен-Шауманн Х., Риф М., Толксдорф К., Гауб Х.Э. (апрель 2000 г.). «Механическая стабильность одиночных молекул ДНК» . Биофизический журнал . 78 (4): 1997–2007. Бибкод : 2000BpJ....78.1997C . дои : 10.1016/S0006-3495(00)76747-6 . ПМЦ 1300792 . ПМИД 10733978 .
- ^ Чаликян Т.В., Фёлькер Дж., Плам Г.Е., Бреслауер К.Дж. (июль 1999 г.). «Более единая картина термодинамики дуплексного плавления нуклеиновых кислот: характеристика с помощью калориметрических и волюметрических методов» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (14): 7853–58. Бибкод : 1999PNAS...96.7853C . дои : 10.1073/pnas.96.14.7853 . ПМК 22151 . ПМИД 10393911 .
- ^ деХасет П.Л., Хельманн Дж.Д. (июнь 1995 г.). «Образование открытого комплекса РНК-полимеразой Escherichia coli: механизм индуцированного полимеразой разделения цепей двойной спиральной ДНК». Молекулярная микробиология . 16 (5): 817–24. дои : 10.1111/j.1365-2958.1995.tb02309.x . ПМИД 7476180 . S2CID 24479358 .
- ^ Исакссон Дж., Ачарья С., Барман Дж., Черуку П., Чаттопадхьяя Дж. (декабрь 2004 г.). «Одноцепочечные богатые аденином ДНК и РНК сохраняют структурные характеристики своих соответствующих двухцепочечных конформаций и демонстрируют направленные различия в структуре укладки» (PDF) . Биохимия . 43 (51): 15996–6010. дои : 10.1021/bi048221v . ПМИД 15609994 . Архивировано (PDF) из оригинала 10 июня 2007 г.
- ↑ Перейти обратно: Перейти обратно: а б Пиовесан А, Пеллери МК, Антонарос Ф, Стрипполи П, Каракаузи М, Витале Л (2019). «О длине, массе и GC-содержании генома человека» . Примечания к резолюциям BMC . 12 (1): 106. дои : 10.1186/s13104-019-4137-z . ПМК 6391780 . ПМИД 30813969 .
- ^ Грегори С.Г., Барлоу К.Ф., Маклей К.Э., Каул Р., Сварбрек Д., Данэм А. и др. (май 2006 г.). «Последовательность ДНК и биологическая аннотация хромосомы 1 человека» . Природа . 441 (7091): 315–21. Бибкод : 2006Natur.441..315G . дои : 10.1038/nature04727 . ПМИД 16710414 .
- ^ Андерсон С., Банкир А.Т., Баррелл Б.Г., де Брёйн М.Х., Коулсон А.Р., Друэн Дж. и др. (апрель 1981 г.). «Последовательность и организация митохондриального генома человека». Природа . 290 (5806): 457–465. Бибкод : 1981Natur.290..457A . дои : 10.1038/290457a0 . ПМИД 7219534 . S2CID 4355527 .
- ^ «Без названия» . Архивировано из оригинала 13 августа 2011 года . Проверено 13 июня 2012 г.
- ↑ Перейти обратно: Перейти обратно: а б с Сато М., Куроива Т. (сентябрь 1991 г.). «Организация множества нуклеоидов и молекул ДНК в митохондриях клетки человека». Экспериментальные исследования клеток . 196 (1): 137–140. дои : 10.1016/0014-4827(91)90467-9 . ПМИД 1715276 .
- ^ Чжан Д., Кейлти Д., Чжан З.Ф., Чиан Р.С. (март 2017 г.). «Митохондрии в старении ооцитов: современное понимание» . Факты, взгляды и видение акушерства и гинекологии . 9 (1): 29–38. ПМК 5506767 . ПМИД 28721182 .
- ↑ Обозначение двух цепей ДНК. Архивировано 24 апреля 2008 г. в информационном бюллетене Wayback Machine JCBN/NC-IUB 1989. Проверено 7 мая 2008 г.
- ^ Хюттенхофер А., Шаттнер П., Полачек Н. (май 2005 г.). «Некодирующие РНК: надежда или обман?». Тенденции в генетике . 21 (5): 289–97. дои : 10.1016/j.tig.2005.03.007 . ПМИД 15851066 .
- ^ Манро С.Х. (ноябрь 2004 г.). «Разнообразие антисмысловой регуляции у эукариот: множественные механизмы, новые закономерности». Журнал клеточной биохимии . 93 (4): 664–71. дои : 10.1002/jcb.20252 . ПМИД 15389973 . S2CID 23748148 .
- ^ Макаловска И., Лин К.Ф., Макаловски В. (февраль 2005 г.). «Перекрывающиеся гены в геномах позвоночных». Вычислительная биология и химия . 29 (1): 1–12. doi : 10.1016/j.compbiolchem.2004.12.006 . ПМИД 15680581 .
- ^ Джонсон З.И., Чисхолм С.В. (ноябрь 2004 г.). «Свойства перекрывающихся генов сохраняются во всех микробных геномах» . Геномные исследования . 14 (11): 2268–72. дои : 10.1101/гр.2433104 . ПМК 525685 . ПМИД 15520290 .
- ^ Лэмб Р.А., Хорват К.М. (август 1991 г.). «Разнообразие стратегий кодирования вирусов гриппа» . Тенденции в генетике . 7 (8): 261–66. дои : 10.1016/0168-9525(91)90326-L . ПМК 7173306 . ПМИД 1771674 .
- ^ Бенхэм С.Дж., Мильке С.П. (2005). «Механика ДНК» (PDF) . Ежегодный обзор биомедицинской инженерии . 7 : 21–53. doi : 10.1146/annurev.bioeng.6.062403.132016 . ПМИД 16004565 . S2CID 1427671 . Архивировано из оригинала (PDF) 1 марта 2019 года.
- ↑ Перейти обратно: Перейти обратно: а б Шампу Джей-Джей (2001). «ДНК-топоизомеразы: структура, функции и механизм». Ежегодный обзор биохимии . 70 : 369–413. doi : 10.1146/annurev.biochem.70.1.369 . ПМИД 11395412 . S2CID 18144189 .
- ↑ Перейти обратно: Перейти обратно: а б Ван Дж.К. (июнь 2002 г.). «Клеточная роль ДНК-топоизомераз: молекулярная перспектива». Nature Reviews Молекулярно-клеточная биология . 3 (6): 430–40. дои : 10.1038/nrm831 . ПМИД 12042765 . S2CID 205496065 .
- ^ Басу Х.С., Фейерштейн Б.Г., Зарлинг Д.А., Шафер Р.Х., Мартон Л.Дж. (октябрь 1988 г.). «Распознавание детерминант Z-РНК и Z-ДНК полиаминами в растворе: экспериментальные и теоретические исследования». Журнал биомолекулярной структуры и динамики . 6 (2): 299–309. дои : 10.1080/07391102.1988.10507714 . ПМИД 2482766 .
- ^
- Франклин Р.Э., Гослинг Р.Г. (6 марта 1953 г.). «Структура волокон тимонуклеата натрия I. Влияние содержания воды» (PDF) . Акта Кристаллогр . 6 (8–9): 673–77. Бибкод : 1953AcCry...6..673F . дои : 10.1107/S0365110X53001939 . Архивировано (PDF) из оригинала 9 января 2016 года.
- Франклин Р.Э., Гослинг Р.Г. (1953). «Структура волокон тимонуклеата натрия. II. Цилиндрически-симметричная функция Паттерсона» (PDF) . Акта Кристаллогр . 6 (8–9): 678–85. Бибкод : 1953AcCry...6..678F . дои : 10.1107/S0365110X53001940 . Архивировано (PDF) из оригинала 29 июня 2017 года.
- ↑ Перейти обратно: Перейти обратно: а б Франклин Р.Э., Гослинг Р.Г. (апрель 1953 г.). «Молекулярная конфигурация тимонуклеата натрия» (PDF) . Природа . 171 (4356): 740–41. Бибкод : 1953Natur.171..740F . дои : 10.1038/171740a0 . ПМИД 13054694 . S2CID 4268222 . Архивировано (PDF) из оригинала 3 января 2011 года.
- ↑ Перейти обратно: Перейти обратно: а б Уилкинс М.Х., Стоукс А.Р., Уилсон Х.Р. (апрель 1953 г.). «Молекулярная структура дезоксипентозных нуклеиновых кислот» (PDF) . Природа . 171 (4356): 738–40. Бибкод : 1953Natur.171..738W . дои : 10.1038/171738a0 . ПМИД 13054693 . S2CID 4280080 . Архивировано (PDF) из оригинала 13 мая 2011 года.
- ^ Лесли А.Г., Арнотт С., Чандрасекаран Р., Рэтлифф Р.Л. (октябрь 1980 г.). «Полиморфизм двойных спиралей ДНК». Журнал молекулярной биологии . 143 (1): 49–72. дои : 10.1016/0022-2836(80)90124-2 . ПМИД 7441761 .
- ^ Баяну И.С. (1980). «Структурный порядок и частичный беспорядок в биологических системах» . Бык. Математика. Биол . 42 (4): 137–41. дои : 10.1007/BF02462372 . S2CID 189888972 .
- ^ Хоземанн Р., Багчи Р.Н. (1962). Прямой анализ дифракции на веществе . Амстердам – Нью-Йорк: Издательство Северной Голландии.
- ^ Баяну И.С. (1978). «Рассеяние рентгеновских лучей частично неупорядоченными мембранными системами» (PDF) . Акта Кристаллогр А. 34 (5): 751–53. Бибкод : 1978AcCrA..34..751B . дои : 10.1107/S0567739478001540 . Архивировано из оригинала (PDF) 14 марта 2020 года . Проверено 29 августа 2019 г.
- ^ Валь MC, Сундаралингам М (1997). «Кристаллические структуры дуплексов А-ДНК». Биополимеры . 44 (1): 45–63. doi : 10.1002/(SICI)1097-0282(1997)44:1<45::AID-BIP4>3.0.CO;2-# . ПМИД 9097733 .
- ^ Лу XJ, Шаккед З., Олсон В.К. (июль 2000 г.). «Конформационные мотивы А-формы в структурах ДНК, связанных с лигандами». Журнал молекулярной биологии . 300 (4): 819–40. дои : 10.1006/jmbi.2000.3690 . ПМИД 10891271 .
- ^ Ротенбург С., Кох-Нольте Ф., Хааг Ф. (декабрь 2001 г.). «Метилирование ДНК и образование Z-ДНК как медиаторы количественных различий в экспрессии аллелей». Иммунологические обзоры . 184 : 286–98. дои : 10.1034/j.1600-065x.2001.1840125.x . ПМИД 12086319 . S2CID 20589136 .
- ^ О Д.Б., Ким Ю.Г., Рич А. (декабрь 2002 г.). «Z-ДНК-связывающие белки могут действовать как мощные эффекторы экспрессии генов in vivo» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (26): 16666–71. Бибкод : 2002PNAS...9916666O . дои : 10.1073/pnas.262672699 . ПМК 139201 . ПМИД 12486233 .
- ^ Палмер Дж. (2 декабря 2010 г.). «Бактерии, любящие мышьяк, могут помочь в охоте на инопланетную жизнь » Новости Би-би-си . Архивировано из оригинала 3 декабря 2010 года . Проверено 2 декабря 2010 г.
- ↑ Перейти обратно: Перейти обратно: а б Бортман Х (2 декабря 2010 г.). «Бактерии, питающиеся мышьяком, открывают новые возможности для инопланетной жизни» . Space.com . Архивировано из оригинала 4 декабря 2010 года . Проверено 2 декабря 2010 г.
- ^ Кацнельсон А (2 декабря 2010 г.). «Микроб, питающийся мышьяком, может изменить химию жизни » Новости природы . дои : 10.1038/news.2010.645 . Архивировано из оригинала 12 февраля 2012 года.
- ^ Кресси Д. (3 октября 2012 г.). « В конце концов, бактерия «мышьяковая жизнь» предпочитает фосфор». Новости природы . дои : 10.1038/nature.2012.11520 . S2CID 87341731 .
- ^ «Структура и упаковка теломерной ДНК человека» . ndbserver.rutgers.edu . Проверено 18 мая 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б Грейдер CW, Блэкберн EH (декабрь 1985 г.). «Идентификация специфической активности терминальной трансферазы теломер в экстрактах тетрахимены» . Клетка . 43 (2, часть 1): 405–13. дои : 10.1016/0092-8674(85)90170-9 . ПМИД 3907856 .
- ↑ Перейти обратно: Перейти обратно: а б с Ньюджент CI, Лундблад V (апрель 1998 г.). «Теломеразная обратная транскриптаза: компоненты и регуляция» . Гены и развитие . 12 (8): 1073–85. дои : 10.1101/gad.12.8.1073 . ПМИД 9553037 .
- ^ Райт В.Е., Тесмер В.М., Хаффман К.Е., Левен С.Д., Шей Дж.В. (ноябрь 1997 г.). «Нормальные человеческие хромосомы имеют на одном конце длинные теломерные выступы, богатые G» . Гены и развитие . 11 (21): 2801–09. дои : 10.1101/gad.11.21.2801 . ПМК 316649 . ПМИД 9353250 .
- ↑ Перейти обратно: Перейти обратно: а б Бердж С., Паркинсон Г.Н., Хейзел П., Тодд А.К., Нидл С. (2006). «Квадруплексная ДНК: последовательность, топология и структура» . Исследования нуклеиновых кислот . 34 (19): 5402–15. дои : 10.1093/нар/gkl655 . ПМЦ 1636468 . ПМИД 17012276 .
- ^ Паркинсон Г.Н., Ли MP, Нидл С. (июнь 2002 г.). «Кристаллическая структура параллельных квадруплексов теломерной ДНК человека». Природа . 417 (6891): 876–80. Бибкод : 2002Natur.417..876P . дои : 10.1038/nature755 . ПМИД 12050675 . S2CID 4422211 .
- ^ Гриффит Дж.Д., Комо Л., Розенфилд С., Стансель Р.М., Бьянки А., Мосс Х., де Ланж Т. (май 1999 г.). «Теломеры млекопитающих заканчиваются большой дуплексной петлей». Клетка . 97 (4): 503–14. CiteSeerX 10.1.1.335.2649 . дои : 10.1016/S0092-8674(00)80760-6 . ПМИД 10338214 . S2CID 721901 .
- ^ Симан, Северная Каролина (ноябрь 2005 г.). «ДНК обеспечивает наномасштабный контроль над структурой материи» . Ежеквартальные обзоры биофизики . 38 (4): 363–71. дои : 10.1017/S0033583505004087 . ПМЦ 3478329 . ПМИД 16515737 .
- ^ Уоррен М. (21 февраля 2019 г.). «Четыре новые буквы ДНК удваивают алфавит жизни» . Природа . 566 (7745): 436. Бибкод : 2019Natur.566..436W . дои : 10.1038/d41586-019-00650-8 . ПМИД 30809059 .
- ^ Хошика С., Лил Н.А., Ким М.Дж., Ким М.С., Каралкар Н.Б., Ким Х.Дж. и др. (22 февраля 2019 г.). «ДНК и РНК Хатимодзи: генетическая система с восемью строительными блоками (платный доступ)» . Наука . 363 (6429): 884–887. Бибкод : 2019Sci...363..884H . doi : 10.1126/science.aat0971 . ПМК 6413494 . ПМИД 30792304 .
- ^ Бургхардт Б., Хартманн А.К. (февраль 2007 г.). «Дизайн вторичной структуры РНК» . Физический обзор E . 75 (2): 021920. arXiv : физика/0609135 . Бибкод : 2007PhRvE..75b1920B . дои : 10.1103/PhysRevE.75.021920 . ПМИД 17358380 . S2CID 17574854 .
- ^ Ройш В. «Нуклеиновые кислоты» . Мичиганский государственный университет . Проверено 30 июня 2022 г.
- ^ «Как извлечь ДНК из всего живого» . Университет Юты . Проверено 30 июня 2022 г.
- ^ Ху Ц, Розенфельд М.Г. (2012). «Эпигенетическая регуляция эмбриональных стволовых клеток человека» . Границы генетики . 3 : 238. дои : 10.3389/fgene.2012.00238 . ПМЦ 3488762 . ПМИД 23133442 .
- ^ Клозе Р.Дж., Bird AP (февраль 2006 г.). «Метилирование геномной ДНК: метка и ее медиаторы». Тенденции биохимических наук . 31 (2): 89–97. дои : 10.1016/j.tibs.2005.12.008 . ПМИД 16403636 .
- ^ Птица А (январь 2002 г.). «Схемы метилирования ДНК и эпигенетическая память» . Гены и развитие . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ^ Уолш К.П., Сюй Г.Л. (2006). «Метилирование цитозина и восстановление ДНК». Метилирование ДНК: основные механизмы . Актуальные темы микробиологии и иммунологии. Том. 301. С. 283–315. дои : 10.1007/3-540-31390-7_11 . ISBN 3-540-29114-8 . ПМИД 16570853 .
- ^ Криауционис С., Хайнц Н. (май 2009 г.). «Основание ядерной ДНК 5-гидроксиметилцитозин присутствует в нейронах Пуркинье и мозге» . Наука . 324 (5929): 929–30. Бибкод : 2009Sci...324..929K . дои : 10.1126/science.1169786 . ПМЦ 3263819 . ПМИД 19372393 .
- ^ Рател Д., Раванат Дж.Л., Бергер Ф., Вион Д. (март 2006 г.). «N6-метиладенин: другое метилированное основание ДНК» . Биоэссе . 28 (3): 309–15. doi : 10.1002/bies.20342 . ПМК 2754416 . ПМИД 16479578 .
- ^ Гоммерс-Ампт Дж.Х., Ван Леувен Ф., де Бир А.Л., Влигентхарт Дж.Ф., Диздароглу М., Ковалак Дж.А., Крейн П.Ф., Борст П. (декабрь 1993 г.). «Бета-D-глюкозилгидроксиметилурацил: новое модифицированное основание, присутствующее в ДНК паразитического простейшего T. brucei». Клетка . 75 (6): 1129–36. дои : 10.1016/0092-8674(93)90322-H . hdl : 1874/5219 . ПМИД 8261512 . S2CID 24801094 .
- ↑ Создано на основе PDB 1JDG. Архивировано 22 сентября 2008 г. на Wayback Machine.
- ^ Дуки Т., Рейно-Анджелин А., Кадет Дж., Сейдж Э. (август 2003 г.). «Бипиримидиновые фотопродукты, а не окислительные повреждения, являются основным типом повреждений ДНК, участвующих в генотоксическом эффекте солнечного UVA-излучения». Биохимия . 42 (30): 9221–26. дои : 10.1021/bi034593c . ПМИД 12885257 .
- ^ Кадет Дж., Делатур Т., Дуки Т., Гаспарутто Д., Пуже Ж.П., Раванат Дж.Л., Саваиго С. (март 1999 г.). «Гидроксильные радикалы и повреждение оснований ДНК». Мутационные исследования . 424 (1–2): 9–21. Бибкод : 1999MRFMM.424....9C . дои : 10.1016/S0027-5107(99)00004-4 . ПМИД 10064846 .
- ^ Бекман К.Б., Эймс Б.Н. (август 1997 г.). «Окислительный распад ДНК» . Журнал биологической химии . 272 (32): 19633–36. дои : 10.1074/jbc.272.32.19633 . ПМИД 9289489 .
- ^ Валери К., Повирк Л.Ф. (сентябрь 2003 г.). «Регуляция и механизмы восстановления двухцепочечных разрывов млекопитающих» . Онкоген . 22 (37): 5792–812. дои : 10.1038/sj.onc.1206679 . ПМИД 12947387 .
- ^ Джонсон Дж. (28 декабря 2010 г.). «Раскопки доисторических опухолей и дебаты» . Нью-Йорк Таймс . Архивировано из оригинала 24 июня 2017 года.
Если бы мы жили достаточно долго, рано или поздно мы все заболели бы раком.
- ^ Альбертс Б., Джонсон А., Льюис Дж. и др. (2002). «Предупредимые причины рака» . Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 0-8153-4072-9 . Архивировано из оригинала 2 января 2016 года.
Независимо от обстоятельств следует ожидать определенной неснижаемой фоновой заболеваемости раком: мутаций никогда нельзя полностью избежать, поскольку они являются неизбежным следствием фундаментальных ограничений точности репликации ДНК, как обсуждается в Глава 5. Если бы человек мог жить достаточно долго, неизбежно, что хотя бы одна из его клеток со временем накопила бы набор мутаций, достаточный для развития рака.
- ^ Бернштейн Х., Пейн С.М., Бернштейн С., Гаревал Х., Дворжак К. (2008). «Рак и старение как последствия невосстановленного повреждения ДНК» . Кимура Х, Сузуки А (ред.). Новое исследование повреждения ДНК . Нью-Йорк: Издательство Nova Science. стр. 1–47. ISBN 978-1-60456-581-2 . Архивировано из оригинала 25 октября 2014 года.
- ^ Хоймейкерс Дж. Х. (октябрь 2009 г.). «Повреждение ДНК, старение и рак». Медицинский журнал Новой Англии . 361 (15): 1475–85. дои : 10.1056/NEJMra0804615 . ПМИД 19812404 .
- ^ Фрейтас А.А., де Магальяйнс ЖП (2011). «Обзор и оценка теории старения, связанной с повреждением ДНК». Мутационные исследования . 728 (1–2): 12–22. Бибкод : 2011MRRMR.728...12F . дои : 10.1016/j.mrrev.2011.05.001 . ПМИД 21600302 .
- ^ Фергюсон Л.Р., Денни В.А. (сентябрь 1991 г.). «Генетическая токсикология акридинов». Мутационные исследования . 258 (2): 123–60. дои : 10.1016/0165-1110(91)90006-H . ПМИД 1881402 .
- ^ Стивенс Т.Д., Бунде С.Дж., Филлмор Б.Дж. (июнь 2000 г.). «Механизм действия талидомида при тератогенезе». Биохимическая фармакология . 59 (12): 1489–99. дои : 10.1016/S0006-2952(99)00388-3 . ПМИД 10799645 .
- ^ Джеффри А.М. (1985). «Модификация ДНК химическими канцерогенами». Фармакология и терапия . 28 (2): 237–72. дои : 10.1016/0163-7258(85)90013-0 . ПМИД 3936066 .
- ^ Бранья М.Ф., Качо М., Градиллас А., де Паскуаль-Тереза Б., Рамос А. (ноябрь 2001 г.). «Интеркаляторы как противораковые препараты». Текущий фармацевтический дизайн . 7 (17): 1745–80. дои : 10.2174/1381612013397113 . ПМИД 11562309 .
- ^ Вентер Дж.К., Адамс М.Д., Майерс Э.В., Ли П.В., Мурал Р.Дж., Саттон Г.Г. и др. (февраль 2001 г.). «Последовательность генома человека» . Наука . 291 (5507): 1304–51. Бибкод : 2001Sci...291.1304V . дои : 10.1126/science.1058040 . ПМИД 11181995 .
- ^ Танбихлер М., Ван С.К., Шапиро Л. (октябрь 2005 г.). «Бактериальный нуклеоид: высокоорганизованная и динамичная структура» . Журнал клеточной биохимии . 96 (3): 506–21. дои : 10.1002/jcb.20519 . ПМИД 15988757 .
- ^ Вольфсберг Т.Г., Макинтайр Дж., Шулер Г.Д. (февраль 2001 г.). «Руководство к проекту генома человека» . Природа . 409 (6822): 824–26. Бибкод : 2001Natur.409..824W . дои : 10.1038/35057000 . ПМИД 11236998 .
- ^ Григорий Т.Р. (январь 2005 г.). «Загадка значения C у растений и животных: обзор параллелей и призыв к партнерству» . Анналы ботаники . 95 (1): 133–46. дои : 10.1093/aob/mci009 . ПМЦ 4246714 . ПМИД 15596463 .
- ^ Бирни Э., Стаматояннопулос Х.А. , Дутта А., Гиго Р., Гингерас Т.Р., Маргулис Э.Х. и др. (июнь 2007 г.). «Идентификация и анализ функциональных элементов в 1% генома человека в рамках пилотного проекта ENCODE» . Природа . 447 (7146): 799–816. Бибкод : 2007Natur.447..799B . дои : 10.1038/nature05874 . ПМК 2212820 . ПМИД 17571346 .
- ^ Инь Ю.В., Стейц Т.А. «RCSB PDB – 1MSW: Структурная основа перехода от инициации к элонгационной транскрипции в РНК-полимеразе Т7» . www.rcsb.org . Проверено 27 марта 2023 г.
- ^ Пиду А.Л., Олшир RC (март 2005 г.). «Роль гетерохроматина в функции центромеры» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 360 (1455): 569–79. дои : 10.1098/rstb.2004.1611 . ПМЦ 1569473 . ПМИД 15905142 .
- ^ Харрисон П.М., Хеджи Х., Баласубраманян С., Ласкомб Н.М., Бертоне П., Эколс Н., Джонсон Т., Герштейн М. (февраль 2002 г.). «Молекулярные окаменелости в геноме человека: идентификация и анализ псевдогенов в хромосомах 21 и 22» . Геномные исследования . 12 (2): 272–80. дои : 10.1101/гр.207102 . ПМК 155275 . ПМИД 11827946 .
- ^ Харрисон П.М., Герштейн М. (май 2002 г.). «Изучение геномов на протяжении веков: семейства белков, псевдогены и эволюция протеома». Журнал молекулярной биологии . 318 (5): 1155–74. дои : 10.1016/S0022-2836(02)00109-2 . ПМИД 12083509 .
- ^ Альба М (2001). «Репликативные ДНК-полимеразы» . Геномная биология . 2 (1): ОБЗОРЫ3002. doi : 10.1186/gb-2001-2-1-reviews3002 . ПМК 150442 . ПМИД 11178285 .
- ^ Тани К., Насу М (2010). «Роль внеклеточной ДНК в бактериальных экосистемах». В: Кикучи Ю., Рыкова Е.Ю. (ред.). Внеклеточные нуклеиновые кислоты . Спрингер. стр. 25–38 . ISBN 978-3-642-12616-1 .
- ^ Власов В.В., Лактионов П.П., Рыкова Е.Ю. (июль 2007 г.). «Внеклеточные нуклеиновые кислоты». Биоэссе . 29 (7): 654–67. doi : 10.1002/bies.20604 . ПМИД 17563084 . S2CID 32463239 .
- ^ Финкель С.Е., Колтер Р. (ноябрь 2001 г.). «ДНК как питательное вещество: новая роль гомологов генов бактериальной компетентности» . Журнал бактериологии . 183 (21): 6288–93. дои : 10.1128/JB.183.21.6288-6293.2001 . ПМК 100116 . ПМИД 11591672 .
- ^ Малкахи Х., Чаррон-Мазенод Л., Левенца С. (ноябрь 2008 г.). «Внеклеточная ДНК хелатирует катионы и индуцирует устойчивость к антибиотикам в биопленках Pseudomonas aeruginosa» . ПЛОС Патогены . 4 (11): e1000213. дои : 10.1371/journal.ppat.1000213 . ПМК 2581603 . ПМИД 19023416 .
- ^ Берн С., Кисела Д.Т., Брун Ю.В. (август 2010 г.). «Бактериальная внеклеточная ДНК ингибирует заселение подвижных клеток-потомков внутри биопленки» . Молекулярная микробиология . 77 (4): 815–29. дои : 10.1111/j.1365-2958.2010.07267.x . ПМЦ 2962764 . ПМИД 20598083 .
- ^ Уитчерч CB, Толкер-Нильсен Т, Рагас ПК, Мэттик Дж.С. (февраль 2002 г.). «Внеклеточная ДНК, необходимая для образования бактериальной биопленки». Наука . 295 (5559): 1487. doi : 10.1126/science.295.5559.1487 . ПМИД 11859186 .
- ^ Ху В., Ли Л., Шарма С., Ван Дж., Макхарди И., Люкс Р., Ян З., Хе Х, Гимжевски Дж.К., Ли Ю., Ши В. (2012). «ДНК строит и укрепляет внеклеточный матрикс в биопленках Myxococcus xanthus путем взаимодействия с экзополисахаридами» . ПЛОС ОДИН . 7 (12): е51905. Бибкод : 2012PLoSO...751905H . дои : 10.1371/journal.pone.0051905 . ПМЦ 3530553 . ПМИД 23300576 .
- ^ Хуэй Л., Бьянки Д.В. (февраль 2013 г.). «Последние достижения в пренатальном исследовании генома плода человека» . Тенденции в генетике . 29 (2): 84–91. дои : 10.1016/j.tig.2012.10.013 . ПМЦ 4378900 . ПМИД 23158400 .
- ^ Фут А.Д., Томсен П.Ф., Свегаард С., Уолберг М., Килгаст Дж., Кин Л.А. и др. (2012). «Исследование потенциального использования ДНК окружающей среды (эДНК) для генетического мониторинга морских млекопитающих» . ПЛОС ОДИН . 7 (8): е41781. Бибкод : 2012PLoSO...741781F . дои : 10.1371/journal.pone.0041781 . ПМЦ 3430683 . ПМИД 22952587 .
- ^ «Исследователи обнаруживают наземных животных, используя ДНК в близлежащих водоемах» .
- ^ Сэндман К., Перейра С.Л., Рив Дж.Н. (декабрь 1998 г.). «Разнообразие прокариотических хромосомных белков и происхождение нуклеосомы» . Клеточные и молекулярные науки о жизни . 54 (12): 1350–64. дои : 10.1007/s000180050259 . ПМЦ 11147202 . ПМИД 9893710 . S2CID 21101836 .
- ^ Дама RT (май 2005 г.). «Роль нуклеоид-ассоциированных белков в организации и уплотнении бактериального хроматина» . Молекулярная микробиология . 56 (4): 858–70. дои : 10.1111/j.1365-2958.2005.04598.x . ПМИД 15853876 . S2CID 26965112 .
- ^ Люгер К., Мэдер А.В., Ричмонд Р.К., Сарджент Д.Ф., Ричмонд Т.Дж. (сентябрь 1997 г.). «Кристаллическая структура ядра нуклеосомы при разрешении 2,8 А». Природа . 389 (6648): 251–60. Бибкод : 1997Natur.389..251L . дои : 10.1038/38444 . ПМИД 9305837 . S2CID 4328827 .
- ^ Дженувейн Т., Эллис, компакт-диск (август 2001 г.). «Трансляция кода гистонов» (PDF) . Наука . 293 (5532): 1074–80. дои : 10.1126/science.1063127 . ПМИД 11498575 . S2CID 1883924 . Архивировано (PDF) из оригинала 8 августа 2017 года.
- ^ Ито Т (2003). «Сборка и ремоделирование нуклеосом». Белковые комплексы, модифицирующие хроматин . Актуальные темы микробиологии и иммунологии. Том. 274. стр. 1–22. дои : 10.1007/978-3-642-55747-7_1 . ISBN 978-3-540-44208-0 . ПМИД 12596902 .
- ^ Томас Дж. О. (август 2001 г.). «HMG1 и 2: архитектурные ДНК-связывающие белки». Труды Биохимического общества . 29 (Часть 4): 395–401. дои : 10.1042/BST0290395 . ПМИД 11497996 .
- ^ Гросседль Р., Гизе К., Пейджел Дж. (март 1994 г.). «Белки домена HMG: архитектурные элементы сборки нуклеопротеиновых структур». Тенденции в генетике . 10 (3): 94–100. дои : 10.1016/0168-9525(94)90232-1 . ПМИД 8178371 .
- ^ Ифтоде С., Дэниели Ю., Боровец Дж.А. (1999). «Репликационный белок A (RPA): эукариотический SSB». Критические обзоры по биохимии и молекулярной биологии . 34 (3): 141–80. дои : 10.1080/10409239991209255 . ПМИД 10473346 .
- ^ Бимер Л.Дж., Пабо Ко. «RCSB PDB - 1LMB: уточненная кристаллическая структура 1,8 Å лямбда-репрессорно-операторного комплекса» . www.rcsb.org . Проверено 27 марта 2023 г.
- ^ Майерс Л.С., Корнберг Р.Д. (2000). «Медиатор регуляции транскрипции». Ежегодный обзор биохимии . 69 : 729–49. doi : 10.1146/annurev.biochem.69.1.729 . ПМИД 10966474 .
- ^ Шпигельман Б.М., Генрих Р. (октябрь 2004 г.). «Биологический контроль посредством регулируемых коактиваторов транскрипции» . Клетка . 119 (2): 157–67. дои : 10.1016/j.cell.2004.09.037 . ПМИД 15479634 .
- ^ Ли З, Ван Калкар С, Цюй С, Кавени В.К., Чжан М.К., Рен Б. (июль 2003 г.). «Глобальная регуляторная роль транскрипции c-Myc в клетках лимфомы Беркитта» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (14): 8164–69. Бибкод : 2003PNAS..100.8164L . дои : 10.1073/pnas.1332764100 . ПМК 166200 . ПМИД 12808131 .
- ^ Кострева Д, Винклер ФК. «RCSB PDB – 1RVA: Связывание Mg2+ с активным сайтом эндонуклеазы EcoRV: кристаллографическое исследование комплексов с ДНК субстрата и продукта при разрешении 2 Å» . www.rcsb.org . Проверено 27 марта 2023 г.
- ^ Бикл Т.А., Крюгер Д.Х. (июнь 1993 г.). «Биология рестрикции ДНК» . Микробиологические обзоры . 57 (2): 434–50. дои : 10.1128/MMBR.57.2.434-450.1993 . ПМК 372918 . ПМИД 8336674 .
- ↑ Перейти обратно: Перейти обратно: а б Доэрти AJ, Suh SW (ноябрь 2000 г.). «Структурная и механистическая консервативность ДНК-лигаз» . Исследования нуклеиновых кислот . 28 (21): 4051–58. дои : 10.1093/нар/28.21.4051 . ПМК 113121 . ПМИД 11058099 .
- ^ Шеффлер А.Дж., Бергер Дж.М. (декабрь 2005 г.). «Последние достижения в понимании структурно-функциональных взаимоотношений в механизме топоизомеразы типа II». Труды Биохимического общества . 33 (Часть 6): 1465–70. дои : 10.1042/BST20051465 . ПМИД 16246147 .
- ^ Тутея Н., Тутея Р. (май 2004 г.). «Распутывание ДНК-хеликаз. Мотив, структура, механизм и функция» (PDF) . Европейский журнал биохимии . 271 (10): 1849–63. дои : 10.1111/j.1432-1033.2004.04094.x . ПМИД 15128295 .
- ^ Джойс К.М., Стейц Т.А. (ноябрь 1995 г.). «Структуры и функции полимеразы: вариации на тему?» . Журнал бактериологии . 177 (22): 6321–29. дои : 10.1128/jb.177.22.6321-6329.1995 . ПМК 177480 . ПМИД 7592405 .
- ^ Хубшер У, Мага Г, Спадари С (2002). «Эукариотические ДНК-полимеразы» (PDF) . Ежегодный обзор биохимии . 71 : 133–63. doi : 10.1146/annurev.biochem.71.090501.150041 . ПМИД 12045093 . S2CID 26171993 . Архивировано из оригинала (PDF) 26 января 2021 года.
- ^ Джонсон А., О'Доннелл М. (2005). «Клеточные репликазы ДНК: компоненты и динамика на репликационной вилке». Ежегодный обзор биохимии . 74 : 283–315. doi : 10.1146/annurev.biochem.73.011303.073859 . ПМИД 15952889 .
- ↑ Перейти обратно: Перейти обратно: а б Тарраго-Литвак Л., Андреола М.Л., Невинский Г.А., Сарих-Коттин Л., Литвак С. (май 1994 г.). «Обратная транскриптаза ВИЧ-1: от энзимологии к терапевтическому вмешательству» . Журнал ФАСЭБ . 8 (8): 497–503. дои : 10.1096/fasebj.8.8.7514143 . ПМИД 7514143 . S2CID 39614573 .
- ^ Мартинес Э. (декабрь 2002 г.). «Мультибелковые комплексы в транскрипции эукариотических генов». Молекулярная биология растений . 50 (6): 925–47. дои : 10.1023/А:1021258713850 . ПМИД 12516863 . S2CID 24946189 .
- ^ Торп Дж.Х., Гейл БК, Тейшейра СК, Карден С.Дж. «RCSB PDB – 1M6G: Структурная характеристика соединения Холлидея TCGGTACCGA» . www.rcsb.org . Проверено 27 марта 2023 г.
- ^ Кремер Т., Кремер С. (апрель 2001 г.). «Хромосомные территории, ядерная архитектура и регуляция генов в клетках млекопитающих». Обзоры природы Генетика . 2 (4): 292–301. дои : 10.1038/35066075 . ПМИД 11283701 . S2CID 8547149 .
- ^ Пал С., Папп Б., Лерчер М.Дж. (май 2006 г.). «Комплексный взгляд на эволюцию белков». Обзоры природы Генетика . 7 (5): 337–48. дои : 10.1038/nrg1838 . ПМИД 16619049 . S2CID 23225873 .
- ^ О'Дрисколл М., Джегго, Пенсильвания (январь 2006 г.). «Роль восстановления двухцепочечных разрывов – выводы из генетики человека». Обзоры природы Генетика . 7 (1): 45–54. дои : 10.1038/nrg1746 . ПМИД 16369571 . S2CID 7779574 .
- ^ Виспе С., Дефе М. (октябрь 1997 г.). «Белок Rad51 млекопитающих: гомолог RecA с плейотропными функциями». Биохимия . 79 (9–10): 587–92. дои : 10.1016/S0300-9084(97)82007-X . ПМИД 9466696 .
- ^ Нил М.Дж., Кини С. (июль 2006 г.). «Выяснение механики обмена цепей ДНК при мейотической рекомбинации» . Природа . 442 (7099): 153–58. Бибкод : 2006Natur.442..153N . дои : 10.1038/nature04885 . ПМК 5607947 . ПМИД 16838012 .
- ^ Дикман М.Дж., Инглстон С.М., Седельникова С.Е., Рафферти Дж.Б., Ллойд Р.Г., Грасби Дж.А., Хорнби Д.П. (ноябрь 2002 г.). «Резолвасома RuvABC» . Европейский журнал биохимии . 269 (22): 5492–501. дои : 10.1046/j.1432-1033.2002.03250.x . ПМИД 12423347 . S2CID 39505263 .
- ^ Джойс Г.Ф. (июль 2002 г.). «Древность эволюции на основе РНК». Природа . 418 (6894): 214–21. Бибкод : 2002Natur.418..214J . дои : 10.1038/418214a . ПМИД 12110897 . S2CID 4331004 .
- ^ Оргель Л.Е. (2004). «Пребиотическая химия и происхождение мира РНК». Критические обзоры по биохимии и молекулярной биологии . 39 (2): 99–123. CiteSeerX 10.1.1.537.7679 . дои : 10.1080/10409230490460765 . ПМИД 15217990 . S2CID 4939632 .
- ^ Давенпорт Р.Дж. (май 2001 г.). «Рибозимы. Копирование в мире РНК». Наука . 292 (5520): 1278а–1278. дои : 10.1126/science.292.5520.1278a . ПМИД 11360970 . S2CID 85976762 .
- ^ Сатмари Э. (апрель 1992 г.). «Каков оптимальный размер генетического алфавита?» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (7): 2614–18. Бибкод : 1992PNAS...89.2614S . дои : 10.1073/pnas.89.7.2614 . ПМК 48712 . ПМИД 1372984 .
- ^ Линдал Т. (апрель 1993 г.). «Нестабильность и распад первичной структуры ДНК». Природа . 362 (6422): 709–15. Бибкод : 1993Natur.362..709L . дои : 10.1038/362709a0 . ПМИД 8469282 . S2CID 4283694 .
- ^ Вриланд Р.Х., Розенцвейг В.Д., Пауэрс Д.В. (октябрь 2000 г.). «Выделение галотолерантной бактерии возрастом 250 миллионов лет из первичного кристалла соли». Природа . 407 (6806): 897–900. Бибкод : 2000Natur.407..897V . дои : 10.1038/35038060 . ПМИД 11057666 . S2CID 9879073 .
- ^ Хебсгаард М.Б., Филлипс М.Дж., Виллерслев Э. (май 2005 г.). «Геологически древняя ДНК: факт или артефакт?». Тенденции в микробиологии . 13 (5): 212–20. дои : 10.1016/j.tim.2005.03.010 . ПМИД 15866038 .
- ^ Никл, округ Колумбия, Жертв Г.Х., Рейн М.В., Маллинз Дж.И., Миттлер Дж.Э. (январь 2002 г.). «Любопытно современная ДНК бактерии возрастом 250 миллионов лет». Журнал молекулярной эволюции . 54 (1): 134–37. Бибкод : 2002JMolE..54..134N . дои : 10.1007/s00239-001-0025-x . ПМИД 11734907 . S2CID 24740859 .
- ^ Каллахан, член парламента, Смит К.Е., Кливс Х.Дж., Ружичка Дж., Стерн Дж.К., Главин Д.П., Палата представителей, Дворкин Дж.П. (август 2011 г.). «Углеродистые метеориты содержат широкий спектр внеземных азотистых оснований» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (34): 13995–98. Бибкод : 2011PNAS..10813995C . дои : 10.1073/pnas.1106493108 . ПМК 3161613 . ПМИД 21836052 .
- ^ Штайгервальд Дж. (8 августа 2011 г.). «Исследователи НАСА: строительные блоки ДНК можно создавать в космосе» . НАСА . Архивировано из оригинала 23 июня 2015 года . Проверено 10 августа 2011 г.
- ^ Сотрудники ScienceDaily (9 августа 2011 г.). «Строительные блоки ДНК можно создавать в космосе, как показывают данные НАСА» . ScienceDaily . Архивировано из оригинала 5 сентября 2011 года . Проверено 9 августа 2011 г.
- ^ Марлер Р. (3 марта 2015 г.). «НАСА Эймс воспроизводит строительные блоки жизни в лаборатории» . НАСА . Архивировано из оригинала 5 марта 2015 года . Проверено 5 марта 2015 г.
- ^ Хант К. (17 февраля 2021 г.). «Самая старая в мире ДНК секвенирована у мамонта, жившего более миллиона лет назад» . Новости CNN . Проверено 17 февраля 2021 г.
- ^ Каллауэй Э (17 февраля 2021 г.). «Геномы мамонтов возрастом в миллион лет побили рекорд древнейшей древней ДНК — сохранившиеся в вечной мерзлоте зубы возрастом до 1,6 миллиона лет идентифицируют новый вид мамонтов в Сибири» . Природа . 590 (7847): 537–538. Бибкод : 2021Natur.590..537C . дои : 10.1038/d41586-021-00436-x . ISSN 0028-0836 . ПМИД 33597786 .
- ^ Гофф С.П., Берг П. (декабрь 1976 г.). «Конструирование гибридных вирусов, содержащих сегменты ДНК фага SV40 и лямбда, и их размножение в культивируемых клетках обезьян». Клетка . 9 (4 ПТ 2): 695–705. дои : 10.1016/0092-8674(76)90133-1 . ПМИД 189942 . S2CID 41788896 .
- ^ Удебин Л.М. (2007). «Модели трансгенных животных в биомедицинских исследованиях». Обзоры и протоколы обнаружения и проверки целей . Методы молекулярной биологии. Том. 360. стр. 163–202. дои : 10.1385/1-59745-165-7:163 . ISBN 978-1-59745-165-9 . ПМИД 17172731 .
- ^ Дэниел Х., Дхингра А. (апрель 2002 г.). «Мультигенная инженерия: рассвет захватывающей новой эры в биотехнологии» . Современное мнение в области биотехнологии . 13 (2): 136–41. дои : 10.1016/S0958-1669(02)00297-5 . ПМЦ 3481857 . ПМИД 11950565 .
- ^ Работа D (ноябрь 2002 г.). «Биотехнология растений в сельском хозяйстве». Биохимия . 84 (11): 1105–10. дои : 10.1016/S0300-9084(02)00013-5 . ПМИД 12595138 .
- ^ Кертис С., Херевард Дж. (29 августа 2017 г.). «От места преступления до зала суда: путешествие образца ДНК» . Разговор . Архивировано из оригинала 22 октября 2017 года . Проверено 22 октября 2017 г.
- ^ Коллинз А., Мортон Н.Е. (июнь 1994 г.). «Отношения вероятностей идентификации ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (13): 6007–11. Бибкод : 1994PNAS...91.6007C . дои : 10.1073/pnas.91.13.6007 . ПМК 44126 . ПМИД 8016106 .
- ^ Вейр Б.С., Триггс К.М., Старлинг Л., Стоуэлл Л.И., Уолш К.А., Баклтон Дж. (март 1997 г.). «Интерпретация смесей ДНК». Журнал судебной медицины . 42 (2): 213–22. дои : 10.1520/JFS14100J . ПМИД 9068179 . S2CID 14511630 .
- ^ Джеффрис А.Дж., Уилсон В., Тейн С.Л. (1985). «Индивидуально-специфические «отпечатки пальцев» человеческой ДНК» . Природа . 316 (6023): 76–79. Бибкод : 1985Natur.316...76J . дои : 10.1038/316076a0 . ПМИД 2989708 . S2CID 4229883 .
- ^ «Колин Питчфорк» . 14 декабря 2006 г. Архивировано из оригинала 14 декабря 2006 г. Проверено 27 марта 2023 г.
- ^ «Идентификация ДНК в происшествиях с массовой гибелью» . Национальный институт юстиции. Сентябрь 2006 г. Архивировано из оригинала 12 ноября 2006 г.
- ^ Поллак А (19 июня 2012 г.). «Перед рождением папино удостоверение» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 24 июня 2017 года . Проверено 27 марта 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б Брейкер Р.Р., Джойс Г.Ф. (декабрь 1994 г.). «Фермент ДНК, расщепляющий РНК». Химия и биология . 1 (4): 223–29. дои : 10.1016/1074-5521(94)90014-0 . ПМИД 9383394 .
- ^ Чандра М., Сачдева А., Сильверман С.К. (октябрь 2009 г.). «ДНК-катализируемый последовательность-специфический гидролиз ДНК» . Химическая биология природы . 5 (10): 718–20. дои : 10.1038/nchembio.201 . ПМЦ 2746877 . ПМИД 19684594 .
- ^ Карми Н., Шульц Л.А., Брейкер Р.Р. (декабрь 1996 г.). «Селекция саморасщепляющихся ДНК in vitro» . Химия и биология . 3 (12): 1039–46. дои : 10.1016/S1074-5521(96)90170-2 . ПМИД 9000012 .
- ^ Тораби С.Ф., Ву П., МакГи CE, Чен Л., Хван К., Чжэн Н., Ченг Дж., Лу Й. (май 2015 г.). «Выбор in vitro натрий-специфического ДНКзима и его применение во внутриклеточном зондировании» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (19): 5903–08. Бибкод : 2015PNAS..112.5903T . дои : 10.1073/pnas.1420361112 . ПМЦ 4434688 . ПМИД 25918425 .
- ^ Балди П. , Брунак С. (2001). Биоинформатика: подход машинного обучения . МТИ Пресс. ISBN 978-0-262-02506-5 . OCLC 45951728 .
- ^ Гасфилд Д. (15 января 1997 г.). Алгоритмы на строках, деревьях и последовательностях: информатика и вычислительная биология . Издательство Кембриджского университета . ISBN 978-0-521-58519-4 .
- ^ Шёландер К. (январь 2004 г.). «Филогеномный вывод о молекулярной функции белка: достижения и проблемы». Биоинформатика . 20 (2): 170–79. CiteSeerX 10.1.1.412.943 . doi : 10.1093/биоинформатика/bth021 . ПМИД 14734307 .
- ^ Гора ДМ (2004). Биоинформатика: анализ последовательностей и генома (2-е изд.). Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. ISBN 0-87969-712-1 . OCLC 55106399 .
- ^ Стронг М (март 2004 г.). «Белковые наномашины» . ПЛОС Биология . 2 (3): Е73. дои : 10.1371/journal.pbio.0020073 . ПМЦ 368168 . ПМИД 15024422 . S2CID 13222080 .
- ^ Ротемунд П.В. (март 2006 г.). «Складывание ДНК для создания наноразмерных форм и узоров» (PDF) . Природа . 440 (7082): 297–302. Бибкод : 2006Natur.440..297R . дои : 10.1038/nature04586 . ПМИД 16541064 . S2CID 4316391 .
- ^ Андерсен Э.С., Донг М., Нильсен М.М., Ян К., Субрамани Р., Мамдух В., Голас М.М., Сандер Б., Старк Х., Оливейра К.Л., Педерсен Дж.С., Биркедал В., Безенбахер Ф., Готельф К.В., Кьемс Дж. (май 2009 г.). «Самостоятельная сборка наноразмерного ящика ДНК с управляемой крышкой». Природа . 459 (7243): 73–76. Бибкод : 2009Natur.459...73A . дои : 10.1038/nature07971 . hdl : 11858/00-001M-0000-0010-9362-B . ПМИД 19424153 . S2CID 4430815 .
- ^ Исицука Ю, Ха Т (май 2009 г.). «ДНК-нанотехнология: наномашина начинает работать». Природные нанотехнологии . 4 (5): 281–82. Бибкод : 2009НатНа...4..281И . дои : 10.1038/nnano.2009.101 . ПМИД 19421208 .
- ^ Алдай Ф.А., Палмер А.Л., Слейман Х.Ф. (сентябрь 2008 г.). «Сборка материалов с использованием ДНК в качестве руководства». Наука . 321 (5897): 1795–99. Бибкод : 2008Sci...321.1795A . дои : 10.1126/science.1154533 . ПМИД 18818351 . S2CID 2755388 .
- ^ Данн М.Р., Хименес Р.М., Чапут Дж.К. (2017). «Анализ открытия и технологии аптамеров» . Обзоры природы Химия . 1 (10). дои : 10.1038/s41570-017-0076 . Проверено 30 июня 2022 г.
- ^ Рэй Г.А. (2002). «Датирование ветвей на древе жизни с помощью ДНК» . Геномная биология . 3 (1): ОБЗОРЫ0001. doi : 10.1186/gb-2001-3-1-reviews0001 . ПМК 150454 . ПМИД 11806830 .
- ^ Панда Д., Молла К.А., Байг М.Дж., Суэйн А., Бехера Д., Дэш М. (май 2018 г.). «ДНК как устройство хранения цифровой информации: надежда или обман?» . 3 Биотехнологии . 8 (5): 239. дои : 10.1007/s13205-018-1246-7 . ПМЦ 5935598 . ПМИД 29744271 .
- ^ Акрам Ф., Хак И.Ю., Али Х., Лагари А.Т. (октябрь 2018 г.). «Тенденции к хранению цифровых данных в ДНК: обзор». Отчеты по молекулярной биологии . 45 (5): 1479–1490. дои : 10.1007/s11033-018-4280-y . ПМИД 30073589 . S2CID 51905843 .
- ^ Мишер Ф (1871). «О химическом составе гнойных клеток». Медико-химические исследования (на немецком языке). 4 : 441–60.
[стр. 456] Поэтому позже я сосредоточил свои эксперименты на целых ядрах, оставив разделение тел, которые я буду пока без дальнейших предубеждений называть растворимыми и нерастворимыми ядрами, более благоприятному материалу. (Поэтому в своих опытах я впоследствии ограничился всем ядром, оставив более благоприятному материалу разделение веществ, который пока без дальнейшего ущерба буду обозначать как растворимый и нерастворимый ядерный материал («Нуклеин»). )
- ^ Дам Р. (январь 2008 г.). «Открытие ДНК: Фридрих Мишер и первые годы исследований нуклеиновых кислот». Генетика человека . 122 (6): 565–81. дои : 10.1007/s00439-007-0433-0 . ПМИД 17901982 . S2CID 915930 .
- ^ См.:
- Коссель А (1879 г.). «Ueber Nucleïn der Hefe» [О нуклеине дрожжей]. Журнал физиологической химии (на немецком языке). 3 :284–91.
- Коссель А (1880). «Ueber Nucleïn der Hefe II» [О нуклеине дрожжей, Часть 2]. Журнал физиологической химии (на немецком языке). 4 :290-95.
- Коссель А (1881). «О распространении гипоксантинов в животном и растительном царстве» . Журнал физиологической химии (на немецком языке). 5 :267–71.
- Коссель А (1881). Клауди К.Дж. (ред.). и продуктов его расщепления Исследования нуклеина (на немецком языке). Страсбург, Германия. п. 19.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - Коссель А (1882). «Ueber Xanthin und Hypoxanthin» [О ксантине и гипоксантине]. Журнал физиологической химии . 6 : 422–31.
- Альбрект Коссель (1883 г.) «О химии клеточного ядра». Архивировано 17 ноября 2017 г. в Wayback Machine (О химии клеточного ядра), Журнал физиологической химии , 7 : 7–22.
- Коссель А (1886). «Дальнейший вклад в химию клеточного ядра» . Журнал физиологической химии (на немецком языке). 10 :248–64.
На стр. 264, Коссель прозорливо заметил: «Исследование количественных соотношений четырех богатых азотом оснований и зависимости их количества от физиологического состояния клетки обещает важные сведения об элементарных физиолого-химических процессах. (Изучение количественных отношений четырех азотистых оснований — [и] зависимости их количества от физиологического состояния клетки — обещает важное понимание фундаментальных физиолого-химических процессов.)
- ^ Джонс М.Э. (сентябрь 1953 г.). «Альбрехт Коссель, биографический очерк» . Йельский журнал биологии и медицины . 26 (1): 80–97. ПМК 2599350 . ПМИД 13103145 .
- ^ Левен П.А., Джейкобс В.А. (1909). «Об инозиновой кислоте» . Отчеты Немецкого химического общества (на немецком языке). 42 : 1198-203. дои : 10.1002/cber.190904201196 .
- ^ Левен П.А., Джейкобс В.А. (1909). «О нуклеиновой кислоте дрожжей» . Отчеты Немецкого химического общества (на немецком языке). 42 (2): 2474–78. дои : 10.1002/cber.190904202148 .
- ^ Левен П. (1919). «Строение нуклеиновой кислоты дрожжей» . J Биол Хим . 40 (2): 415–24. дои : 10.1016/S0021-9258(18)87254-4 .
- ^ Коэн Дж.С., Португалия, FH (1974). «Поиски химической структуры ДНК» (PDF) . Медицина Коннектикута . 38 (10): 551–52, 554–57. ПМИД 4609088 .
- ^ Кольцов предположил, что генетическая информация клетки закодирована в длинной цепочке аминокислот. Видеть:
- Кольцов Х.К. (12 декабря 1927 г.). Физико-химические основы морфологии [ Физико-химические основы морфологии ] (Речь). 3-е Всесоюзное совещание зоологов, анатомов и гистологов (на русском языке). Ленинград, СССР
- Перепечатано в: Koltsov HK (1928). "Физико-химические основы морфологии" [The physical-chemical basis of morphology]. Успехи экспериментальной биологии (Advances in Experimental Biology) series B (in Russian). 7 (1): ?.
- Перепечатано на немецком языке как: Кольцов Н.К. (1928). «Физико-химические основы морфологии». Центральный биологический журнал (на немецком языке). 48 (6): 345–69.
- В 1934 году Кольцов предположил, что белки, содержащие генетическую информацию клетки, реплицируются. Видеть: Кольцов Н. (октябрь 1934 г.). «Строение хромосом слюнных желез дрозофилы». Наука . 80 (2075): 312–13. Бибкод : 1934Sci....80..312K . дои : 10.1126/science.80.2075.312 . ПМИД 17769043 .
Со стр. 313: «Я думаю, что размер хромосом в слюнных железах [дрозофилы] определяется путем умножения геномов . Этим термином я обозначаю осевую нить хромосомы, в которой генетики обнаруживают линейную комбинацию гены; … В нормальной хромосоме обычно имеется только одна генома, до деления клетки эта генома разделилась на две нити».
- ^ Сойфер В.Н. (сентябрь 2001 г.). «Последствия политической диктатуры для российской науки». Обзоры природы Генетика . 2 (9): 723–29. дои : 10.1038/35088598 . ПМИД 11533721 . S2CID 46277758 .
- ^ Гриффит Ф. (январь 1928 г.). «Значение типов пневмококков» . Журнал гигиены . 27 (2): 113–59. дои : 10.1017/S0022172400031879 . ПМК 2167760 . ПМИД 20474956 .
- ^ Лоренц М.Г., Вакернагель В. (сентябрь 1994 г.). «Бактериальный перенос генов путем естественной генетической трансформации в окружающей среде» . Микробиологические обзоры . 58 (3): 563–602. дои : 10.1128/MMBR.58.3.563-602.1994 . ПМК 372978 . ПМИД 7968924 .
- ^ Браше Дж (1933). «Исследование синтеза тимонуклеиновой кислоты при развитии яйца морского ежа». Архивы биологии (на итальянском языке). 44 :519–76.
- ^ Буриан Р. (1994). «Цитохимическая эмбриология Жана Браше: связь с обновлением биологии во Франции?» (PDF) . В Дебрю С., Гайоне Дж., Пикарде Дж. Ф. (ред.). Биологические и медицинские науки во Франции 1920–1950 гг . Тетради для истории исследований. Полет. 2. Париж: Издания CNRS. стр. 207–20.
- ^ См.:
- Эстбери В.Т., Белл ФО (1938). «Некоторые последние достижения в области рентгеновского исследования белков и родственных структур» (PDF) . Симпозиумы Колд-Спринг-Харбор по количественной биологии . 6 : 109–21. дои : 10.1101/sqb.1938.006.01.013 . Архивировано из оригинала (PDF) 14 июля 2014 года.
- Эстбери WT (1947). «Рентгеновские исследования нуклеиновых кислот» . Симпозиумы Общества экспериментальной биологии (1): 66–76. ПМИД 20257017 . Архивировано из оригинала 5 июля 2014 года.
- ^ Эйвери ОТ, Маклауд СМ, Маккарти М (февраль 1944 г.). «Исследование химической природы вещества, индуцирующего трансформацию пневмококков типа: индукция трансформации фракцией дезоксирибонуклеиновой кислоты, выделенной из пневмококка III типа» . Журнал экспериментальной медицины . 79 (2): 137–158. дои : 10.1084/jem.79.2.137 . ПМК 2135445 . ПМИД 19871359 .
- ^ Чаргафф Э (июнь 1950 г.). «Химическая специфичность нуклеиновых кислот и механизм их ферментативной деградации». Эксперименты . 6 (6): 201–209. дои : 10.1007/BF02173653 . ПМИД 15421335 . S2CID 2522535 .
- ^ Кресге Н., Симони Р.Д., Хилл Р.Л. (июнь 2005 г.). «Правила Чаргаффа: работа Эрвина Чаргаффа» . Журнал биологической химии . 280 (24): 172–174. дои : 10.1016/S0021-9258(20)61522-8 .
- ^ Херши А.Д., Чейз М. (май 1952 г.). «Независимые функции вирусного белка и нуклеиновой кислоты в росте бактериофага» . Журнал общей физиологии . 36 (1): 39–56. дои : 10.1085/jgp.36.1.39 . ПМК 2147348 . ПМИД 12981234 .
- ^ «Изображения и иллюстрации: Кристаллографическая фотография тимонуклеата натрия, тип Б. «Фото 51. Май 1952 г.» . Scarc.library.oregonstate.edu . Проверено 18 мая 2023 г.
- ^ Шварц Дж. (2008). В поисках гена: от Дарвина к ДНК . Кембридж, Массачусетс: Издательство Гарвардского университета. ISBN 978-0-674-02670-4 .
- ^ Полинг Л., Кори Р.Б. (февраль 1953 г.). «Предлагаемая структура нуклеиновых кислот» . Труды Национальной академии наук Соединенных Штатов Америки . 39 (2): 84–97. Бибкод : 1953ПНАС...39...84П . дои : 10.1073/pnas.39.2.84 . ПМЦ 1063734 . ПМИД 16578429 .
- ^ Реджис Э (2009). Что такое жизнь?: исследование природы жизни в эпоху синтетической биологии . Оксфорд: Издательство Оксфордского университета . п. 52. ИСБН 978-0-19-538341-6 .
- ^ «Двойная спираль ДНК: 50 лет» . Архивы природы . Архивировано из оригинала 5 апреля 2015 года.
- ^ «Оригинальное рентгеновское дифракционное изображение» . Государственная библиотека Орегона. Архивировано из оригинала 30 января 2009 года . Проверено 6 февраля 2011 г.
- ^ Бураков М. (25 апреля 2023 г.). «Роль Розалинд Франклин в открытии ДНК приобретает новый поворот» . АП Новости . Проверено 25 апреля 2023 г.
- ^ Антес Э (25 апреля 2023 г.). «Распутывание роли Розалинды Франклин в открытии ДНК, 70 лет спустя. Историки уже давно обсуждают роль, которую доктор Франклин сыграла в открытии двойной спирали. В новом эссе утверждается, что она внесла «равный вклад» » . Нью-Йорк Таймс . Архивировано из оригинала 25 апреля 2023 года . Проверено 26 апреля 2023 г.
- ^ Кобб М., Комфорт Н (25 апреля 2023 г.). «Что Розалинда Франклин действительно внесла в открытие структуры ДНК, так это то, что Франклин не стала жертвой того, как была решена двойная спираль ДНК. Пропущенное письмо и неопубликованная новостная статья, написанные в 1953 году, показывают, что она была равным игроком» . Природа . 616 (7958): 657–660. дои : 10.1038/d41586-023-01313-5 . ПМИД 37100935 . S2CID 258314143 .
- ^ «Нобелевская премия по физиологии и медицине 1962 года» . Нобелевская премия.org .
- ^ Мэддокс Б. (январь 2003 г.). «Двойная спираль и «обиженная героиня» » (PDF) . Природа . 421 (6921): 407–08. Бибкод : 2003Natur.421..407M . дои : 10.1038/nature01399 . ПМИД 12540909 . S2CID 4428347 . Архивировано (PDF) из оригинала 17 октября 2016 г.
- ^ Крик Ф.Х. (1955). Заметка для Tie Club RNA (PDF) (Выступление). Кембридж, Англия. Архивировано из оригинала (PDF) 1 октября 2008 года.
- ^ Мезельсон М., Шталь Ф.В. (июль 1958 г.). «Репликация ДНК в Escherichia Coli» . Труды Национальной академии наук Соединенных Штатов Америки . 44 (7): 671–82. Бибкод : 1958ПНАС...44..671М . дои : 10.1073/pnas.44.7.671 . ПМК 528642 . ПМИД 16590258 .
- ^ «Нобелевская премия по физиологии и медицине 1968 года» . Нобелевская премия.org .
- ^ Молись Л (2008). «Открытие структуры и функции ДНК: Уотсон и Крик». Природное образование . 1 (1): 100.
- ^ Паннеерчелвам С., Норазми М.Н. (2003). «Судебно-медицинское профилирование ДНК и база данных» . Малазийский журнал медицинских наук . 10 (2): 20–26. ПМК 3561883 . ПМИД 23386793 .
Дальнейшее чтение
- Берри А., Уотсон Дж (2003). ДНК: секрет жизни . Нью-Йорк: Альфред А. Кнопф. ISBN 0-375-41546-7 .
- Калладайн С.Р., Дрю Х.Р., Луизи Б.Ф., Трэверс А.А. (2003). Понимание ДНК: молекула и как она работает . Амстердам: Elsevier Academic Press. ISBN 0-12-155089-3 .
- Карина Д., Клейтон Дж. (2003). 50 лет ДНК . Бейзингсток: Пэлгрейв Макмиллан. ISBN 1-4039-1479-6 .
- Джадсон Х.Ф. (1979). Восьмой день творения: творцы революции в биологии (2-е изд.). Лабораторный пресс Колд-Спринг-Харбор. ISBN 0-671-22540-5 .
- Олби RC (1994). Путь к двойной спирали: открытие ДНК . Нью-Йорк: Dover Publications. ISBN 0-486-68117-3 . Впервые опубликовано в октябре 1974 года издательством Макмиллан с предисловием Фрэнсиса Крика; полный учебник по ДНК, пересмотренный в 1994 году с девятистраничным постскриптумом.
- Олби Р. (январь 2003 г.). «Тихий дебют двойной спирали» . Природа . 421 (6921): 402–05. Бибкод : 2003Natur.421..402O . дои : 10.1038/nature01397 . ПМИД 12540907 .
- Олби RC (2009). Фрэнсис Крик: Биография . Плейнвью, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. ISBN 978-0-87969-798-3 .
- Миклас Д. (2003). ДНК-наука: первый курс . Пресса Колд-Спринг-Харбор. ISBN 978-0-87969-636-8 .
- Ридли М. (2006). Фрэнсис Крик: первооткрыватель генетического кода . Эшленд, Огайо: Жизни выдающихся людей, Atlas Books. ISBN 0-06-082333-Х .
- Розенфельд I (2010). ДНК: графическое руководство по молекуле, потрясшей мир . Издательство Колумбийского университета. ISBN 978-0-231-14271-7 .
- Шульц М., Кэннон Z (2009). Суть жизни: графическое руководство по генетике и ДНК . Хилл и Ван. ISBN 978-0-8090-8947-5 .
- Стент Г.С. , Уотсон Дж. (1980). Двойная спираль: личный отчет об открытии структуры ДНК . Нью-Йорк: Нортон. ISBN 0-393-95075-1 .
- Уотсон Дж (2004). ДНК: Тайна жизни . Случайный дом. ISBN 978-0-09-945184-6 .
- Уилкинс М (2003). Третий человек двойной спирали автобиография Мориса Уилкинса . Кембридж, Англия: Университетское издательство. ISBN 0-19-860665-6 .
Внешние ссылки
- ДНК в Керли
- Предсказание сайта связывания ДНК на белке
- ДНК: игра «Двойная спираль» С официального сайта Нобелевской премии.
- ДНК под электронным микроскопом
- Учебный центр ДНК Долана
- Двойная спираль: 50 лет ДНК , Природа
- Протеопедия ДНК
- Протеопедия Формы_ДНК
- Обозреватель тем ENCODE Домашняя страница ENCODE на сайте Nature
- Двойная спираль 1953–2003 Национальный центр биотехнологического образования
- Модули генетического образования для учителей – «ДНК с самого начала» Учебное пособие
- PDB Молекула месяца ДНК
- «Найден ключ к разгадке химии наследственности» . The New York Times , июнь 1953 года. Первое освещение в американской газете открытия структуры ДНК.
- ДНК с самого начала Еще один сайт Центра изучения ДНК, посвященный ДНК, генам и наследственности от Менделя до проекта генома человека.
- Реестр личных документов Фрэнсиса Крика 1938–2007 годов в библиотеке специальных коллекций Мандевиля, Калифорнийский университет, Сан-Диего
- Семистраничное рукописное письмо, которое Крик отправил своему 12-летнему сыну Майклу в 1953 году, с описанием структуры ДНК. Смотрите, медаль Крика уходит с молотка , Nature, 5 апреля 2013.
