Малая ядрышковая РНК
В молекулярной биологии малые ядрышковые РНК ( мякРНК ) представляют собой класс малых молекул РНК , которые в первую очередь направляют химические модификации других РНК, главным образом рибосомальных РНК , транспортных РНК и малых ядерных РНК . Существует два основных класса мякРНК: мякРНК C/D-бокса, которые связаны с метилированием , и мякРНК H/ACA-бокса, которые связаны с псевдоуридилированием .SnoRNA обычно называют направляющими РНК, но их не следует путать с направляющими РНК , которые управляют редактированием РНК в трипаносомах , или направляющими РНК (гРНК), используемыми Cas9 для редактирования генов CRISPR .
Модификации, управляемые мякРНК [ править ]
После транскрипции зарождающиеся молекулы рРНК (называемые пре-рРНК) подвергаются серии стадий обработки для создания зрелой молекулы рРНК. Перед расщеплением экзо- и эндонуклеазами пре-рРНК подвергается сложному паттерну нуклеозидных модификаций. К ним относятся метилирования и псевдоуридилирования, управляемые мякРНК.
- Метилирование — это присоединение или замена метильной группы на различных субстратах . РРНК человека содержит около 115 модификаций метильных групп. Большинство из них представляют собой метилирование 2'O-рибозы (когда метильная группа присоединена к группе рибозы). [1]
- Псевдоуридилирование — это преобразование ( изомеризация ) нуклеозида уридина в другую изомерную форму псевдоуридина (Ψ). Эта модификация заключается в повороте на 180° основания уридина вокруг его гликозильной связи с рибозой основной цепи РНК. После этого вращения азотистое основание вносит в гликозильную связь атом углерода вместо обычного атома азота. Полезным аспектом этой модификации является наличие дополнительного донора водородной связи на основании. В то время как уридин образует две водородные связи со своей парой оснований Уотсона-Крика, аденином, псевдоуридин способен образовывать три водородные связи. Когда псевдоуридин образует пару оснований с аденином, он также может образовывать еще одну водородную связь, позволяя принять форму сложной структуры зрелой рРНК. Свободный донор водородной связи часто образует связь с основанием, удаленным от него самого, создавая третичную структуру, которая должна быть функциональной для рРНК. Зрелые рРНК человека содержат около 95 модификаций Ψ. [1]
сноРНП [ править ]
Каждая молекула мякРНК действует как проводник только для одной (или двух) индивидуальных модификаций целевой РНК. [2] Для осуществления модификации каждая мякРНК связывается по меньшей мере с четырьмя коровыми белками в комплексе РНК/белок, называемом малой ядрышковой рибонуклеопротеиновой частицей (snoRNP). [3] Белки, связанные с каждой РНК, зависят от типа молекулы мякРНК (см. направляющие семейства мякРНК ниже). Молекула мякРНК содержит антисмысловой элемент (участок из 10–20 нуклеотидов ), который по основаниям комплементарен последовательности, окружающей основание ( нуклеотид ), предназначенное для модификации в молекуле пре-РНК. Это позволяет snoRNP распознавать целевую РНК и связываться с ней. Как только snoRNP связывается с целевым сайтом, ассоциированные белки оказываются в правильном физическом положении, чтобы катализировать химическую модификацию целевого основания. [4]
направляющие семейства мякРНК [ править ]
Два разных типа модификации рРНК (метилирование и псевдоуридилирование) управляются двумя разными семействами мякРНК. Эти семейства мякРНК называются антисмысловыми мякРНК C/D-бокса и H/ACA-бокса на основании присутствия мотивов консервативной последовательности в мякРНК. Есть исключения, но, как правило, члены C/D-бокса управляют метилированием, а члены H/ACA – псевдоуридилированием. Члены каждого семейства могут различаться по биогенезу, строению и функциям, но каждое семейство классифицируется по следующим обобщенным характеристикам. Подробнее смотрите в обзоре. [5] SnoRNAs классифицируются как малые ядерные РНК в MeSH . HGNC . в сотрудничестве с snoRNABase и экспертами в этой области утвердил уникальные названия для генов человека, кодирующих мякРНК [6]
Коробка C/D [ править ]

C/D-боксы мякРНК содержат два мотива коротких консервативных последовательностей, C (RUGAUGA) и D (CUGA), расположенных вблизи 5'- и 3'- концов мякРНК соответственно. Короткие области (~ 5 нуклеотидов), расположенные выше C-бокса и ниже D-бокса, обычно комплементарны основаниям и образуют структуру стволового бокса, которая сближает мотивы C- и D-бокса. Было показано, что эта структура стволового ящика важна для правильного синтеза мякРНК и ядрышковой локализации. [7] Многие мякРНК C/D-бокса также содержат дополнительную, менее консервативную копию мотивов C и D (называемых C' и D'), расположенную в центральной части молекулы мякРНК. Консервативный участок из 10–21 нуклеотида выше D-бокса комплементарен сайту метилирования РНК-мишени и позволяет мякРНК образовывать дуплекс РНК с РНК. [8] Нуклеотид, который необходимо модифицировать в целевой РНК, обычно расположен в 5-м положении выше D-бокса (или D'-бокса). [9] [10] SnoRNP C/D-бокса ассоциированы с четырьмя эволюционно консервативными и незаменимыми белками — фибрилларином (Nop1p), NOP56 , NOP58 и SNU13 (белок массой 15,5 кДа у эукариот; его архейный гомолог — L7Ae), которые составляют ядро C/D-бокса snoRNP. . [5]
Существует эукариотическая мякРНК C/D-бокса ( мякРНК U3 ), которая, как было показано, не управляет 2'- О -метилированием.Вместо этого он участвует в процессинге рРНК, направляя расщепление пре-рРНК.
Коробка H/ACA [ править ]
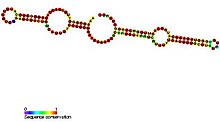
МпРНК H/ACA-бокса имеют общую вторичную структуру, состоящую из двух шпилек и двух одноцепочечных областей, называемую структурой «шпилька-шарнир-шпилька-хвост». [5] МпноРНК H/ACA также содержат мотивы консервативной последовательности, известные как H-бокс (консенсус ANANNA) и ACA-бокс (ACA). Оба мотива обычно располагаются в одноцепочечных участках вторичной структуры. Мотив H расположен в шарнире, а мотив ACA - в хвостовой области; 3 нуклеотида с 3'-конца последовательности. [11] Шпильки содержат внутренние выпуклости, известные как петли узнавания, в которых расположены антисмысловые направляющие последовательности (основания, комплементарные целевой последовательности). Эти направляющие последовательности по существу отмечают местоположение уридина на целевой рРНК, которая будет модифицирована. Эта последовательность распознавания является двудольной (построенной из двух разных плеч петлевой области) и образует сложные псевдоузлы с целевой РНК. SnoRNP H/ACA-бокса ассоциированы с четырьмя эволюционно консервативными и незаменимыми белками — дискирином (Cbf5p), GAR1 , NHP2 и NOP10 , — которые составляют ядро snoRNP H/ACA-бокса. [5] Дискерин, вероятно, является каталитическим компонентом рибонуклеопротеинового (РНП) комплекса, поскольку он обладает несколькими консервативными последовательностями псевдоуридинсинтазы и тесно связан с псевдоуридинсинтазой, которая модифицирует уридин в тРНК . В низших эукариотических клетках, таких как трипаносомы, сходные РНК существуют в форме одиночной шпилечной структуры и AGA-бокса вместо ACA-бокса на 3'-конце РНК. [12] Как и трипаносомы, Entamoeba histolytica имеет смешанную популяцию мякРНК с одинарной и двойной шпилькой H/ACA-бокса. Сообщалось, что происходил процессинг мякРНК с двойной шпилькой H/ACA-бокса в одиночные шпильковые мякРНК, однако, в отличие от трипаносом, она имеет регулярный мотив ACA на 3'-хвосте. [19]
РНК-компонент теломеразы человека (hTERC) содержит домен H/ACA для образования пре-РНП и ядрышковой локализации самой теломеразной РНП. [13] H/ACA snoRNP вовлечен в редкое генетическое заболевание врожденный дискератоз (DKC) из-за его связи с теломеразой человека. Мутации белкового компонента мяРНП H/ACA приводят к снижению физиологических уровней TERC. Это тесно коррелирует с патологией, лежащей в основе DKC, которая, по-видимому, в первую очередь является заболеванием плохого поддержания теломер .
H/ACA и C/ Композитный D блок
необычная направляющая мякРНК U85, которая участвует как в метилировании 2'-О-рибозы, так и в псевдоуридилировании малых ядерных РНК (мяРНК) U5. Идентифицирована [14] Эта составная мякРНК содержит боковые домены C/D и H/ACA и ассоциируется с белками, специфичными для каждого класса мякРНК (фибрилларин и Gar1p соответственно). В настоящее время охарактеризовано более составные мякРНК. [15]
Было обнаружено, что эти составные мякРНК накапливаются в субъядерной органелле, называемой тельцем Кахаля , и называются малыми РНК, специфичными для тела Кахаля (scaRNA). Это контрастирует с большинством мякРНК C/D-бокса или H/ACA-бокса, которые локализуются в ядрышке. Предполагается, что эти РНК, специфичные для тела Кахаля, участвуют в модификации сплайсосомальных РНК U1, U2, U4, U5 и U12, транскрибируемых РНК-полимеразой II. [15] Не все мякРНК, локализованные в тельцах Кахаля, представляют собой составные мякРНК C/D и H/ACA-бокса.
мякРНК Сиротские
Мишени для вновь идентифицированных мякРНК прогнозируются на основе комплементарности последовательностей между предполагаемыми целевыми РНК и антисмысловыми элементами или петлями узнавания в последовательности мякРНК. Однако растет число «сиротских» гидов без каких-либо известных мишеней РНК, что позволяет предположить, что в рРНК может быть задействовано больше белков или транскриптов, чем раньше, и/или что некоторые мякРНК имеют другие функции, не связанные с рРНК. [16] [17] Имеются доказательства того, что некоторые из этих сиротских мякРНК регулируют альтернативно сплайсированные транскрипты. [18] Например, оказывается, что мяРНК C/D-бокса SNORD115 регулирует альтернативный сплайсинг мРНК рецептора серотонина 2C через консервативную область комплементарности. [19] [20] другая мяРНК C/D-бокса, SNORD116 подхода было предсказано, что С использованием биоинформационного , которая находится в том же кластере, что и SNORD115, имеет 23 возможных мишени в генах, кодирующих белок . Было обнаружено, что из них большая часть подвергается альтернативному сплайсингу, что указывает на роль SNORD116 в регуляции альтернативного сплайсинга. [21]
Совсем недавно было высказано предположение, что SNORD90 способен направлять модификации N6-метиладенозина (m6A) на транскрипты целевой РНК. [22] Более конкретно, Lin et al. продемонстрировали, что SNORD90 может снижать экспрессию нейрегулина 3 (NRG3). [22]
Целевые модификации [ править ]
Точный эффект модификаций метилирования и псевдоуридилирования на функцию зрелых РНК пока неизвестен. Модификации не кажутся существенными, но известно, что они слегка усиливают сворачивание РНК и взаимодействие с рибосомальными белками. В подтверждение своей важности модификации сайта-мишени локализуются исключительно внутри консервативных и функционально важных доменов зрелой РНК и обычно консервативны среди отдаленных эукариот. [5] Новый метод Nm-REP-seq был разработан для обогащения 2'-O-метилирований под контролем C/D мяРНК с использованием экзорибонуклеазы РНК (Mycoplasmagentium RNase R, MgR) и реакционной способности окисления периодата для устранения 2'-гидроксилированных (2 '-ОН) нуклеозиды. [23]
- 2'-О-метилированная рибоза вызывает увеличение 3'-эндо-конформации.
- Псевдоуридин (psi/Ψ) добавляет еще один вариант Н-связывания.
- Сильно метилированная РНК защищена от гидролиза. рРНК действует как рибозим, катализируя собственный гидролиз и сплайсинг.
Геномная организация [ править ]
SnoRNA расположены в геноме по-разному. Большинство генов мякРНК позвоночных кодируются в интронах генов, кодирующих белки, участвующие в синтезе или трансляции рибосом, и синтезируются РНК-полимеразой II . Показано также, что SnoRNA локализуются в межгенных областях, ORF генов, кодирующих белки, и UTR. [24] SnoRNA также могут транскрибироваться со своих собственных промоторов с помощью РНК-полимеразы II или III .
Импринтированные локусы [ править ]
В геноме человека есть по крайней мере два примера, когда мяРНК C/D-бокса обнаруживаются в тандемных повторах внутри импринтированных локусов. Эти два локуса (14q32 на хромосоме 14 и 15q11q13 на хромосоме 15) были тщательно охарактеризованы, и в обоих регионах было обнаружено множество мякРНК, расположенных внутри интронов в кластерах близкородственных копий.
В 15q11q13 идентифицировано пять различных мякРНК ( SNORD64 , SNORD107, SNORD108, SNORD109 (две копии), SNORD116 (29 копий) и SNORD115 (48 копий). Потеря 29 копий SNORD116 (HBII-85) из этого региона привела к потере 29 копий SNORD116 (HBII-85). был идентифицирован как причина синдрома Прадера-Вилли [25] [26] [27] [28] тогда как появление дополнительных копий SNORD115 связано с аутизмом . [29] [30] [31]
Область 14q32 содержит повторы двух мякРНК SNORD113 (9 копий) и SNORD114 (31 копия) внутри интронов тканеспецифического транскрипта нкРНК ( MEG8 ). Было показано, что домен 14q32 имеет общие геномные особенности с импринтированными локусами 15q11-q13, и была предложена возможная роль тандемных повторов мякРНК C/D-бокса в эволюции или механизме импринтированных локусов. [32] [33]
Другие функции [ править ]
мяРНК могут функционировать как микроРНК . Было показано, что человеческая ACA45 представляет собой настоящую мякРНК, которая может процессироваться в 21 нуклеотид зрелую микроРНК длиной семейства РНКазы III с помощью эндорибонуклеазы dicer . [34] Этот продукт мякРНК ранее был идентифицирован как mmu-miR-1839 , и было показано, что он процессируется независимо от другой эндорибонуклеазы дроша , генерирующей микроРНК . [35] Биоинформатический анализ показал, что предположительно производные от мяРНК микроРНК-подобные фрагменты встречаются в разных организмах. [36]
Недавно было обнаружено, что мякРНК могут выполнять функции, не связанные с рРНК. Одной из таких функций является регуляция альтернативного сплайсинга транскрипта гена , который осуществляется мякоРНК HBII-52 , также известной как SNORD115. [19]
В ноябре 2012 года Шуберт и др. выявили, что специфические РНК контролируют уплотнение и доступность хроматина в дрозофилы . клетках [37]
В июле 2023 г. Лин и др. показали, что мякРНК потенциально могут направлять другие модификации РНК, в частности N6-метиладенозин , однако это подлежит дальнейшему исследованию. [22]
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б Маден Б.Е., Хьюз Дж.М. (июнь 1997 г.). «Эукариотическая рибосомальная РНК: недавний интерес к проблеме модификации нуклеотидов». Хромосома . 105 (7–8): 391–400. дои : 10.1007/BF02510475 . ПМИД 9211966 . S2CID 846233 .
- ^ Гьерде Д.Т., Хоанг Л., Хорнби Д. (2009). «Эуркаройтическая клеточная ДНК» . Очистка и анализ РНК: подготовка проб, экстракция, хроматография . Вайнхайм: Wiley-VCH. стр. 25–26. ISBN 978-3-527-62720-2 . Проверено 28 сентября 2020 г.
- ^ Бертран Э., Фурнье МЖ (2013). «snoRNP и родственные машины: древние устройства, которые опосредуют созревание рРНК и других РНК» . База данных биологических наук мадам Кюри . Остин, Техас: Landes Bioscience . Проверено 28 сентября 2020 г.
- ^ Люкке-Андерсен С., Ардал Б.К., Холленсен А.К., Дамгаард К.К., Йенсен Т.Х. (октябрь 2018 г.). «Ауторегуляция snoRNP Box C/D с помощью цис-действующей мяРНК в пре-мРНК NOP56» . Молекулярная клетка . 72 (1): 99–111.e5. дои : 10.1016/j.molcel.2018.08.017 . ПМИД 30220559 .
- ^ Jump up to: Перейти обратно: а б с д и Bachellerie JP, Cavaillé J, Hüttenhofer A (август 2002 г.). «Расширяющийся мир мякРНК». Биохимия . 84 (8): 775–790. дои : 10.1016/S0300-9084(02)01402-5 . ПМИД 12457565 .
- ^ Райт М.В., Бруфорд Э.А. (январь 2011 г.). «Именование «мусора»: номенклатура генов небелковой РНК (нкРНК) человека» . Геномика человека . 5 (2): 90–98. дои : 10.1186/1479-7364-5-2-90 . ПМК 3051107 . ПМИД 21296742 .
- ^ Самарский Д.А., Фурнье М.Ж., Сингер Р.Х., Бертран Э. (июль 1998 г.). «Мотив C/D мякРНК-бокса управляет ядрышковым нацеливанием, а также связывает синтез и локализацию мякРНК» . Журнал ЭМБО . 17 (13): 3747–3757. дои : 10.1093/emboj/17.13.3747 . ПМК 1170710 . ПМИД 9649444 .
- ^ Кисс-Ласло З., Генри Ю., Кисс Т. (февраль 1998 г.). «Последовательность и структурные элементы метилирования направляют мякРНК, необходимые для сайт-специфического рибозного метилирования пре-рРНК» . Журнал ЭМБО . 17 (3): 797–807. дои : 10.1093/emboj/17.3.797 . ПМК 1170428 . ПМИД 9451004 .
- ^ Кавайе Дж., Николозо М., Bachellerie JP (октябрь 1996 г.). «Направленное метилирование РНК рибозой in vivo, управляемое специальными антисмысловыми РНК-проводниками» . Природа . 383 (6602): 732–735. Бибкод : 1996Natur.383..732C . дои : 10.1038/383732a0 . ПМИД 8878486 . S2CID 4334683 .
- ^ Кисс-Ласло З., Генри Ю., Бачеллери ЖП, Кайзерг-Феррер М., Кисс Т. (июнь 1996 г.). «Сайт-специфическое метилирование рибозы прерибосомальной РНК: новая функция для малых ядрышковых РНК» . Клетка . 85 (7): 1077–1088. дои : 10.1016/S0092-8674(00)81308-2 . ПМИД 8674114 . S2CID 10418885 .
- ^ Гано П., Кайзерг-Феррер М., Кисс Т. (апрель 1997 г.). «Семейство малых ядрышковых РНК бокса ACA определяется эволюционно консервативной вторичной структурой и повсеместными элементами последовательности, необходимыми для накопления РНК» . Гены и развитие . 11 (7): 941–956. дои : 10.1101/gad.11.7.941 . ПМИД 9106664 .
- ^ Лян XH, Лю Л, Михаэли С (октябрь 2001 г.). «Идентификация первой РНК трипаносомы H/ACA, которая управляет образованием псевдоуридина на рРНК» . Журнал биологической химии . 276 (43): 40313–40318. дои : 10.1074/jbc.M104488200 . ПМИД 11483606 .
- ^ Трэхан С., Дракон F (февраль 2009 г.). «Мутации врожденного дискератоза в домене H/ACA теломеразной РНК человека влияют на ее сборку в пре-РНП» . РНК . 15 (2): 235–243. дои : 10.1261/rna.1354009 . ПМК 2648702 . ПМИД 19095616 .
- ^ Жади Б.Е., Kiss T (февраль 2001 г.). «Маленькая ядрышковая направляющая РНК участвует как в метилировании 2'-О-рибозы, так и в псевдоуридилировании сплайсосомальной РНК U5» . Журнал ЭМБО . 20 (3): 541–551. дои : 10.1093/emboj/20.3.541 . ПМЦ 133463 . ПМИД 11157760 .
- ^ Jump up to: Перейти обратно: а б Дарзак X, Жади Б.Е., Верхегген С., Кисс А.М., Бертран Э., Кисс Т. (июнь 2002 г.). «Малые ядерные РНК, специфичные для тела Кахаля: новый класс 2'-O-метилирования и направляющих псевдоуридилирования РНК» . Журнал ЭМБО . 21 (11): 2746–2756. дои : 10.1093/emboj/21.11.2746 . ПМК 126017 . ПМИД 12032087 .
- ^ Жади Б.Е., Kiss T (март 2000 г.). «Характеристика малых ядрышковых РНК U83 и U84: две новые РНК, направляющие метилирование 2'-О-рибозы, которым не хватает комплементарности рибосомальным РНК» (бесплатный полный текст) . Исследования нуклеиновых кислот . 28 (6): 1348–1354. дои : 10.1093/нар/28.6.1348 . ПМК 111033 . ПМИД 10684929 .
- ^ Ли С.Г., Чжоу Х., Луо Ю.П., Чжан П., Цюй Л.Х. (апрель 2005 г.). «Идентификация и функциональный анализ 20 малых ядрышковых РНК Box H/ACA (snoRNA) из Schizosaccharomyces pombe» . Журнал биологической химии . 280 (16): 16446–16455. дои : 10.1074/jbc.M500326200 . ПМИД 15716270 .
- ^ Кишор С., Стамм С. (2006). «Регуляция альтернативного сплайсинга с помощью мякРНК» . Симпозиумы Колд-Спринг-Харбор по количественной биологии . 71 : 329–334. дои : 10.1101/sqb.2006.71.024 . ПМИД 17381313 .
- ^ Jump up to: Перейти обратно: а б Кишор С., Стамм С. (январь 2006 г.). «МякоРНК HBII-52 регулирует альтернативный сплайсинг рецептора серотонина 2C» . Наука . 311 (5758): 230–232. Бибкод : 2006Sci...311..230K . дои : 10.1126/science.1118265 . ПМИД 16357227 . S2CID 44527461 .
- ^ Доу СМ, Релкович Д., Гарфилд А.С., Дэлли Дж.В., Теобальд Д.Е., Хамби Т., Уилкинсон Л.С., Айлс АР (июнь 2009 г.). «Потеря импринтированной мякРНК mbii-52 приводит к усилению редактирования пре-РНК 5htr2c и изменению поведения, опосредованного 5HT2CR» . Молекулярная генетика человека . 18 (12): 2140–2148. дои : 10.1093/hmg/ddp137 . ПМЦ 2685753 . ПМИД 19304781 .
- ^ Базелей П.С., Шепелев В., Талебизаде З., Батлер М.Г., Федорова Л., Филатов В., Федоров А. (январь 2008 г.). «snoTARGET показывает, что мишени мякРНК-сироты человека располагаются вблизи альтернативных соединений сплайсинга» . Джин . 408 (1–2): 172–179. дои : 10.1016/j.gene.2007.10.037 . ПМК 6800007 . ПМИД 18160232 .
- ^ Jump up to: Перейти обратно: а б с Лин Р., Кос А., Лопес Дж.П., Дайн Дж., Фиори Л.М., Ян Дж. и др. (июль 2023 г.). Вест А.Е., Вонг М.Л. (ред.). « SNORD90 индуцирует глутаматергическую передачу сигналов после лечения моноаминергическими антидепрессантами» . электронная жизнь . 12 : е85316. doi : 10.7554/eLife.85316 . ПМЦ 10335830 . ПМИД 37432876 .
- ^ Чжан П., Хуан Дж., Чжэн В., Чен Л., Лю С., Лю А. и др. (апрель 2023 г.). «Картирование сайтов 2'-O-метилирования с одноосновным разрешением химическим методом, обогащенным экзорибонуклеазой». Наука Китай Науки о жизни . 66 (4): 800–818. дои : 10.1007/s11427-022-2210-0 . ПМИД 36323972 . S2CID 253266867 .
- ^ Каур Д., Гупта А.К., Кумари В., Шарма Р., Бхаттачарья А., Бхаттачарья С. (14 августа 2012 г.). «Вычислительное прогнозирование и проверка мякРНК C/D, H/ACA и Eh_U3 Entamoeba histolytica» . БМК Геномика . 13 :390. дои : 10.1186/1471-2164-13-390 . ПМЦ 3542256 . ПМИД 22892049 .
- ^ Скрябин Б.В., Губар Л.В., Сигер Б., Пфайффер Дж., Гендель С., Робек Т., Карпова Е., Рождественский Т.С., Брозиус Дж. (декабрь 2007 г.). «Удаление кластера генов мякРНК MBII-85 у мышей приводит к постнатальной задержке роста» . ПЛОС Генетика . 3 (12): е235. дои : 10.1371/journal.pgen.0030235 . ПМЦ 2323313 . ПМИД 18166085 .
- ^ Саху Т., дель Гаудио Д., Герман Дж.Р., Шинави М., Петерс С.У., Персон Р.Э., Гарника А., Ченг С.В., Боде А.Л. (июнь 2008 г.). «Фенотип Прадера-Вилли, вызванный отцовским дефицитом малого ядрышкового РНК-кластера HBII-85 C/D» . Природная генетика . 40 (6): 719–721. дои : 10.1038/ng.158 . ПМК 2705197 . ПМИД 18500341 .
- ^ Дин Ф., Ли Х.Х., Чжан С., Соломон Н.М., Кампер С.А., Коэн П., Франк У (март 2008 г.). Акбарян С. (ред.). «Делегация SnoRNA Snord116 (Pwcr1/MBII-85) вызывает задержку роста и гиперфагию у мышей» . ПЛОС ОДИН . 3 (3): e1709. Бибкод : 2008PLoSO...3.1709D . дои : 10.1371/journal.pone.0001709 . ПМК 2248623 . ПМИД 18320030 .
- ^ Дин Ф., Принс Ю, Дхар М.С., Джонсон Д.К., Гарначо-Монтеро С., Николлс Р.Д., Франк У (июнь 2005 г.). «Отсутствие мякРНК Pwcr1/MBII-85 имеет решающее значение для неонатальной смертности в мышиных моделях синдрома Прадера-Вилли». Геном млекопитающих . 16 (6): 424–431. дои : 10.1007/s00335-005-2460-2 . ПМИД 16075369 . S2CID 12256515 .
- ^ Накатани Дж., Тамада К., Хатанака Ф., Исе С., Ота Х., Иноуэ К., Томонага С., Ватанабе Ю., Чунг Ю.Дж., Банерджи Р., Ивамото К., Като Т., Окадзава М., Ямаути К., Танда К., Такао К., Миякава Т. , Брэдли А., Такуми Т. (июнь 2009 г.). «Аномальное поведение на мышиной модели, созданной с помощью хромосомной инженерии, для дупликации человеческого 15q11–13, наблюдаемой при аутизме» . Клетка . 137 (7): 1235–1246. дои : 10.1016/j.cell.2009.04.024 . ПМК 3710970 . ПМИД 19563756 .
- ^ Болтон П.Ф., Велтман М.В., Вайсблатт Э., Холмс-младший, Томас Н.С., Юингс С.А., Томпсон Р.Дж., Робертс С.Е., Деннис Н.Р., Браун CE, Гудсон С., Мур В., Браун Дж. (сентябрь 2004 г.). «Хромосомные нарушения 15q11–13 и другие заболевания у людей с расстройствами аутистического спектра». Психиатрическая генетика . 14 (3): 131–137. дои : 10.1097/00041444-200409000-00002 . ПМИД 15318025 . S2CID 37344935 .
- ^ Кук Э.Х., Шерер С.В. (октябрь 2008 г.). «Вариации числа копий, связанные с нервно-психическими состояниями». Природа . 455 (7215): 919–923. Бибкод : 2008Natur.455..919C . дои : 10.1038/nature07458 . ПМИД 18923514 . S2CID 4377899 .
- ^ Кавайе Дж., Зейтц Х., Полсен М., Фергюсон-Смит AC, Bachellerie JP (июнь 2002 г.). «Идентификация тандемно повторяющихся генов мякРНК C/D в импринтированном домене 14q32 человека, напоминающем гены в области синдрома Прадера-Вилли/Ангельмана» . Молекулярная генетика человека . 11 (13): 1527–1538. дои : 10.1093/hmg/13.11.1527 . ПМИД 12045206 .
- ^ Лабиаль С., Кавайе Ж (август 2011 г.). «Вызывают ли повторяющиеся массивы регуляторных генов малых РНК геномный импринтинг?: Одновременное появление больших кластеров малых некодирующих РНК и геномный импринтинг в четырех эволюционно различных локусах эутериевых хромосом». Биоэссе . 33 (8): 565–573. doi : 10.1002/bies.201100032 . ПМИД 21618561 . S2CID 10408004 .
- ^ Эндер С., Крек А., Фридлендер М.Р., Бейтцингер М., Вайнманн Л., Чен В., Пфеффер С., Раевски Н., Мейстер Г. (ноябрь 2008 г.). «Человеческая мяРНК с функциями, подобными микроРНК» . Молекулярная клетка . 32 (4): 519–528. doi : 10.1016/j.molcel.2008.10.017 . ПМИД 19026782 .
- ^ Бабиарз Дж. Э., Руби Дж. Г., Ван Ю, Бартель Д. П., Блеллок Р. (октябрь 2008 г.). «Мышиные ES-клетки экспрессируют эндогенные shRNA, siRNA и другие независимые от микропроцессора и Dicer-зависимые малые РНК» . Гены и развитие . 22 (20): 2773–2785. дои : 10.1101/gad.1705308 . ПМК 2569885 . ПМИД 18923076 .
- ^ Тафт Р.Дж., Глазов Е.А., Лассманн Т., Хаяшизаки Ю., Карнинчи П., Маттик Дж.С. (июль 2009 г.). «Маленькие РНК, полученные из мякРНК» . РНК . 15 (7): 1233–1240. дои : 10.1261/rna.1528909 . ПМК 2704076 . ПМИД 19474147 .
- ^ Шуберт Т., Пуш М.К., Дирмайер С., Бенеш В., Креммер Э., Имхоф А., Ленгст Г. (ноябрь 2012 г.). «Белок Df31 и мякРНК поддерживают доступные структуры хроматина высшего порядка» . Молекулярная клетка . 48 (3): 434–444. doi : 10.1016/j.molcel.2012.08.021 . ПМИД 23022379 .
Внешние ссылки [ править ]
- атлас мякРНК человека на основе данных секвенирования малых РНК
- база данных мякРНК растений
- snoRNAbase: база данных мякоРНК H/ACA и C/D-бокса человека
- База данных сноРНП
- База данных мякРНК дрожжей
- образец экспрессии мякРНК человека
- Страница Rfam для мяРНК C/D-бокса
- Страница Rfam для мякРНК блока H/ACA
- Страница Rfam для scaRNA-snoRNA