Редактирование генов CRISPR

Редактирование генов CRISPR (произносится / ˈ k r ɪ s p ə r / «четкий»), что означает «Кластерные регулярно расположенные короткие палиндромные повторы», представляет собой метод генной инженерии в молекулярной биологии, с помощью которого геномы можно модифицировать живых организмов. В его основе лежит упрощенная версия бактериальной системы противовирусной защиты CRISPR — Cas9 . Доставляя в клетку нуклеазу Cas9 в комплексе с синтетической направляющей РНК (гРНК), геном клетки можно разрезать в нужном месте, что позволяет удалить существующие гены и/или добавить новые in vivo . [1]
Этот метод считается очень важным в биотехнологии и медицине редактировать геномы in vivo , поскольку он позволяет очень точно, дешево и легко . Его можно использовать при создании новых лекарств, сельскохозяйственной продукции и генетически модифицированных организмов , а также в качестве средства борьбы с патогенами и вредителями . Он также имеет возможности для лечения наследственных генетических заболеваний , а также заболеваний, возникающих в результате соматических мутаций, таких как рак. Однако его использование в генетической модификации зародышевой линии человека весьма спорно. Разработка метода принесла Дженнифер Дудне и Эммануэль Шарпантье Нобелевскую премию по химии в 2020 году. [2] [3] Третья исследовательская группа, получившая премию Кавли за то же открытие, [4] возглавляемый Виргиниюсом Шикшнисом , не был удостоен Нобелевской премии. [5] [6] [7]
Действуя как генетические ножницы, нуклеаза Cas9 открывает обе цепи целевой последовательности ДНК, чтобы внести модификацию одним из двух методов. Нокаин-мутации, осуществляемые посредством репарации, направленной на гомологию (HDR), являются традиционным путем подходов целевого редактирования генома. [1] Это позволяет осуществлять целенаправленное повреждение и восстановление ДНК . HDR использует аналогичные последовательности ДНК для восстановления разрыва за счет включения экзогенной ДНК, которая действует как матрица восстановления. [1] Этот метод основан на периодическом и изолированном возникновении повреждений ДНК в целевом сайте, чтобы начать восстановление. Нокаут-мутации, вызванные CRISPR-Cas9, возникают в результате восстановления двухцепочечного разрыва посредством негомологичного соединения концов (NHEJ) или POLQ/тета-полимеразой соединения концов, опосредованного (TMEJ). Эти пути соединения концов часто могут приводить к случайным делециям или вставкам в сайте репарации, что может нарушать или изменять функциональность гена. Таким образом, геномная инженерия с помощью CRISPR-Cas9 дает исследователям возможность генерировать целенаправленное случайное разрушение генов.
Хотя редактирование генома эукариотических клеток было возможно с использованием различных методов с 1980-х годов, используемые методы оказались неэффективными и непрактичными для реализации в больших масштабах. С открытием CRISPR и, в частности, молекулы нуклеазы Cas9, стало возможным эффективное и высокоселективное редактирование. Cas9, полученный из бактериального вида Streptococcus pyogenes, облегчил целевую модификацию генома в эукариотических клетках, позволив создать надежный метод создания целевого разрыва в определенном месте, обозначенном направляющими нитями crRNA и tracrRNA. [8] Легкость, с которой исследователи могут вставлять Cas9 и матричную РНК, чтобы заставить замолчать или вызвать точечные мутации в определенных локусах, оказалась неоценимой для быстрого и эффективного картирования геномных моделей и биологических процессов, связанных с различными генами у множества эукариот. Были разработаны новые варианты нуклеазы Cas9, которые значительно снижают нецелевую активность. [9]
Методы редактирования генома CRISPR-Cas9 имеют множество потенциальных применений. Использование комплекса CRISPR-Cas9-гРНК для редактирования генома [10] был « выбран AAAS в номинации Прорыв года» в 2015 году. [11] Многие биоэтические опасения были высказаны по поводу перспективы использования CRISPR для редактирования зародышевой линии , особенно в человеческих эмбрионах . [12] первый препарат, использующий редактирование генов CRISPR, Casgevy В 2023 году в Великобритании был одобрен для использования для лечения серповидно-клеточной анемии и бета-талассемии . [13] [14] Касгеви был одобрен для использования в США 8 декабря 2023 года Управлением по контролю за продуктами и лекарствами . [15]
История [ править ]
Другие методы [ править ]
В начале 2000-х годов немецкие исследователи начали разработку нуклеаз с цинковыми пальцами (ZFN), синтетических белков, чьи ДНК-связывающие домены позволяют им создавать двухцепочечные разрывы ДНК в определенных точках. ZFN имеет более высокую точность и преимущество в том, что он меньше, чем Cas9, но ZFN не так широко используются, как методы на основе CRISPR. В 2010 году синтетические нуклеазы, называемые эффекторными нуклеазами, подобными активаторам транскрипции (TALEN), предоставили более простой способ направить двухцепочечный разрыв в определенное место на цепи ДНК. И нуклеазы с цинковыми пальцами, и TALEN требуют разработки и создания специального белка для каждой целевой последовательности ДНК, что является гораздо более сложным и трудоемким процессом, чем создание направляющих РНК. CRISPR гораздо проще спроектировать, поскольку для этого процесса требуется синтезировать только короткую последовательность РНК — процедура, которая уже широко используется во многих других методах молекулярной биологии (например, при создании олигонуклеотидных праймеров ). [16]
В то время как такие методы, как РНК-интерференция (RNAi), не полностью подавляют функцию генов, CRISPR, ZFN и TALEN обеспечивают полный необратимый нокаут генов . [17] CRISPR также может воздействовать на несколько участков ДНК одновременно, просто вводя разные гРНК. Кроме того, затраты на использование CRISPR относительно невелики. [17] [18] [19]
Открытие [ править ]
В 2005 году Александр Болотин из Национального института сельскохозяйственных исследований Франции (INRA) обнаружил локус CRISPR, который содержал новые гены Cas, в частности тот, который кодировал большой белок, известный как Cas9. [20]
В 2006 году Юджин Кунин из Национального центра биотехнологической информации США (NIH) предложил объяснение того, как CRISPR действует каскадно в бактериальную иммунную систему. [20]
В 2007 году Филипп Хорват из Danisco France SAS экспериментально продемонстрировал, что системы CRISPR представляют собой адаптивную иммунную систему и интегрируют новую фаговую ДНК в массив CRISPR, и именно так они борются со следующей волной атакующего фага. [20]
В 2012 году исследовательская группа под руководством профессора Дженнифер Дудна из Калифорнийского университета в Беркли и профессора Университета Умео Эммануэль Шарпантье стала первым человеком, который идентифицировал, раскрыл и подал заявку на патент на систему CRISPR-Cas9, необходимую для редактирования ДНК. [20] Они также опубликовали свое открытие о том, что CRISPR- Cas9 можно запрограммировать с помощью РНК для редактирования геномной ДНК, что сейчас считается одним из самых значительных открытий в истории биологии .
и коммерциализация Патенты
По состоянию на ноябрь 2013 г. [update]Компания SAGE Labs (часть группы Horizon Discovery ) имела от одной из этих компаний эксклюзивные права на производство и продажу генетически модифицированных крыс, а также неисключительные права на модели мышей и кроликов. [21] К 2015 году [update] . Компания Thermo Fisher Scientific получила лицензию на интеллектуальную собственность ToolGen на разработку наборов реагентов CRISPR [22]
По состоянию на декабрь 2014 г. [update], патентные права на CRISPR были оспорены. Было создано несколько компаний для разработки сопутствующих лекарств и исследовательских инструментов. [23] По мере того, как компании наращивали финансирование, возникли сомнения относительно возможности быстрой монетизации CRISPR. [24] В 2014 году Фэн Чжан из Института Броуда Массачусетского технологического института и Гарварда и еще девять человек получили патент США под номером 8 697 359. [25] по поводу использования редактирования генов CRISPR-Cas9 у эукариот. Хотя Шарпантье и Дудна (именуемый CVC) были авторами концепции CRISPR, Институт Броуда был первым, кто добился «перехода к практике», по мнению патентных судей Салли Гарднер Лейн, Джеймса Т. Мура и Деборы Кац. [26]
Первый комплект патентов был выдан команде Броуда в 2015 году, что побудило адвокатов группы CVC запросить первое разбирательство о вмешательстве. [27] В феврале 2017 года Патентное ведомство США вынесло решение по иску о вмешательстве в патенты, возбужденному Калифорнийским университетом в отношении патентов, выданных Институту Броуда , и установило, что патенты Броуда, в которых содержатся претензии, касающиеся применения CRISPR-Cas9 в эукариотических клетках, отличаются друг от друга. из изобретений, заявленных Калифорнийским университетом. [28] [29] [30]
Вскоре после этого Калифорнийский университет подал апелляцию на это решение. [31] [32] В 2019 году был открыт второй спор о вмешательстве. Это произошло в ответ на патентные заявки, поданные CVC, которые требовали от апелляционной комиссии определить первоначального изобретателя технологии. В марте 2022 года ВПТЗ США вынесло решение против Калифорнийского университета, заявив, что Институт Броуда первым подал иск. Это решение повлияло на многие лицензионные соглашения на технологию редактирования CRISPR, которая была лицензирована Калифорнийским университетом в Беркли. Калифорнийский университет заявил о своем намерении обжаловать решение USPTO. [33]
Последние события [ править ]
В марте 2017 года Европейское патентное ведомство (ЕПВ) объявило о своем намерении разрешить заявки на редактирование всех типов клеток в Институт Макса Планка в Берлине, Калифорнийский университет и Венский университет. [34] [35] а в августе 2017 года ЕПВ объявило о своем намерении разрешить заявления о CRISPR в патентной заявке, поданной MilliporeSigma. [34] По состоянию на август 2017 г. [update] патентная ситуация в Европе была сложной: претензии MilliporeSigma, ToolGen, Вильнюсского университета и Гарварда боролись вместе с Калифорнийским университетом и Броудом. [36]
В июле 2018 года Европейский суд постановил, что редактирование генов растений является подкатегорией ГМО-продуктов и, следовательно, отныне технология CRISPR будет регулироваться в Европейском Союзе их правилами и положениями для ГМО . [37]
В феврале 2020 года исследование в США показало безопасное редактирование генов CRISPR на трех больных раком. [38]
В октябре 2020 года исследователи Эммануэль Шарпантье и Дженнифер Дудна были удостоены Нобелевской премии по химии за свои работы в этой области. [39] [40] Они вошли в историю как первые две женщины, разделившие эту награду без участия мужчины. [41] [5]
В июне 2021 года первое небольшое клиническое исследование внутривенного редактирования генов CRISPR на людях завершится многообещающими результатами. [42] [43]
В сентябре 2021 года первый продукт питания, отредактированный с помощью CRISPR, поступил в публичную продажу в Японии. Помидоры были генетически модифицированы примерно в пять раз по сравнению с обычным успокаивающим действием. [44] ГАБА . [45] CRISPR впервые был применен к помидорам в 2014 году. [46]
В декабре 2021 года сообщалось, что первый набор морских животных/ морепродуктов с отредактированным геном CRISPR и второй набор продуктов питания с отредактированным CRISPR поступили в публичную продажу в Японии: две рыбы, один из видов которых вырастает в два раза больше естественных особей из-за к нарушению работы лептина , который контролирует аппетит, а другой вырастает до 1,2 естественного среднего размера при том же количестве пищи из-за отключенного миостатина , который тормозит рост мышц . [47] [48] [49]
Исследование 2022 года показало, что знание большего количества томатов с CRISPR сильно повлияло на предпочтения участников. «Почти половина из 32 участников из Германии, являющихся учеными, продемонстрировали постоянный выбор, в то время как большинство проявило повышенную готовность покупать помидоры CRISPR, в основном не ученые». [50] [51]
В мае 2021 года Калифорнийский университет в Беркли объявил о своем намерении выставить на аукцион невзаимозаменяемые токены как патента на редактирование генов CRISPR, так и иммунотерапии рака . Однако в этом случае университет сохранит право собственности на патенты. [52] [53] 85 % средств, собранных от продажи сборника «Четвертый столп», должны были быть использованы для финансирования исследований. [54] [55] Он был продан в июне 2022 года за 22 эфира, что долларов США . на тот момент составляло около 54 000 [56]
Соединенного Королевства В ноябре 2023 года Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) стало первым в мире, кто одобрил использование первого препарата, основанного на редактировании генов CRISPR, Casgevy, для лечения серповидноклеточной анемии и бета-талассемии . Касгеви, или эксагамглоген аутотемцел , напрямую воздействует на гены стволовых клеток внутри костей пациента, заставляя их производить здоровые эритроциты. Таким образом, это лечение позволяет избежать необходимости регулярных дорогостоящих переливаний крови. [13] [14]
В декабре 2023 года FDA одобрило первую в США генную терапию для лечения пациентов с серповидно-клеточной анемией (СКА). FDA одобрило два важных метода лечения — Casgevy и Lyfgenia, представляющие собой первые клеточные генные методы лечения ВСС. [57]
Геномная инженерия [ править ]

Редактирование генома CRISPR-Cas9 осуществляется с помощью системы CRISPR типа II . При использовании для редактирования генома эта система включает рибонуклеопротеин (РНП), состоящий из Cas9 , crRNA и tracrRNA, а также необязательную матрицу репарации ДНК.

Основные компоненты [ править ]
| Компонент | Функция |
|---|---|
| crRNA | Содержит направляющую РНК, которая находит правильный сегмент ДНК хозяина, а также участок, который связывается с tracrRNA (обычно в форме шпильки ), образуя активный комплекс. |
| тракрРНК | Связывается с crRNA и образует активный комплекс. |
| огРНК | Однопроводящие РНК представляют собой комбинированные РНК, состоящие из тракрРНК и по крайней мере одной crРНК . |
| Cas9 ( чаще всего ) | Фермент, активная форма которого способна модифицировать ДНК. Существует множество вариантов с различными функциями (например, одноцепочечный разрыв, двухцепочечный разрыв, связывание ДНК) благодаря функции распознавания участков ДНК каждого фермента. |
| Шаблон ремонта | Молекула ДНК, используемая в качестве матрицы в процессе восстановления ДНК клетки-хозяина, позволяет вставлять определенную последовательность ДНК в сегмент хозяина, разрушенный Cas9. |
CRISPR-Cas9 часто использует плазмиды , которые кодируют компоненты RNP, для трансфекции клеток-мишеней, или RNP собирается перед добавлением в клетки посредством нуклеофекции. [58] Основные компоненты этой плазмиды отображены на изображении и приведены в таблице. crRNA уникально разработана для каждого применения, поскольку именно эту последовательность Cas9 использует для идентификации и прямого связывания с конкретными последовательностями в ДНК клетки-хозяина. crRNA должна связываться только там, где желательно редактирование. Матрица репарации также уникально разработана для каждого применения, поскольку она должна до некоторой степени дополнять последовательности ДНК по обе стороны от разреза, а также содержать любую последовательность, необходимую для вставки в геном хозяина.
Множественные crRNA и tracrRNA могут быть упакованы вместе с образованием единой направляющей РНК (sgRNA). [59] Эту sgRNA можно включить вместе с геном, кодирующим белок Cas9, и превратить в плазмиду для трансфекции в клетки. Доступно множество онлайн-инструментов, которые помогут в разработке эффективных последовательностей sgRNA. [60] [61]

Альтернативы Cas9 [ править ]
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( октябрь 2021 г. ) |
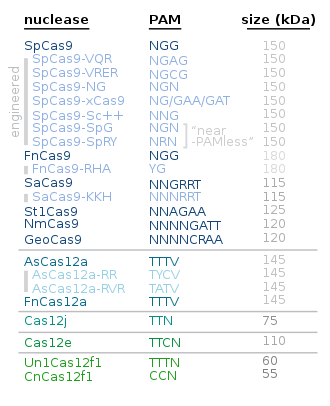
Альтернативные белкам Cas9 включают следующие:
| Белок | Основное использование/характеристики | Годы |
|---|---|---|
| Кас12 | Cas12a меньше и проще Cas9; Cas12b ia для геномной инженерии растений [62] [63] | |
| Кас13 | для редактирования РНК [64] | |
| Кас3 [65] [66] | Создает одноцепочечный широкий разрыв [67] | 2019 |
| КасМИНИ | Примерно в два раза компактнее более часто используемых Cas9 и Cas12a. [68] [69] | 2021 |
| СуперФи-Кас9 | Более точный без снижения скорости [70] [71] | 2022 |
| Кас7-11 | Редактирование РНК [72] | 2022 |
| по шаблону хромосомы Восстановление ДНК | Такой метод применим только к организмам, чья совпадающая хромосома имеет желаемый ген/ы.
| 2022 |
Структура [ править ]
CRISPR-Cas9 предлагает высокую степень точности и относительно простую конструкцию. Его специфичность зависит от двух факторов: целевой последовательности и последовательности мотива, примыкающего к протоспейсеру (PAM). Целевая последовательность имеет длину 20 оснований и является частью каждого локуса CRISPR в массиве crRNA. [58] Типичный массив crRNA имеет несколько уникальных целевых последовательностей. Белки Cas9 выбирают правильное место в геноме хозяина, используя последовательность для связи с парами оснований ДНК хозяина. Последовательность не является частью белка Cas9, поэтому ее можно настраивать и синтезировать независимо . [75] [76]
Последовательность PAM в геноме хозяина распознается Cas9. Cas9 нелегко модифицировать для распознавания другой последовательности PAM. Однако в конечном итоге это не является слишком ограничивающим фактором, поскольку обычно это очень короткая и неспецифическая последовательность, которая часто встречается во многих местах генома (например, последовательность PAM SpCas9 представляет собой 5'-NGG-3' и в геноме человека встречается примерно каждый раз). от 8 до 12 пар оснований). [58]
После того как эти последовательности собраны в плазмиду и трансфицированы в клетки, белок Cas9 с помощью crRNA находит правильную последовательность в ДНК клетки-хозяина и – в зависимости от варианта Cas9 – создает одно- или двухцепочечный разрыв на соответствующее место в ДНК. [77]
Правильно расположенные одноцепочечные разрывы в ДНК хозяина могут вызвать репарацию , направленную на гомологию, которая менее подвержена ошибкам, чем негомологичное соединение концов , которое обычно следует за двухцепочечным разрывом. Предоставление шаблона репарации ДНК позволяет вставить определенную последовательность ДНК в точное место в геноме. Матрица репарации должна простираться на 40–90 пар оснований за пределы разрыва ДНК, вызванного Cas9. [58] Цель состоит в том, чтобы естественный процесс HDR клетки использовал предоставленный шаблон восстановления и тем самым включил новую последовательность в геном. После включения эта новая последовательность теперь становится частью генетического материала клетки и переходит в ее дочерние клетки. Комбинированное временное ингибирование NHEJ и TMEJ небольшой молекулой и миРНК может повысить эффективность HDR до 93% и одновременно предотвратить нецелевое редактирование. [78]
Доставка [ править ]
Доставка Cas9, sgRNA и связанных с ними комплексов в клетки может происходить через вирусные и невирусные системы. Электропорация ДНК, РНК или рибонуклеокомплексов является распространенным методом, хотя она может привести к вредному воздействию на клетки-мишени. [79] Методы химической трансфекции с использованием липидов и пептидов также использовались для введения sgRNA в комплексе с Cas9 в клетки. [80] [81] Доставка на основе наночастиц также использовалась для трансфекции. [82] Типы клеток, которые труднее трансфицировать (например, стволовые клетки, нейроны и гемопоэтические клетки), требуют более эффективных систем доставки, например, на основе лентивируса (LV), аденовируса (AdV) и аденоассоциированного вируса (AAV). . [83] [84] [85]
Было обнаружено, что эффективность CRISPR-Cas9 значительно возрастает, когда различные компоненты системы, включая всю структуру CRISPR/Cas9, до комплексов Cas9-гРНК, доставляются в собранной форме, а не с использованием трансгенов. [86] [87] Это обнаружило особую ценность генетически модифицированных культур для массовой коммерциализации. [88] [89] Поскольку для производства этих белков не требуется механизм репликации хозяина, вероятность узнавания последовательности sgRNA практически равна нулю, что снижает вероятность нецелевых эффектов. [82]
Контролируемое редактирование генома [ править ]
Дальнейшие улучшения и варианты системы CRISPR-Cas9 были направлены на обеспечение большего контроля над ее использованием. В частности, исследования, направленные на улучшение этой системы, включают улучшение ее специфичности, эффективности и детализации возможностей редактирования. Методы можно дополнительно разделить и классифицировать по компонентам системы, которые они модифицируют. К ним относятся использование различных вариантов или новых творений белка Cas, использование совершенно другого эффекторного белка, модификация sgRNA или использование алгоритмического подхода для определения существующих оптимальных решений.
Специфичность является важным аспектом улучшения системы CRISPR-Cas9, поскольку вызываемые ею нецелевые эффекты имеют серьезные последствия для генома клетки и требуют осторожности при ее использовании. Таким образом, минимизация нецелевых эффектов обеспечивает максимальную безопасность системы. Новые варианты белков Cas9, повышающие специфичность, включают эффекторные белки с эффективностью и специфичностью, сравнимыми с оригинальным SpCas9, которые способны воздействовать на ранее нецелевые последовательности, а также вариант, который практически не имеет нецелевых мутаций. [90] [91] Также были проведены исследования по разработке новых белков Cas9, в том числе некоторых, которые частично заменяют нуклеотиды РНК в crРНК на ДНК, а также процедура создания структурно-ориентированного мутанта Cas9, все из которых имели снижение нецелевых эффектов. [92] [93] Было показано, что итеративно укороченные sgRNA и высокостабилизированные gRNA также уменьшают нецелевые эффекты. [94] [95] Вычислительные методы, включая машинное обучение, использовались для прогнозирования сходства и создания уникальных последовательностей для системы, чтобы максимизировать специфичность для заданных целей. [96] [97]
Несколько вариантов CRISPR-Cas9 позволяют активировать гены или редактировать геном с помощью внешнего триггера, такого как свет или небольшие молекулы. [98] [99] [100] К ним относятся фотоактивируемые системы CRISPR, разработанные путем слияния светочувствительных белков-партнеров с активаторным доменом и dCas9 для активации генов, [101] [102] или путем слияния подобных светочувствительных доменов с двумя конструкциями расщепленного Cas9, [103] [104] или путем включения каркасных неприродных аминокислот в Cas9, [105] или путем модификации направляющих РНК фоторасщепляемыми комплементами для редактирования генома. [106]
Методы контроля редактирования генома с помощью малых молекул включают аллостерический Cas9 без обнаруживаемого фонового редактирования, который активирует связывание и расщепление при добавлении 4-гидрокситамоксифена (4-HT), [98] 4-НТ-чувствительный интеин -связанный Cas9, [107] или Cas9, который реагирует на 4-HT при слиянии с четырьмя доменами ERT2. [108] Интеин-индуцируемый расщепление Cas9 позволяет димеризовать фрагменты Cas9. [109] и индуцируемую рапамицином систему расщепления Cas9, разработанную путем слияния двух конструкций расщепленного Cas9 с FRB и FKBP . фрагментами [110] Другие исследования смогли индуцировать транскрипцию Cas9 с помощью небольшой молекулы доксициклина . [111] [112] Небольшие молекулы также можно использовать для улучшения репарации, направленной на гомологию. [113] часто путем ингибирования негомологичного пути соединения концов и/или тета-опосредованного пути соединения концов. [114] [115] Была создана система с эффекторным белком Cpf1, индуцируемая малыми молекулами VE-822 и AZD-7762. [116] Эти системы позволяют условно контролировать активность CRISPR для повышения точности, эффективности и пространственно-временного контроля. Пространственно-временной контроль — это форма устранения нецелевых эффектов: может потребоваться модификация только определенных клеток или частей организма, и поэтому в качестве способа проведения этого можно использовать свет или небольшие молекулы. Эффективность системы CRISPR-Cas9 также значительно повышается за счет правильной доставки инструкций ДНК для создания белков и необходимых реагентов. [116]
CRISPR также использует белки редактирования одной пары оснований для создания специфических изменений одного или двух оснований в целевой последовательности. CRISPR/Cas9 был слит со специфическими ферментами, которые изначально могли менять только мутации C на T и G на A и их обратную реакцию. В конечном итоге это было достигнуто без какого-либо расщепления ДНК. [117] [118] [119] При слиянии другого фермента система редактирования оснований CRISPR-Cas9 также может редактировать C в G и обратно. [120]
CRISPR-скрининг [ править ]
Система кластеризованных коротких палиндромных повторов с регулярными промежутками (CRISPR)/Cas9 представляет собой технологию редактирования генов, которая может вызывать двухцепочечные разрывы (DSB) в любом месте, где рибонуклеиновые кислоты ( гРНК ) могут связываться с последовательностью мотива, примыкающего к протоспейсеру (PAM). [121] Однонитевые разрывы также могут быть индуцированы мутантами активного сайта Cas9. [122] также известный как никасы Cas9. [123] Просто изменив последовательность гРНК, эндонуклеазу Cas9 можно доставить к интересующему гену и индуцировать DSB. [124] Эффективность Cas9-эндонуклеазы и легкость воздействия на гены привели к разработке библиотек CRISPR-нокаута (KO) как для клеток мыши, так и для клеток человека, которые могут охватывать либо конкретные наборы интересующих генов, либо весь геном. [125] [126] Скрининг CRISPR помогает ученым создавать систематические и высокопроизводительные генетические изменения в живых модельных организмах. Это генетическое возмущение необходимо для полного понимания функции генов и эпигенетической регуляции. [127] Преимущество объединенных библиотек CRISPR заключается в том, что одновременно можно воздействовать на большее количество генов.
Нокаутные библиотеки создаются таким образом, чтобы обеспечить одинаковое представительство и эффективность всех экспрессируемых гРНК, и содержат антибиотик или флуоресцентный маркер селекции, который можно использовать для восстановления трансдуцированных клеток. [121] есть две плазмидные В библиотеках CRISPR/Cas9 системы. Во-первых, все это в одной плазмиде, где sgRNA и Cas9 продуцируются одновременно в трансфицированной клетке. Во-вторых, это двухвекторная система: sgRNA и плазмиды Cas9 доставляются отдельно. [127] Важно доставить тысячи уникальных sgRNA-содержащих векторов в один сосуд клеток путем вирусной трансдукции при низкой множественности заражения (MOI, обычно 0,1–0,6), это предотвращает вероятность заражения отдельного клона клетки более чем одним типа сгРНК, в противном случае это может привести к неправильному отнесению генотипа к фенотипу . [125]
После того, как объединенная библиотека подготовлена, необходимо провести глубокое секвенирование (NGS, секвенирование следующего поколения) плазмидной ДНК, амплифицированной с помощью ПЦР, чтобы выявить обилие sgRNA. Интересующие клетки могут быть последовательно инфицированы библиотекой, а затем отобраны в соответствии с фенотипом. Существует 2 типа отбора: негативный и позитивный. Путем негативной селекции эффективно выявляются мертвые или медленно растущие клетки. Он может идентифицировать гены, необходимые для выживания, которые в дальнейшем могут служить кандидатами на молекулярно-направленные лекарства. С другой стороны, положительный отбор дает набор популяций с преимуществом в росте, приобретенных путем случайного мутагенеза. [121] После отбора геномную ДНК собирают и секвенируют с помощью NGS. Истощение или обогащение sgRNA обнаруживается и сравнивается с исходной библиотекой sgRNA, аннотированной целевым геном, которому соответствует sgRNA. Затем статистический анализ идентифицирует гены, которые с большой вероятностью будут иметь отношение к интересующему фенотипу. [125]
| Библиотека | ИДЕНТИФИКАТОР | Разновидность | ПИ | Гены нацелены | гРНК на ген | Всего гРНК |
|---|---|---|---|---|---|---|
| Библиотека нокаутов CRISPR Bassik Mouse | 1000000121–1000000130 | Мышь | Бассик | Варьируется (всего ~23 000) | ~10 | Варьируется |
| Библиотека нокаута генов-супрессоров опухолей мыши CRISPR | 113584 Магистраль EFS 113585 Магистраль ТБГ | Мышь | Чен | 56 | ~4 | 286 |
| Полногеномная библиотека мыши Бри | 73632 (1 плазмида) 73633 (2 плазмиды) | Мышь | Дёнч и Рут | 19,674 | 4 | 78,637 |
| Библиотека нокаутов Bassik Human CRISPR | 101926–101934 | Человек | Бассик | Варьируется (всего ~20 500) | ~10 | Варьируется |
| Библиотека всего генома человека Брунелло | 73179 (1 плазмида) 73178 (2 плазмиды) | Человек | Дёнч и Рут | 19,114 | 4 | 76,441 |
| Мини-человеческая нокаутная библиотека всего генома человека на основе AsCpf1 | 130630 | Человек | Дрэтта | 16,977 | 3–4 | 17 032 массива |
Помимо нокаута существуют также библиотеки нокдауна (CRISPRi) и активации (CRISPRa), которые используют способность протеолитически дезактивированных белков слияния Cas9 (dCas9) связывать целевую ДНК, что означает, что интересующий ген не разрезается, а является чрезмерно выраженным или подавленным. Это сделало систему CRISPR/Cas9 еще более интересной для редактирования генов. Неактивный белок dCas9 модулирует экспрессию генов путем нацеливания репрессоров или активаторов dCas9 на промотор или сайты начала транскрипции генов-мишеней. Для репрессии генов Cas9 может быть слит с эффекторным доменом KRAB, который образует комплекс с гРНК, тогда как CRISPRa использует dCas9, слитый с различными доменами активации транскрипции, которые далее направляются гРНК в области промотора для усиления экспрессии. [129] [130] [131]
Приложения [ править ]
заболеваний Модели
Геномная модификация Cas9 позволила быстро и эффективно создавать трансгенные модели в области генетики. Cas9 можно легко ввести в клетки-мишени вместе с sgRNA посредством трансфекции плазмиды, чтобы моделировать распространение заболеваний, а также реакцию клетки на инфекцию и защиту от нее. [132] Способность Cas9 внедряться in vivo позволяет создавать более точные модели функции генов и эффектов мутаций, избегая при этом нецелевых мутаций, обычно наблюдаемых при использовании старых методов генной инженерии.
Революция CRISPR и Cas9 в геномном моделировании распространяется не только на млекопитающих. Традиционные геномные модели, такие как Drosophila melanogaster , один из первых модельных организмов, получили дальнейшее усовершенствование в разрешении с использованием Cas9. [132] Cas9 использует клеточно-специфичные промоторы, позволяющие контролировать использование Cas9. Cas9 — это точный метод лечения заболеваний, поскольку фермент Cas9 воздействует только на определенные типы клеток. Клетки, подвергающиеся терапии Cas9, также можно удалить и ввести повторно, чтобы обеспечить усиленный эффект терапии. [133]
CRISPR-Cas9 можно использовать для редактирования ДНК организмов in vivo и для удаления отдельных генов или даже целых хромосом из организма на любом этапе его развития. Хромосомы, которые были успешно удалены in vivo с помощью методов CRISPR, включают Y-хромосому и X-хромосому взрослых лабораторных мышей и хромосомы 14 и 21 человека в линиях эмбриональных стволовых клеток и анеуплоидных мышах соответственно. Этот метод может быть полезен для лечения генетических заболеваний, вызванных аномальным количеством хромосом, таких как синдром Дауна и интерсексуальные расстройства. [134]
Успешное редактирование генома in vivo с использованием CRISPR-Cas9 было показано на многочисленных модельных организмах, включая Escherichia coli , [135] сахаромицеты cerevisiae , [136] [137] Candida albicans , Methanosarcina acetivorans , [138] [139] Ценорхабдитис элегантный , [140] виды Arabidopsis , [141] Данио Рерио , [142] и Mus Musculus . [143] [144] Достигнуты успехи в изучении фундаментальной биологии, в создании моделей болезней, [140] [145] и в экспериментальном лечении моделей заболеваний. [146]
Высказывались опасения, что нецелевые эффекты (редактирование генов помимо запланированных) могут исказить результаты эксперимента по редактированию генов CRISPR (т.е. наблюдаемое фенотипическое изменение может быть связано не с модификацией целевого гена, а с каким-то другим геном). В CRISPR были внесены изменения, чтобы свести к минимуму возможность нецелевых эффектов. Ортогональные эксперименты CRISPR часто рекомендуются для подтверждения результатов эксперимента по редактированию генов. [147] [148]
CRISPR упрощает создание генетически модифицированных организмов для исследований, которые имитируют болезнь или показывают, что происходит, когда ген выключается или мутирует. CRISPR можно использовать на уровне зародышевой линии для создания организмов, в которых целевой ген изменен повсюду (т.е. во всех клетках/тканях/органах многоклеточного организма), или его можно использовать в клетках не зародышевой линии для создания локальных изменений, которые только влияют на определенные популяции клеток организма. [149] [150] [151]
CRISPR можно использовать для создания клеточных моделей заболеваний человека. [152] Например, при применении к плюрипотентным стволовым клеткам человека CRISPR использовался для введения целевых мутаций в гены, связанные с поликистозом почек (ПБП) и фокально-сегментарным гломерулосклерозом (ФСГС). [153] Эти CRISPR-модифицированные плюрипотентные стволовые клетки впоследствии были выращены в органоидах почек человека , которые проявляли фенотипы, специфичные для заболевания. почек Органоиды из стволовых клеток с мутациями PKD образовывали большие полупрозрачные кисты из почечных канальцев. Кисты были способны достигать макроскопических размеров, до одного сантиметра в диаметре. [154] Органоиды почек с мутациями в гене, связанном с ФСГС, развивают дефекты соединений между подоцитами , фильтрующими клетками, поражаемыми при этом заболевании. Это было связано с неспособностью подоцитов образовывать микроворсинки между соседними клетками. [155] Важно отметить, что эти фенотипы заболевания отсутствовали в контрольных органоидах с идентичным генетическим фоном, но без модификаций CRISPR. [153]
Аналогичный подход был использован для моделирования синдрома удлиненного интервала QT в кардиомиоцитах, полученных из плюрипотентных стволовых клеток. [156] Эти клеточные модели, созданные с помощью CRISPR, с изогенным контролем открывают новый способ изучения болезней человека и тестирования лекарств.
Биомедицина [ править ]
Технология CRISPR-Cas была предложена для лечения множества заболеваний человека, особенно тех, которые имеют генетическую причину. [157] Его способность изменять определенные последовательности ДНК делает его инструментом, способным исправлять мутации, вызывающие заболевания. Ранние исследования на животных моделях показывают, что методы лечения, основанные на технологии CRISPR, потенциально способны лечить широкий спектр заболеваний. [158] включая рак, [159] прогерия , [160] бета-талассемия, [161] [162] [163] серповидно-клеточная анемия , [163] [164] гемофилия , [165] муковисцидоз , [166] мышечная дистрофия Дюшенна , [167] болезнь Гентингтона , [168] [169] транстиретиновый амилоидоз [43] и болезни сердца. [170] CRISPR также использовался для лечения малярии у комаров, что могло бы уничтожить переносчика и болезнь у людей. [171] CRISPR также может найти применение в тканевой инженерии и регенеративной медицине, например, для создания кровеносных сосудов человека, в которых отсутствует экспрессия белков MHC класса II , которые часто вызывают отторжение трансплантата. [172]
Кроме того, клинические испытания по лечению бета-талассемии и серповидноклеточной анемии у пациентов с использованием технологии CRISPR-Cas9 показали многообещающие результаты. [173] [174]
Тем не менее, остается несколько ограничений использования этой технологии в генной терапии : относительно высокая частота нецелевого эффекта , необходимость наличия последовательности PAM рядом с целевым сайтом, p53- опосредованный апоптоз за счет CRISPR-индуцированных двухцепочечных разрывов и иммуногенная токсичность. из-за системы доставки, как правило, вирусом . [175]
Лебера Врожденный амавроз
Лечение CRISPR LCA10 (наиболее распространенный вариант врожденного амавроза Лебера , который является основной причиной наследственной детской слепоты) модифицирует дефектный ген фоторецептора пациента.
В марте 2020 года первый пациент-волонтер в этом американском исследовании, спонсируемом Editas Medicine, получил низкую дозу препарата для проверки безопасности.
В июне 2021 года начался набор в группу взрослых и детей, получающих высокие дозы, по 4 пациента-добровольца в каждой. Ожидается, что дозирование новых групп будет завершено к июлю 2022 года. [176] В ноябре 2022 года Editas сообщила, что у 20% пролеченных пациентов наблюдались значительные улучшения, но также объявила, что полученная целевая популяция слишком мала, чтобы поддерживать дальнейшее независимое развитие. [177]
Рак [ править ]
CRISPR также нашел множество применений при разработке клеточной иммунотерапии. [178] Первое клиническое испытание с использованием CRISPR началось в 2016 году. Оно включало взятие иммунных клеток у людей с раком легких, использование CRISPR для редактирования гена, экспрессирующего PD-1, а затем введение измененных клеток обратно тому же человеку. По состоянию на 2017 год еще 20 исследований находились в стадии реализации или были почти готовы, в основном в Китае. [update]. [159]
В 2016 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило клиническое исследование, в котором CRISPR будет использоваться для изменения Т-клеток, полученных от людей с различными видами рака, а затем введения этих сконструированных Т-клеток обратно тем же людям. [179]
В ноябре 2020 года на моделях мышей-животных CRISPR был эффективно использован для лечения глиобластомы (быстрорастущей опухоли головного мозга) и метастатического рака яичников , поскольку это два вида рака с наихудшим прогнозом и обычно диагностируются на более поздних стадиях. . Лечение привело к подавлению роста опухоли и увеличению выживаемости на 80% при метастатическом раке яичников и апоптозе опухолевых клеток , подавлению роста опухоли на 50% и улучшению выживаемости на 30% при глиобластоме. [180]
В октябре 2021 года CRISPR Therapeutics объявила о результатах продолжающегося в США исследования фазы 1 аллогенной Т-клеточной терапии. Эти клетки получают от здоровых доноров и редактируют, чтобы атаковать раковые клетки и избежать того, чтобы иммунная система реципиента воспринимали их как угрозу, а затем размножают в огромные партии, которые можно передать большому количеству реципиентов. [176]
В декабре 2022 года 13-летняя британская девочка, у которой был диагностирован неизлечимый острый Т-клеточный лимфобластный лейкоз, была вылечена врачами больницы Грейт-Ормонд-Стрит , что стало первым задокументированным применением терапевтического редактирования генов для этой цели, после шестимесячного курса лечения. экспериментальное лечение, при котором предыдущие попытки других методов лечения оказались безуспешными. Процедура включала перепрограммирование здоровой Т-клетки для уничтожения раковых Т-клеток, чтобы сначала избавить ее от лейкемии, а затем восстановление ее иммунной системы с нуля с использованием здоровых иммунных клеток. [181] Команда использовала редактирование BASE и ранее лечила случай острого лимфобластного лейкоза в 2015 году с использованием TALEN . [182]
Диабет [ править ]
Диабет 1 типа — это эндокринное заболевание, которое возникает из-за нехватки бета-клеток поджелудочной железы, вырабатывающих инсулин, жизненно важное соединение для транспортировки сахара в крови к клеткам для производства энергии. Исследователи пытались трансплантировать здоровые бета-клетки. CRISPR используется для редактирования клеток, чтобы снизить вероятность отторжения трансплантата организмом пациента.
17 ноября 2021 года компании CRISPR therapeutics и ViaCyte объявили, что канадское медицинское агентство одобрило их запрос на проведение клинических испытаний VCTX210, терапии стволовыми клетками с использованием CRISPR, предназначенной для лечения диабета 1 типа. Это было важно, потому что это был первый в истории генно-модифицированный метод лечения диабета, который поступил в клиники. Те же компании также разработали новый метод лечения диабета 1 типа, заключающийся в выработке инсулина с помощью небольшого медицинского имплантата, который использует миллионы клеток поджелудочной железы, полученных из стволовых клеток с отредактированным геном CRISPR. [183]
В феврале 2022 года было проведено исследование первой фазы, в ходе которого лечение получил один пациент-волонтер. [176] [184]
ВИЧ/СПИД [ править ]
Вирус иммунодефицита человека или ВИЧ – это вирус, поражающий иммунную систему организма. Несмотря на то, что существуют эффективные методы лечения, позволяющие пациентам вести здоровый образ жизни, ВИЧ имеет обратную силу, что означает, что он встраивает неактивную версию самого себя в геном человека. CRISPR можно использовать для избирательного удаления вируса из генома путем разработки направляющей РНК, нацеленной на ретроактивный геном ВИЧ. Одна из проблем этого подхода заключается в том, что он требует удаления генома ВИЧ почти из всех клеток, чего в реальности может быть трудно достичь. [176]
Первоначальные результаты лечения ВИЧ были весьма успешными: в 2021 году 9 из 23 гуманизированных мышей получили комбинацию антиретровирусных препаратов и CRISPR/Cas-9, что привело к тому, что вирус стал необнаружимым даже после обычного периода восстановления. . Ни один из двух методов лечения по отдельности не дал такого эффекта. [185] Клинические испытания на людях терапии на основе CRISPR-Cas9, EBT-101, начнутся в 2022 году. [186] [187] В октябре 2023 года раннее исследование на трех людях, принимавших EBT-101, показало, что лечение оказалось безопасным и не имело серьезных побочных эффектов, но никаких данных о его эффективности раскрыто не было. [188] В 2024 году еще одна терапия CRISPR, проведенная исследователями Амстердамского университета, сообщила об устранении ВИЧ на клеточных культурах. В марте 2024 года исследователи из Амстердамского университета сообщили об устранении ВИЧ на клеточных культурах с помощью CRISPR. [189] [190]
Инфекция [ править ]
«РНК-ориентированные нуклеазы» на основе CRISPR-Cas можно использовать для воздействия на факторы вирулентности , гены, кодирующие устойчивость к антибиотикам , и другие представляющие интерес с медицинской точки зрения последовательности. Таким образом, эта технология представляет собой новую форму противомикробной терапии и стратегию манипулирования бактериальными популяциями. [191] [192] Недавние исследования предполагают корреляцию между вмешательством в локус CRISPR-Cas и приобретением устойчивости к антибиотикам. [193] Эта система обеспечивает защиту бактерий от проникновения чужеродной ДНК, такой как транспозоны , бактериофаги и плазмиды. Было показано, что эта система оказывает сильное селективное давление на приобретение устойчивости к антибиотикам и фактора вирулентности у бактериальных патогенов. [193]
Терапия, основанная на технологии редактирования генов CRISPR-Cas3 с помощью сконструированных бактериофагов, может использоваться для разрушения целевой ДНК патогенов. [194] Cas3 более разрушительен, чем более известный Cas9. [195] [196]
Исследования показывают, что CRISPR является эффективным способом ограничения репликации нескольких герпесвирусов . Ему удалось уничтожить вирусную ДНК в случае вируса Эпштейна-Барра (ЭБВ). Антигерпесвирусные CRISPR имеют многообещающие применения, такие как удаление вызывающего рак EBV из опухолевых клеток, помощь в избавлении донорских органов пациентов с ослабленным иммунитетом от вирусных захватчиков или предотвращение вспышек герпеса и рецидивирующих глазных инфекций путем блокирования HSV-1 реактивации . По состоянию на август 2016 г. [update], они ожидали испытаний. [197]
CRISPR может возродить концепцию трансплантации органов животных людям. Ретровирусы, присутствующие в геномах животных, могут нанести вред реципиентам трансплантатов. В 2015 году команда удалила 62 копии определенной последовательности ретровирусной ДНК из генома свиньи в эпителиальной клетке почки. [198] Недавно исследователи продемонстрировали способность рождать живых особей свиней после того, как впервые удалили эти ретровирусы из их генома с помощью CRISPR. [199]
Неврологические заболевания
CRISPR уникален для решения неврологических заболеваний по нескольким причинам. Например, CRISPR позволяет исследователям быстро создавать модели клеток животных и человека. Это позволяет им изучать, как гены функционируют в нервной системе. Вводя в эти клетки мутации, связанные с различными заболеваниями, исследователи могут изучить влияние этих изменений на развитие, функции и поведение нервной системы. [200] Они смогут раскрыть молекулярные механизмы, способствующие этим расстройствам, что важно для разработки эффективных методов лечения. Это особенно полезно при моделировании и лечении сложных неврологических расстройств, таких как болезни Альцгеймера , Паркинсона и эпилепсия .
Болезнь Альцгеймера (БА) — нейродегенеративное заболевание, характеризующееся потерей нейронов и накоплением внутриклеточных нейрофибриллярных клубков и внеклеточных амилоидных бляшек в головном мозге. [201] Идентифицированы три известных патогенных гена, которые вызывают раннее начало болезни Альцгеймера у людей, а именно белок-предшественник амилоида (APP), пресенилин 1 (PSEN1) и пресенилин 2 (PSEN2). [201] В этих генах обнаружено более 300 мутаций, приводящих к увеличению общего количества β-амилоида (Aβ), соотношения Aβ42/40 и/или полимеризации Aβ.
В случае мышечной дистрофии Дюшенна мутация, ответственная за заболевание, возникает в гене дистрофина. [202] Чтобы исправить это, был использован CRISPR. Аналогично, при синдроме Драве, который является эпилептическим расстройством, CRISPR использовался для коррекции мутации гена SCN1A. [203] Несмотря на достигнутый прогресс, по-прежнему существуют проблемы с использованием CRISPR. Поскольку мозг состоит из гематоэнцефалического барьера, через него сложно перенести компоненты CRISPR. Однако недавние достижения в области систем доставки наночастиц и вирусных векторов показали многообещающее преодоление этого препятствия. В будущем ожидается, что использование CRISPR в нейробиологии будет увеличиваться по мере развития технологий.
антропология Генетическая
CRISPR-Cas9 можно использовать для исследования и выявления генетических различий человека и других человекообразных обезьян, особенно в мозге . Например, путем повторного введения архаичных вариантов генов в органоиды мозга, чтобы продемонстрировать влияние на нейрогенез, [204] метафазная длина апикальных предшественников развивающегося неокортекса, [205] или путем нокаута гена в эмбриональных стволовых клетках, чтобы идентифицировать генетический регулятор, который посредством раннего изменения формы клеток приводит к эволюционному расширению переднего мозга человека . [206] [207] В одном исследовании описано серьезное влияние архаичного варианта гена на развитие нервной системы. [208] [209] что может быть артефактом побочного эффекта CRISPR, [210] [211] поскольку это не могло быть воспроизведено в последующем исследовании. [78]
По технике [ править ]
Нокдаун/активация [ править ]

Использование «мертвых» версий Cas9 ( dCas9 ) устраняет способность CRISPR разрезать ДНК, сохраняя при этом его способность нацеливаться на желаемые последовательности. Несколько групп добавили к dCas9 различные регуляторные факторы, что позволило им включать и выключать практически любой ген или регулировать уровень его активности. [198] Как и RNAi, CRISPR-интерференция (CRISPRi) обратимо отключает гены, нацеливаясь на сайт, но не разрезая его. Целевой сайт метилируется, эпигенетически модифицируя ген. Эта модификация ингибирует транскрипцию. Эти точно размещенные модификации могут затем использоваться для регулирования воздействия на экспрессию генов и динамику ДНК после ингибирования определенных последовательностей генома внутри ДНК. В течение последних нескольких лет эпигенетические метки в различных клетках человека были тщательно исследованы, и было обнаружено, что определенные закономерности в этих метках коррелируют со всем — от роста опухоли до активности мозга. [10] И наоборот, активация, опосредованная CRISPR (CRISPRa), способствует транскрипции генов. [212] Cas9 — это эффективный способ нацеливания и подавления определенных генов на уровне ДНК. [213] У бактерий присутствия только Cas9 достаточно, чтобы блокировать транскрипцию. Для млекопитающих добавляется часть белка. Его направляющая РНК нацелена на регуляторные последовательности ДНК, называемые промоторами , которые непосредственно предшествуют целевому гену. [214]
Cas9 использовался для переноса синтетических факторов транскрипции , которые активировали определенные гены человека. Этот метод достиг сильного эффекта за счет нацеливания нескольких конструкций CRISPR на несколько разные места промотора гена. [214]
Редактирование РНК [ править ]
В 2016 году исследователи продемонстрировали, что CRISPR обычной ротовой бактерии можно использовать для редактирования РНК . Исследователи провели поиск в базах данных, содержащих сотни миллионов генетических последовательностей, похожих на гены CRISPR. Они считали фузобактерию Leptotrichia shahii . У него была группа генов, напоминающих гены CRISPR, но с важными отличиями. Когда исследователи снабдили другие бактерии этими генами, которые они назвали C2c2, они обнаружили, что организмы получили новую защиту. [215] Позже C2c2 был переименован в Cas13a, чтобы соответствовать стандартной номенклатуре генов Cas. [216]
Многие вирусы кодируют свою генетическую информацию в РНК, а не в ДНК, которую они используют для создания новых вирусов. ВИЧ и полиовирус являются такими вирусами. Бактерии с Cas13 производят молекулы, которые могут расчленять РНК, уничтожая вирус. Адаптация этих генов открыла возможность редактирования любой молекулы РНК. [215]
Системы CRISPR-Cas также можно использовать для редактирования генов микро-РНК и длинных некодирующих РНК у растений. [217]
применение Терапевтическое
Направление редактирования для исправления мутировавших последовательностей было впервые предложено и продемонстрировано в 1995 году. [218] В этой первоначальной работе использовались синтетические антисмысловые олигонуклеотиды РНК, комплементарные мутации преждевременного стоп-кодона в последовательности дистрофина, чтобы активировать редактирование стоп-кодона A-to-I для считывания кодона в модельной клеточной системе xenopus. [218] Хотя это также привело к близлежащим непреднамеренным переходам от A к I, переходы от A к I (читаются как G) могут исправить все три стоп-кодона, но не могут создать стоп-кодон. Таким образом, изменения привели к более чем 25% коррекции целевого стоп-кодона с считыванием нижестоящей репортерной последовательности люциферазы. Вслед за работой Розенталя удалось отредактировать мутированную последовательность мРНК в культуре клеток млекопитающих, направив олигонуклеотид, связанный с цитидиндезаминазой, на коррекцию мутантной последовательности муковисцидоза. [219] Совсем недавно CRISPR-Cas13, слитый с деаминазами, был использован для управления редактированием мРНК. [220]
В 2022 году было сообщено о терапевтическом редактировании РНК Cas7-11. [221] [222] Он позволяет осуществлять достаточно целевые разрезы, и его ранняя версия использовалась для редактирования in vitro в 2021 году. [223]с редактированием Сравнение ДНК
Генный драйв [ править ]
Генные драйвы могут стать мощным инструментом для восстановления баланса экосистем путем уничтожения инвазивных видов. Были высказаны опасения по поводу эффективности, непредвиденных последствий для целевых и нецелевых видов, особенно в связи с возможностью случайного выброса из лабораторий в дикую природу. Ученые предложили несколько мер безопасности для сдерживания экспериментальных генных драйвов, включая молекулярные, репродуктивные и экологические. [225] Многие рекомендуют развивать иммунизацию и реверсивные стимулы в тандеме с генными драйвами, чтобы при необходимости перезаписать их эффекты. [226] По-прежнему существует консенсус в отношении того, что долгосрочные последствия необходимо изучать более тщательно, особенно в отношении потенциальных экологических нарушений, которые невозможно исправить с помощью реверсивных мер. [227]
in Генетическое vitro истощение
Необогащенные библиотеки секвенирования часто содержат большое количество нежелательных последовательностей. Cas9 может специфически истощать нежелательные последовательности путем разрыва двойной цепи с эффективностью до 99% и без значительных нецелевых эффектов , как это наблюдается при использовании ферментов рестрикции . Лечение Cas9 может истощить обилие рРНК, одновременно повышая чувствительность патогенов в библиотеках RNA-seq. [228]
Редактирование эпигенома [ править ]

Редактирование эпигенома или эпигеномная инженерия — это тип генной инженерии, при котором эпигеном модифицируется в определенных сайтах с использованием сконструированных молекул, нацеленных на эти сайты (в отличие от модификаций всего генома). В то время как редактирование генов включает в себя изменение самой последовательности ДНК, эпигенетическое редактирование включает в себя модификацию и представление последовательностей ДНК белкам и другим факторам связывания ДНК, которые влияют на функцию ДНК. «Редактируя» эпигеномные особенности таким образом, исследователи могут определить точную биологическую роль эпигенетической модификации в рассматриваемом участке.
Сконструированные белки, используемые для редактирования эпигенома, состоят из ДНК-связывающего домена, нацеленного на определенные последовательности, и эффекторного домена, который модифицирует эпигеномные особенности. В настоящее время для редактирования эпигенома преимущественно используются три основные группы ДНК-связывающих белков: цинковых пальцев белки , эффекторы, подобные активаторам транскрипции (TALE), и слияния Cas9 с дефицитом нуклеазы ( CRISPR ).Приложения [ править ]
Направленная регуляция генов, связанных с заболеваниями, может позволить разработать новые методы лечения многих заболеваний, особенно в тех случаях, когда адекватная генная терапия еще не разработана или не подходит. [229] Хотя последствия на трансгенерационном и популяционном уровне еще не до конца понятны, они могут стать основным инструментом прикладной функциональной геномики и персонализированной медицины . [230] Как и редактирование РНК , оно не связано с генетическими изменениями и сопутствующими им рисками. [229] Один из примеров потенциального функционального использования редактирования эпигенома был описан в 2021 году: подавление Na v 1.7 экспрессии гена с помощью CRISPR-dCas9 , что продемонстрировало терапевтический потенциал на трех мышиных моделях хронической боли. [231] [232]
В 2022 году исследования оценили его полезность в снижении уровня тау-белка , регулировании белка, участвующего в болезни Хантингтона , борьбе с наследственной формой ожирения и синдромом Драве . [233]CRISPR-ориентированные интегразы [ править ]
Комбинация CRISPR-Cas9 с интегразами позволила разработать метод большие правки без проблемных двухцепочечных разрывов, как продемонстрировано на примере PASTE в 2022 году. Исследователи сообщили, что его можно использовать для доставки генов длиной до 36 000 пар оснований ДНК в несколько типов клеток человека и, таким образом, потенциально для лечения заболеваний, вызванных большим количеством мутаций. [234] [235]
Основное редактирование [ править ]
Премьер-редактирование [236] (или базовое редактирование) — это усовершенствование CRISPR, позволяющее точно вставлять или удалять участки ДНК. Редактирование CRISPR не всегда идеально, и обрезки могут оказаться не в том месте. Обе проблемы представляют собой проблему для использования технологии в медицине. [237] Прайм-редактирование не разрезает двухцепочечную ДНК, а вместо этого использует устройство нацеливания CRISPR для доставки дополнительного фермента к желаемой последовательности, где он преобразует один нуклеотид в другой. [238] Новый проводник, называемый пегРНК, содержит матрицу РНК для новой последовательности ДНК, которую необходимо добавить в геном в целевом месте. Для этого требуется второй белок, присоединенный к Cas9: фермент обратной транскриптазы, который может создать новую цепь ДНК из матрицы РНК и вставить ее в поврежденный участок. [239] Каждое из этих трех независимых событий сопряжения дает возможность предотвратить нецелевые последовательности, что значительно повышает гибкость таргетинга и точность редактирования. [238] Прайм-редактирование было разработано исследователями из Института Броуда Массачусетского технологического института и Гарварда в Массачусетсе. [240] Требуется дополнительная работа по оптимизации методов. [240] [239]
и Общество культура
человека Модификация линии зародышевой
По состоянию на март 2015 года несколько групп объявили о продолжающихся исследованиях с намерением заложить основы для применения CRISPR к человеческим эмбрионам для инженерии зародышевой линии человека , включая лаборатории в США, Китае и Великобритании, а также американскую биотехнологическую компанию OvaScience . [241] Ученые, в том числе один из первооткрывателей CRISPR, призвали ввести во всем мире мораторий на применение CRISPR к зародышевой линии человека, особенно для клинического использования. Они заявили, что «ученым следует избегать даже попыток в слабых юрисдикциях модифицировать геном зародышевой линии для клинического применения у людей» до тех пор, пока все последствия «не будут обсуждены научными и правительственными организациями». [242] [243] Эти ученые поддерживают дальнейшие исследования CRISPR на низком уровне и не считают CRISPR достаточно развитым для любого клинического использования для внесения наследственных изменений в организм человека. [244]
В апреле 2015 года китайские ученые сообщили о результатах попытки изменить ДНК нежизнеспособных человеческих эмбрионов с помощью CRISPR для исправления мутации, вызывающей бета-талассемию — смертельное наследственное заболевание. [245] [246] Ранее исследование было отклонено журналами Nature и Science отчасти из-за этических соображений. [247] Эксперименты привели к успешному изменению только некоторых из намеченных генов и оказали нецелевое воздействие на другие гены. Исследователи заявили, что CRISPR не готов к клиническому применению в репродуктивной медицине . [247] Сообщалось, что в апреле 2016 года китайские ученые предприняли вторую неудачную попытку изменить ДНК нежизнеспособных человеческих эмбрионов с помощью CRISPR – на этот раз, чтобы изменить ген CCR5 , чтобы сделать эмбрион устойчивым к ВИЧ- инфекции. [248]
В декабре 2015 года в Вашингтоне под руководством Дэвида Балтимора прошел Международный саммит по редактированию генов человека . Члены национальных научных академий США, Великобритании и Китая обсудили этику модификации зародышевой линии. Они согласились поддерживать фундаментальные и клинические исследования в соответствии с определенными юридическими и этическими принципами. Было проведено особое различие между соматическими клетками , где эффекты редактирования ограничены одним человеком, и клетками зародышевой линии, где изменения генома могут быть унаследованы потомками. Наследственные модификации могут иметь непредвиденные и далеко идущие последствия для эволюции человека, генетические (например, взаимодействие генов и окружающей среды) и культурные (например, социальный дарвинизм ). Изменение гаметоцитов и эмбрионов с целью создания наследственных изменений у человека было признано безответственным. Группа согласилась инициировать международный форум для решения подобных проблем и гармонизации правил в разных странах. [249]
В феврале 2017 года Комитет Национальной академии наук, техники и медицины США ( NASEM ) по редактированию генов человека опубликовал отчет, в котором рассматриваются этические, юридические и научные проблемы, связанные с технологиями геномной инженерии. В заключении отчета говорилось, что наследственное редактирование генома в настоящее время недопустимо, но может быть оправдано при определенных заболеваниях; однако они не оправдали использование CRISPR для улучшения. [250]
В ноябре 2018 года Цзянькуй Хэ объявил, что он отредактировал два человеческих эмбриона, пытаясь отключить ген CCR5 , который кодирует рецептор, который ВИЧ использует для проникновения в клетки. Он сказал, что девочки-близнецы Лулу и Нана родились несколькими неделями ранее. Он сказал, что девочки все еще имеют функциональные копии CCR5 наряду с отключенными CCR5 ( мозаицизмом ) и все еще уязвимы к ВИЧ. Работа была широко осуждена как неэтичная, опасная и преждевременная. [251] Международная группа ученых призвала к глобальному мораторию на генетическое редактирование человеческих эмбрионов. [252]
Дизайнерские младенцы
Появление технологии редактирования генов CRISPR-Cas9 привело к возможности создания «дизайнерских детей». Эта технология позволяет устранить определенные генетические заболевания или улучшить здоровье за счет улучшения определенных генетических признаков.
генной Политические барьеры для инженерии
Политические правила для системы CRISPR-Cas9 различаются по всему миру. В феврале 2016 года регулирующие органы дали британским ученым разрешение на генетическую модификацию человеческих эмбрионов с помощью CRISPR-Cas9 и связанных с ним методов. Однако исследователям было запрещено имплантировать эмбрионы, и эмбрионы должны были быть уничтожены через семь дней. [253]
В США существует сложная межведомственная система регулирования для оценки новых генетически модифицированных продуктов питания и сельскохозяйственных культур. Например, Закон о защите сельскохозяйственных рисков 2000 года наделяет Министерство сельского хозяйства США полномочиями контролировать обнаружение, контроль, искоренение, подавление, предотвращение или замедление распространения вредителей растений или вредных сорняков для защиты сельского хозяйства, окружающей среды, и экономики США. Закон регулирует любой генетически модифицированный организм , который использует геном заранее определенного «вредителя растений» или любого растения, ранее не классифицированного. [254] В 2015 году Инонг Ян успешно деактивировал 16 специфических генов белого шампиньона, чтобы они не потемнели. Поскольку он не добавил в свой организм ДНК чужого вида ( трансгенную ), гриб не мог регулироваться Министерством сельского хозяйства США в соответствии с разделом 340.2. [255] Белый шампиньон Янга был первым организмом, генетически модифицированным с помощью белковой системы CRISPR-Cas9, который прошел регулирование США. [256]
В 2016 году Министерство сельского хозяйства США спонсировало комитет для рассмотрения будущей политики регулирования будущих методов генетической модификации. С помощью Национальных академий наук, техники и медицины США группы с особыми интересами встретились 15 апреля, чтобы обсудить возможные достижения в области генной инженерии в течение следующих пяти лет и любые новые правила, которые могут потребоваться в результате. [257] В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов предложило правило, которое будет классифицировать генно-инженерные модификации животных как «лекарства для животных», подвергая их строгому регулированию, если они предлагаются для продажи, и ограничивая возможности частных лиц и малого бизнеса сделать их прибыльными. [258] [259]
В Китае, где социальные условия резко контрастируют с условиями Запада, генетические заболевания несут тяжелую стигму. [260] Это оставляет Китаю меньше политических барьеров для использования этой технологии. [261] [262]
Признание [ править ]
В 2012 и 2013 годах CRISPR занял второе место в Science журнала номинации «Прорыв года» . В 2015 году он стал лауреатом этой награды. [198] CRISPR был назван одной из 10 прорывных технологий по версии MIT Technology Review в 2014 и 2016 годах. [263] [264] В 2016 году Дженнифер Дудна и Эммануэль Шарпантье вместе с Рудольфом Баррангу, Филиппом Хорватом и Фэн Чжаном выиграли международную премию Gairdner. В 2017 году Дудна и Шарпантье были удостоены Японской премии в Токио, Япония, за революционное изобретение CRISPR-Cas9. В 2016 году Шарпантье, Дудна и Чжан выиграли премию Тан в области биофармацевтической науки. [265] В 2020 году Шарпантье и Дудна были удостоены Нобелевской премии по химии , первой такой премии для женской команды, «за разработку метода редактирования генома». [266]
См. также [ править ]
- Инструменты CRISPR/Cas
- Журнал CRISPR
- Евгеника
- ДРАКО
- Цинковый палец
- Джин нокаут
- Генетика
- Глоссарий генетики
- Человеческая природа (документальный фильм, 2019)
- Редактирование генов LEAPER
- Сделайте людей лучше (документальный фильм, 2022 г.)
- РНКи
- миРНК
- Нуклеазный анализ Surveyor
- Синтетическая биология
Ссылки [ править ]
- ^ Jump up to: а б с Бак Р.О., Гомес-Оспина Н., Портеус М.Х. (август 2018 г.). «Редактирование генов в центре внимания». Тенденции в генетике . 34 (8): 600–611. дои : 10.1016/j.tig.2018.05.004 . ПМИД 29908711 . S2CID 49269023 .
- ^ «Нобелевская премия по химии 2020» . Нобелевская премия . Проверено 10 декабря 2020 г.
- ^ Коэн Дж. (7 октября 2020 г.). «CRISPR, революционные генетические «ножницы», удостоенные Нобелевской премии по химии» . Наука . дои : 10.1126/science.abf0540 . S2CID 225116732 .
- ^ Коэн Дж. (04.06.2018). «Получая престижную премию, затмеваемый исследователь CRISPR оказывается в центре внимания» . Наука | АААС . Проверено 2 мая 2020 г.
- ^ Jump up to: а б Оуэнс Р. (8 октября 2020 г.). «Нобелевская премия: кто останется в стороне?» . Разговор . Проверено 13 декабря 2021 г.
- ^ «Литовские учёные не получили Нобелевскую премию, несмотря на открытие той же технологии» . LRT.LT. 8 октября 2020 г.
- ^ Сикснис В. (16.06.2018). «У меня есть генные ножницы, мы вырезаем ошибку, болезни не остается» . Свобода ТВ / Свобода ТВ . 12:22 минута. ЛайсвесТВ. <...>Мы первыми отправили нашу статью в редакцию, но там не очень повезло. Один редактор сказал, что мы даже рецензенту отправлять не будем. Мы отправили ее в другую редакцию - она (статья) очень долго лежала где-то на столе редакции. Что ж, в конце концов мы отправили это в третий журнал, и третий журнал опубликовал его несколько месяцев спустя. Но, конечно, исследователи из Университета Беркли поступили лучше — они отправили статью в журнал Science — она была принята и опубликована через 2 недели. Хотя на самом деле они прислали эту статью на пару месяцев позже нас . Проверено 30 июня 2018 г.
<...> Ну, мы первыми прислали статью, но особо не повезло.
- ^ Чжан Дж.Х., Панди М., Калер Дж.Ф., Лошаков А., Харрис Б., Дагур П.К. и др. (ноябрь 2014 г.). «Улучшение специфичности и эффективности CRISPR/CAS9 и гРНК с помощью целевого репортера ДНК» . Журнал биотехнологии . 189 : 1–8. doi : 10.1016/j.jbiotec.2014.08.033 . ПМЦ 4252756 . ПМИД 25193712 .
- ^ Вакульскас К.А., Девер Д.П., Реттиг Г.Р., Терк Р., Якоби А.М., Коллингвуд М.А. и др. (август 2018 г.). «Высокоточный мутант Cas9, доставленный в виде рибонуклеопротеинового комплекса, позволяет эффективно редактировать гены в гемопоэтических стволовых и клетках-предшественниках человека» . Природная медицина . 24 (8): 1216–1224. дои : 10.1038/s41591-018-0137-0 . ПМК 6107069 . ПМИД 30082871 .
- ^ Jump up to: а б с Ледфорд Х (март 2016 г.). «CRISPR: редактирование генов — это только начало» . Природа . 531 (7593): 156–159. Бибкод : 2016Natur.531..156L . дои : 10.1038/531156a . ПМИД 26961639 .
- ^ Трэвис Дж. (17 декабря 2015 г.). «Прорыв года: CRISPR делает успех» . Научный журнал . Американская ассоциация содействия развитию науки.
- ^ Ледфорд Х (июнь 2015 г.). «CRISPR, разрушитель» . Природа . 522 (7554): 20–24. Бибкод : 2015Natur.522...20L . дои : 10.1038/522020a . ПМИД 26040877 .
- ^ Jump up to: а б «Касжеви: Великобритания одобрила препарат для редактирования генов серповидноклеточной анемии» . Новости Би-би-си . 16 ноября 2023 г. Проверено 16 ноября 2023 г.
- ^ Jump up to: а б «MHRA санкционирует первую в мире генную терапию, целью которой является лечение серповидно-клеточной анемии и трансфузионно-зависимой β-талассемии» . Gov.uk. 16 ноября 2023 г. Проверено 16 ноября 2023 г.
- ^ «FDA одобрило первый метод генной терапии для лечения пациентов с серповидноклеточной анемией» . Управление по контролю за продуктами и лекарствами . 11 декабря 2023 г. Проверено 11 декабря 2023 г.
- ^ Янг С. (11 февраля 2014 г.). «CRISPR и другие инструменты редактирования генома расширяют возможности медицинских исследований и генной терапии» . Обзор технологий Массачусетского технологического института . Проверено 13 апреля 2014 г.
- ^ Jump up to: а б Хайденрайх М., Чжан Ф. (январь 2016 г.). «Применение систем CRISPR-Cas в нейробиологии» . Обзоры природы. Нейронаука . 17 (1): 36–44. дои : 10.1038/nrn.2015.2 . ПМЦ 4899966 . ПМИД 26656253 .
- ^ Баррангу Р., Дудна Дж.А. (сентябрь 2016 г.). «Применение технологий CRISPR в исследованиях и за их пределами». Природная биотехнология . 34 (9): 933–941. дои : 10.1038/nbt.3659 . ПМИД 27606440 . S2CID 21543486 .
- ^ Кокс Д.Б., Платт Р.Дж., Чжан Ф. (февраль 2015 г.). «Терапевтическое редактирование генома: перспективы и проблемы» . Природная медицина . 21 (2): 121–131. дои : 10.1038/нм.3793 . ПМЦ 4492683 . ПМИД 25654603 .
- ^ Jump up to: а б с д «Хронология CRISPR» . Броудский институт . 25 сентября 2015 г. Проверено 8 декабря 2023 г.
- ^ «CRISPR-безумие» . ГЕН . 08.11.2013.
- ^ Персонал (1 апреля 2015 г.). «Новости: Товары и услуги». Новости генной инженерии и биотехнологии (бумага). 35 (7): 8. дои : 10.1089/gen.35.21.05 .
- ^ «Кому принадлежит крупнейшее биотехнологическое открытие века? Идет ожесточенная борьба за патенты на CRISPR, новую прорывную форму редактирования ДНК» . Массачусетского технологического института Обзор технологий . Проверено 25 февраля 2015 г.
- ^ Фай С. «Черновик генетики: Editas и CRISPR» . Бизнес-журнал Атлас . Проверено 19 января 2016 г.
- ^ «Системы CRISPR-Cas и методы изменения экспрессии продуктов генов» . Гугл Патенты .
- ^ Шаффер С. (апрель 2022 г.). «Брод побеждает патент Беркли CRISPR» . Природная биотехнология . 40 (4): 445. дои : 10.1038/d41587-022-00004-2 . ПМИД 35288688 . S2CID 247453528 .
- ^ «Патенты CRISPR пойдут в суд» . Природная биотехнология . 34 (2): 121. Февраль 2016 г. doi : 10.1038/nbt0216-121a . ПМИД 26849500 . S2CID 205265912 .
- ^ Поллак А (15 февраля 2017 г.). «Ученые Гарварда и Массачусетского технологического института выиграли патентную борьбу в области редактирования генов» . Нью-Йорк Таймс .
- ^ Акст Ж (15 февраля 2017 г.). «Broad выиграл дело о вмешательстве в патент CRISPR» . Журнал Ученый .
- ^ Нунан К.Е. (16 февраля 2017 г.). «PTAB принимает решение о вмешательстве в CRISPR в пользу Broad Institute – их аргументация» . Патентные документы .
- ^ Потенца А (13 апреля 2017 г.). «Калифорнийский университет в Беркли оспаривает решение о том, что патенты CRISPR принадлежат Институту Броуда» . Грань . Проверено 22 сентября 2017 г.
- ^ Бур С. (26 июля 2017 г.). «Битва за патент CRISPR возобновилась: Калифорнийский университет в Беркли подал апелляцию» . ТехКранч . Проверено 22 сентября 2017 г.
- ^ Вестман Н. (1 марта 2022 г.). «Калифорнийский университет в Беркли проиграл дело о патенте CRISPR» . Грань . Проверено 6 марта 2022 г.
- ^ Jump up to: а б Филиппидис А (7 августа 2017 г.). «MilliporeSigma получит европейский патент на технологию CRISPR» . Новости генной инженерии и биотехнологии . Проверено 22 сентября 2017 г.
- ^ Акст Ж (24 марта 2017 г.). «Калифорнийский университет в Беркли получил патент CRISPR в Европе» . Ученый . Проверено 22 сентября 2017 г.
- ^ Коэн Дж. (4 августа 2017 г.). «Битва за патенты CRISPR в Европе принимает «дикий» поворот с появлением неожиданного игрока» . Наука . дои : 10.1126/science.aan7211 .
- ^ «Высший суд ЕС: правила ГМО распространяются на технику редактирования генов растений» . Ретуреры. 25 июля 2018 г.
- ^ АФП (7 февраля 2020 г.). «Испытание в США показывает, что геномы троих больных раком были безопасно изменены с помощью CRISPR» . НаукаАлерт . Проверено 9 февраля 2020 г.
- ^ Чамары СП. «Эти учёные заслужили Нобелевскую премию, но не открыли CRISPR» . Форбс . Проверено 10 июля 2020 г.
- ^ Фишман Дж. «Нобелевская премия по химии присуждена за открытие «генетических ножниц» под названием CRISPR/Cas9» . Научный американец . Проверено 24 марта 2021 г.
- ^ «Две женщины разделили Нобелевскую премию по химии в исторической победе за «генетические ножницы» » . Новости Би-би-си . 07.10.2020 . Проверено 6 декабря 2020 г.
- ^ Кайзер Дж. (26 июня 2021 г.). «CRISPR, введенный в кровь, впервые лечит генетическое заболевание» . Наука | АААС . Проверено 11 июля 2021 г.
- ^ Jump up to: а б Гиллмор Дж.Д., Гейн Э., Таубель Дж., Као Дж., Фонтана М., Мейтленд М.Л. и др. (август 2021 г.). «Редактирование гена CRISPR-Cas9 in vivo при транстиретиновом амилоидозе» . Медицинский журнал Новой Англии . 385 (6): 493–502. дои : 10.1056/NEJMoa2107454 . ПМИД 34215024 . S2CID 235722446 .
- ^ Бунстра Э., де Кляйн Р., Колзато Л.С., Алкемаде А., Форстманн Б.У., Ньювенхейс С. (6 октября 2015 г.). «Нейротрансмиттеры как пищевые добавки: влияние ГАМК на мозг и поведение» . Границы в психологии . 6 : 1520. doi : 10.3389/fpsyg.2015.01520 . ПМЦ 4594160 . ПМИД 26500584 .
- ^ «Помидоры в Японии — первый в мире продукт с отредактированной CRISPR информацией, поступивший в продажу» . IFLНаука . Проверено 18 октября 2021 г.
- ^ Ван Т, Чжан Х, Чжу Х (15 июня 2019 г.). «Технология CRISPR производит революцию в улучшении томатов и других плодовых культур» . Исследования в области садоводства . 6 (1): 77. Бибкод : 2019HorR....6...77W . дои : 10.1038/s41438-019-0159-x . ПМК 6570646 . ПМИД 31240102 .
- ^ «Япония принимает рыбу, отредактированную с помощью CRISPR» . Природная биотехнология . 40 (1): 10 января 2022 г. doi : 10.1038/s41587-021-01197-8 . ПМИД 34969964 . S2CID 245593283 .
- ^ «Стартап надеется, что рыба-фугу с отредактированным геномом станет хитом в 2022 году» . Джапан Таймс . 5 января 2022 года. Архивировано из оригинала 17 января 2022 года . Проверено 17 января 2022 г.
- ^ «Набор морского леща с отредактированными генами, выставленный на продажу в Японии» . thefishsite.com .
- ^ Гетц Л., Сванидзе М., Тиссье А., Бранд А. (январь 2022 г.). «Готовность потребителей покупать помидоры с модифицированным геном CRISPR: данные из примера эксперимента по выбору в Германии» . Устойчивость . 14 (2): 971. дои : 10.3390/su14020971 . hdl : 10419/249208 .
- ^ «Готовы ли потребители покупать помидоры с CRISPR?» . Обновление биотехнологии сельскохозяйственных культур . Проверено 21 февраля 2022 г.
- ^ Уитфорд Э (28 мая 2021 г.). «Калифорнийский университет в Беркли выставит на аукцион NFT за 2 патента на Нобелевскую премию» . Внутри высшего образования . Проверено 21 февраля 2023 г.
- ^ Сестино А., Гвидо Дж., Пелузо А.М. (2022). Невзаимозаменяемые токены (NFT). Изучение влияния на потребителей и маркетинговые стратегии . п. 28. дои : 10.1007/978-3-031-07203-1 . ISBN 978-3-031-07202-4 . S2CID 250238540 .
- ^ Чанг К. (27 мая 2021 г.). «Вы можете купить часть открытия, получившего Нобелевскую премию» . Нью-Йорк Таймс . Проверено 21 февраля 2023 г.
- ^ Траутман ЖЖ (2022). «Виртуальное искусство и невзаимозаменяемые жетоны» (PDF) . Обзор закона Хофстра . 50 (361): 369 ф. дои : 10.2139/ssrn.3814087 . S2CID 234830426 .
- ^ Джонс Н. (18 июня 2021 г.). «Как ученые используют NFT» . Природа . 594 (7864): 482. Бибкод : 2021Natur.594..481J . дои : 10.1038/d41586-021-01642-3 . ПМИД 34145410 . S2CID 235481285 .
- ^ Офис комиссара (08.12.2023). «FDA одобрило первый метод генной терапии для лечения пациентов с серповидноклеточной анемией» . FDA . Проверено 14 декабря 2023 г.
- ^ Jump up to: а б с д и Ран Ф.А., Сюй П.Д., Райт Дж., Агарвала В., Скотт Д.А., Чжан Ф. (ноябрь 2013 г.). «Геномная инженерия с использованием системы CRISPR-Cas9» . Протоколы природы . 8 (11): 2281–2308. дои : 10.1038/nprot.2013.143 . hdl : 1721.1/102943 . ПМЦ 3969860 . ПМИД 24157548 .
- ^ Ли Дж (2013). Открытие генов, ответственных за заболевания почек (доктор философии). Университет Торонто . Проверено 26 декабря 2016 г.
- ^ Мор С.Е., Ху Ю., Юэн-Кампен Б., Хаусден Б.Е., Вишванатха Р., Перримон Н. (сентябрь 2016 г.). «CRISPR направляет дизайн РНК для исследовательских целей» . Журнал ФЭБС . 283 (17): 3232–3238. дои : 10.1111/февраль 13777 . ПМК 5014588 . ПМИД 27276584 .
- ^ Бразелтон В.А., Зарекор С., Райт Д.А., Ван Ю., Лю Дж., Чен К. и др. (2015). «Краткое руководство по инструментам проектирования sgRNA CRISPR» . ГМ-культуры и продукты питания . 6 (4): 266–276. дои : 10.1080/21645698.2015.1137690 . ПМК 5033207 . ПМИД 26745836 .
- ^ «Исследователи создают новую жизнеспособную систему CRISPR-Cas12b для геномной инженерии растений» . физ.орг . Проверено 6 апреля 2020 г.
- ^ Мин М., Рен К., Пан С., Хэ Ю., Чжан Ю., Лю С. и др. (март 2020 г.). «CRISPR-Cas12b обеспечивает эффективную инженерию генома растений». Природные растения . 6 (3): 202–208. дои : 10.1038/s41477-020-0614-6 . ПМИД 32170285 . S2CID 212643374 .
- ^ Кокс Д.Б., Гутенберг Дж.С., Абудайе О.О., Франклин Б., Келлнер М.Дж., Йонг Дж., Чжан Ф. (ноябрь 2017 г.). «Редактирование РНК с помощью CRISPR-Cas13» . Наука . 358 (6366): 1019–1027. Бибкод : 2017Sci...358.1019C . дои : 10.1126/science.aaq0180 . ПМЦ 5793859 . ПМИД 29070703 .
- ^ «Инновация CRISPR-Cas3 обещает излечение болезней и продвижение науки» . Корнеллские хроники . Проверено 24 октября 2021 г.
- ^ Долан А.Е., Хоу З., Сяо Ю., Грамельспачер М.Дж., Хио Дж., Хауден С.Е. и др. (июнь 2019 г.). «Представление спектра дальнодействующих геномных делеций в эмбриональных стволовых клетках человека с использованием CRISPR-Cas типа I» . Молекулярная клетка . 74 (5): 936–950.е5. doi : 10.1016/j.molcel.2019.03.014 . ПМК 6555677 . ПМИД 30975459 .
- ^ Лю З, Донг Х, Цуй Ю, Конг Л, Чжан Д (сентябрь 2020 г.). «Применение различных типов систем на основе CRISPR/Cas у бактерий» . Заводы по производству микробных клеток . 19 (1): 172. дои : 10.1186/s12934-020-01431-z . ПМЦ 7470686 . ПМИД 32883277 .
- ^ «Исследователи разрабатывают «мини» систему редактирования генома CRISPR» . физ.орг . Проверено 18 октября 2021 г.
- ^ Сюй X, Чемпарати А., Цзэн Л., Кемптон Х.Р., Шан С., Накамура М., Ци Л.С. (октябрь 2021 г.). «Инженерная миниатюрная система CRISPR-Cas для регуляции и редактирования генома млекопитающих» . Молекулярная клетка . 81 (20): 4333–4345.e4. doi : 10.1016/j.molcel.2021.08.008 . ПМИД 34480847 . S2CID 237417317 .
- ^ Браво Дж.П., Лю М.С., Хибшман Г.Н., Дэнджерфилд Т.Л., Юнг К., МакКул Р.С. и др. (март 2022 г.). «Структурная основа наблюдения за несоответствиями с помощью CRISPR-Cas9» . Природа . 603 (7900): 343–347. Бибкод : 2022Natur.603..343B . дои : 10.1038/s41586-022-04470-1 . ПМЦ 8907077 . ПМИД 35236982 .
- ^ «Настройка белка делает редактирование генов CRISPR в 4000 раз менее подверженным ошибкам» . Новый Атлас . 04.03.2022 . Проверено 7 марта 2022 г.
- ^ Като К., Чжоу В., Оказаки С., Исаяма Ю., Нисидзава Т., Гутенберг Дж.С. и др. (июнь 2022 г.). «Строение и разработка эффекторного комплекса CRISPR-Cas7-11 типа III-E» . Клетка . 185 (13): 2324–2337.e16. дои : 10.1016/j.cell.2022.05.003 . ПМИД 35643083 . S2CID 249103058 .
- Краткое содержание: Уильямс С. «Нейробиологи расширяют набор инструментов CRISPR новым компактным ферментом Cas7-11» . Массачусетский технологический институт . Проверено 22 июня 2022 г.
- ^ « Более мягкая форма CRISPR может более точно редактировать гены» . Новый учёный . Проверено 21 августа 2022 г.
- ^ Рой С., Жюст СС, Снайдер М., Аурадкар А., Клансек С., Ли З. и др. (июль 2022 г.). «Аллельная конверсия, индуцированная Cas9 / никазой, путем репарации гомологичных хромосом в дрозофилы соматических клетках » . Достижения науки . 8 (26): eabo0721. Бибкод : 2022SciA....8O.721R . дои : 10.1126/sciadv.abo0721 . ПМЦ 10883370 . ПМИД 35776792 .
- ^ Хорват П., Баррангу Р. (январь 2010 г.). «CRISPR/Cas, иммунная система бактерий и архей». Наука . 327 (5962): 167–170. Бибкод : 2010Sci...327..167H . дои : 10.1126/science.1179555 . ПМИД 20056882 . S2CID 17960960 .
- ^ Бялк П., Ривера-Торрес Н., Страус Б., Кмиец Э.Б. (8 июня 2015 г.). «Регуляция активности редактирования генов, управляемая одноцепочечными олигонуклеотидами и системами CRISPR/Cas9» . ПЛОС ОДИН . 10 (6): e0129308. Бибкод : 2015PLoSO..1029308B . дои : 10.1371/journal.pone.0129308 . ПМЦ 4459703 . ПМИД 26053390 .
- ^ Сандер Дж.Д., Йонг Дж.К. (апрель 2014 г.). «Системы CRISPR-Cas для редактирования, регулирования и нацеливания геномов» . Природная биотехнология . 32 (4): 347–355. дои : 10.1038/nbt.2842 . ПМК 4022601 . ПМИД 24584096 .
- ^ Jump up to: а б Ризенберг С., Канис П., Мачак Д., Волльни Д., Дюстерхофт Д., Ковалевски Дж. и др. (сентябрь 2023 г.). «Эффективное высокоточное редактирование генома, зависящее от гомологии, с помощью HDRobust» . Природные методы . 20 (9): 1388–1399. дои : 10.1038/s41592-023-01949-1 . ПМЦ 10482697 . ПМИД 37474806 .
- ^ Лино К.А., Харпер Дж.К., Карни Дж.П., Тимлин Дж.А. (ноябрь 2018 г.). «Реализация CRISPR: обзор проблем и подходов» . Доставка лекарств . 25 (1): 1234–1257. дои : 10.1080/10717544.2018.1474964 . ПМК 6058482 . ПМИД 29801422 .
- ^ Ли Л, Ху С, Чен Икс (июль 2018 г.). «Невирусные системы доставки для редактирования генома на основе CRISPR/Cas9: проблемы и возможности» . Биоматериалы . 171 : 207–218. doi : 10.1016/j.bimaterials.2018.04.031 . ПМЦ 5944364 . ПМИД 29704747 .
- ^ Джайн П.К., Ло Дж.Х., Рананавер С., Даунинг М., Панда А., Тай М. и др. (ноябрь 2019 г.). «Невирусная доставка комплекса CRISPR/Cas9 с использованием нанокомплексов CRISPR-GPS» . Наномасштаб . 11 (44): 21317–21323. дои : 10.1039/C9NR01786K . ПМК 7709491 . ПМИД 31670340 .
- ^ Jump up to: а б Ип Б.Х. (май 2020 г.). «Последние достижения в стратегиях внедрения CRISPR/Cas9» . Биомолекулы . 10 (6): 839. doi : 10.3390/biom10060839 . ПМК 7356196 . ПМИД 32486234 .
- ^ Бак Р.О., Портеус М.Х. (июль 2017 г.). «CRISPR-опосредованная интеграция больших кассет генов с использованием донорских векторов AAV» . Отчеты по ячейкам . 20 (3): 750–756. дои : 10.1016/j.celrep.2017.06.064 . ПМЦ 5568673 . ПМИД 28723575 .
- ^ Шмидт Ф., Гримм Д. (февраль 2015 г.). «Геномная инженерия CRISPR и доставка вирусных генов: случай взаимного притяжения». Биотехнологический журнал . 10 (2): 258–272. дои : 10.1002/biot.201400529 . ПМИД 25663455 . S2CID 37653318 .
- ^ Ваксмонский Н. (24 сентября 2015 г.). «CRISPR 101: Системы экспрессии и методы доставки млекопитающих» . Проверено 11 июня 2018 г.
- ^ Мишра Т., Бхардвадж В., Ахуджа Н., Гаджил П., Рамдас П., Шукла С., Чанде А. (июнь 2022 г.). «Улучшенное редактирование генома CRISPR-Cas9 с потерей функции в клетках человека, одновременное с ингибированием передачи сигналов TGF-β» . Молекулярная терапия. Нуклеиновые кислоты . 28 : 202–218. дои : 10.1016/j.omtn.2022.03.003 . ПМЦ 8961078 . ПМИД 35402072 .
- ^ Адли М (май 2018 г.). «Набор инструментов CRISPR для редактирования генома и не только» . Природные коммуникации . 9 (1): 1911. Бибкод : 2018NatCo...9.1911A . дои : 10.1038/s41467-018-04252-2 . ПМЦ 5953931 . ПМИД 29765029 .
- ^ Свиташев С., Шварц С., Лендертс Б., Янг Дж. К., Марк Сиган А. (ноябрь 2016 г.). «Редактирование генома кукурузы под управлением рибонуклеопротеиновых комплексов CRISPR-Cas9» . Природные коммуникации . 7 (1): 13274. Бибкод : 2016NatCo...713274S . дои : 10.1038/ncomms13274 . ПМК 5116081 . ПМИД 27848933 .
- ^ Лян З, Чен К, Ли Т, Чжан Ю, Ван Ю, Чжао Ц и др. (январь 2017 г.). «Эффективное редактирование генома мягкой пшеницы без ДНК с использованием рибонуклеопротеиновых комплексов CRISPR/Cas9» . Природные коммуникации . 8 (1): 14261. Бибкод : 2017NatCo...814261L . дои : 10.1038/ncomms14261 . ПМЦ 5253684 . ПМИД 28098143 . S2CID 17028472 .
- ^ Цуй З, Тянь Р, Хуан З, Цзинь З, Ли Л, Лю Дж и др. (март 2022 г.). «FrCas9 — это система CRISPR/Cas9 с высокой эффективностью и точностью редактирования» . Природные коммуникации . 13 (1): 1425. Бибкод : 2022NatCo..13.1425C . дои : 10.1038/s41467-022-29089-8 . ПМЦ 8931148 . ПМИД 35301321 .
- ^ Кляйнстивер Б.П., Паттанаяк В., Прев М.С., Цай С.К., Нгуен Н.Т., Чжэн З., Йонг Дж.К. (январь 2016 г.). «Высокоточные нуклеазы CRISPR-Cas9 без обнаруживаемых нецелевых эффектов в масштабе всего генома» . Природа . 529 (7587): 490–495. Бибкод : 2016Natur.529..490K . дои : 10.1038/nature16526 . ПМЦ 4851738 . ПМИД 26735016 .
- ^ Slaymaker IM, Гао Л., Зетше Б., Скотт Д.А., Ян В.С., Чжан Ф. (январь 2016 г.). «Рационально сконструированные нуклеазы Cas9 с улучшенной специфичностью» . Наука . 351 (6268): 84–88. Бибкод : 2016Sci...351...84S . дои : 10.1126/science.aad5227 . ПМЦ 4714946 . ПМИД 26628643 .
- ^ Инь Х., Сонг К.К., Суреш С., Кван С.Ю., Ву К., Уолш С. и др. (март 2018 г.). «Частично управляемый ДНК Cas9 позволяет редактировать геном со снижением нецелевой активности» . Химическая биология природы . 14 (3): 311–316. дои : 10.1038/nchembio.2559 . ПМК 5902734 . ПМИД 29377001 .
- ^ Ризенберг С., Хельмбрехт Н., Канис П., Маричич Т., Паабо С. (январь 2022 г.). «Улучшенные вторичные структуры гРНК позволяют редактировать сайты-мишени, устойчивые к расщеплению CRISPR-Cas9» . Природные коммуникации . 13 (1): 489. Бибкод : 2022NatCo..13..489R . дои : 10.1038/s41467-022-28137-7 . ПМЦ 8789806 . ПМИД 35078986 . S2CID 246281892 .
- ^ Фу Ю, Сандер Дж. Д., Рейон Д., Касио В. М., Йонг Дж. К. (март 2014 г.). «Улучшение специфичности нуклеазы CRISPR-Cas с использованием укороченных направляющих РНК» . Природная биотехнология . 32 (3): 279–284. дои : 10.1038/nbt.2808 . ПМЦ 3988262 . ПМИД 24463574 .
- ^ Теан Д.Г., Чу Х.И., Фонг Дж.Х., Чан Б.К., Чжоу П., Квок CC и др. (апрель 2022 г.). «Комбинаторный мутагенез, связанный с машинным обучением, обеспечивает ресурсоэффективную разработку действий редактора генома CRISPR-Cas9» . Природные коммуникации . 13 (1): 2219. Бибкод : 2022NatCo..13.2219T . дои : 10.1038/s41467-022-29874-5 . ПМК 9039034 . PMID 35468907 .
- ^ Чо С.В., Ким С., Ким Ю, Квеон Дж., Ким Х.С., Пэ С., Ким Дж.С. (январь 2014 г.). «Анализ нецелевых эффектов РНК-ориентированных эндонуклеаз и никаз, полученных из CRISPR/Cas» . Геномные исследования . 24 (1): 132–141. дои : 10.1101/гр.162339.113 . ПМЦ 3875854 . ПМИД 24253446 .
- ^ Jump up to: а б Оукс Б.Л., Надлер Д.К., Фламхольц А., Феллманн С., Стаал Б.Т., Дудна Дж.А., Сэвидж Д.Ф. (июнь 2016 г.). «Профилирование инженерных горячих точек идентифицирует аллостерический переключатель CRISPR-Cas9» . Природная биотехнология . 34 (6): 646–651. дои : 10.1038/nbt.3528 . ПМК 4900928 . ПМИД 27136077 .
- ^ Нуньес Дж.К., Харрингтон Л.Б., Дудна Х.А. (март 2016 г.). «Химическая и биофизическая модуляция Cas9 для настраиваемой геномной инженерии». АКС Химическая биология . 11 (3): 681–688. дои : 10.1021/acschembio.5b01019 . ПМИД 26857072 .
- ^ Чжоу В., Дейтерс А. (апрель 2016 г.). «Условное управление функцией CRISPR/Cas9» . Ангеванде Хеми . 55 (18): 5394–5399. дои : 10.1002/anie.201511441 . ПМИД 26996256 .
- ^ Полштейн Л.Р., Герсбах, Калифорния (март 2015 г.). «Светоиндуцируемая система CRISPR-Cas9 для контроля активации эндогенных генов» . Химическая биология природы . 11 (3): 198–200. дои : 10.1038/nchembio.1753 . ПМК 4412021 . ПМИД 25664691 .
- ^ Нихонгаки Ю, Ямамото С, Кавано Ф, Сузуки Х, Сато М (февраль 2015 г.). «Фотоактивируемая транскрипционная система на основе CRISPR-Cas9» . Химия и биология . 22 (2): 169–174. doi : 10.1016/j.chembiol.2014.12.011 . ПМИД 25619936 .
- ^ Райт А.В., Штернберг С.Х., Тейлор Д.В., Стаал Б.Т., Бардалес Дж.А., Корнфельд Дж.Е., Дудна Дж.А. (март 2015 г.). «Рациональный дизайн ферментного комплекса сплит-Cas9» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (10): 2984–2989. Бибкод : 2015PNAS..112.2984W . дои : 10.1073/pnas.1501698112 . ПМК 4364227 . ПМИД 25713377 .
- ^ Нихонгаки Ю, Кавано Ф, Накадзима Т, Сато М (июль 2015 г.). «Фотоактивируемый CRISPR-Cas9 для оптогенетического редактирования генома». Природная биотехнология . 33 (7): 755–760. дои : 10.1038/nbt.3245 . ПМИД 26076431 . S2CID 205281536 .
- ^ Хемфилл Дж., Борхардт Е.К., Браун К., Асокан А., Дейтерс А. (май 2015 г.). «Оптический контроль редактирования генов CRISPR/Cas9» . Журнал Американского химического общества . 137 (17): 5642–5645. дои : 10.1021/ja512664v . ПМЦ 4919123 . ПМИД 25905628 .
- ^ Джайн П.К., Раманан В., Шеперс А.Г., Далви Н.С., Панда А., Флеминг Х.Э., Бхатия С.Н. (сентябрь 2016 г.). «Разработка светоактивируемого CRISPR с использованием направляющих РНК с фоторасщепляемыми протекторами» . Ангеванде Хеми . 55 (40): 12440–12444. дои : 10.1002/anie.201606123 . ПМЦ 5864249 . ПМИД 27554600 .
- ^ Дэвис К.М., Паттанаяк В., Томпсон Д.Б., Зурис Дж.А., Лю Д.Р. (май 2015 г.). «Белок Cas9, запускаемый малыми молекулами, с улучшенной специфичностью редактирования генома» . Химическая биология природы . 11 (5): 316–318. дои : 10.1038/nchembio.1793 . ПМК 4402137 . ПМИД 25848930 .
- ^ Лю К.И., Рамли М.Н., Ву К.В., Ван Ю., Чжао Т., Чжан Х. и др. (ноябрь 2016 г.). «Химически-индуцируемая система CRISPR-Cas9 для быстрого контроля редактирования генома». Химическая биология природы . 12 (11): 980–987. дои : 10.1038/nchembio.2179 . ПМИД 27618190 . S2CID 33891039 .
- ^ Труонг DJ, Кюнер К., Кюн Р., Верфель С., Энгельхардт С., Вурст В., Ортис О. (июль 2015 г.). «Разработка интеин-опосредованной системы расщепления Cas9 для генной терапии» . Исследования нуклеиновых кислот . 43 (13): 6450–6458. дои : 10.1093/nar/gkv601 . ПМЦ 4513872 . ПМИД 26082496 .
- ^ Зетше Б., Волц С.Е., Чжан Ф. (февраль 2015 г.). «Архитектура сплит-Cas9 для индуцируемого редактирования генома и модуляции транскрипции» . Природная биотехнология . 33 (2): 139–142. дои : 10.1038/nbt.3149 . ПМК 4503468 . ПМИД 25643054 .
- ^ Гонсалес Ф., Чжу З., Ши З.Д., Лелли К., Верма Н., Ли К.В., Хуанфу Д. (август 2014 г.). «Платформа iCRISPR для быстрого, мультиплексируемого и индуцируемого редактирования генома плюрипотентных стволовых клеток человека» . Клеточная стволовая клетка . 15 (2): 215–226. дои : 10.1016/j.stem.2014.05.018 . ПМК 4127112 . ПМИД 24931489 .
- ^ Доу Л.Е., Фишер Дж., О'Рурк К.П., Мули А., Кастенхубер Э.Р., Лившиц Г. и др. (апрель 2015 г.). «Индуцируемое редактирование генома in vivo с помощью CRISPR-Cas9» . Природная биотехнология . 33 (4): 390–394. дои : 10.1038/nbt.3155 . ПМК 4390466 . ПМИД 25690852 .
- ^ Ю С, Лю Ю, Ма Т, Лю К, Сюй С, Чжан Ю и др. (февраль 2015 г.). «Малые молекулы усиливают редактирование генома CRISPR в плюрипотентных стволовых клетках» . Клеточная стволовая клетка . 16 (2): 142–147. дои : 10.1016/j.stem.2015.01.003 . ПМЦ 4461869 . ПМИД 25658371 .
- ^ Шиммель Дж., Муньос-Субирана Н., Кул Х., ван Шендель Р., ван дер Влис С., Камп Дж.А. и др. (февраль 2023 г.). «Модуляция результатов мутаций и улучшение точного редактирования генов при разрывах, индуцированных CRISPR-Cas9, путем химического ингибирования путей соединения концов» . Отчеты по ячейкам . 42 (2): 112019. doi : 10.1016/j.celrep.2023.112019 . ПМИД 36701230 . S2CID 256273893 .
- ^ Маруяма Т., Дуган С.К., Труттманн М.К., Билате А.М., Ингрэм-младший, Плоэх Х.Л. (май 2015 г.). «Повышение эффективности точного редактирования генома с помощью CRISPR-Cas9 за счет ингибирования негомологичного соединения концов» . Природная биотехнология . 33 (5): 538–542. дои : 10.1038/nbt.3190 . ПМЦ 4618510 . ПМИД 25798939 .
- ^ Jump up to: а б Ма Х, Чен Х, Цзинь Ю, Ге В, Ван В, Конг Л и др. (апрель 2018 г.). «Малые молекулы способствуют редактированию генома, опосредованному CRISPR-Cpf1, в плюрипотентных стволовых клетках человека» . Природные коммуникации . 9 (1): 1303. Бибкод : 2018NatCo...9.1303M . дои : 10.1038/s41467-018-03760-5 . ПМК 5880812 . ПМИД 29610531 .
- ^ Нисида К., Аразое Т., Ячи Н., Банно С., Какимото М., Табата М. и др. (сентябрь 2016 г.). «Направленное редактирование нуклеотидов с использованием гибридных адаптивных иммунных систем прокариот и позвоночных». Наука . 353 (6305): ааф8729. doi : 10.1126/science.aaf8729 . ПМИД 27492474 . S2CID 5122081 .
- ^ Комор А.С., Ким Ю.Б., Пакер М.С., Зурис Дж.А., Лю Д.Р. (май 2016 г.). «Программируемое редактирование целевого основания геномной ДНК без двухцепочечного расщепления ДНК» . Природа . 533 (7603): 420–424. Бибкод : 2016Natur.533..420K . дои : 10.1038/nature17946 . ПМЦ 4873371 . ПМИД 27096365 .
- ^ Гауделли Н.М., Комор А.С., Рис Х.А., Пакер М.С., Бадран А.Х., Брайсон Д.И., Лю Д.Р. (ноябрь 2017 г.). «Программируемое редактирование оснований A•T на G•C в геномной ДНК без расщепления ДНК» . Природа . 551 (7681): 464–471. Бибкод : 2017Natur.551..464G . дои : 10.1038/nature24644 . ПМК 5726555 . ПМИД 29160308 .
- ^ Чен Л., Пак Дж.Э., Паа П., Раджакумар П.Д., Прекоп Х.Т., Чу Ю.Т. и др. (март 2021 г.). «Программируемое редактирование генома C:G в G:C с помощью CRISPR-Cas9-направленных белков эксцизионной репарации оснований» . Природные коммуникации . 12 (1): 1384. Бибкод : 2021NatCo..12.1384C . дои : 10.1038/s41467-021-21559-9 . ПМЦ 7925527 . ПМИД 33654077 .
- ^ Jump up to: а б с Курата М., Ямамото К., Мориарити Б.С., Китагава М., Ларгаэспада Д.А. (февраль 2018 г.). «Скрининг библиотеки CRISPR/Cas9 на предмет обнаружения целевых лекарств». Журнал генетики человека . 63 (2): 179–186. дои : 10.1038/s10038-017-0376-9 . ПМИД 29158600 . S2CID 3308058 .
- ^ Гасюнас Г., Баррангу Р., Хорват П., Сикснис В. (сентябрь 2012 г.). «Рибонуклеопротеиновый комплекс Cas9-crRNA опосредует специфическое расщепление ДНК для адаптивного иммунитета у бактерий» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (39): E2579–E2586. дои : 10.1073/pnas.1208507109 . ПМЦ 3465414 . ПМИД 22949671 .
- ^ Сатомура А., Нисиока Р., Мори Х., Сато К., Курода К., Уэда М. (май 2017 г.). «Точное общегеномное редактирование с помощью системы CRISPR Nickase в дрожжах» . Научные отчеты . 7 (1): 2095. Бибкод : 2017НатСР...7.2095С . дои : 10.1038/s41598-017-02013-7 . ПМК 5437071 . ПМИД 28522803 .
- ^ Хираннирамол К., Чен Ю, Лю В, Ван Х (май 2020 г.). «Обобщенный дизайн sgRNA для повышения эффективности редактирования CRISPR/Cas9» . Биоинформатика . 36 (9): 2684–2689. doi : 10.1093/биоинформатика/btaa041 . ПМК 7203743 . ПМИД 31971562 .
- ^ Jump up to: а б с Агротис А., Кеттелер Р. (24 сентября 2015 г.). «Новая эра функциональной геномики с использованием CRISPR/Cas9 при скрининге массивных библиотек» . Границы генетики . 6 : 300. дои : 10.3389/fgene.2015.00300 . ПМЦ 4585242 . ПМИД 26442115 .
- ^ Ю Дж.С., Юса К. (июль 2019 г.). «Полногеномный скрининг CRISPR-Cas9 в клетках млекопитающих». Методы . 164–165: 29–35. дои : 10.1016/j.ymeth.2019.04.015 . ПМИД 31034882 . S2CID 140275157 .
- ^ Jump up to: а б Йонг Дж., Конерманн С., Гутенберг Дж.С., Абудайе О.О., Платт Р.Дж., Бригам М.Д. и др. (апрель 2017 г.). «Скрининг нокаута CRISPR-Cas9 и активации транскрипции в масштабе генома» . Протоколы природы . 12 (4): 828–863. дои : 10.1038/нпрот.2017.016 . ПМК 5526071 . ПМИД 28333914 .
- ^ «Addgene: объединенные библиотеки» . www.addgene.org . Проверено 31 января 2020 г.
- ^ МакДейд-младший, Ваксмонски, Северная Каролина, Суонсон Л.Е., Фан М. (июль 2016 г.). «Практические соображения по использованию объединенных лентивирусных библиотек CRISPR». Современные протоколы молекулярной биологии . 115 (1): 31.5.1–31.5.13. дои : 10.1002/cpmb.8 . ПМИД 27366891 . S2CID 5055878 .
- ^ Ченг А.В., Ван Х., Ян Х., Ши Л., Кац Ю., Теуниссен Т.В. и др. (октябрь 2013 г.). «Мультиплексная активация эндогенных генов с помощью CRISPR-on, системы активатора транскрипции, управляемой РНК» . Клеточные исследования . 23 (10): 1163–1171. дои : 10.1038/cr.2013.122 . ПМК 3790238 . ПМИД 23979020 .
- ^ Гилберт Л.А., Хорлбек М.А., Адамсон Б., Виллалта Дж.Э., Чен Ю., Уайтхед Э.Х. и др. (октябрь 2014 г.). «CRISPR-опосредованный контроль репрессии и активации генов в масштабе генома» . Клетка . 159 (3): 647–661. дои : 10.1016/j.cell.2014.09.029 . ПМЦ 4253859 . ПМИД 25307932 .
- ^ Jump up to: а б Доу Л.Е. (октябрь 2015 г.). «Моделирование заболеваний in vivo с помощью CRISPR/Cas9» . Тенденции молекулярной медицины . 21 (10): 609–621. doi : 10.1016/j.molmed.2015.07.006 . ПМЦ 4592741 . ПМИД 26432018 .
- ^ Дудна Дж., Мали П. (2016). CRISPR-Cas: Лабораторное руководство . Колд-Спринг-Харбор, Нью-Йорк. ISBN 978-1-62182-130-4 . OCLC 922914104 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Цзо Э, Хо X, Яо X, Ху X, Сунь Ю, Инь Дж и др. (ноябрь 2017 г.). «Целевая элиминация хромосом, опосредованная CRISPR/Cas9» . Геномная биология . 18 (1): 224. дои : 10.1186/s13059-017-1354-4 . ПМК 5701507 . ПМИД 29178945 .
- «CRISPR использовался для устранения целевых хромосом в новом исследовании» . Геномная сеть . 27 ноября 2017 г.
- ^ Джавед М.Р., Садаф М., Ахмед Т., Джамиль А., Наваз М., Аббас Х., Иджаз А. (декабрь 2018 г.). «Система CRISPR-Cas: история и перспективы как инструмент редактирования генома микроорганизмов». обзор. Современная микробиология . 75 (12): 1675–1683. дои : 10.1007/s00284-018-1547-4 . ПМИД 30078067 . S2CID 51920661 .
- ^ ДиКарло Дж. Э., Норвилл Дж. Э., Мали П., Риос Х, Аах Дж., Черч ГМ (апрель 2013 г.). «Геномная инженерия Saccharomyces cerevisiae с использованием систем CRISPR-Cas» . Нуклеиновые кислоты Рез . 41 (7): 4336–43. дои : 10.1093/нар/gkt135 . ПМЦ 3627607 . ПМИД 23460208 .
- ^ Гирш Р.М., Финниган Г.К. (декабрь 2017 г.). «Дрожжи по-прежнему зверь: разнообразные применения технологии редактирования CRISPR/Cas в S. cerevisiae » . Йельский журнал биологии и медицины . 90 (4): 643–651. ПМЦ 5733842 . ПМИД 29259528 .
- ^ Дхамад А.Е., диджей Лесснер (октябрь 2020 г.). Атоми Х (ред.). «Система CRISPRi-dCas9 для архей и ее использование для изучения функции генов во время фиксации азота с помощью Methanosarcina acetivorans» . Прикладная и экологическая микробиология . 86 (21): e01402–20. Бибкод : 2020ApEnM..86E1402D . дои : 10.1128/АЕМ.01402-20 . ПМЦ 7580536 . ПМИД 32826220 .
- ^ Рашманова Х, Венингер А, Глидер А, Ковар К, Фогль Т (2018). «Внедрение технологий CRISPR-Cas в обычные и нетрадиционные дрожжи: текущее состояние и перспективы» . обзор. Достижения биотехнологии . 36 (3): 641–665. doi : 10.1016/j.biotechadv.2018.01.006 . ПМИД 29331410 .
- ^ Jump up to: а б Ма Д, Лю Ф (декабрь 2015 г.). «Редактирование генома и его применение в модельных организмах» . обзор. Геномика, протеомика и биоинформатика . 13 (6): 336–344. дои : 10.1016/j.gpb.2015.12.001 . ПМЦ 4747648 . ПМИД 26762955 .
- ^ Хуршид Х., Ян С.А., Шинвари З.К., Джамал М., Шах Ш. (2018). «Эра редактирования генома растений с помощью CRISPR/Cas9» . обзор. Актуальные проблемы молекулярной биологии . 26 : 47–54. дои : 10.21775/cimb.026.047 . ПМИД 28879855 .
- ^ Симоне Б.В., Мартинес-Гальвес Дж., УэреХонкас З., Эккер СК (ноябрь 2018 г.). «В поисках понимания: открываем набор инструментов редактора генов рыбок данио» . обзор. Методы . 150 : 3–10. дои : 10.1016/j.ymeth.2018.07.012 . ПМК 6590056 . ПМИД 30076892 .
- ^ Сингх П., Скименти Дж.К., Болкун-Филас Э. (январь 2015 г.). «Практическое руководство для мышиного генетика по применению CRISPR» . обзор. Генетика . 199 (1): 1–15. дои : 10.1534/genetics.114.169771 . ПМК 4286675 . ПМИД 25271304 .
- ^ Сони Д., Ван Д.М., Регми СК, Миттал М., Фогель С.М., Шлютер Д., Тируппати К. (май 2018 г.). «Дебиквитиназная функция А20 поддерживает и восстанавливает эндотелиальный барьер после повреждения сосудов легких» . Открытие клеточной смерти . 4 (60): 60. дои : 10.1038/s41420-018-0056-3 . ПМЦ 5955943 . ПМИД 29796309 .
- ^ Бирлинг MC, Эро Ю, Павлович Г (август 2017 г.). «Моделирование заболеваний человека у грызунов с помощью редактирования генома CRISPR/Cas9» . Геном млекопитающих . 28 (7–8): 291–301. дои : 10.1007/s00335-017-9703-x . ПМЦ 5569124 . ПМИД 28677007 .
- ^ Гао X, Тао Y, Ламас В., Хуан М., Йе В.Х., Пан Б. и др. (январь 2018 г.). «Лечение аутосомно-доминантной тугоухости путем доставки агентов редактирования генома in vivo» . Природа . 553 (7687): 217–221. Бибкод : 2018Natur.553..217G . дои : 10.1038/nature25164 . ПМЦ 5784267 . ПМИД 29258297 .
- ^ Кадам У.С., Шелаке Р.М., Чавхан Р.Л., Супрасанна П. (октябрь 2018 г.). «Опасения по поводу нецелевой активности эндонуклеаз, редактирующих геном». обзор. Физиология и биохимия растений . 131 : 22–30. дои : 10.1016/j.plaphy.2018.03.027 . ПМИД 29653762 . S2CID 4846191 .
- ^ Кимберленд М.Л., Хоу В., Альфонсо-Пеккио А., Уилсон С., Рао Ю., Чжан С., Лу Ц. (октябрь 2018 г.). «Стратегии контроля нецелевых эффектов CRISPR/Cas9 и биологических вариаций в экспериментах по редактированию генома млекопитающих». обзор. Журнал биотехнологии . 284 : 91–101. doi : 10.1016/j.jbiotec.2018.08.007 . ПМИД 30142414 . S2CID 52078796 .
- ^ ван Эрп П.Б., Блумер Г., Уилкинсон Р., Виденхефт Б. (июнь 2015 г.). «История и влияние на рынок нуклеаз, управляемых РНК CRISPR» . Современное мнение в вирусологии . 12 :85–90. дои : 10.1016/j.coviro.2015.03.011 . ПМК 4470805 . ПМИД 25914022 .
- ^ Маджио I, Гонсалвес, Массачусетс (май 2015 г.). «Редактирование генома на стыке доставки, специфичности и точности» . Тенденции в биотехнологии . 33 (5): 280–291. дои : 10.1016/j.tibtech.2015.02.011 . ПМИД 25819765 .
- ^ Рат Д., Амлингер Л., Рат А., Лундгрен М. (октябрь 2015 г.). «Имунная система CRISPR-Cas: биология, механизмы и применение» . Биохимия . 117 : 119–128. дои : 10.1016/j.biochi.2015.03.025 . ПМИД 25868999 .
- ^ «Что такое CRISPR? Как он работает? Это редактирование генов?» . LiveScience.Tech . 2018-04-30. Архивировано из оригинала 06 февраля 2020 г. Проверено 6 февраля 2020 г.
- ^ Jump up to: а б Фридман Б.С., Брукс С.Р., Лам А.К., Фу Х., Моризан Р., Агравал В. и др. (октябрь 2015 г.). «Моделирование заболевания почек с помощью CRISPR-мутантных почечных органоидов, полученных из сфероидов плюрипотентных эпибластов человека» . Природные коммуникации . 6 : 8715. Бибкод : 2015NatCo...6.8715F . дои : 10.1038/ncomms9715 . ПМЦ 4620584 . ПМИД 26493500 .
- ^ Круз Н.М., Сонг Х, Чернецкий С.М., Гулиева Р.Е., Черчилль А.Дж., Ким Ю.К. и др. (ноябрь 2017 г.). «Органоидный цистогенез раскрывает критическую роль микроокружения при поликистозе почек у человека» . Природные материалы . 16 (11): 1112–1119. Бибкод : 2017NatMa..16.1112C . дои : 10.1038/nmat4994 . ПМЦ 5936694 . ПМИД 28967916 .
- ^ Ким Ю.К., Рафаэли И., Брукс Ч.Р., Цзин П., Гулиева Р.Э., Хьюз М.Р. и др. (декабрь 2017 г.). «Генно-отредактированные органоиды почек человека выявляют механизмы заболевания в развитии подоцитов» . Стволовые клетки . 35 (12): 2366–2378. дои : 10.1002/stem.2707 . ПМЦ 5742857 . ПМИД 28905451 .
- ^ Беллин М., Казини С., Дэвис Р.П., Д'Аньелло С., Хаас Дж., Уорд-ван Остваард Д. и др. (декабрь 2013 г.). «Пары изогенных плюрипотентных стволовых клеток человека раскрывают роль мутации KCNH2 в синдроме удлиненного интервала QT» . Журнал ЭМБО . 32 (24): 3161–3175. дои : 10.1038/emboj.2013.240 . ПМЦ 3981141 . ПМИД 24213244 .
- ^ Цай Л., Фишер А.Л., Хуан Х., Се Зи (декабрь 2016 г.). «CRISPR-опосредованное редактирование генома и болезни человека» . Гены и болезни . 3 (4): 244–251. дои : 10.1016/j.gendis.2016.07.003 . ПМК 6150104 . ПМИД 30258895 .
- ^ «Семь болезней, которые может вылечить технология CRISPR» . Labiotech.eu . 25 июня 2018 г. Проверено 22 августа 2018 г.
- ^ Jump up to: а б «CRISPR/Cas9 и рак» . Новости иммуноонкологии . 27 апреля 2018 г. Проверено 18 февраля 2019 г.
- ^ Кроссли М. (февраль 2021 г.). «Новая технология CRISPR может произвести революцию в генной терапии, дав новую надежду людям с генетическими заболеваниями» . Разговор . Проверено 3 февраля 2021 г.
- ^ Кромер М.К., Камарена Дж., Мартин Р.М., Леш Б.Дж., Вакульскас К.А., Боде Н.М. и др. (апрель 2021 г.). «Замена гена α-глобина на β-глобин восстанавливает баланс гемоглобина в гемопоэтических стволовых и клетках-предшественниках, полученных из β-талассемии» . Природная медицина . 27 (4): 677–687. дои : 10.1038/s41591-021-01284-y . ПМЦ 8265212 . ПМИД 33737751 .
- ^ Се Ф., Йе Л., Чанг Дж.К., Бейер А.И., Ван Дж., Мюнх М.О., Кан Ю.В. (сентябрь 2014 г.). «Бесшовная генная коррекция мутаций β-талассемии в ИПСК, специфичных для пациента, с использованием CRISPR/Cas9 и piggyBac» . Геномные исследования . 24 (9): 1526–1533. дои : 10.1101/гр.173427.114 . ПМЦ 4158758 . ПМИД 25096406 .
- ^ Jump up to: а б Франгул Х., Альтшулер Д., Каппеллини М.Д., Чен Ю.С., Домм Дж., Юстас Б.К. и др. (январь 2021 г.). «Редактирование гена CRISPR-Cas9 при серповидно-клеточной анемии и β-талассемии» . Медицинский журнал Новой Англии . 384 (3): 252–260. дои : 10.1056/NEJMoa2031054 . ПМИД 33283989 . S2CID 227521558 .
- ^ Девер Д.П., Бак Р.О., Рейниш А., Камарена Дж., Вашингтон Дж., Николас С.Э. и др. (ноябрь 2016 г.). «Нацеливание на ген CRISPR/Cas9 β-глобина в гемопоэтических стволовых клетках человека» . Природа . 539 (7629): 384–389. Бибкод : 2016Natur.539..384D . дои : 10.1038/nature20134 . ПМЦ 5898607 . ПМИД 27820943 .
- ^ «Разработана одноразовая клеточная терапия CRISPR для лечения гемофилии» . ГЕН . 2018-05-02 . Проверено 22 августа 2018 г.
- ^ Маранги М., Пистритто Дж. (20 апреля 2018 г.). «Инновационные терапевтические стратегии лечения муковисцидоза: переход к технологии CRISPR» . Границы в фармакологии . 9 : 396. дои : 10.3389/fphar.2018.00396 . ПМК 5920621 . ПМИД 29731717 .
- ^ Бенгтссон Н.Е., Холл Дж.К., Одом Г.Л., Фелпс М.П., Андрус Ч.Р., Хокинс Р.Д. и др. (февраль 2017 г.). «Мышечно-специфическое редактирование гена дистрофина CRISPR/Cas9 улучшает патофизиологию на мышиной модели мышечной дистрофии Дюшенна» . Природные коммуникации . 8 : 14454. Бибкод : 2017NatCo...814454B . дои : 10.1038/ncomms14454 . ПМЦ 5316861 . ПМИД 28195574 .
- ^ Эйзенштейн М. (май 2018 г.). «CRISPR борется с болезнью Хантингтона» . Природа . 557 (7707): С42–С43. Бибкод : 2018Natur.557S..42E . дои : 10.1038/d41586-018-05177-y . ПМИД 29844549 .
- ^ Дабровска М., Юзва В., Кшизосяк В.Дж., Олейничак М. (2018). «Точное удаление CAG-тракта из гена Хантингтина с помощью Cas9 Nickases» . Границы в неврологии . 12:75 . дои : 10.3389/fnins.2018.00075 . ПМЦ 5834764 . ПМИД 29535594 .
- ^ Король А (март 2018 г.). «Редактирование CRISPR при заболеваниях сердца» . Природа . 555 (7695): С23–С25. Бибкод : 2018Natur.555.....K . дои : 10.1038/d41586-018-02482-4 . ПМИД 29517035 .
- ^ Скуделлари М (июль 2019 г.). «Самоуничтожающиеся комары и стерилизованные грызуны: перспективы генного драйва» . Природа . 571 (7764): 160–162. Бибкод : 2019Natur.571..160S . дои : 10.1038/d41586-019-02087-5 . ПМИД 31289403 .
- ^ Абрахими П., Чанг В.Г., Клюгер М.С., Цян Й., Теллидес Г., Зальцман В.М., Побер Дж.С. (июль 2015 г.). «Эффективное разрушение генов в культивируемых первичных эндотелиальных клетках человека с помощью CRISPR/Cas9» . Исследование кровообращения . 117 (2): 121–128. дои : 10.1161/CIRCRESAHA.117.306290 . ПМК 4490936 . ПМИД 25940550 .
- ^ «Прошел год, и процветает первый пациент, которому сделали редактирование генов по поводу серповидноклеточной анемии» . NPR.org . Проверено 3 февраля 2021 г.
- ^ «Технология CRISPR для лечения серповидноклеточной анемии» . ScienceDaily . Проверено 3 февраля 2021 г.
- ^ Уддин Ф., Рудин К.М., Сен Т. (август 2020 г.). «Генная терапия CRISPR: применение, ограничения и последствия для будущего» . Границы онкологии . 10 : 1387. doi : 10.3389/fonc.2020.01387 . ПМЦ 7427626 . ПМИД 32850447 .
- ^ Jump up to: а б с д «Клинические испытания CRISPR: обновление 2022 года» . Инновационный институт геномики (ИГИ) . Проверено 2 мая 2022 г.
- ^ «Эдитас останавливает программу LCA10 в поисках партнера» .
- ^ Дженсен Т.И., Аксельгаард Э., Бак Р.О. (июнь 2019 г.). «Терапевтическое редактирование генов при гематологических заболеваниях с помощью CRISPR/Cas9» . Британский журнал гематологии . 185 (5): 821–835. дои : 10.1111/bjh.15851 . ПМИД 30864164 . S2CID 76663873 .
- ^ Рирдон С. (2016). «Первое клиническое испытание CRISPR получило зеленый свет от комиссии США» . Природа . дои : 10.1038/nature.2016.20137 . S2CID 89466280 .
- ^ Розенблюм Д., Гуткин А., Кедми Р., Рамишетти С., Вейга Н., Якоби А.М. и др. (ноябрь 2020 г.). «Редактирование генома CRISPR-Cas9 с использованием целевых липидных наночастиц для терапии рака» . Достижения науки . 6 (47): eabc9450. Бибкод : 2020SciA....6.9450R . дои : 10.1126/sciadv.abc9450 . ПМЦ 7673804 . ПМИД 33208369 .
- ^ «Редактирование базы: революционная терапия избавляет девушку от неизлечимого рака» . Новости Би-би-си . 11 декабря 2022 г. Проверено 11 декабря 2022 г.
- ^ « Дизайнерские клетки» обращают вспять рак у годовалого ребенка» . Новости Би-би-си . 05.11.2015 . Проверено 11 декабря 2022 г.
- ^ 12 мая (12 мая 2022 г.). «Исследователи Британской Колумбии начинают клинические испытания первой терапии диабета 1 типа на основе генно-инженерных стволовых клеток» . Новости ЮБК . Проверено 8 декабря 2023 г.
{{cite web}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ «CRISPR Therapeutics и ViaCyte, Inc. объявляют о первом введении пациенту дозы…» . КРИСПР . Проверено 2 мая 2022 г.
- ^ Национальный институт по борьбе со злоупотреблением наркотиками (14 февраля 2020 г.). «Антиретровирусная терапия в сочетании с редактированием генов CRISPR может устранить ВИЧ-инфекцию у мышей» . Национальный институт по борьбе со злоупотреблением наркотиками . Проверено 18 апреля 2022 г.
- ^ «Первое клиническое испытание терапии ВИЧ на основе CRISPR, основанное на революционных исследованиях в Медицинской школе Льюиса Каца | Медицинской школе Льюиса Каца в Университете Темпл» . Medicine.Temple.edu . Проверено 18 апреля 2022 г.
- ^ Эксцизионная биотерапия (24 марта 2022 г.). «Фаза 1/2a, последовательное когортное исследование безопасности, переносимости, биораспределения и фармакодинамики однократной возрастающей дозы EBT 101 у взрослых, инфицированных ВИЧ-1 с авиремией, на стабильной антиретровирусной терапии» .
- ^ «Три человека подверглись генетическому редактированию с целью вылечить ВИЧ. Результат неизвестен» . Обзор технологий Массачусетского технологического института . Проверено 20 марта 2024 г.
- ^ «ВИЧ в культуре клеток можно полностью устранить с помощью технологии редактирования генов CRISPR-Cas, что увеличивает надежды на излечение» . ЭврекАлерт! . Проверено 20 марта 2024 г.
- ^ «Ученые говорят, что они могут вырезать ВИЧ из клеток» . 20 марта 2024 г. Проверено 20 марта 2024 г.
- ^ Тир А.А., Клумпе Х.Э., Луо М.Л., Селле К., Баррангу Р., Бейзель К.Л. (январь 2014 г.). «Программируемое удаление бактериальных штаммов с помощью систем CRISPR-Cas, нацеленных на геном» . мБио 5 (1): e00928–e00913. дои : 10.1128/mBio.00928-13 . ПМЦ 3903277 . ПМИД 24473129 .
- ^ Ситорик Р.Дж., Мими М., Лу Т.К. (ноябрь 2014 г.). «Последовательность-специфические противомикробные препараты с использованием эффективно доставляемых РНК-нуклеаз» . Природная биотехнология . 32 (11): 1141–1145. дои : 10.1038/nbt.3011 . hdl : 1721.1/100834 . ПМЦ 4237163 . ПМИД 25240928 .
- ^ Jump up to: а б Голизаде П., Агазаде М., Асгарзаде М., Кафил Х.С. (ноябрь 2017 г.). «Подавление адаптивной иммунной системы CRISPR/Cas при бактериальных инфекциях». Европейский журнал клинической микробиологии и инфекционных заболеваний . 36 (11): 2043–2051. дои : 10.1007/s10096-017-3036-2 . ПМИД 28601970 . S2CID 22716314 .
- ^ Гибни Э. (январь 2018 г.). «Чего ждать в 2018 году: наука в новом году» . Природа . 553 (7686): 12–13. Бибкод : 2018Natur.553...12G . дои : 10.1038/d41586-018-00009-5 . ПМИД 29300040 .
- ^ Тейлор П. (3 января 2019 г.). «J&J приобретает долю в противомикробных препаратах Locus «Pac-Man» на основе CRISPR» . Жестокие биотехнологии . Проверено 27 февраля 2019 г.
- ^ Рирдон С. (июнь 2017 г.). «Модифицированные вирусы несут смерть бактериям, устойчивым к антибиотикам» . Природа . 546 (7660): 586–587. Бибкод : 2017Natur.546..586R . дои : 10.1038/nature.2017.22173 . ПМИД 28661508 .
- ^ ван Димен Ф.Р., Крузе Э.М., Хойкаас М.Дж., Брюггелинг К.Э., Шюрх А.К., ван Хэм П.М. и др. (июнь 2016 г.). «CRISPR/Cas9-опосредованное редактирование генома герпесвирусов ограничивает продуктивные и латентные инфекции» . ПЛОС Патогены . 12 (6): e1005701. дои : 10.1371/journal.ppat.1005701 . ПМЦ 4928872 . ПМИД 27362483 .
- «Использование CRISPR для борьбы с вирусными инфекциями: новый способ лечения герпеса?» . ПЛОС Медиа . 4 августа 2016 г. – через YouTube.
- ^ Jump up to: а б с Сотрудники Science News (17 декабря 2015 г.). «Научный прорыв года — это…» news.sciencemag.org . Проверено 21 декабря 2015 г.
- ^ Маллин Э. «Использование CRISPR на свиньях может сделать их органы более безопасными для трансплантации человеку» . Обзор технологий Массачусетского технологического института . Проверено 9 сентября 2017 г.
- ^ Фейхо С. «Как нейробиологи Брауна используют CRISPR для ускорения исследований мозга — и не только» . Университет Брауна . Проверено 8 декабря 2023 г.
- ^ Jump up to: а б Де Плано Л.М., Калабрезе Дж., Коночи С., Гульельмино С.П., Оддо С., Каккамо А. (август 2022 г.). «Применение CRISPR-Cas9 при болезни Альцгеймера и связанных с ней расстройствах» . Международный журнал молекулярных наук . 23 (15): 8714. doi : 10.3390/ijms23158714 . ПМЦ 9368966 . ПМИД 35955847 .
- ^ Эркут Э., Ёкота Т. (февраль 2022 г.). «CRISPR-терапия мышечной дистрофии Дюшенна» . Международный журнал молекулярных наук . 23 (3): 1832. doi : 10.3390/ijms23031832 . ПМЦ 8836469 . ПМИД 35163754 .
- ^ Ямагата Т., Раво М., Кобаяши К., Миямото Х., Тацукава Т., Огивара И. и др. (июль 2020 г.). «Активация гена Scn1a на основе CRISPR/dCas9 в тормозных нейронах улучшает эпилептические и поведенческие фенотипы у мышей с моделью синдрома Драве» . Нейробиология болезней . 141 : 104954. doi : 10.1016/j.nbd.2020.104954 . ПМИД 32445790 . S2CID 218762990 .
- ^ Пинсон А., Син Л., Намба Т., Калебич Н., Питерс Дж., Огема К.Э. и др. (сентябрь 2022 г.). «Человеческий TKTL1 предполагает больший нейрогенез в лобной неокортексе современных людей, чем у неандертальцев». Наука . 377 (6611): eabl6422. дои : 10.1126/science.abl6422 . ПМИД 36074851 . S2CID 252161562 .
- ^ Мора-Бермудес Ф., Канис П., Мачак Д., Петерс Дж., Науманн Р., Син Л. и др. (июль 2022 г.). «Большая метафаза и меньшее количество ошибок разделения хромосом у современного человека, чем развитие мозга неандертальца» . Достижения науки . 8 (30): eabn7702. Бибкод : 2022SciA....8N7702M . дои : 10.1126/sciadv.abn7702 . ПМЦ 9337762 . ПМИД 35905187 .
- ^ «Ученые обнаружили, как у людей развивается мозг большего размера, чем у других обезьян» . физ.орг . Архивировано из оригинала 19 апреля 2021 года . Проверено 19 апреля 2021 г.
- ^ Бенито-Квечинский С., Джандоменико С.Л., Сатклифф М., Риис Э.С., Фрейре-Притчетт П., Келава И. и др. (апрель 2021 г.). «Ранний переход формы клеток стимулирует эволюционное расширение переднего мозга человека» . Клетка . 184 (8): 2084–2102.e19. дои : 10.1016/j.cell.2021.02.050 . ПМЦ 8054913 . PMID 33765444 .
 Доступно под лицензией CC BY 4.0. Архивировано 16 октября 2017 г. на Wayback Machine .
Доступно под лицензией CC BY 4.0. Архивировано 16 октября 2017 г. на Wayback Machine . - ^ Савал И. «Мини-мозг, генетически измененный с помощью CRISPR, чтобы стать похожим на неандертальца» . Новый учёный . Архивировано из оригинала 10 марта 2021 года . Проверено 7 марта 2021 г.
- ^ Трухильо К.А., Райс Э.С., Шефер Н.К., Хаим И.А., Уилер ЕС, Мадригал А.А. и др. (февраль 2021 г.). «Повторное введение архаичного варианта NOVA1 в кортикальные органоиды изменяет развитие нервной системы» . Наука . 371 (6530). doi : 10.1126/science.aax2537 . ПМЦ 8006534 . ПМИД 33574182 .
- ^ Маричич Т., Хельмбрехт Н., Ризенберг С., Мачак Д., Канис П., Лакнер М. и др. (октябрь 2021 г.). «Комментарий к статье «Реинтродукция архаичного варианта NOVA1 в корковые органоиды изменяет развитие нервной системы» ». Наука . 374 (6565): eabi6060. дои : 10.1126/science.abi6060 . PMID 34648345 . S2CID 238990790 .
- ^ Хераи Р.Х., Сето Р.А., Трухильо, Калифорния, Муотри, Арканзас (октябрь 2021 г.). «Ответ на комментарий к статье «Повторное введение архаичного варианта NOVA1 в кортикальные органоиды изменяет развитие нервной системы» ». Наука . 374 (6565): eabi9881. дои : 10.1126/science.abi9881 . ПМИД 34648331 . S2CID 238990560 .
- ^ Домингес А.А., Лим В.А., Ци Л.С. (январь 2016 г.). «Не только редактирование: повторное использование CRISPR-Cas9 для точной регуляции и исследования генома» . Обзоры природы. Молекулярно-клеточная биология . 17 (1): 5–15. дои : 10.1038/номер.2015.2 . ПМЦ 4922510 . ПМИД 26670017 .
- ^ Шалем О., Санджана Н.Е., Хартениан Э., Ши Х., Скотт Д.А., Миккельсон Т. и др. (январь 2014 г.). «Геномный скрининг нокаута CRISPR-Cas9 в клетках человека» . Наука . 343 (6166): 84–87. Бибкод : 2014Sci...343...84S . дои : 10.1126/science.1247005 . ПМК 4089965 . ПМИД 24336571 .
- ^ Jump up to: а б Пенниси Э. (август 2013 г.). «Увлечение CRISPR». Новости Фокус. Наука . 341 (6148): 833–836. Бибкод : 2013Sci...341..833P . дои : 10.1126/science.341.6148.833 . ПМИД 23970676 .
- ^ Jump up to: а б Циммер С (3 июня 2016 г.). «Ученые открывают новые возможности редактирования генов CRISPR» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 10 июня 2016 г.
- ^ Пикар-Оливер А., Герсбах, Калифорния (август 2019 г.). «Следующее поколение технологий и приложений CRISPR-Cas» . Обзоры природы. Молекулярно-клеточная биология . 20 (8): 490–507. дои : 10.1038/s41580-019-0131-5 . ПМК 7079207 . ПМИД 31147612 .
- ^ Басак Дж., Нитин С. (2015). «Нацеливание на некодирующие РНК в растениях с помощью технологии CRISPR-Cas — это задача, которую, однако, стоит принять» . Границы в науке о растениях . 6 : 1001. дои : 10.3389/fpls.2015.01001 . ПМЦ 4652605 . ПМИД 26635829 .
- ^ Jump up to: а б Вульф Т.М., Чейз Дж.М., Стинчкомб Д.Т. (август 1995 г.). «На пути к терапевтическому редактированию мутированных последовательностей РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (18): 8298–8302. Бибкод : 1995PNAS...92.8298W . дои : 10.1073/pnas.92.18.8298 . ПМК 41144 . ПМИД 7545300 .
- ^ Монтьель-Гонсалес М.Ф., Вальесильо-Вьехо I, Юдовски Г.А., Розенталь Дж.Дж. (ноябрь 2013 г.). «Коррекция мутаций в регуляторе трансмембранной проводимости муковисцидоза путем сайт-направленного редактирования РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (45): 18285–18290. Бибкод : 2013PNAS..11018285M . дои : 10.1073/pnas.1306243110 . ПМЦ 3831439 . ПМИД 24108353 .
- ^ Кокс Д.Б., Гутенберг Дж.С., Абудайе О.О., Франклин Б., Келлнер М.Дж., Йонг Дж., Чжан Ф. (ноябрь 2017 г.). «Редактирование РНК с помощью CRISPR-Cas13» . Наука . 358 (6366): 1019–1027. Бибкод : 2017Sci...358.1019C . дои : 10.1126/science.aaq0180 . ПМЦ 5793859 . ПМИД 29070703 .
- ^ Уильямс С. «Нейробиологи расширяют набор инструментов CRISPR новым компактным ферментом Cas7-11» . Массачусетский технологический институт . Проверено 22 июня 2022 г.
- ^ Като К., Чжоу В., Оказаки С., Исаяма Ю., Нисидзава Т., Гутенберг Дж.С. и др. (июнь 2022 г.). «Строение и разработка эффекторного комплекса CRISPR-Cas7-11 типа III-E» . Клетка . 185 (13): 2324–2337.e16. дои : 10.1016/j.cell.2022.05.003 . ПМИД 35643083 . S2CID 249103058 .
- ^ Озджан А., Краески Р., Иоанниди Е., Ли Б., Гарднер А., Макарова К.С. и др. (сентябрь 2021 г.). «Программируемое нацеливание на РНК с помощью однобелкового эффектора CRISPR Cas7-11». Природа . 597 (7878): 720–725. Бибкод : 2021Natur.597..720O . дои : 10.1038/s41586-021-03886-5 . ПМИД 34489594 . S2CID 237432753 .
- ^ Кросс Р (25 марта 2019 г.). «Осторожно, CRISPR. Гонка редактирования РНК началась» . Новости химии и техники . 97 (12) . Проверено 30 сентября 2020 г.
- ^ Акбари О.С., Беллен Х.Дж., Бир Э., Буллок С.Л., Берт А., Черч ГМ и др. (август 2015 г.). «БИОБЕЗОПАСНОСТЬ. Защита экспериментов по генному драйву в лаборатории» . Наука . 349 (6251): 927–929. Бибкод : 2015Sci...349..927A . дои : 10.1126/science.aac7932 . ПМЦ 4692367 . ПМИД 26229113 .
- ^ Каплан А.Л., Родитель Б., Шен М., Планкетт С. (ноябрь 2015 г.). «Нет времени терять зря — этические проблемы, создаваемые CRISPR: CRISPR/Cas, будучи эффективной, простой и дешевой технологией редактирования генома любого организма, поднимает множество этических и нормативных проблем, выходящих за рамки использования для манипулирования клетками зародышевой линии человека» . Отчеты ЭМБО . 16 (11): 1421–1426. дои : 10.15252/эмбр.201541337 . ПМЦ 4641494 . ПМИД 26450575 .
- ^ Ойе К.А., Эсвелт К., Эпплтон Э., Каттеручча Ф., Черч Г., Куикен Т. и др. (август 2014 г.). «Биотехнология. Регулирование генных драйвов» . Наука . 345 (6197): 626–628. Бибкод : 2014Sci...345..626O . дои : 10.1126/science.1254287 . ПМИД 25035410 .
- ^ Гу В., Кроуфорд Э.Д., О'Донован Б.Д., Уилсон М.Р., Чоу Э.Д., Реталлак Х., ДеРизи Дж.Л. (март 2016 г.). «Истощение обильных последовательностей путем гибридизации (DASH): использование Cas9 для удаления нежелательных видов с высокой распространенностью в библиотеках секвенирования и приложениях для молекулярного подсчета» . Геномная биология . 17:41 . дои : 10.1186/s13059-016-0904-5 . ПМЦ 4778327 . ПМИД 26944702 .
- ^ Jump up to: а б Кунгуловский, Горан; Йельч, Альберт (1 февраля 2016 г.). «Редактирование эпигенома: современное состояние, концепции и перспективы» . Тенденции в генетике . 32 (2): 101–113. дои : 10.1016/j.tig.2015.12.001 . ISSN 0168-9525 . ПМИД 26732754 . Проверено 30 апреля 2021 г.
- ^ Лауфер, Бенджамин И.; Сингх, Шива М. (17 сентября 2015 г.). «Стратегии точной модуляции экспрессии генов путем редактирования эпигенома: обзор» . Эпигенетика и хроматин . 8 (1): 34. дои : 10.1186/s13072-015-0023-7 . ISSN 1756-8935 . ПМК 4574080 . ПМИД 26388942 .
- ^ «Уникальная генная терапия CRISPR предлагает лечение хронической боли без опиоидов» . Новый Атлас . 11 марта 2021 г. Проверено 18 апреля 2021 г.
- ^ Морено, Ана М.; Алеман, Фернандо; Катроли, Глауцилен Ф.; Хант, Мэтью; Ху, Майкл; Дайлами, Амир; Пла, Эндрю; Воллер, Сара А.; Палмер, Натан; Парех, Удит; Макдональд, Даниэлла; Робертс, Аманда Дж.; Доброй воли, Ванесса; Драйден, Ян; Хевнер, Роберт Ф.; Задержка, Лориана; Сантос, Жильсон Гонсалвеш душ; Якш, Тони Л.; Мали, Прашант (10 марта 2021 г.). «Длительная анальгезия за счет целенаправленной репрессии NaV1.7 in situ у мышей» . Наука трансляционной медицины . 13 (584): eaay9056. doi : 10.1126/scitranslmed.aay9056 . ISSN 1946-6234 . ПМЦ 8830379 . ПМИД 33692134 . S2CID 232170826 .
- ^ КАЙЗЕР, ДЖОСЕЛИН (1 июня 2022 г.). «Лучше, чем CRISPR? Другой способ решения генных проблем может быть более безопасным и универсальным» . www.science.org . Проверено 21 августа 2022 г.
- ^ МакДоннелл С. «Новый инструмент на основе CRISPR вставляет большие последовательности ДНК в нужные участки клеток» . Массачусетский технологический институт через phys.org . Проверено 18 декабря 2022 г.
- ^ Ярналл М.Т., Иоанниди Э.И., Шмитт-Ульмс С., Краески Р.Н., Лим Дж., Виллигер Л. и др. (ноябрь 2022 г.). «Вставка больших последовательностей в геном методом перетаскивания без двухцепочечного расщепления ДНК с использованием CRISPR-направленных интеграз» . Природная биотехнология . 41 (4): 500–512. bioRxiv 10.1101/2021.11.01.466786 . дои : 10.1038/s41587-022-01527-4 . ПМЦ 10257351 . ПМИД 36424489 . S2CID 253879386 .
- ^ Анзалоне А.В., Рэндольф П.Б., Дэвис Дж.Р., Соуза А.А., Коблан Л.В., Леви Дж.М. и др. (декабрь 2019 г.). «Редактирование генома с поиском и заменой без двухцепочечных разрывов или донорской ДНК» . Природа . 576 (7785): 149–157. Бибкод : 2019Natur.576..149A . дои : 10.1038/s41586-019-1711-4 . ПМК 6907074 . ПМИД 31634902 .
- ^ Тулин Л. (21 октября 2019 г.). «Новый инструмент редактирования генов может сделать CRISPR более точным» . Смитсоновский журнал .
- ^ Jump up to: а б Коэн Дж. (21 октября 2019 г.). «Новый «премиальный» редактор генома может превзойти CRISPR» . Научный журнал .
- ^ Jump up to: а б Ясинский Э (21 октября 2019 г.). «Новый метод «прайм-редактирования» делает разрезы только одноцепочечной ДНК» . Ученый .
- ^ Jump up to: а б Галлахер Дж. (21 октября 2019 г.). «Простое редактирование: инструмент ДНК может исправить 89% генетических дефектов» . Новости Би-би-си .
- ^ Регаладо А (5 марта 2015 г.). «Инженерия идеального ребенка» . Обзор технологий Массачусетского технологического института . Архивировано из оригинала 13 марта 2015 года.
- ^ Балтимор Д., Берг П., Ботчан М., Кэрролл Д., Чаро Р.А., Чёрч Дж. и др. (апрель 2015 г.). «Биотехнология. Разумный путь вперед в области геномной инженерии и модификации генов зародышевой линии» . Наука . 348 (6230): 36–38. Бибкод : 2015Sci...348...36B . дои : 10.1126/science.aab1028 . ПМЦ 4394183 . ПМИД 25791083 .
- ^ Ланфье Э., Урнов Ф., Хеккер С.Е., Вернер М., Смоленски Дж. (март 2015 г.). «Не редактируйте зародышевую линию человека» . Природа . 519 (7544): 410–411. Бибкод : 2015Natur.519..410L . дои : 10.1038/519410a . ПМИД 25810189 .
- ^ Уэйд Н. (19 марта 2015 г.). «Ученые добиваются запрета метода редактирования генома человека» . Нью-Йорк Таймс . Проверено 20 марта 2015 г.
Биологи, пишущие в журнале Science, поддерживают продолжение лабораторных исследований с использованием этой методики, и лишь немногие ученые считают, что она готова к клиническому использованию.
- ^ Лян П., Сюй Ю, Чжан Х, Дин С., Хуан Р., Чжан З. и др. (май 2015 г.). «CRISPR/Cas9-опосредованное редактирование генов в трехпронуклеарных зиготах человека» . Белок и клетка . 6 (5): 363–372. дои : 10.1007/s13238-015-0153-5 . ПМЦ 4417674 . ПМИД 25894090 .
- ^ Колата Г (23 апреля 2015 г.). «Китайские ученые редактируют гены человеческих эмбрионов, вызывая обеспокоенность» . Нью-Йорк Таймс . Проверено 24 апреля 2015 г.
- ^ Jump up to: а б Сираноски Д., Рирдон С. (2015). «Китайские ученые генетически модифицируют человеческие эмбрионы». Природа . дои : 10.1038/nature.2015.17378 . S2CID 87604469 .
- ^ Регаладо А (08 мая 2016 г.). «Китайские исследователи экспериментируют с созданием эмбрионов, устойчивых к ВИЧ» . Обзор технологий Массачусетского технологического института . Проверено 10 июня 2016 г.
- ^ «Международный саммит по редактированию генов» . Национальные академии наук, техники и медицины . 3 декабря 2015 года . Проверено 3 декабря 2015 г.
- ^ Броковски С. (апрель 2018 г.). «Помогут ли заявления об этике зародышевой линии CRISPR?» . Журнал CRISPR . 1 (2): 115–125. дои : 10.1089/crispr.2017.0024 . ПМК 6694771 . ПМИД 31021208 .
- ^ Бегли С. (28 ноября 2018 г.). «На фоне возмущения китайский ученый защищает создание детей с отредактированными генами» . СТАТ .
- ^ Образец I (13 марта 2019 г.). «Ученые призывают к глобальному мораторию на редактирование генов эмбрионов» . Theguardian.com . Проверено 14 марта 2019 г.
- ^ Каллауэй Э (февраль 2016 г.). «Британские учёные получили лицензию на редактирование генов человеческих эмбрионов» . Природа . 530 (7588): 18. Бибкод : 2016Natur.530...18C . дои : 10.1038/nature.2016.19270 . ПМИД 26842037 .
- ^ МакХьюген А., Смит С. (январь 2008 г.). «Система регулирования США для генетически модифицированных [генетически модифицированных организмов (ГМО), рДНК или трансгенных] сортов сельскохозяйственных культур» . Журнал биотехнологии растений . 6 (1): 2–12. дои : 10.1111/j.1467-7652.2007.00300.x . ПМИД 17956539 . S2CID 3210837 .
- ^ Министерство сельского хозяйства США . «Re: Запрос на подтверждение» (PDF) .
- ^ Вальс Е (апрель 2016 г.). «Гриб CRISPR с отредактированным геном избегает регулирования США» . Природа . 532 (7599): 293. Бибкод : 2016Natur.532..293W . дои : 10.1038/nature.2016.19754 . ПМИД 27111611 .
- ^ Ледфорд Х (апрель 2016 г.). «Редактирование генов растет по мере того, как США переосмысливают правила» . Природа . 532 (7598): 158–159. Бибкод : 2016Natur.532..158L . дои : 10.1038/532158а . ПМИД 27075074 .
- ^ Браун КВ (1 февраля 2017 г.). «FDA расправляется с мошенниками-генными инженерами» . Гизмодо . Проверено 5 февраля 2017 г.
- ^ «Руководство для промышленности № 187 / Регулирование намеренно измененной геномной ДНК у животных» (PDF) . Управление по контролю за продуктами и лекарствами . 11.02.2020.
- ^ Сираноски Д. (август 2017 г.). «Принятие Китаем селекции эмбрионов поднимает острые вопросы» . Природа . 548 (7667): 272–274. Бибкод : 2017Natur.548..272C . дои : 10.1038/548272а . ПМИД 28816265 .
- ^ Пэн Ю (июнь 2016 г.). «Мораль и этика, регулирующие патенты CRISPR-Cas9 в Китае». Природная биотехнология . 34 (6): 616–618. дои : 10.1038/nbt.3590 . ПМИД 27281418 . S2CID 38509820 .
- ^ Рана П., Маркус А., Фан В. (21 января 2018 г.). «Китай, которому не мешают правила, лидирует в испытаниях по редактированию генов» . Уолл Стрит Джорнал . ISSN 0099-9660 . Проверено 23 января 2018 г.
- ^ Талбот Д. (2016). «Точное редактирование генов растений/10 прорывных технологий 2016» . Обзор технологий MIT . Массачусетский технологический институт. Архивировано из оригинала 5 ноября 2017 года . Проверено 18 марта 2016 г.
- ^ Ларсон С., Шаффер А. (2014). «Редактирование генома/10 прорывных технологий 2014» . Массачусетский технологический институт. Архивировано из оригинала 5 декабря 2016 года . Проверено 18 марта 2016 г.
- ^ «Лауреаты Танской премии» . www.tang-prize.org . Проверено 5 августа 2018 г.
- ^ «Пресс-релиз: Нобелевская премия по химии 2020» . Нобелевский фонд . Проверено 7 октября 2020 г.