Кас9
В этой статье отсутствует информация о гомологах, включая другие Cas9, другие системы CRISPR класса 2 типа II. ( сентябрь 2021 г. ) |
| CRISPR-ассоциированная эндонуклеаза Cas9 | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Организм | |||
| Символ | cas9 | ||
| Альт. символы | СпКас9 | ||
| Входить | 901176 | ||
| ПДБ | 4OO8 | ||
| RefSeq (мРНК) | NC_002737.2 | ||
| RefSeq (защита) | НП_269215.1 | ||
| ЮниПрот | Q99ZW2 | ||
| Другие данные | |||
| Номер ЕС | 3.1.-.- | ||
| хромосома | Геномный: 0,85 - 0,86 Мб | ||
| |||
| Кас9 | |
|---|---|
| Идентификаторы | |
| Символ | ? |
| ИнтерПро | ИПР028629 |
Cas9 ( CRISPR-ассоциированный белок 9 , ранее называвшийся Cas5 , Csn1 или Csx12 ) представляет собой 160 килодальтон белок массой , который играет жизненно важную роль в иммунологической защите некоторых бактерий от ДНК-вирусов и плазмид и широко используется в приложениях генной инженерии . Его основная функция — разрезать ДНК и тем самым изменить геном клетки. Метод редактирования генома CRISPR-Cas9 внес значительный вклад в получение Нобелевской премии по химии в 2020 году, присужденной Эммануэль Шарпантье и Дженнифер Дудна . [2]
двойной РНК управляемый ДНК -эндонуклеазу, С технической точки зрения, Cas9 представляет собой фермент с кластерными регулярно расположенными короткими палиндромными повторами ( CRISPR , связанный с адаптивной иммунной системой ) у Streptococcus pyogenes . [3] [4] [5] S. pyogenes использует CRISPR для запоминания, а Cas9 — для последующего опроса и расщепления чужеродной ДНК, например, вторгшейся ДНК бактериофага или плазмидной ДНК. [4] [6] [7] [8] Cas9 выполняет этот опрос, раскручивая чужеродную ДНК и проверяя сайты, комплементарные спейсерной области из 20 нуклеотидов направляющей РНК (гРНК). Если ДНК-субстрат комплементарен направляющей РНК, Cas9 расщепляет вторгшуюся ДНК. В этом смысле механизм CRISPR-Cas9 имеет ряд параллелей с механизмом РНК-интерференции (РНКи) у эукариот.
Помимо своей первоначальной функции в бактериальном иммунитете, белок Cas9 широко использовался в качестве инструмента геномной инженерии для индукции сайт-направленных двухцепочечных разрывов ДНК. Эти разрывы могут привести к инактивации генов или внедрению гетерологичных генов посредством негомологичного соединения концов и гомологичной рекомбинации соответственно во многих лабораторных модельных организмах. Исследования по разработке различных вариантов cas9 стали многообещающим способом преодоления ограничений редактирования генома CRISPR-Cas9 . Некоторые примеры включают никазу Cas9 (Cas9n), вариант, который индуцирует одноцепочечные разрывы (SSB), или варианты, распознающие различные последовательности PAM . [9] Наряду с нуклеазами с цинковыми пальцами и эффекторными белками, подобными активаторам транскрипции (TALEN), Cas9 становится важным инструментом в области редактирования генома.
В последние годы Cas9 приобрел популярность, поскольку он может расщеплять практически любую последовательность, комплементарную направляющей РНК. [4] Поскольку целевая специфичность Cas9 обусловлена комплементарностью направляющей РНК:ДНК, а не модификациями самого белка (как TALEN и цинковые пальцы ), разработка Cas9 для нацеливания на новую ДНК является простой задачей. [10] Версии Cas9, которые связываются, но не расщепляют родственную ДНК, могут использоваться для локализации активатора или репрессоров транскрипции в определенных последовательностях ДНК, чтобы контролировать активацию и репрессию транскрипции. [11] [12] Нативному Cas9 требуется направляющая РНК, состоящая из двух несопоставимых связывающихся РНК — РНК CRISPR (crRNA) и транс-активирующей crRNA ( tracrRNA ). [3] Нацеливание на Cas9 было упрощено благодаря созданию химерной единственной направляющей РНК (хиРНК). Ученые предположили, что генные драйвы на основе Cas9 могут редактировать геномы целых популяций организмов. [13] В 2015 году Cas9 впервые был использован для модификации генома эмбрионов человека. [14]
CRISPR-опосредованный иммунитет
[ редактировать ]Чтобы выжить в различных сложных и негостеприимных средах обитания, наполненных бактериофагами , бактерии и археи разработали методы уклонения от хищных вирусов и борьбы с ними . Сюда входит система адаптивного иммунитета CRISPR. На практике системы CRISPR/Cas действуют как самопрограммируемые ферменты рестрикции. Локусы CRISPR состоят из коротких палиндромных повторов, которые встречаются через регулярные промежутки времени и состоят из чередующихся повторов CRISPR и переменных спейсеров CRISPR длиной от 24 до 48 нуклеотидов. Эти локусы CRISPR обычно сопровождаются соседними CRISPR-ассоциированными (cas) генами. В 2005 году тремя отдельными группами было обнаружено, что спейсерные области гомологичны чужеродным элементам ДНК, включая плазмиды и вирусы. Эти отчеты предоставили первые биологические доказательства того, что CRISPR могут функционировать как иммунная система.
Cas9 часто использовался как инструмент редактирования генома. Cas9 использовался в недавних разработках для предотвращения манипулирования вирусами ДНК хозяев. Поскольку CRISPR-Cas9 был разработан на основе бактериальных геномных систем, его можно использовать для воздействия на генетический материал вирусов. Использование фермента Cas9 может стать решением многих вирусных инфекций. Cas9 обладает способностью воздействовать на определенные вирусы, воздействуя на определенные нити вирусной генетической информации. Более конкретно, фермент Cas9 воздействует на определенные участки вирусного генома, что мешает вирусу выполнять свою нормальную функцию. [15] Cas9 также использовался для разрушения вредной цепи ДНК и РНК, вызывающей заболевания и мутировавшие цепи ДНК. Cas9 уже показал многообещающие результаты в преодолении последствий ВИЧ-1. Было показано, что Cas9 подавляет экспрессию длинных концевых повторов ВИЧ-1. При введении в геном ВИЧ-1 Cas9 показал способность мутировать нити ВИЧ-1. [16] [17] Cas9 также использовался при лечении гепатита B путем воздействия на концы некоторых длинных концевых повторов в геноме вируса гепатита B. [18] Cas9 использовался для устранения мутаций, вызывающих катаракту у мышей.
Фактическая точность частей этой статьи (относящихся к количеству основных типов) может быть поставлена под угрозу из-за устаревшей информации . ( сентябрь 2021 г. ) |
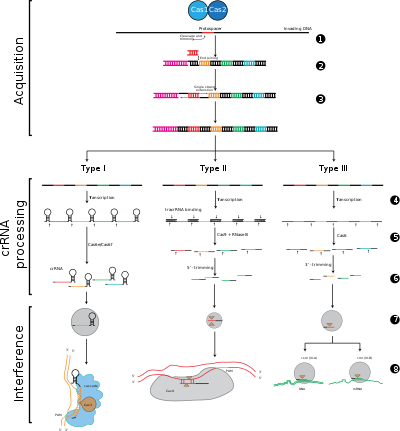
Системы CRISPR-Cas делятся на три основных типа (тип I, тип II и тип III) и двенадцать подтипов, которые основаны на их генетическом содержании и структурных различиях. Однако основными определяющими особенностями всех систем CRISPR-Cas являются гены cas и их белки: cas1 и cas2 универсальны для всех типов и подтипов, тогда как cas3 , cas9 и cas10 являются сигнатурными генами для типа I, типа II и типа III. , соответственно.
Этапы защиты CRISPR-Cas
[ редактировать ]Приспособление
[ редактировать ]Адаптация включает распознавание и интеграцию спейсеров между двумя соседними повторами в локусе CRISPR. «Протоспейсер» относится к последовательности вирусного генома, которая соответствует спейсеру. Короткий участок консервативных нуклеотидов существует проксимальнее протоспейсера, который называется мотивом, примыкающим к протоспейсеру (PAM). PAM представляет собой мотив узнавания, который используется для приобретения фрагмента ДНК. [8] При типе II Cas9 распознает PAM во время адаптации, чтобы гарантировать приобретение функциональных спейсеров. [6]
Утрату спейсеров и даже групп из нескольких также наблюдали Aranaz et al. 2004 и Пурсель и др. 2007. Вероятно, это происходит за счет гомологичной рекомбинации материала между повторами. [19]
Обработка CRISPR/биогенез
[ редактировать ]Экспрессия CRISPR включает транскрипцию первичного транскрипта, называемого РНК CRISPR (пре-crRNA), который транскрибируется из локуса CRISPR с помощью РНК-полимеразы. Затем специфические эндорибонуклеазы расщепляют пре-crRNA на небольшие CRISPR-РНК (crRNA). [20]
Помехи/иммунитет
[ редактировать ]Вмешательство затрагивает crRNA в мультибелковом комплексе под названием CASCADE, который может распознавать и специфически спаривать основания с областями вставки комплементарной чужеродной ДНК. Затем комплекс crRNA-чужеродная нуклеиновая кислота расщепляется, однако если между спейсером и целевой ДНК имеются несоответствия или имеются мутации в PAM, то расщепление не начнется. В последнем сценарии чужеродная ДНК не подвергается атаке со стороны клетки, поэтому репликация вируса продолжается, и хозяин не становится невосприимчивым к вирусной инфекции. Стадия вмешательства может механистически и временно отличаться от приобретения и экспрессии CRISPR, однако для полноценного функционирования защитной системы все три фазы должны быть функциональными. [21]
Этап 1: интеграция спейсера CRISPR. Протоспейсеры и связанные с протоспейсерами мотивы (показаны красным) приобретаются на «лидерном» конце массива CRISPR в ДНК хозяина. Массив CRISPR состоит из спейсерных последовательностей (показаны в цветных прямоугольниках), окруженных повторами (черные ромбы). Для этого процесса требуются Cas1 и Cas2 (и Cas9 в типе II). [6] ), которые закодированы в локусе cas, который обычно расположен рядом с массивом CRISPR.
Этап 2: экспрессия CRISPR. Пре-крРНК транскрибируется, начиная с лидерной области, РНК-полимеразой хозяина, а затем расщепляется белками Cas на более мелкие crРНК, содержащие один спейсер и частичный повтор (показанный в виде шпильки с цветными спейсерами).
Этап 3: вмешательство CRISPR. crRNA со спейсером, который имеет сильную комплементарность входящей чужеродной ДНК, начинает процесс расщепления (изображенный ножницами), для которого требуются белки Cas. Расщепление ДНК препятствует репликации вируса и обеспечивает иммунитет хозяину. Стадия интерференции может функционально и временно отличаться от приобретения и экспрессии CRISPR (изображена белой линией, разделяющей клетку).
Деактивация транскрипции с помощью dCas9
[ редактировать ]dCas9 , также называемый Cas9 с дефицитом эндонуклеазы, можно использовать для редактирования экспрессии гена при применении к сайту связывания транскрипции желаемого участка гена. Оптимальная функция dCas9 объясняется его способом действия. Экспрессия генов ингибируется, когда нуклеотиды больше не добавляются к цепи РНК и, следовательно, прекращают удлинение этой цепи, и в результате влияют на процесс транскрипции. Этот процесс происходит, когда dCas9 производится массово, поэтому он способен влиять на большинство генов в любой момент времени через молекулу направляющей РНК, специфичную для последовательности. Поскольку dCas9, по-видимому, снижает экспрессию генов, это действие усиливается еще больше, когда он используется в сочетании с репрессивными доменами-модификаторами хроматина. [22] Белок dCas9 выполняет и другие функции, помимо регуляции экспрессии генов. К белку dCas9 можно добавить промотор, который позволит им работать друг с другом, чтобы эффективно начинать или останавливать транскрипцию в различных последовательностях вдоль цепи ДНК. Эти два белка специфичны в том, где они действуют на ген. Это распространено у некоторых типов прокариот, когда промотор и dCas9 выравниваются вместе, препятствуя способности удлинения полимера нуклеотидов, объединяющихся с образованием транскрибируемого фрагмента ДНК. Без промотора белок dCas9 не оказывает такого же эффекта сам по себе или с телом гена. [23]
При дальнейшем изучении эффектов репрессии транскрипции H3K27, аминокислотный компонент гистона, становится метилированным в результате взаимодействия dCas9 и пептида под названием FOG1. По сути, это взаимодействие вызывает репрессию гена на C+N-концевом участке аминокислотного комплекса в специфическом месте соединения гена и, как следствие, прекращает транскрипцию. [24]
dCas9 также оказывается эффективным, когда дело доходит до изменения определенных белков, которые могут вызывать заболевания. Когда dCas9 прикрепляется к форме РНК, называемой направляющей РНК, он предотвращает пролиферацию повторяющихся кодонов и последовательностей ДНК, которые могут быть вредными для генома организма. По сути, когда образуется несколько повторяющихся кодонов, это вызывает ответ или привлекает большое количество dCas9 для борьбы с перепроизводством этих кодонов и приводит к остановке транскрипции. dCas9 работает синергически с гРНК и напрямую влияет на ДНК-полимеразу II, вызывая продолжение транскрипции.
Дальнейшее объяснение того, как работает белок dCas9, можно найти в использовании ими растительных геномов путем регуляции производства генов в растениях для увеличения или уменьшения определенных характеристик. Система CRISPR-CAS9 способна как активировать, так и подавлять гены. Белки dCas9 являются компонентом системы CRISPR-CAS9 и могут подавлять определенные области гена растения. Это происходит, когда dCAS9 связывается с репрессорными доменами, а в случае растений действительно происходит дезактивация регуляторного гена, такого как AtCSTF64. [25]
Бактерии также являются еще одним направлением использования белков dCas9. Поскольку эукариоты имеют более крупный состав ДНК и геном; с гораздо меньшими бактериями легко манипулировать. В результате эукариоты используют dCas9 для ингибирования продолжения процесса транскрипции генетического материала РНК-полимеразой. [26]
Структурные и биохимические исследования
[ редактировать ]Кристаллическая структура
[ редактировать ]
Cas9 имеет двухдольную архитектуру, в которой направляющая РНК расположена между альфа-спиральной долей (синий) и долей нуклеазы (голубой, оранжевый и серый). Эти две доли соединены одной спиралью мостика. В многодоменной доле нуклеазы расположены два домена нуклеазы: RuvC (серый), который расщепляет нецелевую цепь ДНК, и домен нуклеазы HNH (голубой), который расщепляет целевую цепь ДНК. Домен RuvC кодируется последовательно разрозненными сайтами, которые взаимодействуют в третичной структуре с образованием домена расщепления RuvC (см. рисунок справа).
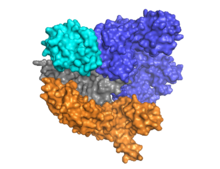
Ключевой особенностью целевой ДНК является то, что она должна содержать мотив, примыкающий к протоспейсеру (PAM), состоящий из трехнуклеотидной последовательности - NGG. Этот PAM распознается PAM-взаимодействующим доменом (домен PI, оранжевый), расположенным вблизи С-конца Cas9. Cas9 претерпевает отчетливые конформационные изменения между состояниями апо, связанной с направляющей РНК и связанной с направляющей РНК:ДНК.
Cas9 распознает архитектуру «стебель-петля», присущую локусу CRISPR, которая опосредует созревание рибонуклеопротеинового комплекса crRNA-tracrRNA. [28] Cas9 в комплексе с CRISPR РНК (crRNA) и трансактивирующей crRNA (tracrRNA) дополнительно распознает и разрушает целевую дцДНК. [29] В показанной здесь сокристаллической структуре комплекс crРНК-tracrRNA заменен химерной однопроводящей РНК (sgRNA, выделена красным), которая, как было доказано, выполняет ту же функцию, что и природный комплекс РНК. [4] Основание sgRNA в паре с целевой оцДНК закрепляется с помощью Cas9 в виде Т-образной архитектуры. Эта кристаллическая структура связанного с ДНК фермента Cas9 демонстрирует отчетливые конформационные изменения в альфа-спиральной доли по отношению к доле нуклеазы, а также расположение домена HNH. Белок состоит из доли узнавания (REC) и доли нуклеазы (NUC). Все регионы, кроме HNH, образуют тесные взаимодействия друг с другом и комплексом огРНК-оцДНК, тогда как домен HNH образует мало контактов с остальной частью белка. В другой конформации комплекса Cas9, наблюдаемой в кристалле, домен HNH не виден. Эти структуры предполагают конформационную гибкость домена HNH.
На сегодняшний день изучены и опубликованы как минимум три кристаллические структуры. Один представляет конформацию Cas9 в состоянии апо, [27] и два представляют Cas9 в связанном с ДНК состоянии. [30] [1]
Взаимодействие с sgRNA
[ редактировать ]
В комплексе sgRNA-Cas9, исходя из кристаллической структуры, домены REC1, BH и PI имеют важные контакты с основной цепью или основаниями как в повторяющейся, так и в спейсерной области. [1] [30] Было протестировано несколько мутантов Cas9, включая делецию доменов REC1 или REC2 и мутации остатков в BH. Мутанты, родственные REC1 и BH, проявляют более низкую активность или ее отсутствие по сравнению с диким типом, что указывает на то, что эти два домена имеют решающее значение для распознавания sgRNA при повторной последовательности и стабилизации всего комплекса. Хотя взаимодействие между спейсерной последовательностью и Cas9, а также доменом PI и областью повтора требует дальнейшего изучения, сокристалл демонстрирует четкую границу между Cas9 и sgRNA.
расщепление ДНК
[ редактировать ]
Предыдущий анализ последовательностей и биохимические исследования показали, что Cas9 содержит два нуклеазных домена: McrA-подобный нуклеазный домен HNH и RuvC-подобный нуклеазный домен. [31] Эти HNH- и RuvC-подобные нуклеазные домены ответственны за расщепление комплементарной/целевой и некомплементарной/нецелевой цепей ДНК соответственно. [4] Несмотря на низкое сходство последовательностей, последовательность, сходная с РНКазой H, имеет складку RuvC (один член семейства РНКазы H), а область HNH складывается, как T4 Endo VII (один член семейства эндонуклеаз HNH). [ нужна ссылка ]
Cas9 дикого типа S. pyogenes требует магния (Mg 2+ ) кофакторы РНК-опосредованного расщепления ДНК; однако было показано, что Cas9 проявляет различные уровни активности в присутствии ионов других двухвалентных металлов. [4] Например, Cas9 в присутствии марганца (Mn 2+ ) было показано, что он способен к РНК-независимому расщеплению ДНК. [32] Кинетика расщепления ДНК Cas9 представляет большой интерес для научного сообщества, поскольку эти данные позволяют понять тонкости реакции. Хотя было показано, что расщепление ДНК РНК-связанным Cas9 происходит относительно быстро ( k ≥ 700 с −1 ), высвобождение продуктов расщепления происходит очень медленно ( t 1/2 = ln(2)/ k ≈ 43–91 ч), что по существу делает Cas9 ферментом с одним оборотом . [33] Дополнительные исследования кинетики Cas9 показали, что сконструированный Cas9 эффективен в снижении нецелевых эффектов за счет изменения скорости реакции. [34] [35]
Эффективность расщепления Cas9 зависит от множества факторов. Ключевым требованием является наличие действующего PAM в нецелевой цепи, находящейся на 3 нуклеотида ниже сайта расщепления. [36] Каноническая последовательность PAM для S. Pyogenes Cas9 представляет собой NGG, но альтернативные мотивы допускаются с более низкой активностью расщепления. Cas9 дикого типа Наиболее эффективными альтернативными мотивами PAM для S. Pyogenes являются NAG и NGA. [37] [38] Состав последовательности в целевом участке ДНК, комплементарном спейсерной области из 20 нуклеотидов гРНК, также влияет на эффективность расщепления. Наиболее значимыми свойствами нуклеотидного состава, влияющими на эффективность, являются свойства проксимальной области PAM. [39] [40] [38] Изменения свободной энергии нуклеиновых кислот также очень важны для определения активности расщепления. [41] Направляющие РНК, которые связываются с ДНК, образуя дуплекс, который попадает в ограниченный диапазон изменений свободной энергии связывания, исключающий чрезвычайно слабые или стабильные связывания, обычно работают эффективно. [38] Стабильные конформации сворачивания направляющей РНК также могут нарушать расщепление. [42]
Проблемы, которые бактерии создают при редактировании Cas9
[ редактировать ]Большинство архей и бактерий упорно не позволяют Cas9 редактировать их геном. Это потому, что они могут присоединять к своему геному чужеродную ДНК, которая на них не влияет. Другой способ, которым эти клетки игнорируют Cas9, — это система процесса модификации рестрикции (RM). Когда бактериофаг проникает в клетку бактерии или археи, на него воздействует система RM. Затем система RM разрезает ДНК бактериофага на отдельные части с помощью ферментов рестрикции и использует эндонуклеазы для дальнейшего разрушения нитей ДНК. Это создает проблему для редактирования Cas9, поскольку система RM также нацелена на чужеродные гены, добавленные в процессе Cas9. [43]
Применение Cas9 для настройки транскрипции
[ редактировать ]Вмешательство в транскрипцию dCas9
[ редактировать ]Из-за уникальной способности Cas9 связываться практически с любой последовательностью комплемента в любом геноме , исследователи хотели использовать этот фермент для подавления транскрипции различных геномных локусов . Для этого два важнейших каталитических остатка доменов RuvC и HNH могут быть мутированы в аланин, устраняющий всю эндонуклеазную активность Cas9. Полученный белок, названный «мертвым» Cas9 или сокращенно «dCas9», все еще может прочно связываться с дцДНК. Этот каталитически неактивный вариант Cas9 использовался как для механистических исследований вопросительного связывания ДНК Cas9, так и в качестве общего программируемого ДНК-связывающего комплекса РНК-белок.
Взаимодействие dCas9 с целевой дцДНК настолько тесное, что высокомолярный денатурирующий белок мочевины не может полностью диссоциировать комплекс РНК-белок dCas9 от дцДНК-мишени. [44] dCas9 был нацелен с помощью сконструированных единых направляющих РНК на сайты инициации транскрипции любых локусов, где dCas9 может конкурировать с РНК-полимеразой на промоторах, останавливая транскрипцию. [45] Кроме того, dCas9 может быть нацелен на кодирующую область локусов, так что ингибирование РНК-полимеразы происходит во время фазы элонгации транскрипции. [45] У эукариот подавление экспрессии генов может быть расширено за счет нацеливания dCas9 на последовательности энхансера, где dCas9 может блокировать сборку факторов транскрипции, что приводит к подавлению экспрессии специфических генов. [12] Более того, направляющие РНК, предоставляемые dCas9, могут быть разработаны так, чтобы включать определенные несовпадения с его комплементарной родственной последовательностью, что будет количественно ослаблять взаимодействие dCas9 с его запрограммированной родственной последовательностью, позволяя исследователю настраивать степень подавления гена, применяемого к интересующему гену. [45] Эта технология в принципе аналогична РНКи , поскольку экспрессия генов модулируется на уровне РНК. Тем не менее, подход dCas9 получил большую популярность, поскольку существует меньше нецелевых эффектов и, в целом, более крупные и воспроизводимые эффекты подавления за счет использования dCas9 по сравнению с скринингами RNAi. [46] Более того, поскольку подход dCas9 к подавлению генов можно контролировать количественно, исследователь теперь может точно контролировать степень подавления интересующего гена, что позволяет больше вопросов о регуляции генов и стехиометрии ответить на генов.
Помимо прямого связывания dCas9 с транскрипционно-чувствительными позициями локусов, dCas9 может быть слит с различными доменами модулирующих белков для выполнения множества функций. Недавно dCas9 был слит с белками ремоделирования хроматина (HDACs/HATs) для реорганизации структуры хроматина вокруг различных локусов. [45] Это важно для воздействия на различные представляющие интерес эукариотические гены, поскольку структуры гетерохроматина препятствуют связыванию Cas9. Кроме того, поскольку Cas9 может реагировать на гетерохроматин , предполагается, что этот фермент может быть дополнительно применен для изучения структуры хроматина различных локусов. [45] Кроме того, dCas9 использовался для полногеномного скрининга репрессии генов. Используя большие библиотеки направляющих РНК, способных воздействовать на тысячи генов, были проведены полногеномные генетические скрининги с использованием dCas9. [47]
Другой метод подавления транскрипции с помощью Cas9 заключается в прямом расщеплении продуктов мРНК каталитически активным ферментом Cas9. [48] Этот подход стал возможным благодаря гибридизации оцДНК с комплементарной последовательностью PAM с оцРНК, что позволяет создать сайт PAM дцДНК-РНК для связывания Cas9. Эта технология дает возможность изолировать эндогенные транскрипты РНК в клетках без необходимости индуцировать химические модификации РНК или методы РНК-маркирования.
Активация транскрипции слитыми белками dCas9
[ редактировать ]В отличие от генов, подавляющих молчание, dCas9 также можно использовать для активации генов при слиянии с факторами, активирующими транскрипцию. [45] Эти факторы включают субъединицы бактериальной РНК-полимеразы II и традиционные факторы транскрипции у эукариот. Недавно были также проведены полногеномные скрининги активации транскрипции с использованием для активации слияний dCas9, названных «CRISPRa». [47]
См. также
[ редактировать ]- Система активации DCas9
- КРИСПР
- Редактирование генов CRISPR
- Редактирование генома
- Нуклеаза цинковых пальцев
- Эффекторная нуклеаза, подобная активатору транскрипции
Ссылки
[ редактировать ]- ^ Jump up to: а б с Нисимасу Х., Ран Ф.А., Сюй П.Д., Конерманн С., Шехата С.И., Домаэ Н., Ишитани Р., Чжан Ф., Нуреки О. (февраль 2014 г.). «Кристаллическая структура Cas9 в комплексе с направляющей РНК и целевой ДНК» . Клетка . 156 (5): 935–49. дои : 10.1016/j.cell.2014.02.001 . ПМЦ 4139937 . ПМИД 24529477 .
- ^ «Нобелевская премия по химии 2020» . NobelPrize.org . Проверено 7 октября 2020 г.
- ^ Jump up to: а б Дельчева Е., Чилински К., Шарма К.М., Гонсалес К., Чао Ю., Пирзада З.А., Эккерт М.Р., Фогель Дж., Шарпантье Э. (март 2011 г.). «Созревание РНК CRISPR с помощью транскодируемой малой РНК и фактора хозяина РНКазы III» . Природа . 471 (7340): 602–607. Бибкод : 2011Natur.471..602D . дои : 10.1038/nature09886 . ПМК 3070239 . ПМИД 21455174 .
- ^ Jump up to: а б с д и ж Джинек М., Чилински К., Фонфара И., Хауэр М., Дудна Дж.А., Шарпантье Э. (август 2012 г.). «Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете» . Наука . 337 (6096): 816–21. Бибкод : 2012Sci...337..816J . дои : 10.1126/science.1225829 . ПМК 6286148 . ПМИД 22745249 .
- ^ О Х.С., Диас Ф.М., Чжоу С., Карпентер Н., Найп Д.М. (01.01.2022). «CRISPR-Cas9, экспрессируемый в стабильно трансдуцированных клеточных линиях, способствует рекомбинации и отбору рекомбинантов вируса простого герпеса» . Современные исследования в области вирусологической науки . 3 : 100023. doi : 10.1016/j.crviro.2022.100023 . ПМЦ 9629518 . ПМИД 36330462 .
- ^ Jump up to: а б с Хелер Р., Самай П., Моделл Дж.В., Вайнер С., Голдберг Г.В., Бикард Д., Марраффини Л.А. (март 2015 г.). «Cas9 определяет функциональные вирусные мишени во время адаптации CRISPR-Cas» . Природа . 519 (7542): 199–202. Бибкод : 2015Natur.519..199H . дои : 10.1038/nature14245 . ПМЦ 4385744 . ПМИД 25707807 .
- ^ Баррангу Р., Фремо С., Дево Х., Ричардс М., Бояваль П., Муано С. и др. (март 2007 г.). «CRISPR обеспечивает приобретенную устойчивость прокариот к вирусам». Наука . 315 (5819): 1709–12. Бибкод : 2007Sci...315.1709B . дои : 10.1126/science.1138140 . hdl : 20.500.11794/38902 . ПМИД 17379808 . S2CID 3888761 .
- ^ Jump up to: а б Гарно Ж.Э., Дюпюи М.Э., Виллион М., Ромеро Д.А., Баррангу Р., Бояваль П., Фремо К., Хорват П., Магадан А.Х., Муано С. (ноябрь 2010 г.). «Бактериальная иммунная система CRISPR/Cas расщепляет ДНК бактериофага и плазмиды». Природа . 468 (7320): 67–71. Бибкод : 2010Natur.468...67G . CiteSeerX 10.1.1.451.9645 . дои : 10.1038/nature09523 . ПМИД 21048762 . S2CID 205222849 .
- ^ Уддин, Фатема; М. Рудин, Чарльз; Сен, Трипарна (август 2020 г.). «Генная терапия CRISPR: применение, ограничения и последствия для будущего» . Границы онкологии . 10 : 1387. doi : 10.3389/fonc.2020.01387 . ПМЦ 7427626 . ПМИД 32850447 .
- ^ Мали П., Эсвелт К.М., генеральный директор Церкви (октябрь 2013 г.). «Cas9 как универсальный инструмент инженерной биологии» . Природные методы . 10 (10): 957–63. дои : 10.1038/nmeth.2649 . ПМК 4051438 . ПМИД 24076990 .
- ^ Мали П., Аах Дж., Стрэнджс П.Б., Эсвелт К.М., Моосбернер М., Косури С., Ян Л., Черч ГМ (сентябрь 2013 г.). «Активаторы транскрипции CAS9 для скрининга целевой специфичности и парные никазы для совместной геномной инженерии» . Природная биотехнология . 31 (9): 833–8. дои : 10.1038/nbt.2675 . ПМЦ 3818127 . ПМИД 23907171 .
- ^ Jump up to: а б Гилберт Л.А., Ларсон М.Х., Морсут Л., Лю З., Брар Г.А., Торрес С.Е., Стерн-Гиноссар Н., Брандман О., Уайтхед Э.Х., Дудна Дж.А., Лим В.А., Вайсман Дж.С., Ци Л.С. (июль 2013 г.). «CRISPR-опосредованная модульная РНК-регулируемая регуляция транскрипции у эукариот» . Клетка . 154 (2): 442–51. дои : 10.1016/j.cell.2013.06.044 . ПМК 3770145 . ПМИД 23849981 .
- ^ Эсвелт К.М., Смидлер А.Л., Каттеручча Ф., генеральный директор Черча (июль 2014 г.). «О управляемых РНК генных двигателях для изменения диких популяций» . электронная жизнь . 3 . doi : 10.7554/eLife.03401 . ПМК 4117217 . ПМИД 25035423 .
- ^ Сираноски Д., Рирдон С. (22 апреля 2015 г.). «Китайские ученые генетически модифицируют человеческие эмбрионы». Природа . дои : 10.1038/nature.2015.17378 . S2CID 87604469 .
- ^ Дудна Дж.А., Мали П. (2016). CRISPR-Cas: лабораторное пособие . Колд-Спринг-Харбор, Нью-Йорк. ISBN 9781621821304 . OCLC 922914104 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Чен В., Пейдж-Маккоу PS (март 2019 г.). «Редактирование гена CRISPR/Cas9». ДоступНаука . Макгроу-Хилл Образование. дои : 10.1036/1097-8542.168060 .
- ^ Эбина Х., Мисава Н., Канемура Ю., Коянаги Ю. (26 августа 2013 г.). «Использование системы CRISPR/Cas9 для разрушения латентного провируса ВИЧ-1» . Научные отчеты . 3 (1): 2510. Бибкод : 2013NatSR...3E2510E . дои : 10.1038/srep02510 . ПМЦ 3752613 . ПМИД 23974631 .
- ^ Ли Х, Шэн С, Ван С, Ян Л, Лян Й, Хуан Й, Лю Х, Ли П, Ян С, Ян Икс, Цзя Л, Се Дж, Ван Л, Хао Р, Ду Х, Сюй Д, Чжоу Дж , Ли М, Сунь Ю, Тонг Ю, Ли Ц, Цю С, Сун Х (22 марта 2017 г.). «Удаление интегрированной ДНК вируса гепатита В с помощью CRISPR-Cas9» . Границы клеточной и инфекционной микробиологии . 7 : 91. дои : 10.3389/fcimb.2017.00091 . ПМК 5360708 . ПМИД 28382278 .
- ^ Дево Х., Гарно Ж.Э., Муано С. (13 октября 2010 г.). «Система CRISPR/Cas и ее роль во взаимодействии фагов и бактерий». Ежегодный обзор микробиологии . 64 (1). Годовые обзоры: 475–493. дои : 10.1146/annurev.micro.112408.134123 . ПМИД 20528693 .
- ^ Хорват П., Баррангу Р. (январь 2010 г.). «CRISPR/Cas, иммунная система бактерий и архей». Наука . 327 (5962): 167–70. Бибкод : 2010Sci...327..167H . дои : 10.1126/science.1179555 . ПМИД 20056882 . S2CID 17960960 .
- ^ Каргинов Ф.В., Хэннон Г.Дж. (январь 2010 г.). «Система CRISPR: защита, управляемая малой РНК, у бактерий и архей» . Молекулярная клетка . 37 (1): 7–19. doi : 10.1016/j.molcel.2009.12.033 . ПМК 2819186 . ПМИД 20129051 .
- ^ Йенсен Э.Д., Феррейра Р., Якочюнас Т., Арсовска Д., Чжан Дж., Дин Л. и др. (март 2017 г.). «Транскрипционное перепрограммирование у дрожжей с использованием dCas9 и комбинаторных стратегий гРНК» . Заводы по производству микробных клеток . 16 (1): 46. дои : 10.1186/s12934-017-0664-2 . ПМЦ 5353793 . ПМИД 28298224 .
- ^ Пинто Б.С., Саксена Т., Оливейра Р., Мендес-Гомес Х.Р., Клири Дж.Д., Денес Л.Т., МакКоннелл О., Арболеда Дж., Ся Г., Суонсон М.С., Ван Э.Т. (ноябрь 2017 г.). «Препятствие транскрипции расширенных микросателлитных повторов с помощью деактивированного Cas9» . Молекулярная клетка . 68 (3): 479–490.е5. doi : 10.1016/j.molcel.2017.09.033 . ПМК 6013302 . ПМИД 29056323 .
- ^ О'Гин Х., Рен С., Николет СМ, Перес А.А., Халмаи Дж., Ле В.М., Маккей Дж.П., Фарнхэм П.Дж., Сигал DJ (сентябрь 2017 г.). «Редактирование эпигенома на основе dCas9 предполагает, что метилирования гистонов недостаточно для репрессии целевого гена» . Исследования нуклеиновых кислот . 45 (17): 9901–9916. дои : 10.1093/нар/gkx578 . ПМЦ 5622328 . ПМИД 28973434 .
- ^ Лоудер Л.Г., Пол Дж.В., Ци Ю (2017). «Мультиплексная активация или репрессия транскрипции у растений с использованием систем на основе CRISPR-dCas9». Сети регулирования генов растений . Методы молекулярной биологии. Том. 1629. стр. 167–184. дои : 10.1007/978-1-4939-7125-1_12 . ISBN 978-1-4939-7124-4 . ПМИД 28623586 .
- ^ Баррангу Р., Хорват П. (июнь 2017 г.). «Десятилетие открытий: функции и приложения CRISPR». Природная микробиология . 2 (7): 17092. doi : 10.1038/nmicrobiol.2017.92 . ПМИД 28581505 . S2CID 19072900 .
- ^ Jump up to: а б Джинек М., Цзян Ф., Тейлор Д.В., Штернберг Ш., Кая Э., Ма Э., Андерс С., Хауэр М., Чжоу К., Лин С., Каплан М., Явароне А.Т., Шарпантье Э., Ногалес Е., Дудна Дж.А. (март 2014 г.). «Структуры эндонуклеаз Cas9 обнаруживают РНК-опосредованную конформационную активацию» . Наука . 343 (6176): 1247997. doi : 10.1126/science.1247997 . ПМК 4184034 . ПМИД 24505130 .
- ^ Виденхефт Б., Штернберг С.Х., Дудна Дж.А. (февраль 2012 г.). «Системы генетического молчания, управляемые РНК, у бактерий и архей». Природа . 482 (7385): 331–8. Бибкод : 2012Natur.482..331W . дои : 10.1038/nature10886 . ПМИД 22337052 . S2CID 205227944 .
- ^ Ран Ф.А., Сюй П.Д., Райт Дж., Агарвала В., Скотт Д.А., Чжан Ф. (ноябрь 2013 г.). «Геномная инженерия с использованием системы CRISPR-Cas9» . Протоколы природы . 8 (11): 2281–2308. дои : 10.1038/nprot.2013.143 . ПМЦ 3969860 . ПМИД 24157548 .
- ^ Jump up to: а б Андерс С., Нивонер О., Дюрст А., Джинек М. (сентябрь 2014 г.). «Структурные основы PAM-зависимого распознавания целевой ДНК эндонуклеазой Cas9» . Природа . 513 (7519): 569–73. Бибкод : 2014Natur.513..569A . дои : 10.1038/nature13579 . ПМК 4176945 . ПМИД 25079318 .
- ^ Макарова К.С., Гришин Н.В., Шабалина С.А., Вольф Ю.И., Кунин Е.В. (март 2006 г.). «Предполагаемая иммунная система прокариот, основанная на РНК-интерференции: вычислительный анализ предсказанного ферментативного механизма, функциональные аналогии с эукариотическими РНКи и гипотетические механизмы действия» . Биология Директ . 1 (1): 7. дои : 10.1186/1745-6150-1-7 . ПМК 1462988 . ПМИД 16545108 .
- ^ Сундаресан Р., Парамешваран Х.П., Йогеша С.Д., Кейлбарт М.В., Раджан Р. (декабрь 2017 г.). «Активность Cas9 и Cas12a по расщеплению ДНК, независимая от РНК» . Отчеты по ячейкам . 21 (13): 3728–3739. дои : 10.1016/j.celrep.2017.11.100 . ПМК 5760271 . ПМИД 29281823 .
- ^ Рэпер А.Т., Стивенсон А.А., Суо З. (февраль 2018 г.). «Функциональная информация, раскрытая с помощью кинетического механизма CRISPR/Cas9». Журнал Американского химического общества . 140 (8): 2971–2984. дои : 10.1021/jacs.7b13047 . ПМИД 29442507 .
- ^ Ли Дж.К., Чон И., Ли Дж., Юнг М., Шин Э., Ким Ю.Х. и др. (август 2018 г.). «Направленная эволюция CRISPR-Cas9 для повышения его специфичности» . Природные коммуникации . 9 (1): 3048. Бибкод : 2018NatCo...9.3048L . дои : 10.1038/s41467-018-05477-x . ПМК 6078992 . ПМИД 30082838 .
- ^ Сингх Д., Ван Й., Мэллон Дж., Ян О., Фей Дж., Поддар А. и др. (апрель 2018 г.). «Механизмы повышения специфичности сконструированных Cas9, выявленные с помощью анализа FRET одиночных молекул» . Структурная и молекулярная биология природы . 25 (4): 347–354. дои : 10.1038/s41594-018-0051-7 . ПМК 6195204 . ПМИД 29622787 .
- ^ Джинек М., Чилински К., Фонфара И., Хауэр М., Дудна Дж.А., Шарпантье Э. (август 2012 г.). «Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете» . Наука . 337 (6096): 816–21. Бибкод : 2012Sci...337..816J . дои : 10.1126/science.1225829 . ПМК 6286148 . ПМИД 22745249 .
- ^ Ким Н., Ким Х.К., Ли С. и др. (2020). «Прогнозирование специфичной для последовательности активности расщепления вариантов Cas9». Нат Биотехнологий . 38 (11): 1328–1336. дои : 10.1038/s41587-020-0537-9 . ПМИД 32514125 . S2CID 219542792 .
- ^ Jump up to: а б с Корси Дж.И., Цюй К., Алкан Ф., Пан Х., Луо Ю., Городкин Дж. (май 2022 г.). «Активность гРНК CRISPR/Cas9 зависит от изменений свободной энергии и от целевого контекста PAM» . Природные коммуникации . 13 (3006): 3006. Бибкод : 2022NatCo..13.3006C . дои : 10.1038/s41467-022-30515-0 . ПМЦ 9151727 . ПМИД 35637227 .
- ^ Сюй Х, Сяо Т, Чен Чэнь, Ли В, Мейер К.А., Ву Ц, Ву Д, Конг Л, Чжан Ф, Лю Дж.С., Браун М., Лю XS (август 2015 г.). «Детерминанты последовательности улучшенного дизайна sgRNA CRISPR» . Геном Рез . 25 (8): 1147–1157. дои : 10.1101/гр.191452.115 . ПМК 4509999 . ПМИД 26063738 .
- ^ Сян X, Корси, GI, Антон C, Цюй К, Пан X, Лян X, Хан П, Дун Z, Лю Л, Чжун J, Ма Т, Ван J, Чжан X, Цзян Х, Сюй Ф, Лю X, Сюй X, Ван Дж., Ян Х., Болунд Л., Чёрч ГМ, Линь Л., Городкин Дж., Луо Ю. (май 2021 г.). «Улучшение прогнозирования эффективности гРНК CRISPR-Cas9 за счет интеграции данных и глубокого обучения» . Природные коммуникации . 12 (1): 3238. Бибкод : 2021NatCo..12.3238X . дои : 10.1038/s41467-021-23576-0 . ПМЦ 8163799 . ПМИД 34050182 .
- ^ Алкан Ф., Венцель А., Антон К., Хавгаард Дж. Х., Городкин Дж. (октябрь 2018 г.). «Оценка отклонения CRISPR-Cas9 от энергетических параметров дуплекса нуклеиновых кислот» . Геномная биология . 19 (177): 177. дои : 10.1186/s13059-018-1534-x . ПМК 6203265 . ПМИД 30367669 .
- ^ Тимьян С.Б., Ахметова Л., Монтегю Т.Г., Вален Э., Шир А.Ф. (июнь 2016 г.). «Взаимодействия внутренней направляющей РНК мешают расщеплению, опосредованному Cas9» . Природные коммуникации . 7 (11750): 11750. Бибкод : 2016NatCo...711750T . дои : 10.1038/ncomms11750 . ПМК 4906408 . ПМИД 27282953 .
- ^ Кусано К., Наито Т., Ханда Н., Кобаяши И. (ноябрь 1995 г.). «Системы рестрикции-модификации как геномные паразиты, конкурирующие за определенные последовательности» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (24): 11095–9. Бибкод : 1995PNAS...9211095K . дои : 10.1073/pnas.92.24.11095 . ПМК 40578 . ПМИД 7479944 .
- ^ Штернберг С.Х., Реддинг С., Джинек М., Грин ЕС, Дудна Дж.А. (март 2014 г.). «Опрос ДНК с помощью CRISPR-РНК-ориентированной эндонуклеазы Cas9» . Природа . 507 (7490): 62–7. Бибкод : 2014Natur.507...62S . дои : 10.1038/nature13011 . ПМК 4106473 . ПМИД 24476820 .
- ^ Jump up to: а б с д и ж Бикард Д., Цзян В., Самай П., Хохшильд А., Чжан Ф., Марраффини Л.А. (август 2013 г.). «Программируемая репрессия и активация экспрессии бактериальных генов с использованием инженерной системы CRISPR-Cas» . Исследования нуклеиновых кислот . 41 (15): 7429–37. дои : 10.1093/нар/gkt520 . ПМЦ 3753641 . ПМИД 23761437 .
- ^ Хайнце Дж., Люфт С., Кеттелер Р. (2013). «СЛУЧАЙ CRISPR для высокопроизводительного подавления шума» . Границы генетики . 4 : 193. дои : 10.3389/fgene.2013.00193 . ПМЦ 3791873 . ПМИД 24109485 .
- ^ Jump up to: а б Гилберт Л.А., Хорлбек М.А., Адамсон Б., Виллалта Дж.Е., Чен Ю., Уайтхед Э.Х., Гимарайнш К., Пэннинг Б., Плох Х.Л., Бассик М.С., Ци Л.С., Кампманн М., Вайсман Дж.С. (октябрь 2014 г.). «CRISPR-опосредованный контроль репрессии и активации генов в масштабе генома» . Клетка . 159 (3): 647–61. дои : 10.1016/j.cell.2014.09.029 . ПМЦ 4253859 . ПМИД 25307932 .
- ^ О'Коннелл М.Р., Оукс Б.Л., Штернберг С.Х., Ист-Селецкий А., Каплан М., Дудна Дж.А. (декабрь 2014 г.). «Программируемое распознавание и расщепление РНК с помощью CRISPR/Cas9» . Природа . 516 (7530): 263–6. Бибкод : 2014Natur.516..263O . дои : 10.1038/nature13769 . ПМК 4268322 . ПМИД 25274302 .
Дальнейшее чтение
[ редактировать ]- Кеннеди Э.М., Каллен Б.Р. (май 2015 г.). «Бактериальные ДНК-эндонуклеазы CRISPR/Cas: революционная технология, которая может существенно повлиять на исследования и лечение вирусов» . Вирусология . 479–480: 213–20. дои : 10.1016/j.virol.2015.02.024 . ПМК 4424069 . ПМИД 25759096 .
- Эбботт Т.Р., Дамдере Дж., Лю Ю, Лин X, Гуди Л., Цзэн Л. и др. (май 2020 г.). «Развитие CRISPR как противовирусной стратегии борьбы с SARS-CoV-2 и гриппом» . Клетка . 181 (4): 865–876.e12. дои : 10.1016/j.cell.2020.04.020 . ПМК 7189862 . ПМИД 32353252 .
- Стивен Леви (18 марта 2020 г.). «Может ли Crispr стать следующим убийцей вирусов человечества?» . Проводной .