РНК-интерференция

РНК-интерференция ( РНКи ) — это биологический процесс, в котором молекулы РНК участвуют в специфичном для последовательности подавлении экспрессии генов с помощью двухцепочечной РНК посредством репрессии трансляции или транскрипции. Исторически РНКи была известна под другими названиями, включая ко-супрессию , посттранскрипционное молчание генов (PTGS) и подавление . Детальное изучение каждого из этих, казалось бы, разных процессов показало, что все эти явления на самом деле были РНКи. Эндрю Файер и Крейг К. Мелло получили Нобелевскую премию по физиологии и медицине 2006 года за работу над РНКи у нематодного червя Caenorhabditis elegans , которую они опубликовали в 1998 году. С момента открытия РНКи и ее регуляторного потенциала стало очевидно, что РНКи имеет огромный потенциал в подавлении желаемых генов. РНКи теперь известна как точная, эффективная, стабильная и лучшая антисмысловая терапия для подавления генов. [1] Антисмысловая РНК, продуцируемая внутриклеточно с помощью вектора экспрессии, может быть разработана и найти применение в качестве новых терапевтических агентов. [2]
Два типа малых молекул рибонуклеиновой кислоты (РНК), микроРНК (миРНК) и малая интерферирующая РНК ( миРНК ), играют центральную роль в компонентах пути РНКи. Как только мРНК деградирует, происходит посттранскрипционное молчание, поскольку трансляция белка предотвращается. Транскрипция может ингибироваться с помощью механизма претранскрипционного молчания РНКи, посредством которого ферментный комплекс катализирует метилирование ДНК в геномных положениях, комплементарных комплексным миРНК или микроРНК. РНКи играет важную роль в защите клеток от паразитных нуклеотидных последовательностей (например, вирусов или транспозонов ), а также влияет на развитие организмов.
Путь РНКи — это естественный процесс, обнаруженный во многих эукариотах и клетках животных. Он инициируется ферментом Dicer , который расщепляет длинные двухцепочечной РНК (дцРНК) молекулы на короткие двухцепочечные фрагменты, состоящие примерно из 21–23 нуклеотидов siRNA. Каждая миРНК раскручивается на две одноцепочечные РНК (оцРНК): пассажирскую (смысловую) цепь и направляющую (антисмысловую) цепь. Пассажирская цепь затем расщепляется белком Argonaute 2 (Ago2). Пассажирская цепь разрушается, а направляющая цепь включается в РНК-индуцированный комплекс молчания (RISC). Затем сборка RISC связывает и разрушает целевую мРНК. В частности, это достигается, когда направляющая цепь спаривается с комплементарной последовательностью в молекуле мРНК и индуцирует расщепление с помощью Ago2, каталитического компонента RISC. У некоторых организмов этот процесс распространяется системно, несмотря на изначально ограниченные молярные концентрации миРНК. [3]
РНКи является ценным исследовательским инструментом как в клеточной культуре , так и в живых организмах , поскольку синтетическая дцРНК, введенная в клетки, может избирательно и надежно вызывать подавление определенных представляющих интерес генов. РНКи может использоваться для крупномасштабных скринингов, которые систематически отключают каждый ген (и последующие белки, которые он кодирует) в клетке, что может помочь идентифицировать компоненты, необходимые для конкретного клеточного процесса или такого события, как деление клетки . Путь также используется в качестве практического инструмента для производства продуктов питания, лекарств и инсектицидов . [4]
Клеточный механизм [ править ]

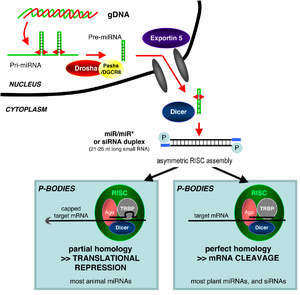
RNAi представляет собой РНК-зависимый процесс молчания генов , который контролируется RISC и инициируется короткими двухцепочечными молекулами РНК в цитоплазме клетки, где они взаимодействуют с каталитическим компонентом RISC Argonaute . [6] Когда дцРНК является экзогенной (поступающей в результате заражения вирусом с РНК-геномом или лабораторных манипуляций), РНК импортируется непосредственно в цитоплазму и расщепляется на короткие фрагменты с помощью Dicer. Инициирующая дцРНК также может быть эндогенной (происходящей из клетки), как в случае пре-микроРНК, экспрессируемых из РНК-кодирующих генов в геноме. Первичные транскрипты таких генов сначала процессируются с образованием характерной структуры «стебель-петля» пре-миРНК в ядре , а затем экспортируются в цитоплазму. Таким образом, два пути дцРНК, экзогенный и эндогенный, сходятся в RISC. [7]
Экзогенная дцРНК инициирует РНКи путем активации белка рибонуклеазы Dicer. [8] который связывает и расщепляет дцРНК у растений или короткие шпильковые РНК (shRNA) у людей с образованием двухцепочечных фрагментов из 20–25 пар оснований с выступающим 2-нуклеотидом на 3'-конце. [9] Биоинформатические исследования геномов множества организмов показывают, что такая длина максимизирует специфичность целевого гена и сводит к минимуму неспецифические эффекты. [10] Эти короткие двухцепочечные фрагменты называются миРНК . Эти миРНК затем разделяются на отдельные цепи и интегрируются в активный RISC с помощью RISC-загрузочного комплекса (RLC). RLC включает Dicer-2 и R2D2 и имеет решающее значение для объединения Ago2 и RISC. [11] Фактор 11, ассоциированный с ТАТА-связывающим белком (TAF11), собирает RLC, облегчая тетрамеризацию Dcr-2-R2D2, что увеличивает аффинность связывания с siRNA в 10 раз. Ассоциация с TAF11 превратит комплекс R2-D2-инициатор (RDI) в RLC. [12] R2D2 несет тандемные двухцепочечные РНК-связывающие домены для распознавания термодинамически стабильного конца дуплексов миРНК , тогда как Dicer-2 - другой менее стабильный конец. Загрузка асимметрична: домен MID Ago2 распознает термодинамически стабильный конец siRNA. Следовательно, «пассажирская» (смысловая) цепь, 5'-конец которой отбрасывается MID, выбрасывается, в то время как сохраненная «ведущая» (антисмысловая) цепь взаимодействует с AGO, образуя RISC. [11]
После интеграции в RISC основания миРНК соединяются с целевой мРНК и расщепляют ее, тем самым предотвращая ее использование в качестве матрицы трансляции . [13] В отличие от siRNA , комплекс RISC, нагруженный микроРНК, сканирует цитоплазматические мРНК на предмет потенциальной комплементарности. Вместо деструктивного расщепления (посредством Ago2) микроРНК скорее нацелены на области 3'-нетранслируемой области (UTR) мРНК, где они обычно связываются с несовершенной комплементарностью, тем самым блокируя доступ рибосом для трансляции. [14]
Экзогенная дцРНК обнаруживается и связывается эффекторным белком, известным как RDE-4 у C. elegans и R2D2 у дрозофилы , который стимулирует активность Dicer. [15] Механизм, обеспечивающий такую специфичность длины, неизвестен, и этот белок связывает только длинные дцРНК. [15]
У C. elegans этот ответ инициации усиливается за счет синтеза популяции «вторичных» миРНК, продуцируемые Dicer, во время которого инициирующие или «первичные» миРНК, используются в качестве матриц. [16] Эти «вторичные» миРНК структурно отличаются от миРНК, продуцируемых Dicer , и, по-видимому, продуцируются РНК-зависимой РНК-полимеразой (RdRP). [17] [18]
МикроРНК [ править ]

МикроРНК (миРНК) представляют собой геномно кодируемые некодирующие РНК , которые помогают регулировать экспрессию генов , особенно во время развития . [19] Феномен РНКи в широком смысле включает в себя эндогенно индуцированные эффекты подавления генов микроРНК, а также подавление, запускаемое чужеродной дсРНК. Зрелые микроРНК структурно сходны с siРНК, продуцируемыми из экзогенной дсРНК, но прежде чем достичь зрелости, микроРНК должны сначала подвергнуться обширной посттранскрипционной модификации . МикроРНК экспрессируется из гораздо более длинного гена, кодирующего РНК, в виде первичного транскрипта , известного как при-миРНК , который обрабатывается в ядре клетки до 70-нуклеотидной структуры «стебель-петля » , называемой пре-миРНК , микропроцессорным комплексом . Этот комплекс состоит из фермента РНКазы III, называемого Дроша , и дцРНК-связывающего белка DGCR8 . Часть дсРНК этой пре-миРНК связывается и расщепляется Dicer с образованием зрелой молекулы микроРНК, которая может быть интегрирована в комплекс RISC; таким образом, miRNA и siRNA используют один и тот же нижестоящий клеточный механизм. [20] Впервые микроРНК, кодируемая вирусом, была описана у вируса Эпштейна-Барр (ЭБВ). [21] После этого в вирусах было описано все больше микроРНК. VIRmiRNA — это полный каталог, охватывающий вирусные микроРНК, их мишени и антивирусные микроРНК. [22] (см. также ресурс VIRmiRNA: http://crdd.osdd.net/servers/virmirna/).
siRNA, полученные из предшественников длинных дцРНК, отличаются от miRNA тем, что miRNA, особенно у животных, обычно имеют неполное спаривание оснований с мишенью и ингибируют трансляцию многих различных мРНК со схожими последовательностями. Напротив, siRNA обычно идеально спаривают основания и индуцируют расщепление мРНК только в одной специфической мишени. [23] У Drosophila и C. elegans микроРНК и миРНК процессируются разными белками Argonaute и ферментами Dicer. [24] [25]
региона и нетранслируемых микроРНК Три основных
Три первичных нетранслируемых участка (3'UTR) мРНК часто содержат регуляторные последовательности, которые посттранскрипционно вызывают РНКи. Такие 3'-UTR часто содержат сайты связывания как для микроРНК , так и для регуляторных белков. Связываясь со специфическими сайтами внутри 3'-UTR, микроРНК могут снижать экспрессию генов различных мРНК, либо ингибируя трансляцию, либо непосредственно вызывая деградацию транскрипта. 3'-UTR также может иметь участки сайленсера, которые связывают белки-репрессоры, ингибирующие экспрессию мРНК.
3'-UTR часто содержит элементы ответа микроРНК (MRE) . MRE — это последовательности, с которыми связываются микроРНК. Это преобладающие мотивы в 3'-UTR. Среди всех регуляторных мотивов внутри 3'-UTR (например, включая сайленсеры), MRE составляют около половины мотивов.
По состоянию на 2023 год miRBase веб-сайт [26] архив микроРНК последовательностей и аннотаций содержит 28 645 записей о 271 биологическом виде. Из них 1917 микроРНК находились в аннотированных локусах микроРНК человека. Было предсказано, что микроРНК содержат в среднем около четырехсот целевых мРНК (влияющих на экспрессию нескольких сотен генов). [27] Фридман и др. [27] подсчитали, что> 45 000 целевых сайтов микроРНК в 3'UTR мРНК человека консервативны выше фоновых уровней, и> 60% генов, кодирующих белки человека, находились под селективным давлением для поддержания спаривания с микроРНК.
Прямые эксперименты показывают, что одна микроРНК может снизить стабильность сотен уникальных мРНК. [28] Другие эксперименты показывают, что одна микроРНК может подавлять продукцию сотен белков, но эта репрессия часто бывает относительно легкой (менее чем в 2 раза). [29] [30]
Эффекты нарушения регуляции экспрессии генов микроРНК, по-видимому, важны при раке. [31] Например, при раке желудочно-кишечного тракта девять микроРНК были идентифицированы как эпигенетически измененные и эффективные в подавлении ферментов репарации ДНК. [32]
Эффекты нарушения регуляции экспрессии генов микроРНК также кажутся важными при нервно-психических расстройствах, таких как шизофрения, биполярное расстройство, большая депрессия, болезнь Паркинсона, болезнь Альцгеймера и расстройства аутистического спектра. [33] [34] [35]
и катализ Активация RISC
Экзогенная дцРНК обнаруживается и связывается эффекторным белком, известным как RDE-4 у C. elegans и R2D2 у дрозофилы , который стимулирует активность Dicer. [15] Этот белок связывает только длинные дцРНК, но механизм, обеспечивающий такую специфичность длины, неизвестен. [15] Этот РНК-связывающий белок затем облегчает перенос расщепленных миРНК в комплекс RISC. [36]
У C. elegans этот ответ инициации усиливается за счет синтеза популяции «вторичных» миРНК, продуцируемые Dicer, во время которого инициирующие или «первичные» миРНК, используются в качестве матриц. [16] Эти «вторичные» миРНК структурно отличаются от миРНК, продуцируемых Dicer , и, по-видимому, продуцируются РНК-зависимой РНК-полимеразой (RdRP). [17] [18]


Активными компонентами РНК-индуцированного комплекса молчания (RISC) являются эндонуклеазы, называемые белками Argonaute, которые расщепляют целевую цепь мРНК, комплементарную связанной с ними миРНК . [6] Поскольку фрагменты, продуцируемые Dicer, являются двухцепочечными, каждый из них теоретически может продуцировать функциональную миРНК . Однако только одна из двух цепей, известная как направляющая цепь , связывает Аргонавта и управляет молчанием генов. Другая антинаправляющая или пассажирская цепь разрушается во время активации RISC. [37] Хотя сначала считалось, что АТФ -зависимая хеликаза . эти две цепи разделяет [38] процесс оказался АТФ-независимым и осуществлялся непосредственно белковыми компонентами RISC. [3] [39] Однако кинетический анализ РНКи in vitro в присутствии и в отсутствие АТФ показал, что АТФ может потребоваться для раскручивания и удаления расщепленной цепи мРНК из комплекса RISC после катализа. [40] Направляющей цепью обычно является та, чей 5'-конец менее стабильно спарен с комплементом. [41] но на выбор цепи не влияет направление, в котором Дайсер расщепляет дцРНК перед включением RISC. [42] Вместо этого белок R2D2 может служить дифференцирующим фактором, связывая более стабильный 5'-конец цепи-пассажира. [43]
Структурную основу связывания РНК с белком Argonaute исследовали с помощью рентгеновской кристаллографии связывающего домена РНК-связанного Argonaute. Здесь фосфорилированный 5'-конец цепи РНК входит в консервативный основной поверхностный карман и устанавливает контакты через двухвалентный катион (атом с двумя положительными зарядами), такой как магний, и посредством ароматической укладки (процесс, который позволяет более чем одному атому совместно использовать электрон, пропуская его туда и обратно) между 5'-нуклеотидом в миРНК и консервативным остатком тирозина . Считается, что этот сайт образует сайт нуклеации для связывания миРНК с ее мишенью мРНК. [44] Анализ ингибирующего эффекта несовпадений на 5'- или 3'-конце направляющей цепи показал, что 5'-конец направляющей цепи, вероятно, отвечает за сопоставление и связывание целевой мРНК, тогда как 3'-конец отвечает за физическое расположение целевой мРНК в благоприятной для расщепления области RISC. [40]
Непонятно, как активированный комплекс RISC находит комплементарные мРНК внутри клетки. Хотя предполагается, что процесс расщепления связан с трансляцией , трансляция мРНК-мишени не является существенной для деградации, опосредованной РНКи. [45] Действительно, RNAi может быть более эффективным против мишеней мРНК, которые не транслируются. [46] Белки Argonaute локализованы в определенных областях цитоплазмы, называемых P-тельцами (также цитоплазматических тельца или GW-тельца), которые представляют собой области с высокой скоростью распада мРНК; [47] Активность микроРНК также сосредоточена в Р-тельцах. [48] Разрушение Р-тельц снижает эффективность РНКи, что позволяет предположить, что они являются критическим местом в процессе РНКи. [49]
Транскрипционное молчание [ править ]
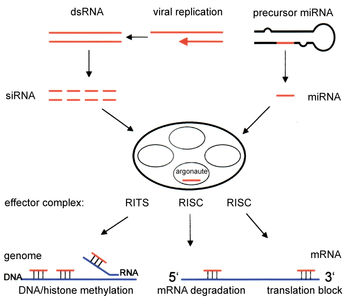
Компоненты пути РНКи используются у многих эукариот для поддержания организации и структуры их геномов . Модификация гистонов и связанная с ней индукция образования гетерохроматина регуляции генов служат для подавления претранскрипционной ; [51] этот процесс называется РНК-индуцированным транскрипционным молчанием (RITS) и осуществляется комплексом белков, называемым комплексом RITS. У делящихся дрожжей этот комплекс содержит Argonaute, хромодоменный белок Chp1 и белок Tas3 неизвестной функции. [52] Как следствие, для индукции и распространения гетерохроматических областей необходимы белки Argonaute и RdRP. [53] Действительно, делеция этих генов у делящихся дрожжей S. pombe нарушает метилирование гистонов и образование центромер . [54] вызывая медленную или остановленную анафазу во время деления клеток . [55] В некоторых случаях наблюдалось, что аналогичные процессы, связанные с модификацией гистонов, активируют транскрипцию генов. [56]
Механизм, с помощью которого комплекс RITS индуцирует образование и организацию гетерохроматина, недостаточно изучен. Большинство исследований были сосредоточены на области типа спаривания у делящихся дрожжей, которая может не отражать активность других геномных областей/организмов. Поддерживая существующие области гетерохроматина, RITS образует комплекс с siRNAs, комплементарными локальным генам, и стабильно связывает локальные метилированные гистоны, действуя котранскрипционно, разрушая любые возникающие транскрипты пре-мРНК, инициируемые РНК-полимеразой . Формирование такой области гетерохроматина, хотя и не ее поддержание, является Dicer-зависимым, по-видимому, потому, что Dicer необходим для генерации начального набора siRNAs , которые нацелены на последующие транскрипты. [57] Было высказано предположение, что поддержание гетерохроматина функционирует как самоусиливающаяся петля обратной связи, поскольку новые siRNA образуются из случайно возникающих транскриптов с помощью RdRP для включения в локальные комплексы RITS. [58] Актуальность наблюдений за областями и центромерами типа спаривания делящихся дрожжей для млекопитающих не ясна, поскольку поддержание гетерохроматина в клетках млекопитающих может быть независимым от компонентов пути RNAi. [59]
РНК редактировании Перекрестные помехи при
Тип редактирования РНК , который наиболее распространен у высших эукариот, превращает аденозиновые нуклеотиды в инозин в дцРНК с помощью фермента аденозиндезаминазы (ADAR). [60] Первоначально в 2000 году было высказано предположение, что пути редактирования РНК RNAi и A→I могут конкурировать за общий субстрат дцРНК. [61] Некоторые пре-миРНК подвергаются редактированию A→I РНК. [62] [63] и этот механизм может регулировать процессинг и экспрессию зрелых микроРНК. [63] Более того, по крайней мере один ADAR млекопитающих может изолировать siRNA из компонентов пути RNAi. [64] Дополнительную поддержку этой модели дают исследования на штаммах C. elegans, не имеющих ADAR , показывающие, что редактирование РНК A→I может противодействовать подавлению РНКи эндогенных генов и трансгенов. [65]
Различия между организмами [ править ]
Организмы различаются по своей способности захватывать чужеродную дцРНК и использовать ее в пути РНКи. Эффекты РНКи могут быть как системными, так и наследственными у растений и C. elegans , но не у дрозофилы или млекопитающих. Считается, что у растений РНКи распространяются путем переноса миРНК между клетками через плазмодесмы (каналы в клеточных стенках, которые обеспечивают связь и транспорт). [38] Наследственность обусловлена метилированием промоторов, на которые нацелена РНКи; новый образец метилирования копируется в каждом новом поколении клетки. [67] Широкое общее различие между растениями и животными заключается в нацеливании эндогенно продуцируемых микроРНК; у растений микроРНК обычно идеально или почти идеально комплементарны своим генам-мишеням и индуцируют прямое расщепление мРНК с помощью RISC, в то время как микроРНК животных имеют тенденцию быть более дивергентными по последовательности и вызывать репрессию трансляции. [66] Этот трансляционный эффект может быть достигнут путем ингибирования взаимодействия факторов инициации мРНК трансляции с полиадениновым хвостом . [68]
У некоторых эукариотических простейших, таких как Leishmania major и Trypanosoma cruzi, путь RNAi полностью отсутствует. [69] [70] Большинство или все компоненты отсутствуют у некоторых грибов , особенно у модельного организма Saccharomyces cerevisiae . [71] Присутствие РНКи у других видов почкующихся дрожжей, таких как Saccharomyces castellii и Candida albicans , дополнительно демонстрирует, что индуцирование двух родственных РНКи белков из S. castellii облегчает РНКи у S. cerevisiae . [72] Тот факт, что у некоторых аскомицетов и базидиомицетов отсутствуют пути РНКи, указывает на то, что белки, необходимые для подавления РНК, были потеряны независимо от многих грибковых линий , возможно, из-за эволюции нового пути со схожей функцией или из-за отсутствия селективного преимущества в определенных нишах . [73]
системы прокариотические Родственные
На экспрессию генов у прокариот влияет система на основе РНК, в некоторых отношениях сходная с РНКи. Здесь гены, кодирующие РНК, контролируют численность или трансляцию мРНК, производя комплементарную РНК, которая отжигается с мРНК. Однако эти регуляторные РНК обычно не считаются аналогами микроРНК, поскольку в них не участвует фермент Dicer. [74] Было высказано предположение, что системы интерференции CRISPR у прокариот аналогичны эукариотическим системам РНКи, хотя ни один из белковых компонентов не является ортологичным . [75]
Биологические функции [ править ]
Этот раздел необходимо обновить . ( май 2020 г. ) |
Иммунитет [ править ]
РНКи является жизненно важной частью иммунного ответа на вирусы и другой чужеродный генетический материал , особенно у растений, где она также может предотвращать саморазмножение транспозонов. [76] Такие растения, как Arabidopsis thaliana, Dicer экспрессируют множество гомологов , которые специализируются на том, чтобы по-разному реагировать, когда растение подвергается воздействию различных вирусов. [77] Еще до того, как путь РНКи был полностью понятен, было известно, что индуцированное молчание генов в растениях может распространяться по всему растению с системным эффектом и может передаваться от подвоя к привойным растениям посредством прививки . [78] С тех пор это явление было признано особенностью иммунной системы растений, которая позволяет всему растению реагировать на вирус после первоначального локального контакта. [79] В ответ многие растительные вирусы развили сложные механизмы подавления ответа РНКи. [80] К ним относятся вирусные белки, которые связывают короткие фрагменты двухцепочечной РНК с одноцепочечными выступающими концами, например, продуцируемые Dicer. [81] Геномы некоторых растений также экспрессируют эндогенные миРНК в ответ на заражение определенными типами бактерий . [82] Эти эффекты могут быть частью генерализованной реакции на патогены, которая подавляет любой метаболический процесс в организме хозяина, способствующий инфекционному процессу. [83]
Хотя животные обычно экспрессируют меньше вариантов фермента Dicer, чем растения, у некоторых животных РНКи вызывает противовирусный ответ. И у ювенильных, и у взрослых дрозофил РНКи важна для противовирусного врожденного иммунитета и активна против таких патогенов как вирус дрозофилы X. , [84] [85] Аналогичная роль в иммунитете может действовать и у C. elegans , поскольку активность белков Argonaute повышается в ответ на вирусы и черви, которые сверхэкспрессируют компоненты пути RNAi, устойчивые к вирусной инфекции. [86] [87]
Роль РНКи во врожденном иммунитете млекопитающих плохо изучена, и данных относительно мало. Однако существование вирусов, кодирующих гены, способные подавлять РНКи-ответ в клетках млекопитающих, может свидетельствовать в пользу РНКи-зависимого иммунного ответа млекопитающих. [88] [89] хотя эта гипотеза была оспорена как плохо обоснованная. [90] Были представлены доказательства существования функционального противовирусного пути РНКи в клетках млекопитающих. [91] [92]
Существуют также другие функции РНКи в вирусах млекопитающих, такие как микроРНК, экспрессируемые вирусом герпеса , которые могут действовать как триггеры организации гетерохроматина , опосредующие латентный период вируса. [93]
генов Подавление
Эндогенно экспрессируемые микроРНК, включая как интронные , так и межгенные микроРНК, играют наиболее важную роль в репрессии трансляции. [66] и в регуляции развития, особенно в отношении сроков морфогенеза и поддержания недифференцированных или неполностью дифференцированных типов клеток, таких как стволовые клетки . [94] Роль эндогенно экспрессируемой микроРНК в подавлении экспрессии генов была впервые описана у C. elegans в 1993 году. [95] У растений эта функция была обнаружена, когда было показано, что «микроРНК JAW» Arabidopsis участвует в регуляции нескольких генов, контролирующих форму растений. [96] У растений большинство генов, регулируемых микроРНК, являются факторами транскрипции ; [97] таким образом, активность miRNA особенно широка и регулирует целые генные сети во время развития путем модуляции экспрессии ключевых регуляторных генов, включая факторы транскрипции, а также белки F-box . [98] У многих организмов, включая человека, микроРНК связаны с образованием опухолей и нарушением регуляции клеточного цикла . Здесь микроРНК могут функционировать как онкогены , так и супрессоры опухолей . [99]
Эволюция [ править ]
На основании основанного на экономии филогенетического анализа, , самый последний общий предок всех эукариот, скорее всего, уже обладал ранним путем RNAi; отсутствие этого пути у некоторых эукариот считается производной характеристикой. [100] Эта предковая система RNAi, вероятно, содержала по крайней мере один Dicer-подобный белок, один Argonaute, один белок PIWI и РНК-зависимую РНК-полимеразу , которая, возможно, также играла и другие клеточные роли. Крупномасштабное сравнительное геномное эукариот исследование также показывает, что коронная группа уже обладала этими компонентами, которые затем могли иметь более тесные функциональные связи с генерализованными системами деградации РНК, такими как экзосомы . [101] Это исследование также предполагает, что семейство РНК-связывающих белков Argonaute, которое является общим для эукариот, большинства архей и, по крайней мере, некоторых бактерий (таких как Aquifex aeolicus ), гомологичны компонентам системы инициации трансляции и первоначально произошли от них .
Приложения [ править ]
РНКи для нокдауна Путь генов
Нокдаун генов — это метод, используемый для снижения экспрессии специфических генов организма. Это достигается за счет использования естественного процесса РНКи. [6] В этом методе нокдауна гена используется двухцепочечная молекула миРНК, которая синтезируется с последовательностью, комплементарной интересующему гену. Каскад РНКи начинается, когда фермент Dicer начинает обрабатывать миРНК. Конечный результат процесса приводит к деградации мРНК и уничтожению всех инструкций, необходимых для построения определенных белков. Используя этот метод, исследователи могут уменьшить (но не полностью устранить) экспрессию целевого гена. Изучение эффектов этого снижения экспрессии может показать физиологическую роль или влияние продуктов целевых генов. [102] [103]
Нецелевые эффекты гена нокдауна
Обширные усилия в области вычислительной биологии были направлены на разработку успешных реагентов дцРНК, которые максимизируют нокдаун генов, но минимизируют «нецелевые» эффекты. Нецелевые эффекты возникают, когда введенная РНК имеет последовательность оснований, которая может спариваться и, таким образом, снижать экспрессию нескольких генов. Такие проблемы возникают чаще, когда дцРНК содержит повторяющиеся последовательности. было подсчитано На основе изучения геномов человека, C. elegans и S. pombe , что около 10% возможных миРНК оказывают существенное нецелевое воздействие. [10] Разработано множество программных средств, реализующих алгоритмы проектирования общих [104] [105] специфичные для млекопитающих, [106] и вирусспецифические [107] siRNA , которые автоматически проверяются на возможную перекрестную реактивность.
В зависимости от организма и экспериментальной системы экзогенная РНК может представлять собой длинную цепь, предназначенную для расщепления Dicer, или короткие РНК, предназначенные для использования в качестве миРНК субстратов . В большинстве клеток млекопитающих используются более короткие РНК, поскольку длинные двухцепочечные молекулы РНК индуцируют у млекопитающих интерфероновую реакцию — форму врожденного иммунитета , которая неспецифически реагирует на чужеродный генетический материал. [108] Мышиные ооциты и клетки ранних эмбрионов мыши лишены этой реакции на экзогенную дцРНК и поэтому являются обычной модельной системой для изучения эффектов нокдауна генов млекопитающих. [109] Также были разработаны специализированные лабораторные методы для повышения применимости РНКи в системах млекопитающих за счет исключения прямого введения миРНК , например, путем стабильной трансфекции плазмидой , кодирующей соответствующую последовательность, из которой миРНК . можно транскрибировать [110] или с помощью более сложных лентивирусных векторных систем, позволяющих индуцируемую активацию или деактивацию транскрипции, известных как условные РНКи . [111] [112]
Лекарства [ править ]


Методика подавления генов с помощью терапии RNAi продемонстрировала успех в рандомизированных контролируемых клинических исследованиях. Эти лекарства представляют собой растущий класс препаратов на основе миРНК, которые снижают экспрессию белков, кодируемых определенными генами. На сегодняшний день регулирующими органами США и Европы одобрено пять препаратов RNAi: патисиран (2018 г.), гивосиран (2019 г.), лумасиран (2020 г.), инклисиран (2020 г. в Европе с ожидаемым одобрением в США в 2021 г.) и вутрисиран (2022 г.). ). [113] [114] [115] [116]
В то время как все ныне одобренные регулирующими органами РНКи-терапевтические препараты направлены на заболевания, возникающие в печени, дополнительные исследуемые лекарства нацелены на множество областей заболеваний, включая сердечно-сосудистые заболевания, нарушения свертываемости крови, расстройства, связанные с употреблением алкоголя, муковисцидоз, подагру, карциному и заболевания глаз. .
Патисиран — первый препарат на основе двухцепочечной миРНК, одобренный в 2018 году и разработанный компанией Alnylam Pharmaceuticals . Патисиран использует каскад РНКи для подавления гена, кодирующего TTR (транстриетин). Мутации в этом гене могут вызвать неправильное сворачивание белка, ответственного за наследственный ATTR-амилоидоз . Для достижения терапевтического ответа патирисан заключен в мембрану из липидных наночастиц , которая облегчает переход в цитоплазму. Попав внутрь клетки, миРНК начинает обработку ферментом Dicer. Патирисан вводится медицинским работником путем внутривенной инфузии в дозировке, рассчитанной в зависимости от массы тела. Предупреждения и меры предосторожности включают риск инфузионных реакций и снижение уровня витамина А (в сыворотке). [117]
В 2019 году FDA и EMA одобрили гивосиран для лечения острой печеночной порфирии (ОГП) у взрослых. [118] В ноябре 2019 года FDA также предоставило гивосирану статус прорывной терапии , статус приоритетного обзора и статус орфанного препарата для лечения острой печеночной порфирии (ОГП). [119] К 2020 году гивосиран получил одобрение EMA. [120] Гивосиран представляет собой миРНК, которая расщепляет мРНК синтазы аминолевулиновой кислоты 1 (ALAS1) в печени. Разрушение мРНК ALAS1 предотвращает токсинов (ответственных за нейровисцеральные приступы и болезнь АГП), таких как аминолевулиновая кислота (АЛК) и порфобилиноген (ПБГ). накопление [121] [122] [123] [124] Для облегчения проникновения в цитоплазму гивосиран использует лиганды GalNAc и проникает в клетки печени. Лекарство вводится подкожно медицинским работником в дозировке в зависимости от массы тела. Предупреждения и меры предосторожности включают риск анафилактических реакций, печеночной токсичности, почечной токсичности и реакций в месте инъекции. [125]
Лумасиран был одобрен как препарат на основе миРНК в 2020 году для использования как в Европейском Союзе, так и в США. [126] [127] Этот препарат используется для лечения первичной гипероксалурии типа 1 (PH1) у детей и взрослых. Препарат предназначен для снижения выработки оксалатов в печени и уровня оксалатов в моче посредством РНКи путем воздействия на мРНК оксидазы гидроксикислоты 1 (HAO1) для разрушения. Снижение уровня фермента HAO1 снижает окисление гликолята в глиоксилат (который является субстратом оксалата). Лумасиран вводится медицинским работником подкожно в зависимости от массы тела. [128] Данные рандомизированных контролируемых клинических исследований показывают, что наиболее распространенной побочной реакцией были реакции в месте инъекции. Эти реакции были легкими и присутствовали у 38 процентов пациентов, принимавших лумасиран. [129]
В 2022 году FDA и EMA одобрили вутрисиран для лечения взрослых с наследственным транстиретин-опосредованным амилоидозом с полиневропатией 1 или 2 стадии. [130] [131] Вутрисиран предназначен для разрушения мРНК, кодирующей транстиретин .
Другие исследуемые препараты, использующие РНКи, разрабатываются такими фармацевтическими компаниями, как Arrowhead Pharmaceuticals , Dicerna, Alnylam Pharmaceuticals , Amgen и Sylentis. Эти лекарства поражают различные цели посредством РНКи и заболеваний.
Исследовательские РНКи-терапевтические средства в разработке:
| Лекарство | Цель | Система доставки | Болезнь | Фаза | Статус | Компания | Идентификатор |
| АЛН–ВСП02 | КСП и ВЭФФ | ЛНП | Солидные опухоли | я | Завершенный | Алнилам Фармасьютикалс | NCT01158079 |
| миРНК-EphA2-DOPC | ЭфА2 | ЛНП | Поздние стадии рака | я | Рекрутинг | Онкологический центр доктора медицины Андерсона | NCT01591356 |
| Ату027 | ПКН3 | ЛНП | Солидные опухоли | я | Завершенный | Тишина Терапия | NCT00938574 |
| ТКМ–080301 | ПЛК1 | ЛНП | Рак | я | Рекрутинг | Текмира Фармасьютикал | NCT01262235 |
| ТКМ–100201 | VP24, VP35, Заир L-полимераза Эболы | ЛНП | Инфекция, вызванная вирусом Эбола | я | Рекрутинг | Текмира Фармасьютикал | NCT01518881 |
| АЛН–РСВ01 | Нуклеокапсид РСВ | Голая миРНК | Респираторно-синцитиальные вирусные инфекции | II | Завершенный | Алнилам Фармасьютикалс | NCT00658086 |
| ПРО-040201 | АпоБ | ЛНП | Гиперхолестеринемия | я | Прекращено | Текмира Фармасьютикал | NCT00927459 |
| АЛН–PCS02 | ПКСК9 | ЛНП | Гиперхолестеринемия | я | Завершенный | Алнилам Фармасьютикалс | NCT01437059 |
| АЛН–TTR02 | ТТР | ЛНП | Транстиретин-опосредованный амилоидоз | II | Рекрутинг | Алнилам Фармасьютикалс | NCT01617967 |
| АЛАА-01 | РРМ2 | Циклодекстрин НП | Солидные опухоли | я | Активный | Каландо Фармасьютикалс | NCT00689065 |
| ТД101 | K6a (мутация N171K) | Голая миРНК | Врожденная пахионихия | я | Завершенный | Проект врожденной пахионихии | NCT00716014 |
| АГН211745 | ВЕФФР1 | Голая миРНК | Возрастная макулярная дегенерация, хориоидальная неоваскуляризация | II | Прекращено | Аллерган | NCT00395057 |
| QPI-1007 | КАСП2 | Голая миРНК | Атрофия зрительного нерва, неартериальная передняя ишемическая нейропатия зрительного нерва | я | Завершенный | Кварк Фармасьютикалс | NCT01064505 |
| И5НП | стр.53 | Голая миРНК | Травма почек, острая почечная недостаточность. | я | Завершенный | Кварк Фармасьютикалс | NCT00554359 |
| Задержка функции трансплантата, осложнения трансплантации почки | я, я | Рекрутинг | Кварк Фармасьютикалс | NCT00802347 | |||
| ПФ-655 (ПФ-04523655) | RTP801 (собственная цель) | Голая миРНК | Хориоидальная неоваскуляризация, диабетическая ретинопатия, диабетический макулярный отек | II | Активный | Кварк Фармасьютикалс | NCT01445899 |
| SiG12D ЛОДЕР | КРАС | ЛОДЕР полимер | Рак поджелудочной железы | II | Рекрутинг | Силенсед | NCT01676259 |
| Запятнанный | ВЭФР | Голая миРНК | Диабетический макулярный отек, дегенерация желтого пятна | II | Завершенный | Опко Здоровье | NCT00306904 |
| SYL1001 | ТРПВ1 | Голая миРНК | Боль в глазах, синдром сухого глаза | я, я | Рекрутинг | Тихий | NCT01776658 |
| SYL040012 | АДРБ2 | Голая миРНК | Глазная гипертензия, открытоугольная глаукома. | II | Рекрутинг | Тихий | NCT01739244 |
| CEQ508 | CTNNB1 | ШРНК, несущая Escherichia coli | Семейный аденоматозный полипоз | я, я | Рекрутинг | Марина Биотех | Неизвестный |
| RXi-109 | ЦТГФ | Самодоставляющееся соединение РНКи | Профилактика рубцов и рубцов | я | Рекрутинг | RXi Фармацевтика | NCT01780077 |
| АЛН–TTRsc | ТТР | конъюгат миРНК-GalNAc | Транстиретин-опосредованный амилоидоз | я | Рекрутинг | Алнилам Фармасьютикалс | NCT01814839 |
| АРК-520 | Консервативные регионы HBV | ЦОД | ВГВ | я | Рекрутинг | Исследования стрелы | NCT01872065 |
вопросы в ближайшем будущем Правовая категоризация и правовые
В настоящее время и микроРНК, и миРНК синтезируются химическим путем и поэтому по закону в ЕС и США относятся к категории «простых» лекарственных средств. Но поскольку биоинженерные миРНК (BERA) находятся в стадии разработки, они будут классифицироваться как биологические лекарственные средства, по крайней мере, в ЕС. Развитие технологии BERAS ставит вопрос о категоризации лекарств, имеющих одинаковый механизм действия, но производимых химическим или биологическим путем. Эту несогласованность следует устранить. [132]
Механизмы доставки [ править ]
Для реализации клинического потенциала РНКи миРНК должна эффективно транспортироваться в клетки тканей-мишеней. Однако существуют различные препятствия, которые необходимо устранить, прежде чем его можно будет использовать в клинических целях. Например, «голая» миРНК подвержена нескольким препятствиям, которые снижают ее терапевтическую эффективность. [133] Кроме того, как только миРНК попадает в кровоток, голая РНК может разрушаться сывороточными нуклеазами и стимулировать врожденную иммунную систему. [133] Из-за своего размера и высокополианионной (содержащей отрицательные заряды в нескольких сайтах) природы немодифицированные молекулы миРНК не могут легко проникать в клетки через клеточную мембрану. искусственную или инкапсулированную в наночастицы миРНК Следовательно, необходимо использовать . Если миРНК переносится через клеточную мембрану, может возникнуть непреднамеренная токсичность, если терапевтические дозы не оптимизированы, а миРНК могут проявлять нецелевые эффекты (например, непреднамеренное подавление генов с частичной комплементарностью последовательностей ). [134] Даже после попадания в клетки требуется повторное введение дозы, поскольку их действие ослабевает при каждом делении клеток. В ответ на эти потенциальные проблемы и препятствия два подхода помогают облегчить доставку миРНК к клеткам-мишеням: липидные наночастицы и конъюгаты. [135]
Липидные наночастицы [ править ]
Липидные наночастицы (ЛНЧ) основаны на липосомоподобных структурах, которые обычно состоят из водного центра, окруженного липидной оболочкой. [136] Подмножество липосомальных структур, используемых для доставки лекарств в ткани, находится в больших однослойных везикулах (LUV), размер которых может достигать 100 нм. Механизмы доставки LNP становятся все более растущим источником оболочек нуклеиновых кислот и могут включать плазмиды , CRISPR и мРНК . [137]
Первое одобренное использование липидных наночастиц в качестве механизма доставки лекарств началось в 2018 году с препарата siRNA патисиран, разработанного Alnylam Pharmaceuticals. Dicerna Pharmaceuticals, Persomics , Sanofi и Sirna Therapeutics также работали над выводом на рынок РНКи-терапии. [138] [139]
Другие недавние применения включают две одобренные FDA вакцины против COVID-19: мРНК-1273, разработанную Moderna . и BNT162b , разработанный в результате сотрудничества компаний Pfizer и BioNtech . [140] В этих двух вакцинах для доставки мРНК антигена используются липидные наночастицы. Инкапсулирование молекулы мРНК в липидные наночастицы стало решающим прорывом в производстве жизнеспособных мРНК-вакцин, разрешив ряд ключевых технических барьеров в доставке молекулы мРНК в клетку-хозяина, которая распределялась через аполипопротеин Е (апоЕ) в рецепторе липопротеинов низкой плотности (ЛПНП). ). В декабре 2020 года Novartis объявила, что положительные результаты исследований эффективности III фазы считают, что инклисиран является средством лечения гетерозиготной семейной гиперхолестеринемии (ГеСГ) и атеросклеротических сердечно-сосудистых заболеваний (АСЦЗ). [141]
Конъюгаты [ править ]
Помимо ЛНЧ, РНКи-терапевтические средства имеют адресную доставку через конъюгаты миРНК (например, GalNAc, углеводы, пептиды, аптамеры, антитела). [142] Терапия с использованием конъюгатов миРНК была разработана для лечения редких или генетических заболеваний, таких как острая печеночная порфирия (ОГП), гемофилия , первичная гипероксалурия (ПГ) и наследственный ATTR- амилоидоз , а также других кардиометаболических заболеваний, таких как гипертония и неалкогольный стеатогепатит (НАСГ). [143]
Биотехнология [ править ]
РНКи использовалась для множества других применений, включая продукты питания, сельскохозяйственные культуры и инсектициды. Использование пути RNAi позволило разработать множество продуктов, таких как арктические яблоки , табак без никотина, кофе без кофеина, растительность, обогащенная питательными веществами, и гипоаллергенные культуры. [144] [145] [146] Новое использование РНКи может позволить разработать множество других продуктов для будущего использования.
Вирусная инфекция [ править ]
Противовирусное лечение является одним из первых предложенных медицинских применений на основе РНКи, и были разработаны два разных типа. Первый тип нацелен на вирусные РНК. Многие исследования показали, что воздействие на вирусные РНК может подавлять репликацию многочисленных вирусов, включая ВИЧ . [147] ВПЧ , [148] гепатит А , [149] гепатит В , [150] вирус гриппа , [151] [152] [153] [154] респираторно-синцитиальный вирус (РСВ), [154] коронавирус SARS (SARS-CoV), [154] аденовирус [154] и вирус кори . [155] Другая стратегия заключается в блокировании первоначальных проникновений вируса путем воздействия на гены клетки-хозяина. [156] Например, подавление хемокиновых рецепторов ( CXCR4 и CCR5 ) в клетках-хозяевах может предотвратить проникновение вируса ВИЧ. [157]
Рак [ править ]
Хотя традиционная химиотерапия может эффективно убивать раковые клетки, отсутствие специфичности в различении нормальных и раковых клеток в этих методах лечения обычно приводит к серьезным побочным эффектам. Многочисленные исследования показали, что RNAi может обеспечить более специфический подход к подавлению роста опухоли путем воздействия на гены, связанные с раком (т. е. онкогены ). [158] Также было высказано предположение, что РНКи может повысить чувствительность раковых клеток к химиотерапевтическим агентам , обеспечивая комбинаторный терапевтический подход с химиотерапией. [159] Еще одним потенциальным методом лечения на основе РНКи является ингибирование инвазии и миграции клеток . [160]
По сравнению с химиотерапией или другими противораковыми препаратами у препарата siRNA есть много преимуществ. [161] SiRNA действует на посттранскрипционной стадии экспрессии генов, поэтому не модифицирует и не изменяет ДНК с вредным эффектом. [161] SiRNA также можно использовать для получения специфического ответа определенным способом, например, путем снижения степени подавления экспрессии генов. [161] В одной раковой клетке миРНК может вызвать резкое подавление экспрессии генов всего несколькими копиями. [161] Это происходит путем подавления генов, способствующих раку, с помощью РНКи, а также воздействия на последовательность мРНК. [161]
Препараты RNAi лечат рак, подавляя определенные гены, способствующие развитию рака. [161] Это достигается путем дополнения раковых генов РНКи, например, путем сохранения последовательностей мРНК в соответствии с препаратом РНКи. [161] В идеале РНКи следует инъецировать и/или химически модифицировать, чтобы РНКи могли более эффективно достигать раковых клеток. [161] Поглощение и регуляция РНКи контролируются почками. [161]
Неврологические заболевания [ править ]
Стратегии РНКи также демонстрируют потенциал для лечения нейродегенеративных заболеваний . Исследования на клетках и мышах показали, что специфическое воздействие РНКи на гены, продуцирующие бета-амилоид (например, BACE1 и APP), может значительно снизить количество пептида Aβ, что коррелирует с причиной болезни Альцгеймера . [162] [163] [164] Кроме того, подходы, основанные на подавлении звука, также дают многообещающие результаты в лечении болезни Паркинсона и полиглутаминовой болезни . [165] [166] [167]
Стимуляция иммунного ответа [ править ]
Иммунная система человека делится на две отдельные ветви: врожденную иммунную систему и адаптивную иммунную систему. [168] Врожденная иммунная система является первой защитой от инфекции и реагирует на патогены общим образом. [168] С другой стороны, адаптивная иммунная система, система, которая развилась позже, чем врожденная, состоит в основном из высокоспециализированных В- и Т-клеток, обученных реагировать на определенные части патогенных молекул. [168]
Борьба между старыми и новыми патогенами помогла создать систему защищенных клеток и частиц, называемую безопасной основой. [168] Эта система дала людям армию систем, которые ищут и уничтожают частицы-захватчики, такие как патогены, микроскопические организмы, паразиты и инфекции. [168] Была разработана система безопасности для млекопитающих, включающая миРНК в качестве инструмента для выявления вирусного заражения, что позволило миРНК создавать интенсивный врожденный иммунный ответ. [168]
siRNA контролируется врожденной иммунной системой, которую можно разделить на острые воспалительные реакции и противовирусные реакции. [168] Воспалительная реакция создается сигналами малых сигнальных молекул или цитокинов. [168] К ним относятся интерлейкин-1 (IL-1), интерлейкин-6 (IL-6), интерлейкин-12 (IL-12) и фактор некроза опухоли α (TNF-α). [168] Врожденная иммунная система генерирует воспаление и противовирусные реакции, которые вызывают высвобождение рецепторов распознавания образов (PRR). [168] Эти рецепторы помогают определить, какие патогены являются вирусами, грибами или бактериями. [168] Более того, важность миРНК и врожденной иммунной системы заключается во включении большего количества PRR, которые помогают распознавать различные структуры РНК. [168] Это повышает вероятность того, что миРНК вызовет иммуностимулирующий ответ в случае воздействия патогена. [168]
Еда [ править ]
РНКи использовалась для генетической инженерии растений для производства более низких уровней естественных растительных токсинов. Такие методы используют преимущества стабильного и наследуемого фенотипа RNAi в растительных запасах. Семена хлопка богаты пищевым белком , но, естественно, содержат токсичный терпеноидный продукт госсипол , что делает их непригодными для потребления человеком. RNAi использовалась для производства хлопчатника, семена которого содержат пониженный уровень дельта-кадиненсинтазы , ключевого фермента в производстве госсипола, не влияя при этом на выработку фермента в других частях растения, где госсипол сам по себе важен для предотвращения повреждения растений вредителями. [169]
Усилия в области развития успешно снизили уровень аллергенов в томата . растениях [170] и обогащение растений, таких как помидоры, диетическими антиоксидантами . [171] Замалчивание альфа-амилазы с помощью РНКи также использовалось для уменьшения роста грибков Aspergillus flavus в кукурузе, которые в противном случае загрязнили бы зерна опасными афлатоксинами . [172] Замалчивание синтазы слезоточивого фактора в луке привело к образованию лука без слез, а РНКи использовалась в генах BP1 семян рапса для улучшения фотосинтеза. [173] Гены SBEIIa и SBEIIb в пшенице были нацелены на производство более высоких уровней амилозы для улучшения функции кишечника. [174] и Травелла и др. В 2006 году РНКи использовалась для функциональной геномики при исследовании гексаплоидных хлебных рас , а индуцированное вирусом подавление генов (VIGS, подтип РНКи) использовалось Скофилдом и соавт. 2005 г. для изучения механизма устойчивости Lr21 к у листовой ржавчине гексаплоидной пшеницы . [175]
Инсектициды [ править ]
РНКи находится в стадии разработки как инсектицид , с использованием нескольких подходов, включая генную инженерию и местное применение. [4] Клетки средней кишки некоторых насекомых поглощают молекулы дцРНК в процессе, называемом РНКи окружающей среды. [176] У некоторых насекомых эффект носит системный характер, поскольку сигнал распространяется по всему телу насекомого (так называемый системный РНКи). [177]
Животные, подвергшиеся воздействию РНКи в дозах, в миллионы раз превышающих ожидаемые уровни воздействия для человека, не показали никаких побочных эффектов. [178] РНКи оказывает различное действие на разные виды чешуекрылых (бабочек и мотыльков). [179]
Виды Drosophila , Bombyx mori , Locusta spp., Spodoptera spp., Tribolium castaneum , Nilaparvata lugens , Helicoverpa Armigera и Apis mellifera — это модели, которые широко использовались для изучения того, как RNAi работает в определенных таксонах насекомых. Musca Domestica имеет два Ago2 гена , а Glossina morsitans — три, как обнаружили Льюис и др. 2016 и Хейн и др. 2010. [180] [181] В случае микроРНК пути Diuraphis noxia имеет два Ago1 , M. Domestica — два Dcr1 , Acyrthosiphon pisum — по два Ago1 , Loqs и Dcr1 и четыре Pasha . В то время как в piRNA и G. morsitans A. pisum имеют по два или три Ago3 каждый. [181] Это привело к определению будущих целей разработки инсектицидов , а также способов действия и причин резистентности других инсектицидов. [181]
Трансгенные растения [ править ]
трансгенные культуры Были созданы для экспрессии дцРНК, тщательно отобранные для подавления важных генов у целевых вредителей. Эти дцРНК предназначены для воздействия только на насекомых, экспрессирующих определенные последовательности генов. В качестве доказательства принципа в 2009 году исследование показало РНК, которые могут убить любой из четырех видов плодовых мух, не причиняя вреда остальным трем. [4]
Актуально [ править ]
Альтернативно, дцРНК можно получить без генной инженерии. Один из подходов — добавлять их в поливную воду. систему растений Молекулы всасываются в сосудистую и отравляют питающихся ими насекомых. Другой подход предполагает распыление дсРНК, как обычного пестицида. Это позволит быстрее адаптироваться к сопротивлению. Такие подходы потребуют недорогих источников дцРНК, которых в настоящее время не существует. [4]
Функциональная геномика [ править ]
Подходы к созданию полногеномных библиотек РНКи могут потребовать большей сложности, чем создание одной миРНК для определенного набора экспериментальных условий. Искусственные нейронные сети часто используются для создания siRNA . библиотек [182] и предсказать их вероятную эффективность при нокдауне генов. [183] Массовый геномный скрининг широко рассматривается как многообещающий метод аннотации генома и послужил толчком к разработке высокопроизводительных методов скрининга на основе микрочипов . [184] [185]
Геномный скрининг
Исследования РНКи в масштабе генома основаны на технологии высокопроизводительного скрининга (HTS). Технология RNAi HTS позволяет проводить полногеномный скрининг потери функции и широко используется для идентификации генов, связанных с конкретными фенотипами. Эта технология была провозглашена потенциальной второй волной геномики после первой волны геномики, основанной на экспрессии генов микрочипах и платформах для обнаружения однонуклеотидного полиморфизма . [186] Одним из основных преимуществ скрининга РНКи в масштабе генома является его способность одновременно опрашивать тысячи генов. Благодаря возможности генерировать большой объем данных за эксперимент, скрининг РНКи в масштабе генома привел к взрывному росту скорости генерации данных. Использование таких больших наборов данных является фундаментальной задачей, требующей подходящих методов статистики/биоинформатики. Основной процесс клеточного скрининга РНКи включает выбор библиотеки РНКи, надежных и стабильных типов клеток, трансфекцию агентами РНКи, обработку/инкубацию, обнаружение сигнала, анализ и идентификацию важных генов или терапевтических мишеней. [187]
История [ править ]
Открытие РНКи [ править ]

Процесс РНКи назывался «совупрессией» и «подавлением», если наблюдать до того, как был известен механизм, связанный с РНК. Открытию РНКи предшествовали наблюдения ингибирования транскрипции антисмысловыми РНК, экспрессируемыми в трансгенных растениях. [189] и, более конкретно, сообщениями о неожиданных результатах экспериментов, проведенных учеными-растоводителями в США и Нидерландах в начале 1990-х годов. [190] Пытаясь изменить цветков окраску петунии , исследователи ввели дополнительные копии гена, кодирующего халконсинтазу , ключевой фермент, отвечающий за пигментацию цветков , в растения петунии с обычно розовым или фиолетовым цветом цветов. Ожидалось, что сверхэкспрессия гена приведет к более темным цветам, но вместо этого у некоторых цветов появился менее видимый фиолетовый пигмент, иногда с пестрыми узорами, что указывает на то, что активность халконсинтазы существенно снизилась или подавлялась в зависимости от контекста. Позже это будет объяснено как результат вставки трансгена рядом с промоторами в противоположном направлении в различных положениях по всему геному некоторых трансформантов, что приводит к экспрессии антисмысловых транскриптов и молчанию генов, когда эти промоторы активны. [ нужна ссылка ] Еще одно раннее наблюдение РНКи было получено в результате изучения гриба Neurospora crassa . [191] хотя это не сразу было признано родственным. Дальнейшее исследование этого явления на растениях показало, что подавление было связано с посттранскрипционным ингибированием экспрессии генов за счет повышенной скорости деградации мРНК. [192] Это явление назвали ко-супрессией экспрессии генов , но молекулярный механизм остался неизвестным. [193]
Вскоре после этого вирусологи растений , работающие над повышением устойчивости растений к вирусным заболеваниям, заметили аналогичное неожиданное явление. Хотя было известно, что растения, экспрессирующие вирусспецифические белки, демонстрируют повышенную толерантность или устойчивость к вирусной инфекции, не ожидалось, что растения, несущие только короткие некодирующие участки последовательностей вирусной РНК, будут демонстрировать аналогичные уровни защиты. Исследователи полагали, что вирусная РНК, продуцируемая трансгенами, также может ингибировать репликацию вируса. [194] Обратный эксперимент, в котором короткие последовательности растительных генов вводились в вирусы, показал, что целевой ген подавляется у зараженного растения. [195] Это явление получило название «вирус-индуцированное молчание генов» (VIGS). [175] и совокупность таких явлений получила общее название посттранскрипционное молчание генов. [196]
После этих первоначальных наблюдений на растениях лаборатории начали искать это явление у других организмов. [197] [198] Первый случай подавления РНК у животных был задокументирован в 1996 году, когда Гуо и Кемфуес заметили, что введение смысловой и антисмысловой РНК в мРНК par-1 у Caenorhabditis elegans вызывало деградацию сообщения par-1. [199] Считалось, что эта деградация была вызвана одноцепочечной РНК (оцРНК), но два года спустя, в 1998 году, Файер и Мелло обнаружили, что эта способность подавлять экспрессию гена par-1 на самом деле запускалась двухцепочечной РНК (дцРНК). ). [199] В статье Крэйга Мелло и Эндрю Файра , опубликованной в журнале Nature в 1998 году , сообщалось о мощном эффекте подавления генов после инъекции двухцепочечной РНК в C. elegans . [200] Исследуя регуляцию производства мышечного белка, они заметили, что ни инъекции мРНК, ни антисмысловой РНК не оказали влияния на производство белка, но двухцепочечная РНК успешно подавляла целевой ген. В результате этой работы они придумали термин RNAi . Это открытие стало первой идентификацией возбудителя этого явления. Файер и Мелло были удостоены Нобелевской премии по физиологии и медицине 2006 года . [6] [201]
РНКи-терапия [ править ]
Сразу после новаторского открытия Файера и Мелло Эльбашир и др. обнаружили, что с помощью синтетически созданной малой интерферирующей РНК (миРНК) можно нацелиться на подавление определенных последовательностей в гене, а не на подавление всего гена. [202] Всего год спустя Маккаффри и его коллеги продемонстрировали, что это специфичное для последовательности молчание имеет терапевтическое применение, воздействуя на последовательность вируса гепатита С у трансгенных мышей. [203] С тех пор множество исследователей пытались расширить терапевтическое применение РНКи, в частности, стремясь воздействовать на гены, вызывающие различные типы рака . [204] [205] К 2006 году первые применения, прошедшие клинические испытания, были связаны с лечением дегенерации желтого пятна и респираторно-синцитиального вируса . [206] Четыре года спустя было начато первое клиническое испытание I фазы на людях с использованием системы доставки наночастиц для воздействия на солидные опухоли . [207]
FDA одобрило первый препарат на основе миРНК ( патисиран ) в 2018 году. Гивосиран и лумасиран позже получили одобрение FDA для лечения AHP и PH1 в 2019 и 2020 годах соответственно. [113] Инклисиран получил одобрение EMA в 2020 году для лечения высокого уровня холестерина и в настоящее время находится на рассмотрении FDA. [208]
См. также [ править ]
Ссылки [ править ]
- ^ Саураб С., Видьярти А.С., Прасад Д. (март 2014 г.). «РНК-интерференция: от концепции к реальности в улучшении урожая» . Планта . 239 (3): 543–64. Бибкод : 2014Plant.239..543S . дои : 10.1007/s00425-013-2019-5 . ПМИД 24402564 .
- ^ Вайс Б., Давидкова Г., Чжоу Л.В. (март 1999 г.). «Генная терапия антисмысловыми РНК для изучения и модуляции биологических процессов» . Клеточные и молекулярные науки о жизни . 55 (3): 334–58. дои : 10.1007/s000180050296 . ПМЦ 11146801 . ПМИД 10228554 . S2CID 9448271 .
- ^ Jump up to: Перейти обратно: а б Матранга С., Томари Ю., Шин С., Бартель Д.П., Замор П.Д. (ноябрь 2005 г.). «Расщепление цепи-пассажира облегчает сборку миРНК в Ago2-содержащие ферментные комплексы РНКи» . Клетка . 123 (4): 607–20. дои : 10.1016/j.cell.2005.08.044 . ПМИД 16271386 .
- ^ Jump up to: Перейти обратно: а б с д Купфершмидт К. (август 2013 г.). «Смертельная доза РНК» . Наука . 341 (6147): 732–3. Бибкод : 2013Sci...341..732K . дои : 10.1126/science.341.6147.732 . ПМИД 23950525 .
- ^ Макрэ И.Дж., Чжоу К., Ли Ф., Репик А., Брукс А.Н., Канде В.З. и др. (январь 2006 г.). «Структурная основа процессинга двухцепочечной РНК с помощью Dicer». Наука . 311 (5758): 195–8. Бибкод : 2006Sci...311..195M . дои : 10.1126/science.1121638 . ПМИД 16410517 . S2CID 23785494 .
- ^ Jump up to: Перейти обратно: а б с д Дэнехольт Б. «Дополнительная информация: РНК-интерференция» . Нобелевская премия по физиологии и медицине 2006 года . Архивировано из оригинала 20 января 2007 года . Проверено 25 января 2007 г.
- ^ Багасра О, Прилиман К.Р. (август 2004 г.). «РНК-интерференция: молекулярная иммунная система». Журнал молекулярной гистологии . 35 (6): 545–53. CiteSeerX 10.1.1.456.1701 . дои : 10.1007/s10735-004-2192-8 . ПМИД 15614608 . S2CID 2966105 .
- ^ Бернштейн Э., Коди А.А., Хаммонд С.М., Хэннон Г.Дж. (январь 2001 г.). «Роль бидентатной рибонуклеазы на этапе инициации РНК-интерференции». Природа . 409 (6818): 363–6. Бибкод : 2001Natur.409..363B . дои : 10.1038/35053110 . ПМИД 11201747 . S2CID 4371481 .

- ^ Сиоми Х, Сиоми MC (январь 2009 г.). «На пути к чтению кода РНК-интерференции». Природа . 457 (7228): 396–404. Бибкод : 2009Natur.457..396S . дои : 10.1038/nature07754 . ПМИД 19158785 . S2CID 205215974 .
Замор П.Д., Тушл Т., Шарп П.А., Бартель Д.П. (март 2000 г.). «РНКи: двухцепочечная РНК направляет АТФ-зависимое расщепление мРНК с интервалами от 21 до 23 нуклеотидов» . Клетка . 101 (1): 25–33. дои : 10.1016/S0092-8674(00)80620-0 . ПМИД 10778853 .
Вермюлен А., Белен Л., Рейнольдс А., Вольфсон А., Маршалл В.С., Карпилов Дж. и др. (май 2005 г.). «Вклад структуры дцРНК в специфичность и эффективность Dicer» . РНК . 11 (5): 674–82. дои : 10.1261/rna.7272305 . ПМК 1370754 . ПМИД 15811921 .
Кастанотто Д., Росси Дж.Дж. (январь 2009 г.). «Перспективы и подводные камни терапии, основанной на РНК-интерференции» . Природа . 457 (7228): 426–33. Бибкод : 2009Natur.457..426C . дои : 10.1038/nature07758 . ПМК 2702667 . ПМИД 19158789 . - ^ Jump up to: Перейти обратно: а б Цю С., Адема С.М., Лейн Т. (2005). «Вычислительное исследование нецелевых эффектов РНК-интерференции» . Исследования нуклеиновых кислот . 33 (6): 1834–47. дои : 10.1093/nar/gki324 . ПМЦ 1072799 . ПМИД 15800213 .
- ^ Jump up to: Перейти обратно: а б Наканиши К. (сентябрь 2016 г.). «Анатомия RISC: как малые РНК и шапероны активируют белки Argonaute?» . Междисциплинарные обзоры Wiley: РНК . 7 (5): 637–60. дои : 10.1002/wrna.1356 . ПМК 5084781 . ПМИД 27184117 .
- ^ Лян С., Ван Ю., Мурота Ю., Лю Х., Смит Д., Сиоми М.С. и др. (сентябрь 2015 г.). «TAF11 собирает загрузочный комплекс RISC для повышения эффективности RNAi» . Молекулярная клетка . 59 (5): 807–18. doi : 10.1016/j.molcel.2015.07.006 . ПМК 4560963 . ПМИД 26257286 .
- ^ Алквист П. (май 2002 г.). «РНК-зависимые РНК-полимеразы, вирусы и подавление РНК». Наука . 296 (5571): 1270–3. Бибкод : 2002Sci...296.1270A . дои : 10.1126/science.1069132 . ПМИД 12016304 . S2CID 42526536 .
- ^ Робертс ТК (2015). «Машина микроРНК». МикроРНК: Фундаментальная наука . Достижения экспериментальной медицины и биологии. Том. 887. стр. 15–30. дои : 10.1007/978-3-319-22380-3_2 . ISBN 978-3-319-22379-7 . ПМИД 26662984 .
- ^ Jump up to: Перейти обратно: а б с д Паркер Дж., Эккерт Д., Басс Б. (2006). «RDE-4 преимущественно связывает длинную дсРНК, и ее димеризация необходима для расщепления дсРНК до миРНК» . РНК . 12 (5): 807–18. дои : 10.1261/rna.2338706 . ПМК 1440910 . ПМИД 16603715 .
- ^ Jump up to: Перейти обратно: а б Баулкомб, округ Колумбия (январь 2007 г.). «Молекулярная биология. Усиленное замалчивание». Наука . 315 (5809): 199–200. дои : 10.1126/science.1138030 . ПМИД 17218517 . S2CID 46285020 .
- ^ Jump up to: Перейти обратно: а б Пак Дж, Файр А (январь 2007 г.). «Различные популяции первичных и вторичных эффекторов во время RNAi у C. elegans». Наука . 315 (5809): 241–4. Бибкод : 2007Sci...315..241P . дои : 10.1126/science.1132839 . ПМИД 17124291 . S2CID 46620298 .
- ^ Jump up to: Перейти обратно: а б Сиден Т., Штайнер Ф.А., Тийссен К.Л., Пластерк Р.Х. (январь 2007 г.). «Вторичные миРНК возникают в результате синтеза непраймированной РНК и образуют отдельный класс». Наука . 315 (5809): 244–7. Бибкод : 2007Sci...315..244S . дои : 10.1126/science.1136699 . ПМИД 17158288 . S2CID 9483460 .
- ^ Ван QL, Ли ZH (май 2007 г.). «Функции микроРНК у растений» . Границы бионауки . 12 : 3975–82. дои : 10.2741/2364 . ПМЦ 2851543 . ПМИД 17485351 . S2CID 23014413 .
Чжао Ю., Шривастава Д. (апрель 2007 г.). «Взгляд на функцию микроРНК, связанный с развитием». Тенденции биохимических наук . 32 (4): 189–97. дои : 10.1016/j.tibs.2007.02.006 . ПМИД 17350266 . - ^ Грегори Р.И., Чендримада Т.П., Шихаттар Р. (2006). «Биогенез микроРНК: выделение и характеристика микропроцессорного комплекса». Протоколы микроРНК . Методы молекулярной биологии. Том. 342. стр. 33–47. дои : 10.1385/1-59745-123-1:33 . ISBN 978-1-59745-123-9 . ПМИД 16957365 .
- ^ Пфеффер С., Заволан М., Грассер Ф.А., Чиен М., Руссо Дж.Дж., Джу Дж. и др. (апрель 2004 г.). «Идентификация микроРНК, кодируемых вирусом». Наука . 304 (5671): 734–6. Бибкод : 2004Sci...304..734P . дои : 10.1126/science.1096781 . ПМИД 15118162 . S2CID 25287167 .
- ^ Куреши А., Тхакур Н., Монга И., Тхакур А., Кумар М. (1 января 2014 г.). «VIRmiRNA: комплексный ресурс экспериментально подтвержденных вирусных микроРНК и их мишеней» . База данных . 2014 : бау103. дои : 10.1093/база данных/bau103 . ПМК 4224276 . ПМИД 25380780 .
- ^ Пиллаи Р.С., Бхаттачария С.Н., Филипович В. (2007). «Репрессия синтеза белка микроРНК: сколько механизмов?». Тенденции клеточной биологии . 17 (3): 118–26. дои : 10.1016/j.tcb.2006.12.007 . ПМИД 17197185 .
- ^ Окамура К., Ишизука А., Сиоми Х., Сиоми М. (2004). «Особая роль белков Argonaute в путях расщепления РНК, направленных на малые РНК» . Генс Дев . 18 (14): 1655–66. дои : 10.1101/gad.1210204 . ПМЦ 478188 . ПМИД 15231716 .
- ^ Ли Ю, Накахара К, Фам Дж, Ким К, Хе З, Сонтхаймер Э и др. (2004). «Различные роли Drosophila Dicer-1 и Dicer-2 в путях молчания siRNA/miRNA» . Клетка . 117 (1): 69–81. дои : 10.1016/S0092-8674(04)00261-2 . ПМИД 15066283 .
- ^ miRBase.org
- ^ Jump up to: Перейти обратно: а б Фридман Р.К., Фарх К.К., Бердж CB, Бартель Д.П. (2009). «Большинство мРНК млекопитающих являются консервативными мишенями микроРНК» . Геном Рез . 19 (1): 92–105. дои : 10.1101/гр.082701.108 . ПМЦ 2612969 . ПМИД 18955434 .
- ^ Лим Л.П., Лау Н.К., Гарретт-Энгеле П., Гримсон А., Шелтер Дж.М., Касл Дж. и др. (февраль 2005 г.). «Анализ микрочипов показывает, что некоторые микроРНК подавляют большое количество целевых мРНК». Природа . 433 (7027): 769–73. Бибкод : 2005Natur.433..769L . дои : 10.1038/nature03315 . ПМИД 15685193 . S2CID 4430576 .
- ^ Зельбах М., Шванхойссер Б., Тирфельдер Н., Фанг З., Ханин Р., Раевски Н. (сентябрь 2008 г.). «Широко распространенные изменения в синтезе белка, вызванные микроРНК». Природа . 455 (7209): 58–63. Бибкод : 2008Natur.455...58S . дои : 10.1038/nature07228 . ПМИД 18668040 . S2CID 4429008 .
- ^ Пэк Д., Виллен Дж., Шин С., Камарго Ф.Д., Гиги С.П., Бартель Д.П. (сентябрь 2008 г.). «Влияние микроРНК на выход белка» . Природа . 455 (7209): 64–71. Бибкод : 2008Natur.455...64B . дои : 10.1038/nature07242 . ПМК 2745094 . ПМИД 18668037 .
- ^ Палмеро Э.И., де Кампос С.Г., Кампос М., де Соуза Н.К., Геррейру И.Д., Карвалью А.Л. и др. (июль 2011 г.). «Механизмы и роль дерегуляции микроРНК в возникновении и прогрессировании рака» . Генетика и молекулярная биология . 34 (3): 363–70. дои : 10.1590/S1415-47572011000300001 . ПМК 3168173 . ПМИД 21931505 .
- ^ Бернштейн С., Бернштейн Х. (май 2015 г.). «Эпигенетическое снижение репарации ДНК при прогрессировании рака желудочно-кишечного тракта» . Всемирный журнал желудочно-кишечной онкологии . 7 (5): 30–46. дои : 10.4251/wjgo.v7.i5.30 . ПМЦ 4434036 . ПМИД 25987950 .
- ^ Маффиолетти Э., Тардито Д., Дженнарелли М., Боккио-Кьяветто Л. (2014). «Микрошпионы от мозга к периферии: новые данные исследований микроРНК при нервно-психических расстройствах» . Границы клеточной нейронауки . 8 : 75. дои : 10.3389/fncel.2014.00075 . ПМЦ 3949217 . ПМИД 24653674 .
- ^ Меллиос Н., Сур М. (2012). «Новая роль микроРНК при шизофрении и расстройствах аутистического спектра» . Границы в психиатрии . 3 : 39. doi : 10.3389/fpsyt.2012.00039 . ПМК 3336189 . ПМИД 22539927 .
- ^ Гиган М., Кэрнс MJ (август 2015 г.). «МикроРНК и посттранскрипционная дисрегуляция в психиатрии» . Биологическая психиатрия . 78 (4): 231–9. doi : 10.1016/j.biopsych.2014.12.009 . hdl : 1959.13/1335073 . ПМИД 25636176 .
- ^ Лю Кью, Рэнд Т.А., Калидас С., Ду Ф, Ким Х.Э., Смит Д.П. и др. (сентябрь 2003 г.). «R2D2, мост между инициирующим и эффекторным этапами пути РНКи дрозофилы». Наука . 301 (5641): 1921–5. Бибкод : 2003Sci...301.1921L . дои : 10.1126/science.1088710 . ПМИД 14512631 . S2CID 41436233 .
- ^ Грегори Р.И., Чендримада Т.П., Куч Н., Шихаттар Р. (ноябрь 2005 г.). «Человеческий RISC сочетает биогенез микроРНК и посттранскрипционное молчание генов» . Клетка . 123 (4): 631–40. дои : 10.1016/j.cell.2005.10.022 . ПМИД 16271387 .
- ^ Jump up to: Перейти обратно: а б Лодиш Х., Берк А., Мацудайра П., Кайзер К.А., Кригер М., Скотт М.П. и др. (2004). Молекулярно-клеточная биология (5-е изд.). WH Фриман: Нью-Йорк, штат Нью-Йорк. ISBN 978-0-7167-4366-8 .
- ^ Лейшнер П.Дж., Амерес С.Л., Куенг С., Мартинес Дж. (март 2006 г.). «Расщепление пассажирской цепи siRNA во время сборки RISC в клетках человека» . Отчеты ЭМБО . 7 (3): 314–20. дои : 10.1038/sj.embor.7400637 . ПМЦ 1456892 . ПМИД 16439995 .
- ^ Jump up to: Перейти обратно: а б Хейли Б., полиция Замора (июль 2004 г.). «Кинетический анализ ферментного комплекса РНКи». Структурная и молекулярная биология природы . 11 (7): 599–606. дои : 10.1038/nsmb780 . ПМИД 15170178 . S2CID 12400060 .
- ^ Шварц Д.С., Хутвагнер Г., Ду Т., Сюй З., Аронин Н., Замор П.Д. (октябрь 2003 г.). «Асимметрия сборки ферментного комплекса РНКи» . Клетка . 115 (2): 199–208. дои : 10.1016/S0092-8674(03)00759-1 . ПМИД 14567917 .
- ^ Преалл Дж.Б., Хе З., Горра Дж.М., Сонтхаймер Э.Дж. (март 2006 г.). «Выбор коротких интерферирующих цепей РНК не зависит от полярности процессинга дцРНК во время РНКи у дрозофилы» . Современная биология . 16 (5): 530–5. Бибкод : 2006CBio...16..530P . дои : 10.1016/j.cub.2006.01.061 . ПМИД 16527750 .
- ^ Томари Ю., Матранга С., Хейли Б., Мартинес Н., Замор П.Д. (ноябрь 2004 г.). «Белковый сенсор асимметрии миРНК». Наука . 306 (5700): 1377–80. Бибкод : 2004Sci...306.1377T . дои : 10.1126/science.1102755 . ПМИД 15550672 . S2CID 31558409 .
- ^ Ма Дж.Б., Юань Ю.Р., Мейстер Г., Пей Ю., Тушл Т., Патель DJ (март 2005 г.). «Структурная основа специфического распознавания 5'-конца направляющей РНК белком Piwi A. fulgidus» . Природа . 434 (7033): 666–70. Бибкод : 2005Natur.434..666M . дои : 10.1038/nature03514 . ПМЦ 4694588 . ПМИД 15800629 .
- ^ Сен Г., Верман Т., Блау Х. (2005). «Трансляция мРНК не является обязательным условием для расщепления мРНК, опосредованного малой интерферирующей РНК». Дифференциация . 73 (6): 287–93. дои : 10.1111/j.1432-0436.2005.00029.x . ПМИД 16138829 . S2CID 41117614 .
- ^ Гу С, Росси Дж (2005). «Отключение РНКи от активной трансляции в клетках млекопитающих» . РНК . 11 (1): 38–44. дои : 10.1261/rna.7158605 . ПМК 1370689 . ПМИД 15574516 .
- ^ Сен Г, Блау Х (2005). «Argonaute 2/RISC находится в местах распада мРНК млекопитающих, известных как цитоплазматические тельца». Nat Cell Biol . 7 (6): 633–6. дои : 10.1038/ncb1265 . ПМИД 15908945 . S2CID 6085169 .
- ^ Лиан С., Джекимив А., Эйстатиой Т., Хамель Дж., Фрицлер М., Чан Э. (2006). «Тела GW, микроРНК и клеточный цикл» . Клеточный цикл . 5 (3): 242–5. дои : 10.4161/cc.5.3.2410 . ПМИД 16418578 .
- ^ Джекимив А., Лиан С., Эйстатиой Т., Ли С., Сато М., Хамель Дж. и др. (2005). «Нарушение P-телец ухудшает интерференцию РНК млекопитающих». Nat Cell Biol . 7 (12): 1267–74. дои : 10.1038/ncb1334 . ПМИД 16284622 . S2CID 36630239 .
- ^ Хаммонд С., Бернштейн Э., Бич Д., Хэннон Дж. (2000). «РНК-направленная нуклеаза опосредует посттранскрипционное молчание генов в клетках дрозофилы». Природа . 404 (6775): 293–6. Бибкод : 2000Natur.404..293H . дои : 10.1038/35005107 . ПМИД 10749213 . S2CID 9091863 .

- ^ Холмквист GP, Эшли Т (2006). «Организация хромосом и модификация хроматина: влияние на функцию и эволюцию генома». Цитогенетические и геномные исследования . 114 (2): 96–125. дои : 10.1159/000093326 . ПМИД 16825762 . S2CID 29910065 .
- ^ Вердель А., Цзя С., Гербер С., Сугияма Т., Гиги С., Гревал С.И. и др. (январь 2004 г.). «РНКи-опосредованное нацеливание на гетерохроматин комплексом RITS» . Наука . 303 (5658): 672–6. Бибкод : 2004Sci...303..672V . дои : 10.1126/science.1093686 . ПМК 3244756 . ПМИД 14704433 .
- ^ Ирвин Д.В., Заратиеги М., Толия Н.Х., Гото Д.Б., Читвуд Д.Х., Вон М.В. и др. (август 2006 г.). «Нарезка аргонавта необходима для гетерохроматического подавления и распространения». Наука . 313 (5790): 1134–7. Бибкод : 2006Sci...313.1134I . дои : 10.1126/science.1128813 . ПМИД 16931764 . S2CID 42997104 .
- ^ Вольпе Т.А., Киднер С., Холл И.М., Тенг Г., Гревал С.И., Мартиенссен Р.А. (сентябрь 2002 г.). «Регуляция гетерохроматического молчания и метилирования гистона H3 лизина-9 с помощью РНКи» . Наука . 297 (5588): 1833–7. Бибкод : 2002Sci...297.1833V . дои : 10.1126/science.1074973 . ПМИД 12193640 . S2CID 2613813 .
- ^ Вольпе Т., Шрамке В., Гамильтон Г.Л., Уайт С.А., Тенг Г., Мартиенсен Р.А. и др. (2003). «РНК-интерференция необходима для нормальной функции центромеры у делящихся дрожжей». Хромосомные исследования . 11 (2): 137–46. дои : 10.1023/А:1022815931524 . ПМИД 12733640 . S2CID 23813417 .
- ^ Ли Л.С., Окино С.Т., Чжао Х., Пукот Д., Плейс РФ, Ураками С. и др. (ноябрь 2006 г.). «Маленькие дцРНК индуцируют активацию транскрипции в клетках человека» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17337–42. Бибкод : 2006PNAS..10317337L . дои : 10.1073/pnas.0607015103 . ПМК 1859931 . ПМИД 17085592 .
- ^ Нома К., Сугияма Т., Кэм Х., Вердель А., Зофалл М., Цзя С. и др. (ноябрь 2004 г.). «RITS действует в цис-цис-системе, способствуя опосредованному РНК-интерференцией транскрипционному и посттранскрипционному молчанию» . Природная генетика . 36 (11): 1174–80. дои : 10.1038/ng1452 . ПМИД 15475954 .
- ^ Сугияма Т., Кэм Х., Вердель А., Моазед Д., Гревал С.И. (январь 2005 г.). «РНК-зависимая РНК-полимераза является важным компонентом самоподдерживающейся петли, соединяющей сборку гетерохроматина с производством миРНК» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (1): 152–7. Бибкод : 2005PNAS..102..152S . дои : 10.1073/pnas.0407641102 . ПМК 544066 . ПМИД 15615848 .
- ^ Ван Ф., Кояма Н., Нисида Х., Харагути Т., Рейт В., Цукамото Т. (июнь 2006 г.). «Сборка и поддержание гетерохроматина, инициируемая повторами трансгена, не зависит от пути РНК-интерференции в клетках млекопитающих» . Молекулярная и клеточная биология . 26 (11): 4028–40. дои : 10.1128/MCB.02189-05 . ПМК 1489094 . ПМИД 16705157 .
- ^ Бас БЛ (2002). «Редактирование РНК аденозиндезаминазами, действующими на РНК» . Ежегодный обзор биохимии . 71 : 817–46. doi : 10.1146/annurev.biochem.71.110601.135501 . ПМК 1823043 . ПМИД 12045112 .
- ^ Бас БЛ (апрель 2000 г.). «Двухцепочечная РНК как матрица для подавления генов» . Клетка . 101 (3): 235–8. дои : 10.1016/S0092-8674(02)71133-1 . ПМИД 10847677 .
- ^ Лучано DJ, Мирски Х, Вендетти Нью-Джерси, Маас С (август 2004 г.). «Редактирование РНК предшественника микроРНК» . РНК . 10 (8): 1174–7. дои : 10.1261/rna.7350304 . ПМК 1370607 . ПМИД 15272117 .
- ^ Jump up to: Перейти обратно: а б Ян В., Чендримада Т.П., Ван К., Хигучи М., Сибург П.Х., Шихаттар Р. и др. (январь 2006 г.). «Модуляция процессинга и экспрессии микроРНК посредством редактирования РНК деаминазами ADAR» . Структурная и молекулярная биология природы . 13 (1): 13–21. дои : 10.1038/nsmb1041 . ПМЦ 2950615 . ПМИД 16369484 .
- ^ Ян В., Ван К., Хауэлл К.Л., Ли Дж.Т., Чо Д.С., Мюррей Дж.М. и др. (февраль 2005 г.). «РНК-дезаминаза ADAR1 ограничивает эффективность коротких интерферирующих РНК в клетках млекопитающих» . Журнал биологической химии . 280 (5): 3946–53. дои : 10.1074/jbc.M407876200 . ПМЦ 2947832 . ПМИД 15556947 .
- ^ Нисикура К. (декабрь 2006 г.). «Редактор встречает глушитель: перекрестные помехи между редактированием РНК и вмешательством РНК» . Nature Reviews Молекулярно-клеточная биология . 7 (12): 919–31. дои : 10.1038/nrm2061 . ПМЦ 2953463 . ПМИД 17139332 .
- ^ Jump up to: Перейти обратно: а б с Саумет А, Леселье CH (2006). «Антивирусное подавление РНК: мы похожи на растения?» . Ретровирусология . 3 (1): 3. дои : 10.1186/1742-4690-3-3 . ПМЦ 1363733 . ПМИД 16409629 .
- ^ Джонс Л., Рэтклифф Ф., Баулкомб, округ Колумбия (май 2001 г.). «РНК-направленное подавление транскрипционных генов у растений может наследоваться независимо от РНК-триггера и для поддержания требует Met1» . Современная биология . 11 (10): 747–57. Бибкод : 2001CBio...11..747J . дои : 10.1016/S0960-9822(01)00226-3 . ПМИД 11378384 . S2CID 16789197 .
- ^ Хамфрис Д.Т., Вестман Б.Дж., Мартин Д.И., Прейсс Т. (ноябрь 2005 г.). «МикроРНК контролируют инициацию трансляции, ингибируя фактор инициации эукариот 4E/cap и функцию поли(А) хвоста» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (47): 16961–6. Бибкод : 2005PNAS..10216961H . дои : 10.1073/pnas.0506482102 . ПМК 1287990 . ПМИД 16287976 .
- ^ ДаРоча В.Д., Оцу К., Тейшейра С.М., Донельсон Дж.Э. (февраль 2004 г.). «Тесты цитоплазматической РНК-интерференции (РНКи) и конструирования индуцируемой тетрациклином системы промотора Т7 у Trypanosoma cruzi». Молекулярная и биохимическая паразитология . 133 (2): 175–86. дои : 10.1016/j.molbiopara.2003.10.005 . ПМИД 14698430 .
- ^ Робинсон К.А., Беверли С.М. (май 2003 г.). «Повышение эффективности трансфекции и тестирование подходов РНК-интерференции (РНКи) у простейших паразитов Leishmania». Молекулярная и биохимическая паразитология . 128 (2): 217–28. дои : 10.1016/S0166-6851(03)00079-3 . ПМИД 12742588 .
- ^ Аравинд Л., Ватанабэ Х., Липман Д.Д., Кунин Е.В. (октябрь 2000 г.). «Линейно-специфическая потеря и дивергенция функционально связанных генов у эукариот» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (21): 11319–24. Бибкод : 2000PNAS...9711319A . дои : 10.1073/pnas.200346997 . ПМК 17198 . ПМИД 11016957 .
- ^ Дринненберг И.А., Вайнберг Д.Е., Се К.Т., Мауэр Дж.П., Вулф К.Х., Финк Г.Р. и др. (октябрь 2009 г.). «РНКи в почкующихся дрожжах» . Наука . 326 (5952): 544–550. Бибкод : 2009Sci...326..544D . дои : 10.1126/science.1176945 . ПМЦ 3786161 . ПМИД 19745116 .
- ^ Накаяшики Х., Кадотани Н., Маяма С. (июль 2006 г.). «Эволюция и диверсификация белков, подавляющих РНК, у грибов» (PDF) . Журнал молекулярной эволюции . 63 (1): 127–35. Бибкод : 2006JMolE..63..127N . дои : 10.1007/s00239-005-0257-2 . ПМИД 16786437 . S2CID 22639035 . Архивировано из оригинала (PDF) 6 августа 2020 года . Проверено 4 декабря 2019 г.
- ^ Морита Т., Мочизуки Ю., Айба Х. (март 2006 г.). «Трансляционной репрессии достаточно для подавления генов малыми бактериальными некодирующими РНК при отсутствии разрушения мРНК» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (13): 4858–63. Бибкод : 2006PNAS..103.4858M . дои : 10.1073/pnas.0509638103 . ПМЦ 1458760 . ПМИД 16549791 .
- ^ Макарова К.С., Гришин Н.В., Шабалина С.А., Вольф Ю.И., Кунин Е.В. (март 2006 г.). «Предполагаемая иммунная система прокариот, основанная на РНК-интерференции: вычислительный анализ предсказанного ферментативного механизма, функциональные аналогии с эукариотическими РНКи и гипотетические механизмы действия» . Биология Директ . 1 :7. дои : 10.1186/1745-6150-1-7 . ПМК 1462988 . ПМИД 16545108 .
- ^ Страм Ю., Кузцова Л. (июнь 2006 г.). «Ингибирование вирусов интерференцией РНК» . Гены вирусов . 32 (3): 299–306. дои : 10.1007/s11262-005-6914-0 . ПМЦ 7088519 . ПМИД 16732482 .
- ^ Блевинс Т., Раджешваран Р., Шивапрасад П.В., Бекназарианц Д., Си-Аммур А., Парк Х.С. и др. (2006). «Четыре растительных Dicer опосредуют биогенез вирусных малых РНК и подавление ДНК-вируса, индуцированное» . Исследования нуклеиновых кислот . 34 (21): 6233–46. дои : 10.1093/nar/gkl886 . ПМК 1669714 . ПМИД 17090584 .
- ^ Палауки Х.К., Эльмаян Т., Поллиен Дж.М., Вошере Х. (август 1997 г.). «Системное приобретенное молчание: специфичное для трансгенов посттранскрипционное молчание передается путем прививки от молчащих подвоев к не молчащим привоям» . Журнал ЭМБО . 16 (15): 4738–45. дои : 10.1093/emboj/16.15.4738 . ПМК 1170100 . ПМИД 9303318 .
- ^ Вуанне О (август 2001 г.). «Замалчивание РНК как иммунная система растений против вирусов». Тенденции в генетике . 17 (8): 449–59. дои : 10.1016/S0168-9525(01)02367-8 . ПМИД 11485817 .
- ^ Люси А.П., Го Х.С., Ли В.С., Дин С.В. (апрель 2000 г.). «Подавление посттранскрипционного молчания генов растительным вирусным белком, локализованным в ядре» . Журнал ЭМБО . 19 (7): 1672–80. дои : 10.1093/emboj/19.7.1672 . ПМК 310235 . ПМИД 10747034 .
- ^ Мерай З., Кереньи З., Кертес С., Магна М., Лакатош Л., Силхави Д. (июнь 2006 г.). «Связывание двухцепочечной РНК может быть общей вирусной стратегией растительной РНК для подавления молчания РНК» . Журнал вирусологии . 80 (12): 5747–56. дои : 10.1128/JVI.01963-05 . ПМЦ 1472586 . ПМИД 16731914 .
- ^ Катияр-Агарвал С., Морган Р., Дальбек Д., Борсани О., Виллегас А., Чжу Дж.К. и др. (ноябрь 2006 г.). «Индуцируемая патогеном эндогенная миРНК в иммунитете растений» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (47): 18002–7. Бибкод : 2006PNAS..10318002K . дои : 10.1073/pnas.0608258103 . ПМК 1693862 . ПМИД 17071740 .
- ^ Фриц Дж. Х., Жирарден С. Е., Филпотт DJ (июнь 2006 г.). «Врожденная иммунная защита посредством вмешательства РНК». СТКЭ науки . 2006 (339): пе27. дои : 10.1126/stke.3392006pe27 . ПМИД 16772641 . S2CID 33972766 .
- ^ Замбон Р.А., Вахариа В.Н., Ву Л.П. (май 2006 г.). «РНКи представляет собой противовирусный иммунный ответ против вируса дцРНК у Drosophila melanogaster» . Клеточная микробиология . 8 (5): 880–9. дои : 10.1111/j.1462-5822.2006.00688.x . ПМИД 16611236 . S2CID 32439482 .
- ^ Ван XH, Алияри Р., Ли WX, Ли Х.В., Ким К., Картью Р. и др. (апрель 2006 г.). «РНК-интерференция направляет врожденный иммунитет против вирусов у взрослой дрозофилы» . Наука . 312 (5772): 452–4. Бибкод : 2006Sci...312..452W . дои : 10.1126/science.1125694 . ПМК 1509097 . ПМИД 16556799 .
- ^ Лу Р., Мадуро М., Ли Ф., Ли Х.В., Бройтман-Мадуро Г., Ли В.С. и др. (август 2005 г.). «Репликация вируса животных и противовирусное подавление, опосредованное РНКи, у Caenorhabditis elegans» . Природа . 436 (7053): 1040–1043. Бибкод : 2005Natur.436.1040L . дои : 10.1038/nature03870 . ПМЦ 1388260 . ПМИД 16107851 .
- ^ Уилкинс С., Дишонг Р., Мур С.К., Уитт М.А., Чоу М., Мачака К. (август 2005 г.). «РНК-интерференция является механизмом противовирусной защиты у Caenorhabditis elegans». Природа . 436 (7053): 1044–7. Бибкод : 2005Natur.436.1044W . дои : 10.1038/nature03957 . ПМИД 16107852 . S2CID 4431035 .
- ^ Берхаут Б., Хааснут Дж. (май 2006 г.). «Взаимодействие между вирусной инфекцией и механизмом интерференции клеточной РНК» . Письма ФЭБС . 580 (12): 2896–902. Бибкод : 2006FEBSL.580.2896B . дои : 10.1016/j.febslet.2006.02.070 . ПМЦ 7094296 . ПМИД 16563388 .
- ^ Шютц С., Сарнов П. (январь 2006 г.). «Взаимодействие вирусов с путем РНК-интерференции млекопитающих» . Вирусология . 344 (1): 151–7. дои : 10.1016/j.virol.2005.09.034 . ПМИД 16364746 .
- ^ Каллен БР (июнь 2006 г.). «Участвует ли РНК-интерференция во внутреннем противовирусном иммунитете у млекопитающих?». Природная иммунология . 7 (6): 563–7. дои : 10.1038/ni1352 . ПМИД 16715068 . S2CID 23467688 .
- ^ Майяр П.В., Чаудо С., Марше А., Ли Ю., Джей Ф., Дин С.В. и др. (октябрь 2013 г.). «Противовирусная РНК-интерференция в клетках млекопитающих» . Наука . 342 (6155): 235–8. Бибкод : 2013Sci...342..235M . дои : 10.1126/science.1241930 . ПМЦ 3853215 . ПМИД 24115438 .
- ^ Ли Ю, Лу Дж, Хан Ю, Фань Х, Дин СВ (октябрь 2013 г.). «РНК-интерференция действует как механизм противовирусного иммунитета у млекопитающих» . Наука . 342 (6155): 231–4. Бибкод : 2013Sci...342..231L . дои : 10.1126/science.1241911 . ПМЦ 3875315 . ПМИД 24115437 .
- ^ Ли Х.В., Дин С.В. (октябрь 2005 г.). «Противовирусное молчание у животных» . Письма ФЭБС . 579 (26): 5965–73. Бибкод : 2005FEBSL.579.5965L . дои : 10.1016/j.febslet.2005.08.034 . ПМК 1350842 . ПМИД 16154568 .
- ^ Кэррингтон Дж. К., Амброс В. (июль 2003 г.). «Роль микроРНК в развитии растений и животных» . Наука . 301 (5631): 336–8. Бибкод : 2003Sci...301..336C . дои : 10.1126/science.1085242 . ПМИД 12869753 . S2CID 43395657 .
- ^ Ли Р.К., Фейнбаум Р.Л., Амброс В. (декабрь 1993 г.). «Гетерохронный ген lin-4 C. elegans кодирует малые РНК с антисмысловой комплементарностью к lin-14» . Клетка . 75 (5): 843–54. дои : 10.1016/0092-8674(93)90529-Y . ПМИД 8252621 .
- ^ Палатник Дж. Ф., Аллен Э., Ву X, Шоммер С., Шваб Р., Кэррингтон Дж. К. и др. (сентябрь 2003 г.). «Контроль морфогенеза листьев с помощью микроРНК» . Природа . 425 (6955): 257–63. Бибкод : 2003Natur.425..257P . дои : 10.1038/nature01958 . ПМИД 12931144 . S2CID 992057 .
- ^ Чжан Б., Пан Х, Кобб ГП, Андерсон Т.А. (январь 2006 г.). «Растительная микроРНК: маленькая регуляторная молекула с большим влиянием» . Биология развития . 289 (1): 3–16. дои : 10.1016/j.ydbio.2005.10.036 . ПМИД 16325172 .
- ^ Джонс-Роудс М.В., Бартель Д.П., Бартель Б. (2006). «МикроРНК и их регуляторная роль в растениях». Ежегодный обзор биологии растений . 57 : 19–53. doi : 10.1146/annurev.arplant.57.032905.105218 . ПМИД 16669754 . S2CID 13010154 .
- ^ Чжан Б., Пан Х, Кобб ГП, Андерсон Т.А. (февраль 2007 г.). «микроРНК как онкогены и супрессоры опухолей» . Биология развития . 302 (1): 1–12. дои : 10.1016/j.ydbio.2006.08.028 . ПМИД 16989803 .
- ^ Черутти Х., Касас-Моллано Х.А. (август 2006 г.). «О происхождении и функциях РНК-опосредованного молчания: от протистов к человеку» . Современная генетика . 50 (2): 81–99. дои : 10.1007/s00294-006-0078-x . ПМК 2583075 . ПМИД 16691418 .
- ^ Анантараман В., Кунин Е.В., Аравинд Л. (апрель 2002 г.). «Сравнительная геномика и эволюция белков, участвующих в метаболизме РНК» . Исследования нуклеиновых кислот . 30 (7): 1427–64. дои : 10.1093/нар/30.7.1427 . ПМК 101826 . ПМИД 11917006 .
- ^ Вурхув П.М., Агами Р. (январь 2003 г.). «Нокдаун встает». Тенденции в биотехнологии . 21 (1): 2–4. дои : 10.1016/S0167-7799(02)00002-1 . ПМИД 12480342 .
- ^ Мункачи Г., Штупински З., Херман П., Бан Б., Пенцвалло З., Сарвас Н. и др. (сентябрь 2016 г.). «Проверка эффективности подавления РНКи с использованием данных генного массива показывает 18,5% частоты неудач в 429 независимых экспериментах» . Молекулярная терапия: нуклеиновые кислоты . 5 (9): е366. дои : 10.1038/mtna.2016.66 . ПМК 5056990 . ПМИД 27673562 .
- ^ Наито Ю, Ямада Т, Мацумия Т, Уи-Тей К, Сайго К, Моришита С (июль 2005 г.). «dsCheck: высокочувствительное программное обеспечение для поиска нецелевых РНК-интерференции, опосредованной двухцепочечной РНК» . Исследования нуклеиновых кислот . 33 (проблема с веб-сервером): W589–91. дои : 10.1093/nar/gki419 . ПМК 1160180 . ПМИД 15980542 .
- ^ Хеншель А., Бухгольц Ф., Хаберманн Б. (июль 2004 г.). «DEQOR: веб-инструмент для разработки и контроля качества миРНК» . Исследования нуклеиновых кислот . 32 (проблема с веб-сервером): W113–20. дои : 10.1093/nar/gkh408 . ПМЦ 441546 . ПМИД 15215362 .
- ^ Наито И., Ямада Т., Уи-Тей К., Моришита С., Сайго К. (июль 2004 г.). «siDirect: высокоэффективное программное обеспечение для проектирования целевых миРНК для интерференции РНК млекопитающих» . Исследования нуклеиновых кислот . 32 (проблема с веб-сервером): W124–9. дои : 10.1093/nar/gkh442 . ПМК 441580 . ПМИД 15215364 .
- ^ Наито Й., Уи-Тей К., Нишикава Т., Такэбе Й., Сайго К. (июль 2006 г.). «siVirus: сетевое программное обеспечение для разработки антивирусных миРНК для сильно расходящихся вирусных последовательностей» . Исследования нуклеиновых кислот . 34 (проблема с веб-сервером): W448–50. дои : 10.1093/нар/gkl214 . ПМЦ 1538817 . ПМИД 16845046 .
- ^ Рейнольдс А., Андерсон Э.М., Вермюлен А., Федоров Ю., Робинсон К., Лик Д. и др. (июнь 2006 г.). «Индукция интерферонового ответа с помощью миРНК зависит от типа клеток и длины дуплекса» . РНК . 12 (6): 988–93. дои : 10.1261/rna.2340906 . ПМЦ 1464853 . ПМИД 16611941 .
- ^ Штейн П., Цзэн Ф., Пан Х., Шульц Р.М. (октябрь 2005 г.). «Отсутствие неспецифических эффектов РНК-интерференции, запускаемой длинной двухцепочечной РНК в ооцитах мыши» . Биология развития . 286 (2): 464–71. дои : 10.1016/j.ydbio.2005.08.015 . ПМИД 16154556 .
- ^ Бруммелькамп Т.Р., Бернардс Р. , Агами Р. (апрель 2002 г.). «Система стабильной экспрессии коротких интерферирующих РНК в клетках млекопитающих». Наука . 296 (5567): 550–3. Бибкод : 2002Sci...296..550B . дои : 10.1126/science.1068999 . hdl : 1874/15573 . ПМИД 11910072 . S2CID 18460980 .
- ^ Тискорния Г., Тергаонкар В., Галими Ф., Верма И.М. (май 2004 г.). «Интерференция РНК, индуцируемая рекомбиназой CRE, опосредованная лентивирусными векторами» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (19): 7347–51. Бибкод : 2004PNAS..101.7347T . дои : 10.1073/pnas.0402107101 . ПМК 409921 . ПМИД 15123829 .
- ^ Вентура А., Мейснер А., Диллон С.П., Макманус М., Шарп П.А., Ван Парийс Л. и др. (июль 2004 г.). «Условная РНК-интерференция, регулируемая Cre-lox, со стороны трансгенов» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (28): 10380–5. Бибкод : 2004PNAS..10110380V . дои : 10.1073/pnas.0403954101 . ПМЦ 478580 . ПМИД 15240889 .
- ^ Jump up to: Перейти обратно: а б Адамс Д., Гонсалес-Дуарте А., О'Риордан В.Д., Ян CC, Уеда М., Кристен А.В. и др. (5 июля 2018 г.). «Патисиран, терапевтическое средство RNAi для лечения наследственного транстиретинового амилоидоза» . Медицинский журнал Новой Англии . 379 (1): 11–21. дои : 10.1056/NEJMoa1716153 . hdl : 2445/138257 . ПМИД 29972753 . S2CID 205102839 .
- ^ Балвани М., Сард Э., Вентура П., Пейро П.А., Рис Д.С., Стельзель У. и др. (11 июня 2020 г.). «Фаза 3 исследования терапевтического препарата Гивосиран с РНКи при острой перемежающейся порфирии» . Медицинский журнал Новой Англии . 382 (24): 2289–2301. дои : 10.1056/NEJMoa1913147 . ISSN 0028-4793 . ПМИД 32521132 .
- ^ Гаррелфс С.Ф., Фришберг Ю., Халтон С.А., Корен М.Дж., О'Риордан В.Д., Кочат П. и др. (1 апреля 2021 г.). «Лумасиран, РНКи-терапевтическое средство для лечения первичной гипероксалурии типа 1» . Медицинский журнал Новой Англии . 384 (13): 1216–1226. дои : 10.1056/NEJMoa2021712 . ISSN 1533-4406 . ПМИД 33789010 .
- ^ Адамс Д., Турнев И.Л., Тейлор М.С., Коэльо Т., Планте-Борденёв В., Берк Дж.Л. и др. (март 2023 г.). «Эффективность и безопасность вутрисирана у пациентов с наследственным транстиретин-опосредованным амилоидозом с полиневропатией: рандомизированное клиническое исследование» . Амилоид . 30 (1): 18–26. дои : 10.1080/13506129.2022.2091985 . hdl : 1959.4/unsworks_80922 . ISSN 1744-2818 . PMID 35875890 .
- ^ «ЭТИКЕТКА:ONPATTRO- патисиран для инъекций, липидный комплекс» . Дейли Мед . 10 мая 2021 г.
- ^ «Пакет одобрения препарата: ГИВЛААРИ (гивосиран) для инъекций» . FDA .
- ^ Гонсалес-Асегиноласа Дж. (11 июня 2020 г.). «Гивосиран — вмешательство в РНК для борьбы с приступами порфирии». Медицинский журнал Новой Англии . 382 (28–4793): 2366–2367. дои : 10.1056/NEJMe2010986 . ПМИД 32521139 . S2CID 219592948 .
- ^ «Гивлаари» . Европейское агентство по лекарственным средствам .
- ^ Пюи Х., Гуя Л., Дейбах Дж. К. (2010). «Порфирии». Ланцет . 375 (9718): 924–937. дои : 10.1016/S0140-6736(09)61925-5 . ПМИД 20226990 . S2CID 208791867 .
- ^ Саймон А., Помпилус Ф., Кербес В., Вэй А., Стржок С., Пенц С. и др. (2018). «Точка зрения пациента на острую интермиттирующую порфирию с частыми приступами: заболевание с интермиттирующими и хроническими проявлениями» . Пациент . 11 (5): 527–537. дои : 10.1007/s40271-018-0319-3 . ПМК 6132435 . ПМИД 29915990 .
- ^ Пищик Э., Кауппинен Р. (2015). «Обновление клинического ведения острой интермиттирующей порфирии» . Применение клинической генетики . 8 : 201–214. дои : 10.2147/TACG.S48605 . ПМЦ 4562648 . ПМИД 26366103 .
- ^ Бисселл Д.М., Лай Дж.К., Мейстер Р.К., Блан П.Д. (2015). «Роль дельта-аминолевулиновой кислоты в симптомах острой порфирии» . Американский медицинский журнал . 128 (3): 313–317. дои : 10.1016/j.amjmed.2014.10.026 . ПМЦ 4339446 . ПМИД 25446301 .
- ^ «ЭТИКЕТКА: ГИВЛААРИ- гивосиран натрия для инъекций, раствор» . Дейли Мед . 5 апреля 2022 г.
- ^ «Пакет одобрения лекарств: OXLUMO» . FDA .
- ^ «Окслюмо» . Европейское агентство по лекарственным средствам .
- ^ «ЭТИКЕТКА: ОКЛЮМОЛЮМАСИРАН для инъекций, раствор» . Дейли Мед . 2 декабря 2021 г.
- ^ Гаррелфс С.Ф., Фришберг Ю., Халтон С.А., Корен М.Дж., О'Риордан В.Д., Кочат П. и др. (1 апреля 2021 г.). «Лумасиран, РНКи-терапевтическое средство для лечения первичной гипероксалурии типа 1» . Медицинский журнал Новой Англии . 384 (13): 1216–1226. дои : 10.1056/NEJMoa2021712 . ПМИД 33789010 . S2CID 232482623 .
- ^ Исследования Cf (27 ноября 2023 г.). «Снимки испытаний наркотиков: AMVUTTRA» . FDA .
- ^ «Амвуттра | Европейское агентство лекарственных средств» . www.ema.europa.eu . Проверено 11 января 2024 г.
- ^ Геррио М., Кохли Э. (2022). «Лекарства на основе РНК и регулирование: на пути к необходимой эволюции определений, данных в законодательстве Европейского союза» . Границы в медицине . 9 . дои : 10.3389/fmed.2022.1012497 . ISSN 2296-858X . ПМЦ 9618588 . ПМИД 36325384 .
- ^ Jump up to: Перейти обратно: а б Канасти Р., Доркин-младший, Вегас А., Андерсон Д. (ноябрь 2013 г.). «Материалы для доставки миРНК-терапевтических средств». Природные материалы . 12 (11): 967–77. Бибкод : 2013NatMa..12..967K . дои : 10.1038/nmat3765 . ПМИД 24150415 .
- ^ Виттруп А., Либерман Дж. (сентябрь 2015 г.). «Сбивание болезни: отчет о прогрессе в терапии siRNA» . Обзоры природы Генетика . 16 (9): 543–52. дои : 10.1038/nrg3978 . ПМЦ 4756474 . ПМИД 26281785 .
- ^ Де-Суза Э.А., Камара Х., Салгейро В.Г., Моро Р.П., Книттель Т.Л., Тонон Дж. и др. (май 2019 г.). «РНК-интерференция может привести к неожиданным фенотипам у Caenorhabditis elegans» . Исследования нуклеиновых кислот . 47 (8): 3957–3969. дои : 10.1093/nar/gkz154 . ПМК 6486631 . ПМИД 30838421 .
- ^ Ли В, «Сока» (24 марта 2007 г.). «Наночастицы на основе липидов для доставки нуклеиновых кислот». Фарм Рес . 24 (3): 438–449. дои : 10.1007/s11095-006-9180-5 . ПМИД 17252188 . S2CID 9995555 .
- ^ Люнг А.К., Там Ю.Ю., Каллис П.Р. (2014). «Липидные наночастицы для доставки коротких интерферирующих РНК». Невирусные векторы для генной терапии — перенос генов на основе липидов и полимеров . Достижения генетики. Том. 88. стр. 71–110. дои : 10.1016/B978-0-12-800148-6.00004-3 . ISBN 978-0-12-800148-6 . ПМК 7149983 . ПМИД 25409604 .
- ^ Джон ЛаМаттина (15 апреля 2014 г.). «Включение крупных фармацевтических компаний в использование RNAi показывает, что новые технологии не гарантируют успех исследований и разработок» . Форбс .
- ^ Эрик Бендер (1 сентября 2014 г.). «Второе пришествие РНКи» . Ученый .
- ^ Баден ЛР (2021). «Эффективность и безопасность вакцины мРНК-1273 SARS-CoV-2» . Медицинский журнал Новой Англии . 384 (5): 403–416. дои : 10.1056/NEJMoa2035389 . ПМЦ 7787219 . ПМИД 33378609 .
- ^ Фицджеральд К., Уайт С., Бородовский А., Бетанкур Б.Р., Страс А., Клаузен В. (январь 2017 г.). «Высокостойкий терапевтический ингибитор RNAi PCSK9» . Медицинский журнал Новой Англии . 376 (1): 41–51. дои : 10.1056/NEJMoa1609243 . ПМЦ 5778873 . ПМИД 27959715 .
- ^ Круспе С., Джангранде П. (2017). «Химеры аптамер-миРНК: открытие, прогресс и перспективы» . Биомедицины . 5 (4): 45. doi : 10.3390/biomedicines5030045 . ПМК 5618303 . ПМИД 28792479 .
- ^ Балвани М., Сард Э., Вентура П., Пейро П.А., Рис Д.С., Стельзель У. и др. (11 июня 2020 г.). «Фаза 3 исследования терапевтического препарата Гивосиран с РНКи при острой перемежающейся порфирии» . Медицинский журнал Новой Англии . 382 (24): 2289–2301. дои : 10.1056/NEJMoa1913147 . ПМИД 32521132 . S2CID 219586624 .
- ^ Андерссон М., Меландер М., Поймарк П., Ларссон Х., Бюлов Л., Хофвандер П. (2006). «Направленное подавление генов с помощью РНК-интерференции: эффективный метод получения линий картофеля с высоким содержанием амилозы» . Журнал биотехнологии . 123 (2): 137–148. doi : 10.1016/j.jbiotec.2005.11.001 . PMID 16466822 .
- ^ Фриззи А., Хуан С. (2010). «Использование путей подавления РНК для биотехнологии растений» . Журнал биотехнологии растений . 8 (6): 655–677. дои : 10.1111/j.1467-7652.2010.00505.x . ПМИД 20331529 .
- ^ Пэрротт В., Часси Б., Лигон Дж., Мейер Л., Патрик Дж., Чжоу Дж. и др. (2010). «Применение принципов оценки безопасности пищевых продуктов и кормов для оценки трансгенных подходов к модуляции генов сельскохозяйственных культур» . Британская ассоциация промышленных биологических исследований . 48 (7): 1773–1790. дои : 10.1016/j.fct.2010.04.017 . ПМИД 20399824 .
- ^ Берхаут Б (апрель 2004 г.). «РНК-интерференция как противовирусный подход: воздействие на ВИЧ-1». Современное мнение о молекулярной терапии . 6 (2): 141–5. ПМИД 15195925 .
- ^ Цзян М., Милнер Дж. (сентябрь 2002 г.). «Селективное подавление экспрессии вирусных генов в ВПЧ-положительных клетках карциномы шейки матки человека, обработанных миРНК, праймером РНК-интерференции» . Онкоген . 21 (39): 6041–8. дои : 10.1038/sj.onc.1205878 . ПМИД 12203116 .
- ^ Кусов Ю., Канда Т., Палменберг А., Сгро Ю., Гаусс-Мюллер В. (июнь 2006 г.). «Подавление инфекции вируса гепатита А с помощью малых интерферирующих РНК» . Журнал вирусологии . 80 (11): 5599–610. дои : 10.1128/jvi.01773-05 . ПМЦ 1472172 . ПМИД 16699041 .
- ^ Цзя Ф, Чжан Ю.З., Лю С.М. (октябрь 2006 г.). «Система на основе ретровирусов, обеспечивающая стабильное подавление генов вируса гепатита В посредством РНК-интерференции» . Биотехнологические письма . 28 (20): 1679–85. дои : 10.1007/s10529-006-9138-z . ПМИД 16900331 . S2CID 34511611 .
- ^ Ли Ю.К., Конг Л.Х., Ченг Б.З., Ли КС (декабрь 2005 г.). «Конструирование векторов экспрессии миРНК вируса гриппа и их ингибирующее действие на размножение вируса гриппа». Птичьи болезни . 49 (4): 562–73. дои : 10.1637/7365-041205R2.1 . ПМИД 16405000 . S2CID 86214047 .
- ^ Кханна М., Саксена Л., Раджпут Р., Кумар Б., Прасад Р. (2015). «Замалчивание генов: терапевтический подход к борьбе с вирусными инфекциями гриппа». Будущая микробиология . 10 (1): 131–40. дои : 10.2217/fmb.14.94 . ПМИД 25598342 .
- ^ Раджпут Р., Ханна М., Кумар П., Кумар Б., Шарма С., Гупта Н. и др. (декабрь 2012 г.). «Маленькая интерферирующая РНК, нацеленная на транскрипт неструктурного гена 1, ингибирует репликацию вируса гриппа А у экспериментальных мышей». Нуклеиновая кислотная терапия . 22 (6): 414–22. дои : 10.1089/нат.2012.0359 . ПМИД 23062009 .
- ^ Jump up to: Перейти обратно: а б с д Аша К., Кумар П., Саникас М., Месеко К.А., Ханна М., Кумар Б. (декабрь 2018 г.). «Достижения в области терапии на основе нуклеиновых кислот против респираторных вирусных инфекций» . Журнал клинической медицины . 8 (1): 6. дои : 10.3390/jcm8010006 . ПМК 6351902 . ПМИД 30577479 .
- ^ Ху Л., Ван З., Ху С., Лю Х, Яо Л., Ли В. и др. (2005). «Ингибирование размножения вируса кори в культуре клеток с помощью РНК-интерференции». Акта вирусологика . 49 (4): 227–34. ПМИД 16402679 .
- ^ Куреши А., Тхакур Н., Монга И., Тхакур А., Кумар М. (2014). «VIRmiRNA: комплексный ресурс экспериментально подтвержденных вирусных микроРНК и их мишеней» . База данных . 2014 . дои : 10.1093/база данных/bau103 . ПМК 4224276 . ПМИД 25380780 .
- ^ Кроу С. (2003). «Подавление экспрессии хемокиновых рецепторов с помощью РНК-интерференции позволяет ингибировать репликацию ВИЧ-1, Мартинес и др.» . СПИД . 17 (Приложение 4): S103–5. дои : 10.1097/00002030-200317004-00014 . ПМИД 15080188 .
- ^ Фукс У, Дамм-Велк С, Боркхардт А (август 2004 г.). «Замалчивание генов, связанных с болезнями, с помощью малых интерферирующих РНК». Современная молекулярная медицина . 4 (5): 507–17. дои : 10.2174/1566524043360492 . ПМИД 15267222 .
- ^ Чока Д.П., Аоки Ю., Кийосава К. (февраль 2003 г.). «РНК-интерференция — это функциональный путь с терапевтическим потенциалом в клеточных линиях миелолейкоза человека» . Генная терапия рака . 10 (2): 125–33. дои : 10.1038/sj.cgt.7700544 . ПМИД 12536201 .
- ^ Лаптева Н., Ян А.Г., Сандерс Д.Е., Штрубе Р.В., Чен С.Ю. (январь 2005 г.). «Нокдаун CXCR4 небольшой интерферирующей РНК прекращает рост опухоли молочной железы in vivo» . Генная терапия рака . 12 (1): 84–9. дои : 10.1038/sj.cgt.7700770 . ПМИД 15472715 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я Сюй CF, Ван Дж (1 февраля 2015 г.). «Системы доставки для разработки препаратов siRNA для терапии рака» . Азиатский журнал фармацевтических наук . 10 (1): 1–12. дои : 10.1016/j.ajps.2014.08.011 .
- ^ Сингер О., Марр Р.А., Рокенштейн Э., Крюс Л., Куфал Н.Г., Гейдж Ф.Х. и др. (октябрь 2005 г.). «Нацеливание на BACE1 с помощью siRNA улучшает невропатологию болезни Альцгеймера на трансгенной модели». Природная неврология . 8 (10): 1343–9. дои : 10.1038/nn1531 . ПМИД 16136043 . S2CID 6978101 .
- ^ Родригес-Леброн Э., Гувион СМ, Мур С.А., Дэвидсон Б.Л., Полсон Х.Л. (сентябрь 2009 г.). «Аллель-специфическая РНКи смягчает фенотипическое прогрессирование в трансгенной модели болезни Альцгеймера» . Молекулярная терапия . 17 (9): 1563–73. дои : 10.1038/mt.2009.123 . ПМЦ 2835271 . ПМИД 19532137 .
- ^ Пьедрахита Д., Эрнандес И., Лопес-Тобон А., Федоров Д., Обара Б., Маньюнат Б.С. и др. (октябрь 2010 г.). «Замалчивание CDK5 уменьшает нейрофибриллярные клубки у трансгенных мышей с болезнью Альцгеймера» . Журнал неврологии . 30 (42): 13966–76. doi : 10.1523/jneurosci.3637-10.2010 . ПМЦ 3003593 . ПМИД 20962218 .
- ^ Рауль С., Баркер С.Д., Эбишер П. (март 2006 г.). «Вирусное моделирование и коррекция нейродегенеративных заболеваний методом РНК-интерференции» . Генная терапия . 13 (6): 487–95. дои : 10.1038/sj.gt.3302690 . ПМИД 16319945 .
- ^ Харпер С.К., Стабер П.Д., Хе Х, Элиасон С.Л., Мартинс И.Х., Мао К. и др. (апрель 2005 г.). «РНК-интерференция улучшает двигательные и невропатологические нарушения в мышиной модели болезни Хантингтона» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (16): 5820–5. Бибкод : 2005PNAS..102.5820H . дои : 10.1073/pnas.0501507102 . ПМК 556303 . ПМИД 15811941 .
- ^ Будро Р.Л., Родригес-Леброн Э., Дэвидсон Б.Л. (апрель 2011 г.). «РНКи-медицина для мозга: прогресс и проблемы» . Молекулярная генетика человека . 20 (Р1): Р21–7. дои : 10.1093/hmg/ddr137 . ПМК 3095054 . ПМИД 21459775 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м Уайтхед К.А., Дальман Дж.Э., Лангер Р.С., Андерсон Д.Г. (2011). «Замалчивание или стимуляция? Доставка миРНК и иммунная система». Ежегодный обзор химической и биомолекулярной инженерии . 2 : 77–96. doi : 10.1146/annurev-chembioeng-061010-114133 . ПМИД 22432611 . S2CID 28803811 .
- ^ Сунилкумар Г., Кэмпбелл Л.М., Пукхабер Л., Стипанович Р.Д., Ратор К.С. (ноябрь 2006 г.). «Разработка семян хлопка для использования в питании человека путем тканеспецифического снижения токсичного госсипола» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (48): 18054–9. дои : 10.1073/pnas.0605389103 . ПМЦ 1838705 . ПМИД 17110445 .
- ^ Ле Л.К., Лоренц Й., Шерер С., Фетиш К., Энрике Э., Бартра Дж. и др. (март 2006 г.). «Создание плодов томата со сниженной аллергенностью за счет опосредованного dsRNAi ингибирования экспрессии ns-LTP (Lyc e 3)» . Журнал биотехнологии растений . 4 (2): 231–42. дои : 10.1111/j.1467-7652.2005.00175.x . ПМИД 17177799 .
- ^ Ниггевег Р., Майкл А.Дж., Мартин С. (июнь 2004 г.). «Технические растения с повышенным содержанием антиоксиданта хлорогеновой кислоты». Природная биотехнология . 22 (6): 746–54. дои : 10.1038/nbt966 . ПМИД 15107863 . S2CID 21588259 .
- ^ Гилберт М.К., Маджумдар Р., Раджасекаран К., Чен З.Ю., Вэй К., Сиклер К.М. и др. (июнь 2018 г.). «Замалчивание гена альфа-амилазы (amy1) в Aspergillus flavus на основе РНК-интерференции снижает рост грибков и выработку афлатоксина в зернах кукурузы». Планта . 247 (6): 1465–1473. Бибкод : 2018Plant.247.1465G . дои : 10.1007/s00425-018-2875-0 . ПМИД 29541880 . S2CID 3918937 .
- ^ Каточ Р., Такур Н. (март 2013 г.). «РНК-интерференция: многообещающий метод улучшения традиционных сельскохозяйственных культур». Международный журнал пищевых наук и питания . 64 (2): 248–59. дои : 10.3109/09637486.2012.713918 . ПМИД 22861122 . S2CID 45212581 .
- ^ Каточ Р., Такур Н. (март 2013 г.). «Достижения в области технологии РНК-интерференции и ее влияние на улучшение питания, борьбу с болезнями и насекомыми у растений». Прикладная биохимия и биотехнология . 169 (5): 1579–605. дои : 10.1007/s12010-012-0046-5 . ПМИД 23322250 . S2CID 23733295 .
- ^ Jump up to: Перейти обратно: а б Дауни Р.К., Лин М., Корси Б., Фик А., Лиллемо М., Оливер Р.П. и др. (27 июля 2021 г.). «Septoria Nodorum Пятнистость пшеницы: борьба с болезнями и селекция устойчивости перед лицом меняющейся динамики заболеваний и меняющейся окружающей среды». Фитопатология . 111 (6). Американское фитопатологическое общество : PHYTO–07–20–028. doi : 10.1094/phyto-07-20-0280-rvw . hdl : 20.500.11937/83208 . ISSN 0031-949X . PMID 33245254 . S2CID 227181536 .
- ^ Ивашута С., Чжан Ю., Виггинс Б.Е., Рамасешадри П., Сегерс Г.К., Джонсон С. и др. (май 2015 г.). «Экологические РНКи у травоядных насекомых» . РНК . 21 (5): 840–50. дои : 10.1261/rna.048116.114 . ПМЦ 4408792 . ПМИД 25802407 .
- ^ Миллер С.К., Мията К., Браун С.Дж., Томоясу Ю. (2012). «Рассечение системной РНК-интерференции у красного мучного жука Tribolium castaneum : параметры, влияющие на эффективность РНКи» . ПЛОС ОДИН . 7 (10): е47431. Бибкод : 2012PLoSO...747431M . дои : 10.1371/journal.pone.0047431 . ПМЦ 3484993 . ПМИД 23133513 .
- ^ Петрик Дж.С., Фридрих Г.Е., Карлтон С.М., Кессенич С.Р., Сильванович А., Чжан Ю. и др. (ноябрь 2016 г.). «Активная РНК кукурузного жука DvSnf7: оценка пероральной токсикологии повторной дозы в поддержку безопасности человека и млекопитающих» . Нормативная токсикология и фармакология . 81 : 57–68. дои : 10.1016/j.yrtph.2016.07.009 . ПМИД 27436086 .
- ^ Терениус О., Папаниколау А., Гарбутт Дж.С., Элефтерианос И., Хувенн Х., Кангинакудру С. и др. (февраль 2011 г.). «РНК-интерференция у чешуекрылых: обзор успешных и неудачных исследований и значение для дизайна эксперимента» . Журнал физиологии насекомых . 57 (2): 231–45. Бибкод : 2011JInsP..57..231T . дои : 10.1016/j.jinsphys.2010.11.006 . hdl : 1854/LU-1101411 . ПМИД 21078327 .
- ^ Монгелли В., Салех MC (29 сентября 2016 г.). «Ошибки нельзя замалчивать: пути малых РНК и противовирусные реакции у насекомых» (PDF) . Ежегодный обзор вирусологии . 3 (1). Годовые обзоры : 573–589. doi : 10.1146/annurev-virology-110615-042447 . ISSN 2327-056X . ПМИД 27741406 . S2CID 38499958 .
- ^ Jump up to: Перейти обратно: а б с Чжу К.Ю., Палли С.Р. (7 января 2020 г.). «Механизмы, применение и проблемы интерференции РНК насекомых» . Ежегодный обзор энтомологии . 65 (1). Годовые обзоры : 293–311. doi : 10.1146/annurev-ento-011019-025224 . ISSN 0066-4170 . ПМЦ 9939233 . ПМИД 31610134 . S2CID 204702574 .
- ^ Хьюскен Д., Ланге Дж., Миканин С., Вейлер Дж., Ассельбергс Ф., Уорнер Дж. и др. (август 2005 г.). «Разработка полногеномной библиотеки миРНК с использованием искусственной нейронной сети». Природная биотехнология . 23 (8): 995–1001. дои : 10.1038/nbt1118 . ПМИД 16025102 . S2CID 11030533 .
- ^ Ге Дж., Вонг Г.В., Луо Б. (октябрь 2005 г.). «Прогнозирование эффективности нокдауна siRNA с использованием моделей искусственных нейронных сетей». Связь с биохимическими и биофизическими исследованиями . 336 (2): 723–8. дои : 10.1016/j.bbrc.2005.08.147 . ПМИД 16153609 .
- ^ Яниц М., Ванекке Д., Лерах Х. (2006). «Высокопроизводительная РНК-интерференция в функциональной геномике». РНК на пути к медицине . Справочник по экспериментальной фармакологии. Том. 173. С. 97–104. дои : 10.1007/3-540-27262-3_5 . ISBN 978-3-540-27261-8 . ПМИД 16594612 .
- ^ Ванхеке Д., Яниц М. (февраль 2005 г.). «Функциональная геномика с использованием высокопроизводительной РНК-интерференции» . Открытие наркотиков сегодня . 10 (3): 205–12. дои : 10.1016/S1359-6446(04)03352-5 . hdl : 11858/00-001M-0000-0010-86E7-8 . ПМИД 15708535 . S2CID 9934291 .
- ^ Мэтсон Р.С. (2005). Применение технологии геномных и протеомных микрочипов для открытия лекарств . ЦРК Пресс. п. 6 . ISBN 978-0-8493-1469-8 .
- ^ Чжан XHD (2011). Оптимальный высокопроизводительный скрининг: практический дизайн эксперимента и анализ данных для исследования РНКи в масштабе генома . Издательство Кембриджского университета. стр. ix – xiii. ISBN 978-0-521-73444-8 .
- ^ Мацке М.А., Мацке А.Ю. (2004). «Посадка семян новой парадигмы» . ПЛОС Биол . 2 (5): е133. дои : 10.1371/journal.pbio.0020133 . ПМК 406394 . ПМИД 15138502 .
- ^ Экер-младший, Дэвис Р.В. (август 1986 г.). «Ингибирование экспрессии генов в растительных клетках путем экспрессии антисмысловой РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (15): 5372–6. Бибкод : 1986PNAS...83.5372E . дои : 10.1073/pnas.83.15.5372 . ПМК 386288 . ПМИД 16593734 .
- ^ Наполи К, Лемье К, Йоргенсен Р (апрель 1990 г.). «Введение химерного гена халконсинтазы в петунию приводит к обратимой совместной супрессии гомологичных генов в транс» . Растительная клетка . 2 (4): 279–289. дои : 10.1105/tpc.2.4.279 . ПМК 159885 . ПМИД 12354959 .
- ^ Романо Н., Мачино Дж. (ноябрь 1992 г.). «Подавление: временная инактивация экспрессии генов Neurospora crassa путем трансформации гомологичными последовательностями». Молекулярная микробиология . 6 (22): 3343–53. дои : 10.1111/j.1365-2958.1992.tb02202.x . ПМИД 1484489 . S2CID 31234985 .
- ^ Ван Блокланд Р., Ван дер Гест Н., Мол Дж. Н., Кутер Дж. М. (1994). «Трансгенно-опосредованное подавление экспрессии халконсинтазы у Petunia Hybrida является результатом увеличения оборота РНК» . Плант Дж . 6 (6): 861–77. дои : 10.1046/j.1365-313X.1994.6060861.x .
- ^ Мол Дж.Н., ван дер Крол А.Р. (1991). Антисмысловые нуклеиновые кислоты и белки: основы и применение . М. Деккер. стр. 4, 136. ISBN. 978-0-8247-8516-1 .
- ^ Кови С., Аль-Кафф Н., Лангара А., Тернер Д. (1997). «Растения борются с инфекцией путем подавления генов». Природа . 385 (6619): 781–2. Бибкод : 1997Natur.385..781C . дои : 10.1038/385781a0 . S2CID 43229760 .
- ^ Кумагай М.Х., Донсон Дж., Делла-Чиоппа Дж., Харви Д., Хэнли К., Гриль Л.К. (февраль 1995 г.). «Цитоплазматическое ингибирование биосинтеза каротиноидов с помощью РНК вирусного происхождения» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (5): 1679–83. Бибкод : 1995PNAS...92.1679K . дои : 10.1073/pnas.92.5.1679 . ПМК 42583 . ПМИД 7878039 .
- ^ Рэтклифф Ф., Харрисон Б.Д., Баулкомб, округ Колумбия (июнь 1997 г.). «Сходство между вирусной защитой и подавлением генов у растений». Наука . 276 (5318): 1558–60. дои : 10.1126/science.276.5318.1558 . ПМИД 18610513 .
- ^ Го С., Кемфуес К.Дж. (май 1995 г.). «par-1, ген, необходимый для установления полярности у эмбрионов C. elegans, кодирует предполагаемую киназу Ser/Thr, которая распределена асимметрично» . Клетка . 81 (4): 611–20. дои : 10.1016/0092-8674(95)90082-9 . ПМИД 7758115 .
- ^ Пал-Бхадра М., Бхадра У., Бирчлер Дж.А. (август 1997 г.). «Косупрессия у дрозофилы: подавление гена алкогольдегидрогеназы трансгенами белого Adh зависит от Polycomb» . Клетка . 90 (3): 479–90. дои : 10.1016/S0092-8674(00)80508-5 . ПМИД 9267028 .
- ^ Jump up to: Перейти обратно: а б Сен Г.Л., Блау Х.М. (июль 2006 г.). «Краткая история РНКи: молчание генов» . Журнал ФАСЭБ . 20 (9): 1293–9. дои : 10.1096/fj.06-6014рев . ПМИД 16816104 . S2CID 12917676 .
- ^ Файр А, Сюй С, Монтгомери МК, Костас С.А., Драйвер С.Е., Мелло CC (февраль 1998 г.). «Мощное и специфическое генетическое вмешательство двухцепочечной РНК в Caenorhabditis elegans» . Природа . 391 (6669): 806–11. Бибкод : 1998Natur.391..806F . дои : 10.1038/35888 . ПМИД 9486653 . S2CID 4355692 .
- ^ Данехольт Б. (2 октября 2006 г.). «Нобелевская премия по физиологии и медицине 2006 г.» . nobelprize.org . Проверено 30 октября 2017 г.
- ^ Эльбашир С., Харборт Дж., Лендекель В. и др. (2001). «Дуплексы 21-нуклеотидных РНК опосредуют РНК-интерференцию в культивируемых клетках млекопитающих». Природа . 411 (6836): 494–498. Бибкод : 2001Natur.411..494E . дои : 10.1038/35078107 . ПМИД 11373684 . S2CID 710341 .
- ^ Маккаффри А.П., Маас Л., Фам Т.Т., Конклин Д.С., Хэннон Г.Дж. , Кей М.А. (июль 2002 г.). «РНК-интерференция у взрослых мышей». Природа . 418 (6893): 38–9. Бибкод : 2002Natur.418...38M . дои : 10.1038/418038a . ПМИД 12097900 . S2CID 4361399 .

- ^ Деви Г.Р. (сентябрь 2006 г.). «Подходы на основе миРНК в терапии рака» . Генная терапия рака . 13 (9): 819–29. дои : 10.1038/sj.cgt.7700931 . ПМИД 16424918 .
- ^ Уолл Н.Р., Ши Ю (октябрь 2003 г.). «Малая РНК: можно ли использовать интерференцию РНК для терапии?». Ланцет . 362 (9393): 1401–3. дои : 10.1016/s0140-6736(03)14637-5 . ПМИД 14585643 . S2CID 25034627 .
- ^ Сах Д. (2006). «Терапевтический потенциал РНК-интерференции при неврологических расстройствах». Наука о жизни . 79 (19): 1773–80. дои : 10.1016/j.lfs.2006.06.011 . ПМИД 16815477 .
- ^ Дэвис М.Э. , Цукерман Дж.Е., Чой Ч., Селигсон Д., Толчер А., Алаби К.А. и др. (апрель 2010 г.). «Доказательства существования РНКи у людей из системно вводимых миРНК через целевые наночастицы» . Природа . 464 (7291): 1067–70. Бибкод : 2010Natur.464.1067D . дои : 10.1038/nature08956 . ПМЦ 2855406 . ПМИД 20305636 .
- ^ «Новартис получает одобрение ЕС на Леквио (инклизиран), первую в своем классе миРНК для снижения уровня холестерина при двух дозах в год» . Новартис . 11 декабря 2020 г.
Внешние ссылки [ править ]
- Обзор процесса RNAi , из книги «Обнаженные ученые» Кембриджского университета.
- Анимация процесса РНКи из природы
- NOVA scienceNOW объясняет RNAi – 15-минутное видео трансляции Nova , вышедшей в эфир на канале PBS , 26 июля 2005 г.
- Замалчивание геномов. Архивировано 10 августа 2019 года в экспериментах Wayback Machine по РНК-интерференции (RNAi) и биоинформатике на C. elegans в образовательных целях. Из Центра изучения ДНК Долана лаборатории Колд-Спринг-Харбор.
- Скрининг РНКи у C. elegans в 96-луночном жидкостном формате и их применение для систематической идентификации генетических взаимодействий (протокол)
- 2. Американские «люди-черви» получили Нобелевскую премию за работу в области РНК , газета «Нью-Йорк Таймс»
- Интернет-направление «Молекулярная терапия» : «Развитие РНКи как терапевтической стратегии» , сборник бесплатных статей о РНКи как терапевтической стратегии.
- GenomeRNAi : база данных фенотипов, полученных в результате экспериментов по скринингу РНК-интерференции у Drosophila melanogaster и Homo sapiens.
- Инструменты RNAi. Архивировано 19 июня 2018 г. на Wayback Machine. Предварительно разработанные и специальные инструменты для интерференции РНК.