ооцит
| ооцит | |
|---|---|
| Идентификаторы | |
| МеШ | D009865 |
| ФМА | 18644 |
| Анатомическая терминология | |
Яйцеклетка ( Великобритания : / ˈ oʊ ə s aɪ t / , США : / ˈ oʊ oʊ -/ ), ооцит или овоцит — женский гаметоцит или зародышевая клетка, участвующий в размножении . Другими словами, это незрелая яйцеклетка , или яйцеклетка . Ооцит вырабатывается у плода женского пола в яичнике во время женского гаметогенеза . Женские половые клетки производят первичную зародышевую клетку (ПГК), которая затем подвергается митозу , образуя оогонии . В ходе оогенеза оогонии превращаются в первичные ооциты. Ооцит — это форма генетического материала, который можно собрать для криоконсервации .
Формирование
[ редактировать ]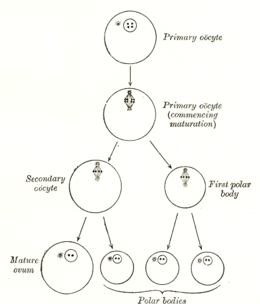
Образование ооцита называется ооцитогенезом, который является частью оогенеза. [1] Оогенез приводит к образованию как первичных ооцитов во время внутриутробного периода, так и вторичных ооцитов после него в рамках овуляции .
| Тип ячейки | плоидность / хромосомы | хроматиды | Процесс | Время завершения |
| Оогоний | диплоид/46(2N) | 2С | Ооцитогенез ( митоз ) | третий триместр |
| первичный ооцит | диплоид/46(2N) | 4С | Оотидогенез ( мейоз I) ( фолликулогенез ) | Диктовать в профазе I до 50 лет. |
| вторичный ооцит | гаплоид/23(1N) | 2С | Оотидогенез ( мейоз II) | Останавливается в метафазе II до оплодотворения. |
| Вы ждете | гаплоид/23(1N) | 1С | Оотидогенез ( мейоз II) | Через несколько минут после оплодотворения |
| яйцеклетка | гаплоид/23(1N) | 1С |
Характеристики
[ редактировать ]Цитоплазма
[ редактировать ]Ооциты богаты цитоплазмой , которая содержит гранулы желтка, питающие клетку на ранних стадиях развития.
Ядро
[ редактировать ]На стадии оогенеза первичного ооцита ядро называется зародышевым пузырьком. [2]
Единственный нормальный человеческий тип вторичного ооцита имеет 23-ю (половую) хромосому как 23,X (определяющую женский пол), тогда как сперматозоиды могут иметь 23,X (определяющую женский пол) или 23,Y (определяющий мужской пол).
Гнездо
[ редактировать ]Пространство внутри яйцеклетки или незрелой яйцеклетки является клеточным гнездом . [3]
Кумулюсно-ооцитный комплекс
[ редактировать ]Комплекс кумулюс-ооцит содержит слои плотно упакованных кумулюсных клеток, окружающих ооцит в Граафовом фолликуле. Ооцит задерживается при мейозе II на стадии метафазы II и считается вторичным ооцитом. Перед овуляцией комплекс кучевых облаков претерпевает структурные изменения, известные как расширение кучевых облаков. Клетки гранулезы трансформируются из плотно уплотненного в расширенный мукоидный матрикс. Многие исследования показывают, что расширение кумулюса имеет решающее значение для созревания ооцита, поскольку кумулюсный комплекс обеспечивает прямую связь ооцита с окружающей средой развивающегося фолликула. Он также играет значительную роль в оплодотворении, хотя механизмы не совсем известны и зависят от вида. [4] [5] [6]
Материнские взносы
[ редактировать ]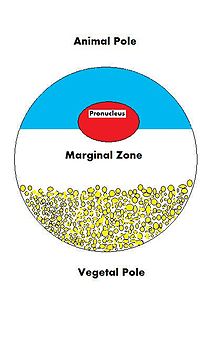
Чтобы яйцеклетка могла оплодотвориться и в конечном итоге превратиться в полностью функционирующий организм, она должна быть способна регулировать множество клеточных процессов и процессов развития. Ооцит, большая и сложная клетка, должен быть способен направлять рост эмбриона и контролировать клеточную активность. Поскольку ооцит является продуктом женского гаметогенеза , материнский вклад в яйцеклетку и, следовательно, в вновь оплодотворенную яйцеклетку огромен. Существует множество типов молекул, которые поставляются в ооцит по материнской линии и управляют различными видами деятельности внутри растущей зиготы .
Предотвращение повреждения ДНК зародышевой линии
[ редактировать ]ДНК клетки уязвима к повреждающему действию окислительных свободных радикалов, образующихся как побочные продукты клеточного метаболизма. Повреждение ДНК, происходящее в ооцитах, если его не устранить, может быть смертельным и привести к снижению плодовитости и потере потенциального потомства. Ооциты существенно крупнее средней соматической клетки, поэтому для их обеспечения необходима значительная метаболическая активность. Если бы эта метаболическая активность осуществлялась метаболическим механизмом ооцита, геном ооцита подвергался бы воздействию образующихся реактивных окислительных побочных продуктов. Таким образом, похоже, что процесс развился, чтобы избежать этой уязвимости ДНК зародышевой линии. Было высказано предположение, что во избежание повреждения ДНК-генома ооцитов метаболизм, способствующий синтезу большей части компонентов ооцита, был перенесен на другие материнские клетки, которые затем перенесли эти компоненты в ооциты. [7] [8] Таким образом, ооциты многих организмов защищены от окислительного повреждения ДНК, сохраняя при этом большую массу веществ, необходимых для питания зиготы в ее начальном эмбриональном росте.
мРНК и белки
[ редактировать ]Во время роста ооцита различные транскрибируемые материнскими информационными РНК или мРНК материнские клетки поставляют . Эти мРНК могут храниться в комплексах мРНП (рибонуклеопротеин-сообщение) и транслироваться в определенные моменты времени, они могут быть локализованы в определенной области цитоплазмы или могут быть гомогенно диспергированы в цитоплазме всего ооцита. [9] Материнские белки также могут быть локализованы или повсеместно распространены в цитоплазме. Транслированные продукты мРНК и загруженные белки выполняют множество функций; от регуляции клеточного «домашнего хозяйства», такого как развитие клеточного цикла и клеточный метаболизм, до регуляции процессов развития, таких как оплодотворение , активация зиготической транскрипции и формирование осей тела. [9] Ниже приведены некоторые примеры унаследованных от матери мРНК и белков, обнаруженных в ооцитах африканской шпорцевой лягушки .
| Имя | Тип материнской молекулы | Локализация | Функция |
|---|---|---|---|
| ВегТ [10] | мРНК | Растительное полушарие | Транскрипционный фактор |
| Вг1 [11] | мРНК | Растительное полушарие | Транскрипционный фактор |
| XXBP-1 [12] | мРНК | Не известно | Транскрипционный фактор |
| КРЕБ [13] | Белок | Вездесущий | Транскрипционный фактор |
| ФоксH1 [14] | мРНК | Вездесущий | Транскрипционный фактор |
| стр.53 [15] | Белок | Вездесущий | Транскрипционный фактор |
| Леф/Ткф [16] | мРНК | Вездесущий | Транскрипционный фактор |
| ФГФ2 [17] | Белок | Ядро | Не известно |
| ФГФ2, 4, 9 ФГФР1 [16] | мРНК | Не известно | Передача сигналов FGF |
| Эктодермин [18] | Белок | Животное полушарие | Убиквитинлигаза |
| МИР4 [19] | мРНК | Растительное полушарие | Пропротеинконвертаза |
| Коко [20] | Белок | Не известно | Ингибитор BMP |
| Извращенная гаструляция [16] | Белок | Не известно | Белок, связывающий BMP/хордин |
| фатвг [21] | мРНК | Растительное полушарие | Образование зародышевых клеток и вращение коры |

Митохондрии
[ редактировать ]Ооцит получает митохондрии от материнских клеток, которые в дальнейшем будут контролировать эмбриональный метаболизм и процессы апоптоза. [9] Разделение митохондрий осуществляется системой микротрубочек , которые локализуют митохондрии по всему ооциту. У некоторых организмов, например млекопитающих, отцовские митохондрии, принесенные в ооцит сперматозоидом, разрушаются за счет прикрепления убиквитинированных белков. Разрушение отцовских митохондрий обеспечивает строго материнское наследование митохондрий и митохондриальной ДНК (мтДНК). [9]
Ядрышко
[ редактировать ]У млекопитающих ядрышко ооцита происходит исключительно из материнских клеток. [22] Ядрышко, структура внутри ядра, представляет собой место, где рРНК транскрибируется и собирается в рибосомы. Хотя ядрышко у зрелого ооцита плотное и неактивное, оно необходимо для правильного развития эмбриона. [22]
Рибосомы
[ редактировать ]Материнские клетки также синтезируют и создают запас рибосом , которые необходимы для трансляции белков до активации зиготического генома . В ооцитах млекопитающих рибосомы материнского происхождения и некоторые мРНК хранятся в структуре, называемой цитоплазматической решеткой. Было замечено, что эти цитоплазматические решетки, сеть фибрилл, белков и РНК, увеличиваются в плотности по мере уменьшения количества рибосом внутри растущего ооцита. [23] и мутация в них была связана с бесплодием. [24] [25]
Профаза я арестовываю
[ редактировать ]Самки млекопитающих и птиц рождаются со всеми ооцитами, необходимыми для будущих овуляций, и эти ооциты задерживаются на стадии профазы I мейоза . [26] У человека, например, ооциты образуются между тремя и четырьмя месяцами беременности внутри плода и, следовательно, присутствуют при рождении. Во время этой профазы I арестованная стадия ( диктиата ), которая может длиться много лет, четыре копии генома в ооцитах присутствуют . Арест ooctyes на стадии четырех копий генома, по-видимому, обеспечивает информационную избыточность, необходимую для восстановления повреждений в ДНК зародышевой линии . [26] Используемый процесс репарации, вероятно, включает гомологичную рекомбинационную репарацию. [26] [27] [28] Ооциты с остановкой профазы обладают высокой способностью к эффективному восстановлению повреждений ДНК . [27] В частности, двухцепочечные разрывы ДНК могут быть восстановлены в период остановки профазы путем гомологичной рекомбинационной репарации и негомологичного соединения концов . [29] Способность к репарации ДНК, по-видимому, является ключевым механизмом контроля качества женской зародышевой линии и важнейшим фактором, определяющим фертильность . [27]
Отцовский вклад
[ редактировать ]Сперматозоид , оплодотворяющий яйцеклетку, вносит вклад в ее пронуклеус , другую половину зиготического генома . У некоторых видов сперматозоид также содержит центриоль , которая помогает составить зиготическую центросому, необходимую для первого деления. Однако у некоторых видов, например у мышей, вся центросома приобретается по материнской линии. [30] В настоящее время исследуется возможность другого цитоплазматического вклада, вносимого сперматозоидом в эмбрион.
Во время оплодотворения сперма обеспечивает три основных компонента ооцита: (1) сигнальный или активирующий фактор, который вызывает активацию метаболически спящего ооцита; (2) гаплоидный отцовский геном; (3) центросома, которая отвечает за поддержание системы микротрубочек. См. анатомию спермы.
Аномалии
[ редактировать ]- Нерасхождение — нарушение правильного разделения гомологов в мейозе I или разделение сестринских хроматид в мейозе II может привести к анеуплоидии , при которой ооцит имеет неправильное количество хромосом, например 22,X или 24,X. Это причина таких состояний, как синдром Дауна и синдром Эдвардса у людей. Это более вероятно в пожилом возрасте матери .
- Некоторые ооциты имеют несколько ядер , хотя считается, что они никогда не созревают.
См. также
[ редактировать ]- Кортикальная гранула
- Криоконсервация генетических ресурсов животных
- фолликулогенез
- Ингибитор созревания ооцитов
- Полярное тело
- Нарушение симметрии и кортикальная ротация
- Аномалии ооцитов
- Список различных типов клеток в организме взрослого человека
Ссылки
[ редактировать ]- ^ ответы.com
- ^ «Зародышевый пузырек» . Статьи, учебные пособия и онлайн-словари по биологии . 07.10.2019 . Проверено 9 апреля 2022 г.
- ^ Гриер Х.Дж., Урибе М.К., Паренти Л.Р. (апрель 2007 г.). «Зародышевый эпителий, фолликулогенез и постовуляторные фолликулы в яичниках радужной форели Oncorhynchus mykiss (Walbaum, 1792) (Teleostei, protacanthopterygii, Salmoniformes)». Журнал морфологии . 268 (4): 293–310. дои : 10.1002/jmor.10518 . ПМИД 17309079 . S2CID 23482731 .
- ^ Йоко М., Сато Э (2004). «Комплексные взаимодействия кумулюса и ооцита во время созревания ооцита». Международный обзор цитологии . 235 : 251–91. дои : 10.1016/S0074-7696(04)35006-0 . ISBN 978-0-12-364639-2 . ПМИД 15219785 .
- ^ Танге С., Ван Сум А., Наувинк Х., Корин М., де Круиф А. (март 2002 г.). «Мини-обзор: Функции кумулюса офора во время созревания яйцеклетки, овуляции и оплодотворения». Молекулярное воспроизводство и развитие . 61 (3): 414–24. дои : 10.1002/mrd.10102 . ПМИД 11835587 . S2CID 5728551 .
- ^ Хуан З., Уэллс Д. (октябрь 2010 г.). «Взаимоотношения ооцитов человека и кумулюсных клеток: новые идеи транскриптома кумулюсных клеток» . Молекулярная репродукция человека . 16 (10): 715–25. дои : 10.1093/моль/gaq031 . ПМИД 20435609 .
- ^ Бернштейн С (1993). «Секс как реакция на окислительное повреждение ДНК. Глава 10». В Холливелл Б., Аруома О.И. (ред.). ДНК и свободные радикалы . Великобритания: Ellis Horwood Limited. стр. 204–205. ISBN 978-0-13-222035-4 .
- ^ Бернштейн С (1998). «Секс как реакция на окислительное повреждение ДНК. Глава 4». В Аруоме О.И., Холливелл Б. (ред.). ДНК и свободные радикалы: методы, механизмы и применение . Сент-Люсия и Лондон: OICA International. стр. 112–113. ISBN 976-8056169 .
- ^ Jump up to: а б с д Мтанго Н.Р., Потиредди С., Лэтэм К.Э. (2008). «Качество ооцитов и материнский контроль развития». Международное обозрение клеточной и молекулярной биологии . 268 : 223–90. дои : 10.1016/S1937-6448(08)00807-1 . ПМИД 18703408 .
- ^ Чжан Дж, Кинг ML (декабрь 1996 г.). «РНК Xenopus VegT локализуется в вегетативной коре во время оогенеза и кодирует новый фактор транскрипции Т-бокса, участвующий в формировании мезодермального паттерна». Разработка . 122 (12): 4119–29. дои : 10.1242/dev.122.12.4119 . ПМИД 9012531 . S2CID 28462527 .
- ^ Хисман Дж., Уэссели О., Лэнгленд Р., Крейг Э.Дж., Кесслер Д.С. (декабрь 2001 г.). «Вегетативная локализация материнских мРНК нарушается из-за истощения VegT» . Биология развития . 240 (2): 377–86. дои : 10.1006/dbio.2001.0495 . ПМИД 11784070 .
- ^ Чжао Х., Цао Ю., Грюнц Х. (май 2003 г.). «Белок 1, связывающий X-box Xenopus, фактор транскрипции лейциновой молнии, участвует в сигнальном пути BMP» . Биология развития . 257 (2): 278–91. дои : 10.1016/s0012-1606(03)00069-1 . ПМИД 12729558 .
- ^ Сундарам Н., Тао К., Уайли С., Хисман Дж. (сентябрь 2003 г.). «Роль материнского CREB в раннем эмбриогенезе Xenopus laevis» . Биология развития . 261 (2): 337–52. дои : 10.1016/s0012-1606(03)00303-8 . ПМИД 14499645 .
- ^ Кофрон М., Пак Х., Стэндли Х., Уайли С., Олд Р., Уитмен М., Хисман Дж. (октябрь 2004 г.). «Новая роль FoxH1 в формировании рисунка раннего эмбриона» . Разработка . 131 (20): 5065–78. дои : 10.1242/dev.01396 . ПМИД 15459100 .
- ^ Такебаяси-Сузуки К., Фунами Дж., Токумори Д., Сайто А., Ватабе Т., Миядзоно К. и др. (сентябрь 2003 г.). «Взаимодействие между супрессором опухоли р53 и передачей сигналов TGF бета формирует оси эмбрионального тела у Xenopus» . Разработка . 130 (17): 3929–39. дои : 10.1242/dev.00615 . ПМИД 12874116 .
- ^ Jump up to: а б с Хисман Дж. (февраль 2006 г.). «Материнские детерминанты судьбы эмбриональных клеток». Семинары по клеточной биологии и биологии развития . 17 (1): 93–8. дои : 10.1016/j.semcdb.2005.11.005 . ПМИД 16426874 .
- ^ Сонг Дж, Slack JM (декабрь 1994 г.). «Пространственная и временная экспрессия мРНК и белка основного фактора роста фибробластов (FGF-2) на раннем этапе развития Xenopus». Механизмы развития . 48 (3): 141–51. дои : 10.1016/0925-4773(94)90055-8 . ПМИД 7893598 . S2CID 20281053 .
- ^ Дюпон С., Заккинья Л., Корденонси М., Солиго С., Адорно М., Ругге М., Пикколо С. (апрель 2005 г.). «Спецификация зародышевого слоя и контроль роста клеток с помощью эктодермина, убиквитинлигазы Smad4» . Клетка . 121 (1): 87–99. дои : 10.1016/j.cell.2005.01.033 . hdl : 11577/2439217 . ПМИД 15820681 . S2CID 16628152 .
- ^ Бирсой Б., Берг Л., Уильямс П.Х., Смит Дж.К., Уайли CC, Кристиан Дж.Л., Хисман Дж. (февраль 2005 г.). «XPACE4 представляет собой локализованную пропротеиновую конвертазу, необходимую для индукции мезодермы и расщепления специфических белков TGFbeta при развитии Xenopus» . Разработка . 132 (3): 591–602. дои : 10.1242/dev.01599 . ПМИД 15634697 .
- ^ Белл Э., Муньос-Санхуан И., Альтманн Ч.Р., Воника А., Бриванлу А.Х. (апрель 2003 г.). «Спецификация клеточной судьбы и компетентность Коко, материнского BMP, ингибитора TGFbeta и Wnt» . Разработка . 130 (7): 1381–9. дои : 10.1242/dev.00344 . ПМИД 12588853 .
- ^ Чан А.П., Клок М., Ларабелл К.А., ЛеГрос М., Эткин Л.Д. (май 2007 г.). «Материнская локализованная РНК необходима для вращения коры головного мозга и образования зародышевых клеток» . Механизмы развития . 124 (5): 350–63. дои : 10.1016/j.mod.2007.02.001 . ПМЦ 2435194 . ПМИД 17376659 .
- ^ Jump up to: а б Огуши С., Палмиери С., Фулка Х., Сайто М., Мияно Т., Фулка Дж. (февраль 2008 г.). «Материнское ядрышко необходимо для раннего эмбрионального развития млекопитающих». Наука . 319 (5863): 613–6. дои : 10.1126/science.1151276 . ПМИД 18239124 . S2CID 7799743 .
- ^ Юрттас П., Витале А.М., Фитценри Р.Дж., Коэн-Гулд Л., Ву В., Госсен Дж.А., Кунрод С.А. (август 2008 г.). «Роль PADI6 и цитоплазматических решеток в хранении рибосом в ооцитах и контроле трансляции у ранних эмбрионов мыши» . Разработка . 135 (15): 2627–36. дои : 10.1242/dev.016329 . ПМК 2708103 . ПМИД 18599511 .
- ^ Джентофт, Ида, Массачусетс; Бауэрляйн, Феликс Дж.Б.; Велп, Луиза М.; Купер, Бенджамин Х.; Петрович, Арсен; Итак, Чун; Сыр, Сара Мэй; Полити, Антонио З.; Гороховский, Егор; Такала, Ина; Экель, Хайке; Мольтрехт, Рюдигер; Ленар, Питер; Кавацца, Томас; Лиепе, Юлиана (ноябрь 2023 г.). «Ооциты млекопитающих хранят белки раннего эмбриона на цитоплазматических решетках» . Клетка . 186 (24): 5308–5327.e25. дои : 10.1016/j.cell.2023.10.003 . ПМИД 37922900 .
- ^ Вайдьянатан, Гаятри (02 ноября 2023 г.). «Новое объяснение бесплодия: у яйцеклеток нет загадочной «решетки» » . Природа . дои : 10.1038/d41586-023-03415-6 . ПМИД 37919411 . S2CID 264972543 .
- ^ Jump up to: а б с Мира А. (сентябрь 1998 г.). «Почему останавливается мейоз?». Журнал теоретической биологии . 194 (2): 275–87. Бибкод : 1998JThBi.194..275M . дои : 10.1006/jtbi.1998.0761 . ПМИД 9778439 .
- ^ Jump up to: а б с Стрингер Дж. М., Уиншип А., Зерафа Н., Уэйкфилд М., Хатт К. (май 2020 г.). «Ооциты могут эффективно восстанавливать двухцепочечные разрывы ДНК, восстанавливая генетическую целостность и защищая здоровье потомства» . Труды Национальной академии наук Соединенных Штатов Америки . 117 (21): 11513–11522. Бибкод : 2020PNAS..11711513S . дои : 10.1073/pnas.2001124117 . ПМК 7260990 . ПМИД 32381741 .
- ^ Он, Да-Цзянь; Ван, Линь; Чжан, Чжи-Би; Го, Кун; Ли, Цзин-Чжэн; Он, Се-Чао; Цуй, Цин-Хуа; Чжэн, Пин (18 ноября 2018 г.). «Материнский ген Ooep может участвовать в репарации двухцепочечных разрывов ДНК, опосредованной гомологичной рекомбинацией, в мышиных ооцитах» . Зоологические исследования . 39 (6): 387–395. дои : 10.24272/j.issn.2095-8137.2018.067 . ПМК 6085769 . ПМИД 29955025 .
- ^ Лим Дж., Ли С., Чой Д.И., О Дж.С. Отличительные характеристики реакции на повреждение ДНК в ооцитах млекопитающих. Exp Мол Мед. 2024, 14 февраля. дои : 10.1038/s12276-024-01178-2 . Epub перед печатью. ПМИД 38355825
- ^ Сутовский П., Шаттен Г. (2000). «Отцовский вклад в зиготу млекопитающих: оплодотворение после слияния сперматозоида и яйцеклетки». Международный обзор цитологии . 195 : 1–65. дои : 10.1016/s0074-7696(08)62703-5 . ISBN 978-0-12-364599-9 . ПМИД 10603574 .
Источники
[ редактировать ]- Первс В.К., Орианс Г.Х., Садава Д., Хеллер Х.К. (2004). Жизнь: наука биологии (7-е изд.). Фриман, WH & Company. стр. 823–824. ISBN 978-0-7167-9856-9 .