Семейная гиперхолестеринемия
| Семейная гиперхолестеринемия | |
|---|---|
| Другие имена | Семейная гиперхолестеринемия |
 | |
| Xanthelasma palpebrarum — желтоватые пятна, состоящие из отложений холестерина над веками. Они чаще встречаются у людей с СГ. | |
| Специальность | Эндокринология |
Семейная гиперхолестеринемия ( СГ ) — генетическое заболевание, характеризующееся высоким уровнем холестерина , особенно очень высоким уровнем холестерина липопротеинов низкой плотности (холестерина ЛПНП), в крови и ранними сердечно-сосудистыми заболеваниями . Наиболее распространенные мутации уменьшают количество функциональных рецепторов ЛПНП в печени или производят аномальные рецепторы ЛПНП, которые никогда не выходят на поверхность клетки для правильного функционирования (аномальный трафик). [ нужна ссылка ] Поскольку основная биохимия тела у людей с СГ немного отличается, их высокий уровень холестерина менее чувствителен к методам контроля холестерина, которые обычно более эффективны у людей без СГ (например, изменение диеты и таблетки статинов ). Тем не менее лечение (включая более высокие дозы статинов) обычно эффективно.
СГ классифицируется как семейная дислипидемия 2 типа . [1] Существует пять типов семейной дислипидемии (не включая подтипы), каждый из которых классифицируется как по измененному липидному профилю, так и по генетическим аномалиям. Например, высокий уровень ЛПНП (часто из-за дефекта рецептора ЛПНП) относится к типу 2. Другие включают дефекты метаболизма хиломикронов , метаболизма триглицеридов и метаболизма других частиц, содержащих холестерин, таких как ЛПОНП и ЛПНП.
Примерно у 1 из 100–200 человек наблюдаются мутации в гене LDLR , который кодирует рецептор ЛПНП белок- , который в норме удаляет ЛПНП из кровообращения, или аполипопротеин B (ApoB), который является частью ЛПНП, которая связывается с рецептором; мутации в других генах редки, но их важно знать, включая мутации усиления функции в PCSK9 , молекулярных «ножницах» рецепторов ЛПНП, что приводит к уменьшению количества доступных ЛПНП. По данным большинства эпидемиологических исследований, мутации PCSK9 вызывают менее 5% случаев СГ. [2] У людей, имеющих одну аномальную копию ( гетерозиготных ) гена LDLR , в возрасте от 30 до 40 лет может преждевременно развиться сердечно-сосудистое заболевание. Наличие двух аномальных копий ( гомозиготных ) может вызвать тяжелые сердечно-сосудистые заболевания в детстве. Гетерозиготная СГ — распространенное генетическое заболевание, наследуемое по аутосомно-доминантному типу, встречающееся у 1:250 человек в большинстве стран; [3] гомозиготная СГ встречается гораздо реже и встречается у 1 из 300 000 человек. [ нужна ссылка ]
Гетерозиготную СГ обычно лечат статинами, секвестрантами желчных кислот или другими гиполипидемическими средствами , которые снижают уровень холестерина. В новых случаях обычно предлагается генетическое консультирование . Гомозиготная СГ часто не реагирует на медикаментозную терапию и может потребовать других методов лечения, включая аферез ЛПНП (удаление ЛПНП методом, аналогичным диализу ) и иногда трансплантацию печени . [4]
Признаки и симптомы [ править ]
Физические признаки [ править ]
Высокий уровень холестерина обычно не вызывает никаких симптомов. Желтые отложения богатого холестерином жира можно увидеть в различных местах тела, например, вокруг век (так называемая ксантелазма пальпебрарум ), на внешнем крае радужной оболочки глаза (известная как старческая дуга роговицы ) и в сухожилиях рук. локти, колени и ступни, особенно ахиллово сухожилие (известное как сухожильная ксантома ). [4] [5]
Сердечно-сосудистые заболевания [ править ]
Ускоренное отложение холестерина в стенках артерий приводит к атеросклерозу , основной причине сердечно-сосудистых заболеваний. Наиболее распространенной проблемой при СГ является развитие ишемической болезни сердца (атеросклероз коронарных артерий , кровоснабжающих сердце ) в гораздо более молодом возрасте, чем можно было бы ожидать в общей популяции. Это может привести к стенокардии (боль в груди или стеснение при нагрузке) или сердечным приступам . Реже артерии головного мозга поражаются ; это может привести к транзиторным ишемическим атакам (краткие эпизоды слабости на одной стороне тела или неспособности говорить) или иногда к инсульту . Окклюзионное заболевание периферических артерий (обструкция артерий ног) встречается преимущественно у курящих людей с СГ ; это может вызвать боль в икроножных мышцах во время ходьбы, которая проходит в покое ( перемежающаяся хромота ), а также проблемы, связанные с уменьшением кровоснабжения стоп (например, гангрена ). [6] Риск атеросклероза увеличивается с возрастом, а также у тех, кто курит, страдает диабетом , высоким кровяным давлением и семейным анамнезом сердечно-сосудистых заболеваний. [4] [7]
Диагностика [ править ]
| Критерии диагностики вероятной гетерозиготной СГ (98% специфичность) [8] | ||||||
|---|---|---|---|---|---|---|
| Родственник 1-й степени родства | население в целом | |||||
| возраст | холестерин | мг/дл | ммоль/л | мг/дл | ммоль/л | |
| < 18 | общий | > 220 | > 5,7 | > 270 | > 7,0 | |
| ЛПНП-Х | > 155 | > 4,0 | > 200 | > 5,2 | ||
| 20–29 | общий | > 240 | > 6,2 | > 290 | > 7,5 | |
| ЛПНП-Х | > 170 | > 4,4 | > 220 | > 5,7 | ||
| 30–39 | общий | > 270 | > 7,0 | > 340 | > 8,8 | |
| ЛПНП-Х | > 190 | > 5,0 | > 240 | > 6,2 | ||
| ≥ 40 | общий | > 290 | > 7,5 | > 360 | > 9,3 | |
| ЛПНП-Х | > 205 | > 5,3 | > 260 | > 6,7 | ||
| Родственниками первой степени являются родители, дети, братья и сестры. | ||||||
Приблизительно 85% людей с этим расстройством не были диагностированы и, следовательно, не получают гиполипидемического лечения. [9] Результаты физикального обследования могут помочь врачу поставить диагноз СГ. Ксантомы сухожилий наблюдаются у 20-40% людей с СГ и являются патогномоничными для этого заболевания. [9] Также может наблюдаться ксантелазма или дуга роговицы. Эти общие признаки подтверждают диагноз, но не являются специфическими. [9]
липидов Измерения
Уровни холестерина могут быть определены в рамках медицинского обследования для медицинского страхования или профессионального здоровья , когда наблюдаются внешние физические признаки, такие как ксантелазма, ксантома, дуга, развиваются симптомы сердечно-сосудистых заболеваний или у члена семьи обнаруживается СГ. картина, совместимая с гиперлипопротеинемией типа IIа по классификации Фредриксона Обычно обнаруживается : повышенный уровень общего холестерина, заметно повышенный уровень липопротеинов низкой плотности (ЛПНП), нормальный уровень липопротеинов высокой плотности (ЛПВП) и нормальный уровень триглицеридов . Уровни общего холестерина 350–550 мг/дл типичны для гетерозиготной СГ, тогда как уровни общего холестерина 650–1000 мг/дл типичны для гомозиготной СГ. [9] ЛПНП обычно превышает 75-й процентиль , то есть у 75% здорового населения уровень ЛПНП будет ниже. [4] Уровни холестерина могут быть значительно выше у людей с СГ, которые также страдают ожирением . [6]
Мутационный анализ [ править ]
На основании изолированного высокого уровня ЛПНП и клинических критериев (которые различаются в зависимости от страны) генетическое тестирование на мутации рецептора ЛПНП, мутации ApoB и PCSK9 можно провести . Мутации выявляются в 50–80% случаев; те, у кого нет мутации, часто имеют более высокие уровни триглицеридов и на самом деле могут иметь другие причины высокого уровня холестерина, такие как комбинированная гиперлипидемия из-за метаболического синдрома . [10]
Дифференциальный диагноз [ править ]
СГ необходимо отличать от семейной комбинированной гиперлипидемии и полигенной гиперхолестеринемии . Уровень липидов и наличие ксантом могут подтвердить диагноз. Ситостеринемия и церебротендинальный ксантоматоз — два редких состояния, которые также могут проявляться преждевременным атеросклерозом и ксантомами. Как правило, измерение уровня холестерина не позволяет дифференцировать пациентов с СГ и ситостеролемией, у которых вместо холестерина животного происхождения накапливается растительный станол. Лечение этого заболевания очень эффективно с помощью класса гиполипидемических средств: эзетимиб. Полигенная гиперхолестеринемия может также включать неврологические или психиатрические проявления, катаракту , диарею и аномалии скелета. [11] Это состояние не сопровождается повышением уровня холестерина в крови, но накопление производных холестерина в сухожилиях может имитировать СГ.
Генетика [ править ]
Наиболее распространенными генетическими дефектами при СГ являются LDLR мутации потери функции ( распространенность 1 на 250, в зависимости от популяции), [3] Мутации потери функции ApoB (распространенность 1 на 1000), мутации усиления функции PCSK9 (менее 1 на 2500) и LDLRAP1 . Родственное заболевание ситостеринемия , которое имеет много общего с СГ, а также характеризуется накоплением холестерина в тканях, обусловлено ABCG5 и ABCG8 . мутациями [4]
Рецептор ЛПНП [ править ]


Ген рецептора ЛПНП ( расположен на коротком плече 19-й хромосомы 19p13.1-13.3). [9] Он состоит из 18 экзонов и занимает 45 т.п.н. , а белковый генный продукт содержит 839 аминокислот в зрелой форме. Единственная аномальная копия (гетерозигота) СГ вызывает сердечно-сосудистые заболевания к 50 годам примерно в 40% случаев. Наличие двух аномальных копий (гомозигот) вызывает ускорение развития атеросклероза в детском возрасте, включая его осложнения. Уровни ЛПНП в плазме обратно пропорциональны активности рецептора ЛПНП (ЛПНП). У гомозигот активность ЛПНП составляет менее 2%, а у гетерозигот дефектный процессинг ЛПНП с активностью рецепторов составляет 2–25%, в зависимости от характера мутации. Известно более 1000 различных мутаций. [4]
Существует пять основных классов СГ, обусловленных мутациями LDLR : [12]
- Класс I: ЛПНП вообще не синтезируется.
- Класс II: ЛПНП не транспортируются должным образом из эндоплазматического ретикулума в аппарат Гольджи для экспрессии на поверхности клетки.
- Класс III: ЛПНП не связываются должным образом с ЛПНП на поверхности клеток из-за дефекта либо аполипопротеина B100 (R3500Q), либо ЛПНП-Р.
- Класс IV: ЛПНП, связанные с ЛПНП, не группируются должным образом в покрытых клатрином ямках для рецептор-опосредованного эндоцитоза (этап пути 2).
- Класс V: ЛПНП не возвращается обратно на поверхность клетки (этап пути 5).
Аполипопротеин B [ править ]
Аполипопротеин B в форме ApoB100 является основным аполипопротеином или белковой частью липопротеиновой частицы. Его ген расположен на второй хромосоме (2p24-p23) и имеет 46,2 т.п.н. длину СГ часто связана с мутацией R3500Q, которая вызывает замену аргинина на глутамин в положении 3500. Мутация локализуется в части белка, которая обычно связывается с рецептором ЛПНП, и в результате мутации связывание снижается. Как и LDLR , количество аномальных копий определяет тяжесть гиперхолестеринемии. [4] [13]
PCSK9 [ править ]
мутации в гене пропротеинконвертазы субтилизин/кексин типа 9 ( PCSK9 ) были связаны с аутосомно-доминантной (т.е. требующей только одной аномальной копии) СГ. В отчете 2003 года [4] [14] Ген расположен на первой хромосоме (1p34.1-p32) и кодирует белок из 666 аминокислот, который экспрессируется в печени. Было высказано предположение, что PCSK9 вызывает СГ главным образом за счет уменьшения количества рецепторов ЛПНП на клетках печени. [15]
LDLRAP1 [ править ]
Аномалии гена ARH , также известного как LDLRAP1 , впервые были зарегистрированы в семье в 1973 году. [16] В отличие от других причин, для развития СГ необходимы две аномальные копии гена (аутосомно-рецессивный тип). Мутации в белке имеют тенденцию вызывать образование укороченного белка. Его реальная функция неясна, но, по-видимому, он играет роль во взаимоотношениях между рецептором ЛПНП и ямками, покрытыми клатрином. Люди с аутосомно-рецессивной гиперхолестеринемией, как правило, имеют более тяжелое заболевание, чем LDLR -гетерозиготы, но менее тяжелое, чем LDLR -гомозиготы. [4]
Патофизиология [ править ]
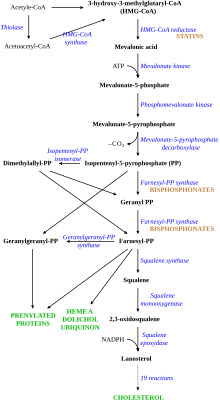
Холестерин ЛПНП обычно циркулирует в организме в течение 2,5 дней, а затем часть холестерина ЛПНП аполипопротеина В связывается с рецептором ЛПНП на клетках печени , запуская его поглощение и переваривание . [9] Этот процесс приводит к удалению ЛПНП из системы кровообращения. Синтез холестерина в печени подавляется по пути ГМГ-КоА-редуктазы . [17] При СГ функция рецепторов ЛПНП снижена или отсутствует. [9] ЛПНП циркулируют в среднем в течение 4,5 дней, что приводит к значительному повышению уровня холестерина ЛПНП в крови при нормальных уровнях других липопротеинов. [6] При мутациях ApoB снижение связывания частиц ЛПНП с рецептором вызывает повышение уровня холестерина ЛПНП. Неизвестно, как мутация вызывает дисфункцию рецептора ЛПНП при мутациях PCSK9 и ARH . [4]
Хотя атеросклероз в определенной степени встречается у всех людей, у людей с СГ может развиться ускоренный атеросклероз из-за избыточного уровня ЛПНП. Степень атеросклероза примерно зависит от количества все еще экспрессируемых рецепторов ЛПНП и функциональности этих рецепторов. При многих гетерозиготных формах СГ функция рецептора нарушается лишь незначительно, а уровни ЛПНП остаются относительно низкими. В более серьезных гомозиготных формах рецептор вообще не экспрессируется. [4]
Некоторые исследования когорт СГ предполагают, что при развитии атеросклероза у человека обычно действуют дополнительные факторы риска. [18] [19] В дополнение к классическим факторам риска, таким как курение, высокое кровяное давление и диабет, генетические исследования показали, что распространенная аномалия в гене протромбина (G20210A) увеличивает риск сердечно-сосудистых событий у людей с СГ. [20] Несколько исследований показали, что высокий уровень липопротеина(а) является дополнительным фактором риска развития ишемической болезни сердца. [21] [22] Также было обнаружено, что риск выше у людей с определенным генотипом ангиотензинпревращающего фермента (АПФ). [23]
Скрининг [ править ]
Скрининг холестерина и генетическое тестирование среди членов семей людей с известной СГ являются экономически эффективными . [24] Другие стратегии, такие как универсальный скрининг в возрасте 16 лет, были предложены в 2001 году. [25] [26] Однако последний подход может оказаться менее экономически эффективным в краткосрочной перспективе. [27] Считалось, что скрининг в возрасте до 16 лет может привести к неприемлемо высокому уровню ложноположительных результатов . [6]
2007 года Метаанализ показал, что «предлагаемая стратегия скрининга детей и родителей на семейную гиперхолестеринемию может оказать значительное влияние на предотвращение медицинских последствий этого заболевания одновременно у двух поколений». [28] «Использование только общего холестерина может лучше всего различать людей с СГ и без СГ в возрасте от 1 до 9 лет». [29] [28]
Было предложено проводить скрининг малышей, а в 2016 году были опубликованы результаты исследования на 10 000 годовалых детей. Необходимо было провести работу, чтобы выяснить, является ли скрининг экономически эффективным и приемлемым для семей. [30] [31] Генетическое консультирование может помочь в проведении генетического тестирования после положительного результата скрининга холестерина на СГ. [32]
Лечение [ править ]
Гетерозиготная СГ [ править ]
Гетерозиготную семейную гиперхолестеринемию (ГСГ) обычно лечат статинами . [9] Статины действуют путем ингибирования фермента гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в печени. В ответ печень вырабатывает больше рецепторов ЛПНП, которые удаляют циркулирующие ЛПНП из крови. Статины эффективно снижают уровень холестерина и ЛПНП, хотя иногда требуется дополнительная терапия другими препаратами, такими как секвестранты желчных кислот ( холестирамин или колестипол ), препаратами никотиновой кислоты или фибратами. [33] [4] Требуется контроль других факторов риска сердечно-сосудистых заболеваний, поскольку риск остается несколько повышенным даже при контроле уровня холестерина. Профессиональные рекомендации рекомендуют, чтобы решение о лечении человека с СГ статинами не основывалось на обычных инструментах прогнозирования риска (например, полученных на основе Фрамингемского исследования сердца ), поскольку они могут недооценивать риск сердечно-сосудистых заболеваний; в отличие от остальной части населения, у СГ с рождения наблюдается высокий уровень холестерина, что, вероятно, увеличивает их относительный риск. [34] До появления статинов клофибрат (более старый фибрат, который часто вызывал образование камней в желчном пузыре ), пробукол (особенно при крупных ксантомах) и тироксин для снижения уровня холестерина ЛПНП использовались .
Более спорным является добавление эзетимиба , который ингибирует всасывание холестерина в кишечнике. Хотя он снижает уровень холестерина ЛПНП, он, по-видимому, не улучшает показатель атеросклероза, называемый толщиной интимы-медиа . Означает ли это, что эзетимиб не приносит общей пользы при СГ, неизвестно. [35]
Не существует интервенционных исследований, которые бы прямо показывали преимущества снижения уровня холестерина в смертности при СГ. Скорее, доказательства пользы получены из ряда исследований, проведенных на людях с полигенной гиперхолестеринемией (в которой наследственность играет меньшую роль). Тем не менее, обсервационное исследование крупного британского регистра в 1999 году показало, что смертность среди людей с СГ начала снижаться в начале 1990-х годов, когда были введены статины. [36]
Когортное исследование показало, что лечение СГ статинами приводит к снижению смертности от ишемической болезни сердца на 48% до такой степени, что вероятность смерти людей от ишемической болезни сердца не выше, чем у населения в целом. Однако если у человека уже была ишемическая болезнь сердца, снижение составило 25%. Результаты подчеркивают важность раннего выявления СГ и лечения статинами. [37]
Алирокумаб и эволокумаб , моноклональные антитела против PCSK9 , специально показаны в качестве дополнения к диете и максимально переносимой терапии статинами для лечения взрослых с гетерозиготной семейной гиперхолестеринемией, которым требуется дополнительное снижение уровня холестерина ЛПНП. [38]
Совсем недавно Инклисиран был одобрен для лечения HeFH.
Хотя моноклональные антитела против PCSK9 высокоэффективны для пациентов с СГ, парентеральное введение делает их менее приемлемыми для пациента. В клинических испытаниях (фаза 2 и фаза 3) изучалось множество пероральных PCSK9, которые вскоре будут приняты для лечения гиперхолестеринемии.
Гомозиготная СГ [ править ]
Гомозиготную семейную гиперхолестеринемию (ГСГ) лечить труднее. Рецепторы ЛПНП (липопротеинов низкой плотности) минимально функциональны, если вообще функционируют. Только высокие дозы статинов, часто в сочетании с другими лекарствами, умеренно эффективны для улучшения уровня липидов. [39] Если медикаментозная терапия не помогает снизить уровень холестерина, аферез ЛПНП можно использовать ; это фильтрует ЛПНП из кровотока в процессе, напоминающем диализ . [4] В очень тяжелых случаях может быть рассмотрена возможность трансплантации печени ; это обеспечивает печень нормально функционирующими рецепторами ЛПНП и приводит к быстрому улучшению уровня холестерина, но с риском осложнений от любой трансплантации паренхиматозных органов (таких как отторжение , инфекции или побочные эффекты лекарств, необходимых для подавления отторжения) . [40] [41] Другие хирургические методы включают частичное шунтирование подвздошной кишки , при котором шунтируют часть тонкой кишки , чтобы уменьшить всасывание питательных веществ и, следовательно, холестерина, и операцию портокавального шунтирования , при которой воротную вену соединяют с полой веной, чтобы обеспечить поступление крови с питательными веществами из кишечник, минуя печень. [42] [43] [44]
Ломитапид – ингибитор микросомального белка-переносчика триглицеридов . [45] был одобрен FDA США в декабре 2012 года как орфанный препарат для лечения гомозиготной семейной гиперхолестеринемии. [46] В январе 2013 года FDA США также одобрило мипомерсен , который ингибирует действие гена аполипопротеина B , для лечения гомозиготной семейной гиперхолестеринемии. [47] [48] [49] Генная терапия является возможной альтернативой в будущем. [50]
Эвинакумаб , моноклональное антитело, ингибирующее ангиопоэтин-подобный белок 3 , было одобрено в 2021 году для дополнительной терапии . [51]
Дети [ править ]
Учитывая, что СГ присутствует с рождения и атеросклеротические изменения могут начаться в раннем возрасте, [52] иногда приходится лечить подростков или даже подростков препаратами, изначально разработанными для взрослых. Из соображений безопасности многие врачи предпочитают использовать секвестранты желчных кислот и фенофибрат, поскольку они разрешены для применения у детей. [53] Тем не менее, статины кажутся безопасными и эффективными. [54] [55] У детей старшего возраста можно применять так же, как у взрослых. [6] [53]
В 2006 году экспертная группа рекомендовала раннюю комбинированную терапию аферезом ЛПНП, статинами и ингибиторами абсорбции холестерина у детей с гомозиготной СГ из группы самого высокого риска. [56]
Эпидемиология [ править ]
Глобальная распространенность СГ составляет около 10 миллионов человек. [9] В большинстве изученных популяций гетерозиготная СГ встречается примерно у 1:250 человек, но не у всех появляются симптомы. [3] Гомозиготная СГ встречается примерно у 1:1 000 000. [4] [6]
Мутации LDLR более распространены в определенных популяциях, предположительно из-за генетического феномена, известного как эффект основателя — они были созданы небольшой группой людей, один или несколько из которых были носителями мутации. Африканеры . , французские канадцы , ливанские христиане и финны имеют высокий уровень специфических мутаций, которые делают СГ особенно распространенной в этих группах Мутации APOB чаще встречаются в Центральной Европе. [4]
История [ править ]
Норвежский врач доктор Карл Мюллер впервые связал физические признаки с высоким уровнем холестерина и аутосомно-доминантным наследованием в 1938 году. [57] В начале 1970-х и 1980-х годов генетическая причина СГ была описана доктором Джозефом Л. Гольдштейном и доктором Майклом С. Брауном из Далласа, штат Техас. Первоначально они обнаружили повышенную активность ГМГ-КоА-редуктазы, но исследования показали, что это не объясняет аномальные уровни холестерина у людей с СГ. [58] Фокус сместился на связывание ЛПНП с его рецептором и влияние нарушения связывания на метаболизм; это оказалось основным механизмом СГ. [59] Впоследствии многочисленные мутации в белке были непосредственно идентифицированы с помощью секвенирования. [12] Позже они получили Нобелевскую премию по медицине 1985 года за открытие рецептора ЛПНП и его влияния на метаболизм липопротеинов. [60]
См. также [ править ]
- Первичная гиперлипопротеинемия
- Семейная гипертриглицеридемия
- Дефицит липопротеинлипазы
- Семейный дефицит апопротеина CII
- Акира Эндо , первооткрыватель первого статина
Ссылки [ править ]
- ^ Пежич Р.Н. (2014). «Семейная гиперхолестеринемия» . Журнал Окснера . 14 (4): 669–72. ПМЦ 4295745 . ПМИД 25598733 .
- ^ Голдберг AC, Хопкинс PN, Тот PP, Баллантайн CM, Рейдер DJ, Робинсон JG, Дэниэлс SR, Гиддинг SS, де Ферранти SD, Ито МК, Макгоуэн MP, Мориарти PM, Cromwell WC, Росс JL, Зиайка П.Е., эксперт Национальной липидной ассоциации Панель по семейному H (июнь 2011 г.). «Семейная гиперхолестеринемия: скрининг, диагностика и ведение педиатрических и взрослых пациентов: клинические рекомендации экспертной группы Национальной липидной ассоциации по семейной гиперхолестеринемии». Журнал клинической липидологии . 5 (3 доп.): С1–8. дои : 10.1016/j.jacl.2011.04.003 . ПМИД 21600525 .
- ↑ Перейти обратно: Перейти обратно: а б с Акиоямен Л.Е., Дженест Дж., Шан С.Д., Рил Р.Л., Альбаум Дж.М., Чу А. и др. (2017). «Оценка распространенности гетерозиготной семейной гиперхолестеринемии: систематический обзор и метаанализ» . БМЖ Опен . 7 (9): e016461. doi : 10.1136/bmjopen-2017-016461 . ПМЦ 5588988 . ПМИД 28864697 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот Рейдер DJ, Коэн Дж, Хоббс Х.Х. (2003). «Моногенная гиперхолестеринемия: новые взгляды на патогенез и лечение» . Дж. Клин. Инвестируйте . 111 (12): 1795–803. дои : 10.1172/JCI18925 . ПМЦ 161432 . ПМИД 12813012 .
- ^ Цули С.Г., Киорцис Д.Н., Аргиропулу М.И., Михайлидис Д.П., Элисаф М.С. (2005). «Патогенез, выявление и лечение ксантом ахиллова сухожилия» . Евро. Дж. Клин. Инвестируйте . 35 (4): 236–44. дои : 10.1111/j.1365-2362.2005.01484.x . ПМИД 15816992 . S2CID 38952905 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Даррингтон П. (2003). «Дислипидемия». Ланцет . 362 (9385): 717–31. дои : 10.1016/S0140-6736(03)14234-1 . ПМИД 12957096 . S2CID 208792416 .
- ^ Янсен А.С., ван Алст-Коэн Э.С., Танк М.В., Трип М.Д., Лансберг П.Дж., Лием А.Х., Ротерс Ван Леннеп Х.В., Сейбрандс Э.Дж., Кастельейн Дж.Дж. (2004). «Вклад классических факторов риска в сердечно-сосудистые заболевания при семейной гиперхолестеринемии: данные 2400 пациентов» . Дж. Стажер. Мед . 256 (6): 482–90. дои : 10.1111/j.1365-2796.2004.01405.x . ПМИД 15554949 . S2CID 25292760 .
- ^ Уильямс Р.Р., Хант С.С., Шумахер М.С. и др. (1993). «Диагностика гетерозиготной семейной гиперхолестеринемии с использованием новых практических критериев, подтвержденных молекулярной генетикой». Я Дж Кардиол . 2 (72): 171–76. дои : 10.1016/0002-9149(93)90155-6 . ПМИД 8328379 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я Репас ТБ, Таннер-младший (февраль 2014 г.). «Профилактика ранней сердечно-сосудистой смерти у пациентов с семейной гиперхолестеринемией» . J Am Доцент остеопата . 114 (2): 99–108. дои : 10.7556/jaoa.2014.023 . ПМИД 24481802 .
- ^ ван Аалст-Коэн Э.С., Янсен А.К., Танк М.В., Дефеш Дж.К., Трип МД, Лансберг П.Дж., Сталенхоф А.Ф., Кастелеин Дж.Дж. (2006). «Диагностика семейной гиперхолестеринемии: актуальность генетического тестирования» . Евро. Сердце Дж . 27 (18): 2240–6. doi : 10.1093/eurheartj/ehl113 . ПМИД 16825289 .
- ^ Могадасян М.Х., Сален Дж., Фрелих Дж.Дж., Скадамор CH (апрель 2002 г.). «Церебротендинозный ксантоматоз: редкое заболевание с многообразными проявлениями». Арх. Нейрол . 59 (4): 527–9. дои : 10.1001/archneur.59.4.527 . ПМИД 11939886 .
- ↑ Перейти обратно: Перейти обратно: а б Хоббс Х.Х., Браун М.С., Гольдштейн Дж.Л. (1992). «Молекулярная генетика гена LDLR при семейной гиперхолестеринемии» . Хм. Мутат . 1 (6): 445–66. дои : 10.1002/humu.1380010602 . ПМИД 1301956 . S2CID 5756814 .
- ^ Вега Г.Л., Гранди С.М. (1986). «Доказательства in vivo снижения связывания липопротеинов низкой плотности с рецепторами как причины первичной умеренной гиперхолестеринемии» . Дж. Клин. Инвестируйте . 78 (5): 1410–4. дои : 10.1172/JCI112729 . ПМК 423848 . ПМИД 3771801 .
- ^ Абифадель М., Варре М., Рабес Ж.П., Аллард Д., Угеррам К., Девиллерс М., Крюо К., Бенжаннет С., Уикхэм Л. (2003). «Мутации в PCSK9 вызывают аутосомно-доминантную гиперхолестеринемию». Нат. Жене . 34 (2): 154–6. дои : 10.1038/ng1161 . ПМИД 12730697 . S2CID 19462210 .
- ^ Сейда Н.Г., Хатиб А.М., Прат А. (2006). «Пропротеинконвертазы и их участие в метаболизме стеринов и / или липидов». Биол. Хим . 387 (7): 871–7. дои : 10.1515/BC.2006.110 . ПМИД 16913836 . S2CID 22395543 .
- ^ Хачадурян А.К., Усман С.М. (1973). «Опыт гомозиготных случаев семейной гиперхолестеринемии. Отчет о 52 пациентах». Нутр Метаб . 15 (1): 132–40. дои : 10.1159/000175431 . ПМИД 4351242 .
- ^ Браун М.С., Гольдштейн Дж.Л. (1974). «Семейная гиперхолестеринемия: дефектное связывание липопротеинов с культивируемыми фибробластами, связанное с нарушением регуляции активности 3-гидрокси-3-метилглутарил-коэнзима А-редуктазы» . Учеб. Натл. акад. наук. США . 71 (3): 788–92. Бибкод : 1974PNAS...71..788B . дои : 10.1073/pnas.71.3.788 . ПМЦ 388099 . ПМИД 4362634 .
- ^ Научный руководящий комитет от имени Регистрационной группы Саймона Брума (1991 г.). «Риск фатальной ишемической болезни сердца при семейной гиперхолестеринемии» . БМЖ . 303 (6807): 893–6. дои : 10.1136/bmj.303.6807.893 . ПМЦ 1671226 . ПМИД 1933004 .
- ^ Сийбрандс Э.Дж., Вестендорп Р.Г., Дефеше Дж.К., де Мейер П.Х., Смелт А.Х., Кастелеин Дж.Дж. (2001). «Смертность в течение двух столетий в крупных родословных с семейной гиперхолестеринемией: исследование смертности генеалогического древа» . БМЖ . 322 (7293): 1019–23. дои : 10.1136/bmj.322.7293.1019 . ПМК 31037 . ПМИД 11325764 .
- ^ Янсен А.С., ван Алст-Коэн Э.С., Танк М.В., Ченг С., Фонтеча М.Р., Ли Дж., Дефеше Дж.К., Кастелеин Дж.Дж. (2005). «Генетические детерминанты риска сердечно-сосудистых заболеваний при семейной гиперхолестеринемии» . Артериосклер. Тромб. Васк. Биол . 25 (7): 1475–81. CiteSeerX 10.1.1.498.4838 . дои : 10.1161/01.ATV.0000168909.44877.a7 . ПМИД 15879303 .
- ^ Виклунд О., Анжелин Б., Олофссон С.О., Эрикссон М., Фагер Г., Берглунд Л., Бонджерс Г. (июнь 1990 г.). «Аполипопротеин (а) и ишемическая болезнь сердца при семейной гиперхолестеринемии». Ланцет . 335 (8702): 1360–1363. дои : 10.1016/0140-6736(90)91242-3 . ПМИД 1971660 . S2CID 27054208 .
- ^ Сид М., Хоппихлер Ф., Ривли Д., Маккарти С., Томпсон Г.Р., Бурвинкль Э., Утерманн Г. (май 1990 г.). «Связь концентрации липопротеина (а) в сыворотке крови и фенотипа аполипопротеина (а) с ишемической болезнью сердца у пациентов с семейной гиперхолестеринемией» (бесплатный полный текст) . Медицинский журнал Новой Англии . 322 (21): 1494–1499. дои : 10.1056/NEJM199005243222104 . ISSN 0028-4793 . ПМИД 2139920 .
- ^ О'Мэлли Дж.П., Маслен К.Л., Иллингворт Д.Р. (19 мая 1998 г.). «Генотип DD ангиотензинпревращающего фермента и сердечно-сосудистые заболевания при гетерозиготной семейной гиперхолестеринемии» . Тираж . 97 (18): 1780–3. дои : 10.1161/01.CIR.97.18.1780 . ПМИД 9603531 .
- ^ Бесселинг Дж., Сьюке Б., Кастелеин Дж.Дж. (август 2015 г.). «Скрининг и лечение семейной гиперхолестеринемии – уроки прошлого и возможности для будущего (на основе лекции Аничкова 2014 г.)». Атеросклероз . 241 (2): 597–606. doi : 10.1016/j.atherosclerosis.2015.06.011 . ПМИД 26115072 .
- ^ Маркс Д., Уандерлинг Д., Торогуд М., Ламберт Х., Хамфрис С.Э., Нил Х.А. (июнь 2002 г.). «Анализ экономической эффективности различных подходов скрининга семейной гиперхолестеринемии» . БМЖ . 324 (7349): 1303. doi : 10.1136/bmj.324.7349.1303 . ПМЦ 113765 . ПМИД 12039822 .
- ^ Уманс-Экенхаузен М.А., Дефеше Дж.К., Сийбрандс Э.Дж., Шеердер Р.Л., Кастелеин Дж.Дж. (январь 2001 г.). «Обзор первых 5 лет скрининга семейной гиперхолестеринемии в Нидерландах». Ланцет . 357 (9251): 165–8. дои : 10.1016/S0140-6736(00)03587-X . ПМИД 11213091 . S2CID 25342898 .
- ^ Маркс Д., Торогуд М., Нил Х.А., Уандерлинг Д., Хамфрис С.Е. (март 2003 г.). «Сравнение затрат и выгод стратегий скрининга семейной гиперхолестеринемии за 10-летний период» . J Мед. общественного здравоохранения . 25 (1): 47–52. doi : 10.1093/pubmed/fdg010 . ПМИД 12669918 .
- ↑ Перейти обратно: Перейти обратно: а б Уолд Д.С., Бествик Дж.П., Уолд, Нью-Джерси (22 сентября 2007 г.). «Детско-родительский скрининг семейной гиперхолестеринемии: стратегия скрининга, основанная на метаанализе» . БМЖ . 335 (7620): 599. doi : 10.1136/bmj.39300.616076.55 . ЧВК 1989026 . ПМИД 17855284 .
- ^ Сенгер АК (1 августа 2012 г.). «Универсальный скрининг липидов у детей и подростков: маленький шаг к первичной профилактике?» . Клиническая химия . 58 (8): 1179–1181. дои : 10.1373/clinchem.2012.182287 . ПМИД 22510399 .
- ^ Кэролайн Паркинсон (27 октября 2016 г.). «Малыши должны пройти тест на риск сердечно-сосудистых заболеваний » . Новости Би-би-си . Проверено 27 октября 2016 г.
- ^ Уолд Д.С., Бествик Дж.П., Моррис Дж.К., Уайт К., Дженкинс Л., Уолд Нью-Джерси (2016). «Детско-родительский скрининг семейной гиперхолестеринемии в учреждениях первичной медико-санитарной помощи» . Медицинский журнал Новой Англии . 375 (17): 1628–1637. дои : 10.1056/NEJMoa1602777 . ISSN 0028-4793 . ПМИД 27783906 .

- ^ «Генетическое консультирование при семейной гиперхолестеринемии | CDC» . www.cdc.gov . 01.04.2020 . Проверено 12 февраля 2021 г.
- ^ Немати М.Х., Астане Б. (2010). «Оптимальное лечение семейной гиперхолестеринемии: стратегии лечения и управления» . Vasc Управление рисками для здоровья . 6 : 1079–1088. дои : 10.2147/VHRM.S8283 . ПМК 3004511 . ПМИД 21191428 .
- ^ Национальный институт здравоохранения и клинического мастерства . Клиническое руководство 71: Семейная гиперхолестеринемия . Лондон, 2008.
- ^ Кастелен Дж. Дж., Акдим Ф., Строес Э.С., Звиндерман А.Х., Ботс М.Л., Сталенхуф А.Ф., Виссерен Ф.Л., Сийбрандс Э.Дж., Трип М.Д. (апрель 2008 г.). «Симвастатин с эзетимибом или без него при семейной гиперхолестеринемии» (PDF) . Н. англ. Дж. Мед . 358 (14): 1431–43. doi : 10.1056/NEJMoa0800742 . ПМИД 18376000 . S2CID 8085257 . Архивировано из оригинала (PDF) 29 июня 2020 г.
- ^ Научный руководящий комитет от имени группы Регистров Саймона Брума (1999). «Смертность при леченной гетерозиготной семейной гиперхолестеринемии: значение для клинического ведения». Атеросклероз . 142 (1): 105–12. дои : 10.1016/S0021-9150(98)00200-7 . ПМИД 9920511 .
- ^ Нил А., Купер Дж., Беттеридж Дж. и др. (ноябрь 2008 г.). «Снижение смертности от всех причин, рака и коронарной смертности у пациентов с гетерозиготной семейной гиперхолестеринемией, получающих статины: проспективное исследование реестра» . Евро. Сердце Дж . 29 (21): 2625–33. doi : 10.1093/eurheartj/ehn422 . ПМК 2577142 . ПМИД 18840879 .
- ^ Ито МК, Сантос РД (16 мая 2016 г.). «Ингибирование PCSK9 моноклональными антителами – современное лечение гиперхолестеринемии» . Журнал клинической фармакологии . Сначала онлайн (1): 7–32. дои : 10.1002/jcph.766 . ПМЦ 5215586 . ПМИД 27195910 .
- ^ Марэ А.Д., Блом Дж., Ферт Дж.К. (январь 2002 г.). «Статины при гомозиготной семейной гиперхолестеринемии». Представитель Curr Atheroscler . 4 (1): 19–25. дои : 10.1007/s11883-002-0058-7 . ПМИД 11772418 . S2CID 8075552 .
- ^ Билхаймер Д.В., Гольдштейн Дж.Л., Гранди С.М., Старзл Т.Е., Браун М.С. (декабрь 1984 г.). «Трансплантация печени для обеспечения рецепторов липопротеинов низкой плотности и снижения уровня холестерина в плазме у ребенка с гомозиготной семейной гиперхолестеринемией» . Н. англ. Дж. Мед . 311 (26): 1658–64. дои : 10.1056/NEJM198412273112603 . ПМК 2975980 . ПМИД 6390206 .
- ^ Ревелл С.П., Ноубл-Джемисон Дж., Джонстон П., Расмуссен А., Джеймисон Н., Барнс Н.Д. (ноябрь 1995 г.). «Трансплантация печени при гомозиготной семейной гиперхолестеринемии» . Арх. Дис. Ребенок . 73 (5): 456–8. дои : 10.1136/adc.73.5.456 . ПМК 1511367 . ПМИД 8554367 .
- ^ Лопес-Сантамария М., Мильяцца Л., Гамес М., Мурсия Х., Диас-Гонсалес М., Камарена С., Йерро Л., Де Ла Вега А., Фраука Э. (апрель 2000 г.). «Трансплантация печени пациентам с гомозиготной семейной гиперхолестеринемией, ранее получавшим сквозное портокавальное шунтирование и подвздошное шунтирование». Ж. Педиатр. Сург . 35 (4): 630–3. дои : 10.1053/jpsu.2000.0350630 . ПМИД 10770402 .
- ^ Бухвальд Х., Варко Р.Л., Боэн Дж.Р., Уильямс С.Е., Хансен Б.Дж., Кампос К.Т., Кэмпбелл Г.С., Пирс М.Б., Йеллин А.Е. (июнь 1998 г.). «Эффективная модификация липидов с помощью частичного подвздошного шунтирования снизила долгосрочную смертность и заболеваемость ишемической болезнью сердца: отчет о пятилетнем послеоперационном наблюдении POSCH. Программа хирургического контроля гиперлипидемий». Арх. Стажер. Мед . 158 (11): 1253–61. дои : 10.1001/archinte.158.11.1253 . ПМИД 9625405 . S2CID 27446759 .
- ^ Билхаймер Д.В., Гольдштейн Дж.Л., Гранди С.М., Браун М.С. (декабрь 1975 г.). «Снижение уровня холестерина и синтеза липопротеинов низкой плотности после операции портокавального шунтирования у пациента с гомозиготной семейной гиперхолестеринемией» . Дж. Клин. Инвестируйте . 56 (6): 1420–30. дои : 10.1172/JCI108223 . ПМК 333120 . ПМИД 172531 .
- ^ Кучел М., Блоедон Л.Т., Сапари П.О., Колански Д.М., Вулф М.Л., Саркис А., Миллар Дж.С., Икеваки К., Сигельман Э.С. (январь 2007 г.). «Ингибирование микросомального белка-переносчика триглицеридов при семейной гиперхолестеринемии» . Н. англ. Дж. Мед . 356 (2): 148–56. doi : 10.1056/NEJMoa061189 . ПМИД 17215532 .
- ^ «FDA одобрило новый орфанный препарат для лечения редкого нарушения холестерина» (пресс-релиз). Управление по контролю за продуктами и лекарствами США. 26 декабря 2012 г. Архивировано из оригинала 31 декабря 2012 г.
- ^ Астане Б., Махдами Н., Астане В., Гайятт Дж. (июль 2021 г.). «Эффект мипомерсена при лечении пациентов с семейной гиперхолестеринемией: систематический обзор и метаанализ клинических исследований» . J Cardiovasc Dev Dis . 8 (7): 82. doi : 10.3390/jcdd8070082 . ПМК 8304130 . ПМИД 34357325 .
- ^ Поллак А (29 января 2013 г.). «FDA одобрило генетический препарат для лечения редких заболеваний» . Нью-Йорк Таймс .
- ^ «FDA одобрило новый орфанный препарат Кинамро для лечения наследственного холестерина» (пресс-релиз). Управление по контролю за продуктами и лекарствами США. 29 января 2013 г. Архивировано из оригинала 2 февраля 2013 г.
- ^ Гроссман М., Рейдер Дж., Мюллер Д.В., Колански Д.М., Козарски К., Кларк Б.Дж., Штейн Э.А., Лупиен П.Дж., Брюэр Х.Б. (ноябрь 1995 г.). «Пилотное исследование генной терапии ex vivo гомозиготной семейной гиперхолестеринемии». Нат. Мед . 1 (11): 1148–54. дои : 10.1038/нм1195-1148 . ПМИД 7584986 . S2CID 3194865 .
- ^ «Утверждения новых лекарств на 2021 год» . FDA . 13 мая 2022 г.
- ^ Мабути Х., Коидзуми Дж., Симидзу М., Такеда Р. (февраль 1989 г.). «Развитие ишемической болезни сердца при семейной гиперхолестеринемии». Тираж . 79 (2): 225–32. дои : 10.1161/01.CIR.79.2.225 . ПМИД 2914343 .
- ↑ Перейти обратно: Перейти обратно: а б Грин О., Даррингтон П. (май 2004 г.). «Клиническое ведение детей и молодых людей с гетерозиготной семейной гиперхолестеринемией в Великобритании» . JR Soc Med . 97 (5): 226–9. дои : 10.1177/014107680409700505 . ПМЦ 1079462 . ПМИД 15121812 .
- ^ Роденбург Дж., Виссерс М.Н., Вигман А., Трип М.Д., Баккер Х.Д., Кастелеин Дж.Дж. (август 2004 г.). «Семейная гиперхолестеринемия у детей». Курс. Мнение. Липидол . 15 (4): 405–11. дои : 10.1097/01.mol.0000137228.92396.f3 . ПМИД 15243213 . S2CID 38754088 .
- ^ Вигман А., Хуттен Б.А., де Гроот Э., Роденбург Дж., Баккер Х.Д., Бюллер Х.Р., Сийбрандс Э.Дж., Кастелеин Дж.Дж. (июль 2004 г.). «Эффективность и безопасность терапии статинами у детей с семейной гиперхолестеринемией: рандомизированное контролируемое исследование». ДЖАМА . 292 (3): 331–7. дои : 10.1001/jama.292.3.331 . ПМИД 15265847 .
- ^ Кейви Р.Э., Аллада В., Дэниелс С.Р., Хейман Л.Л., МакКриндл Б.В., Ньюбургер Дж.В., Парех Р.С., Стейнбергер Дж., Группа экспертов Американской кардиологической ассоциации по науке о профилактике народонаселения (декабрь 2006 г.). «Снижение сердечно-сосудистого риска у педиатрических пациентов из группы высокого риска: научное заявление Экспертной группы Американской кардиологической ассоциации по популяционной и профилактической науке; Советов по сердечно-сосудистым заболеваниям у молодежи, эпидемиологии и профилактике, питанию, физической активности и обмену веществ, высокому кровяному давлению». Исследования, уход за сердечно-сосудистыми заболеваниями и почки при сердечных заболеваниях и Междисциплинарная рабочая группа по исследованию качества медицинской помощи и результатов: одобрено Американской академией педиатрии» . Тираж . 114 (24): 2710–38. doi : 10.1161/CIRCULATIONAHA.106.179568 . ПМИД 17130340 .
- ^ Мюллер С (1938). «Ксантома, гиперхолестеринемия, стенокардия». Акта Медика Скандинавика . 95 Приложение (89): 75–84. дои : 10.1111/j.0954-6820.1938.tb19279.x .
- ^ Гольдштейн Дж. Л., Браун М. С. (октябрь 1973 г.). «Семейная гиперхолестеринемия: выявление дефекта регуляции активности 3-гидрокси-3-метилглутарил-коэнзима А-редуктазы, связанного с перепроизводством холестерина» . Учеб. Натл. акад. наук. США . 70 (10): 2804–8. Бибкод : 1973PNAS...70.2804G . дои : 10.1073/pnas.70.10.2804 . ПМК 427113 . ПМИД 4355366 .
- ^ Браун М.С., Гольдштейн Дж.Л. (январь 1976 г.). «Рецепторно-опосредованный контроль метаболизма холестерина». Наука . 191 (4223): 150–4. Бибкод : 1976Sci...191..150B . дои : 10.1126/science.174194 . ПМИД 174194 .
- ^ Нобелевская премия.org. «Медицина 1985» . Проверено 28 февраля 2008 г.