Серин/треонин-специфическая протеинкиназа
| Протеин-сериновые/треониновые киназы | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.11.- | ||
| Номер CAS. | 9026-43-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||

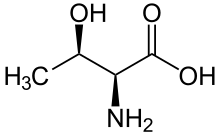
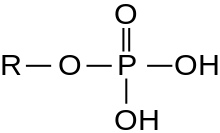

Серин /треониновая протеинкиназа ( EC 2.7.11.- ) представляет собой киназный фермент , в частности протеинкиназу , которая фосфорилирует аминокислотных ОН-группу остатков серина или треонина , которые имеют сходные боковые цепи. По меньшей мере 350 из более чем 500 протеинкиназ человека являются серин/треониновыми киназами (STK). [2]
В энзимологии термин протеинкиназа описывает класс ферментов семейства трансфераз , которые переносят фосфаты к атому кислорода сериновой серин/ треониновая или треониновой боковой цепи в белках . Этот процесс называется фосфорилированием . Фосфорилирование белков, в частности, играет значительную роль в широком спектре клеточных процессов и является очень важной посттрансляционной модификацией . [3] [4] [5] [6] [7] [8] [9]
Химическую реакцию, осуществляемую этими ферментами, можно записать как
- АТФ + белок АДФ + фосфопротеин
Таким образом, двумя субстратами этого фермента являются АТФ и белок , тогда как двумя его продуктами являются АДФ и фосфопротеин .
Систематическое название этого класса ферментов — АТФ:протеинфосфотрансфераза (неспецифическая) .
Функция
[ редактировать ]Серин/треониновые киназы играют роль в регуляции пролиферации клеток, запрограммированной гибели клеток ( апоптоз ), дифференцировке клеток и эмбриональном развитии. [ нужна ссылка ]
Селективность
[ редактировать ]Хотя все серин/треониновые киназы фосфорилируют остатки серина или треонина в своих субстратах, они выбирают определенные остатки для фосфорилирования на основе остатков, фланкирующих фосфоакцепторный сайт, которые вместе составляют консенсусную последовательность . Поскольку остатки консенсусной последовательности целевого субстрата контактируют только с несколькими ключевыми аминокислотами в каталитической щели киназы (обычно посредством гидрофобных сил и ионных связей ), киназа обычно не специфична к одному субстрату, но вместо этого может фосфорилировать целое «семейство субстратов», которое имеет общие последовательности узнавания. Хотя каталитический домен этих киназ высококонсервативен , вариация последовательности, наблюдаемая в киноме (подмножестве генов в геноме, кодирующих киназы), обеспечивает распознавание различных субстратов. Многие киназы ингибируются псевдосубстратом , который связывается с киназой как настоящий субстрат, но не имеет аминокислоты, подлежащей фосфорилированию. Когда псевдосубстрат удаляется, киназа может выполнять свою нормальную функцию. [ нужна ссылка ]
номера ЕС
[ редактировать ]Многие серин/треониновые протеинкиназы не имеют собственных индивидуальных номеров EC и используют 2.7.11.1, «неспецифическую серин/треониновую протеинкиназу». Эта запись предназначена для любого фермента, который фосфорилирует белки при превращении АТФ в АДФ (т. е. АТФ:протеинфосфотрансферазы). [10] 2.7.11.37 «протеинкиназа» раньше была общим заполнителем и была разделена на несколько записей (включая 2.7.11.1) в 2005 году. [11] 2.7.11.70 «протаминкиназа» была объединена с 2.7.11.1 в 2004 году. [12]
2.7.11.- это общий уровень, на котором должны находиться все серин/треониновые киназы. [13]
Типы
[ редактировать ]Типы включают те, которые действуют непосредственно как мембраносвязанные рецепторы ( рецепторная протеинсерин/треониновая киназа ) и внутриклеточные киназы, участвующие в передаче сигнала . Из последних к типам относятся:
| Номер ЕС | Имя | Описание |
|---|---|---|
| ЭК 2.7.11.1 | CK2, также известный под неправильным названием казеинкиназа 2. | был открыт в 1954 году Бернеттом и Кеннеди. |
| ЭК 2.7.11.1 | Mos / Raf киназы | являются частью семейства MAPKK-киназ и активируются факторами роста. Фермент действует, стимулируя рост клеток. Ингибирование Raf стало мишенью для новых антиметастатических противораковых препаратов, поскольку они ингибируют каскад МАРК и уменьшают пролиферацию клеток. |
| ЭК 2.7.11.1 | Протеинкиназа B, также известная как AKT. киназа | Ген v-akt был идентифицирован как ретровируса AKT8 онкоген . Ген кодирует протеинкиназу. Человеческие гомологи онкогенного белка AKT8 были идентифицированы в 1987 году. К 1995 году было обнаружено, что киназы Akt функционируют как митоген-активируемые киназы, расположенные ниже рецепторов клеточной поверхности, которые активируют фосфоинозитид-3-киназу . Существуют три человеческих гена akt. Все три киназы Akt регулируют пролиферацию клеток, а Akt2 особенно важен для действия инсулина в клетках. Основной мишенью киназ Akt является киназа-3 гликогенсинтазы . |
| ЭК 2.7.11.1 | Кожа | представляет собой серин/треониновую киназу, которая может фосфорилировать себя, а также Tube и Toll. |
| ЭК 2.7.11.11 | Протеинкиназа А | состоит из двух доменов: небольшого домена с несколькими структурами β-листов и более крупного домена, содержащего несколько α-спиралей . Сайты связывания субстрата и АТФ расположены в каталитической щели между доменами (или долями). Когда АТФ и субстрат связываются, две доли вращаются так, что концевая фосфатная группа АТФ и целевая аминокислота субстрата перемещаются в правильные положения для проведения каталитической реакции. |
| ЭК 2.7.11.13 | Протеинкиназа C («PKC») | на самом деле представляет собой семейство протеинкиназ, состоящее из ~10 изоферментов . Они разделены на три подсемейства: традиционные (или классические), новые и атипичные, в зависимости от их требований к вторичному мессенджеру. |
| ЭК 2.7.11.24 | Митоген-активируемые протеинкиназы (МАРК) | отвечают на внеклеточные стимулы (митогены) и регулируют различные клеточные активности, такие как экспрессия генов, митоз, дифференцировка и выживание/апоптоз клеток. |
| ЭК 2.7.11.17 | Са2+/кальмодулин-зависимые протеинкиназы или СаМ-киназы (CAMK) | в первую очередь регулируются Ca 2+ / кальмодулиновый комплекс. |
| ЭК 2.7.11.19 | киназа фосфорилазы | фактически была первой открытой протеинкиназой Ser/Thr (в 1959 году Кребсом и др. ). |
Клиническое значение
[ редактировать ]Экспрессия серин/треониновой киназы (STK) изменяется при многих типах рака . [14] Ограниченная польза ингибиторов серин/треониновой киназы была продемонстрирована при раке яичников. [15] но исследования продолжаются для оценки их безопасности и эффективности. [ нужна ссылка ]
Серин/треониновая протеинкиназа p90-kDa, рибосомальная киназа S6 (RSK) участвует в развитии некоторых видов рака простаты . [16]
Ингибирование Raf стало мишенью для новых антиметастатических противораковых препаратов, поскольку они ингибируют каскад МАРК и уменьшают пролиферацию клеток. [ нужна ссылка ]
См. также
[ редактировать ]- Белковая серин/треонинфосфатаза , фермент обратного процесса.
- Псевдокиназа , белок без ферментативной активности ( псевдофермент ). Это может быть связано с белками этого класса.
- Серин/треониновая киназа АТМ , ответственная за расстройство атаксия-телеангиэктазия .
Ссылки
[ редактировать ]- ^ Новаковски Дж.; Кронин, Китай; Макри, Делавэр; Кнут, М.В.; Нельсон, CG; Павлетич, Н.П.; Роджерс, Дж.; Санг, Британская Колумбия; Шайбе, Д.Н.; Суонсон, Р.В.; Томпсон, Д.А. (2002). «Структуры протеинкиназ Aurora-A, FAK и EphA2, связанных с раком, по данным нанообъемной кристаллографии» . Структура . 10 (12): 1659–1667. дои : 10.1016/S0969-2126(02)00907-3 . ПМИД 12467573 .
- ^ Моди, В; Данбрэк, РЛ (24 декабря 2019 г.). «Структурно подтвержденное множественное выравнивание последовательностей 497 доменов протеинкиназы человека» . Научные отчеты . 9 (1): 19790. Бибкод : 2019НатСР...919790М . дои : 10.1038/s41598-019-56499-4 . ПМК 6930252 . ПМИД 31875044 .
- ^ Дамуни З., Рид Л.Дж. (1988). «Очистка и свойства протаминкиназы и казеинкиназы типа II из митохондрий бычьих почек». Арх. Биохим. Биофиз . 262 (2): 574–84. дои : 10.1016/0003-9861(88)90408-0 . ПМИД 2835010 .
- ^ Баджо Б., Пинна Л.А., Море В., Силипранди Н. (1970). «Простая процедура очистки фосвитинкиназы печени крысы». Биохим. Биофиз. Акта . 212 (3): 515–7. дои : 10.1016/0005-2744(70)90261-5 . ПМИД 5456997 .
- ^ Джергил Б., Диксон Г.Х. (1970). «Протаминкиназа из семенников радужной форели. Частичная очистка и характеристика» . Ж. Биол. Хим . 245 (2): 425–34. дои : 10.1016/S0021-9258(18)63408-8 . ПМИД 4312674 .
- ^ Ланган Т.А. (1969). «Действие аденозин-3',5'-монофосфат-зависимой гистоновой киназы in vivo» . Ж. Биол. Хим . 244 (20): 5763–5. дои : 10.1016/S0021-9258(18)63626-9 . ПМИД 4310608 .
- ^ Такеучи М., Янагида М. (1993). «Митотическая роль новой протеинкиназы делящихся дрожжей dsk1 с фосфорилированием и локализацией, зависящими от стадии клеточного цикла» . Мол. Биол. Клетка . 4 (3): 247–60. дои : 10.1091/mbc.4.3.247 . ПМК 300923 . ПМИД 8485317 .
- ^ НФ; Лютцельбергер, М; Вейгманн, Х; Клингенхофф, А; Шеной, С; Койфер, Н.Ф. (1997). «Функциональный анализ протеинкиназы Prp4 делящихся дрожжей, участвующей в сплайсинге пре-мРНК и выделении предполагаемого гомолога млекопитающих» . Нуклеиновые кислоты Рез . 25 (5): 1028–35. дои : 10.1093/нар/25.5.1028 . ПМК 146536 . ПМИД 9102632 .
- ^ Ван Й., Хофманн Т.Г., Рункель Л., Хааф Т., Шаллер Х., Дебатин К., Хуг Х. (2001). «Выделение и характеристика кДНК протеинкиназы HIPK2». Биохим. Биофиз. Акта . 1518 (1–2): 168–72. дои : 10.1016/S0167-4781(00)00308-0 . ПМИД 11267674 .
- ^ «ФЕРМЕНТ-2.7.11.1 неспецифическая серин/треониновая протеинкиназа» . энзим.expasy.org . Проверено 25 декабря 2023 г.
- ^ «ФЕРМЕНТ КЕГГ: 2.7.1.37» . www.genome.jp . Проверено 25 декабря 2023 г.
- ^ «ФЕРМЕНТ КЕГГ: 2.7.1.70» . www.genome.jp . Проверено 25 декабря 2023 г.
- ^ «ЭК 2.7.11» . iubmb.qmul.ac.uk . Проверено 25 декабря 2023 г.
- ^ Капра, Мария; Нучифоро, Паоло Джованни; Конфалоньери, Стефано; В-четвертых, Микаэла; Бьянки, Марко; Небулони, Мануэла; Болдорини, Ренцо; Паллотти, Франческо; Виале, Джузеппе; Гишицкий Михаил Леонидович; Дрэтта, Джулио Ф.; Фиоре, Пьер Паоло Ди (15 августа 2006 г.). «Частые изменения в экспрессии серин/треонин киназ при раке человека». Исследования рака . 66 (16): 8147–8154. дои : 10.1158/0008-5472.CAN-05-3489 . ПМИД 16912193 .
- ^ Чикконе, Марсия А.; Маоз, Асаф; Касабар, Дженнифер К.; Мачида, Хироко; Мабути, Сейджи; Мацуо, Кодзи (2 июля 2016 г.). «Клинический результат лечения ингибиторами серин-треониновой киназы при рецидивирующем эпителиальном раке яичников: систематический обзор литературы» . Экспертное заключение об исследуемых препаратах . 25 (7): 781–796. дои : 10.1080/13543784.2016.1181748 . ПМЦ 7534810 . ПМИД 27101098 .
- ^ Кларк, Делавэр; Эррингтон, ТМ; Смит, Дж.А.; Фриерсон, ХФ; Вебер, MJ; Ланниган, Д.А. (15 апреля 2005 г.). «Серин/треониновая протеинкиназа, рибосомальная киназа S6 p90, является важным регулятором пролиферации клеток рака простаты». Исследования рака . 65 (8): 3108–3116. дои : 10.1158/0008-5472.CAN-04-3151 . ПМИД 15833840 .
Внешние ссылки
[ редактировать ]- протеин-серин-треонин+киназы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- KinCore (конформационный ресурс киназы)
