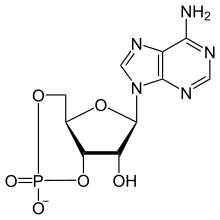
Циклический аденозинмонофосфат
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Аденозин 3',5'-(фосфат водорода) | |
| Систематическое название ИЮПАК (4a R ,6 R ,7 R ,7a S )-6-(6-амино- 9H -пурин-9-ил)-2,7-дигидрокситетрагидро- 2H ,4H - 2λ 5 -фуро[3,2- d ][1,3,2]диоксафосфинин-2-он | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.000.448 |
| КЕГГ | |
| МеШ | Циклический+AMP |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 10 Ч 11 Н 5 О 6 П | |
| Молярная масса | 329.206 g/mol |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |


Циклический аденозинмонофосфат ( цАМФ , циклический АМФ или 3',5'-циклический аденозинмонофосфат ) представляет собой вторичный мессенджер или клеточный сигнал, происходящий внутри клеток, который важен во многих биологических процессах. цАМФ является производным аденозинтрифосфата (АТФ) и используется для внутриклеточной передачи сигналов во многих различных организмах, передавая цАМФ-зависимый путь .
История [ править ]
Эрл Сазерленд из Университета Вандербильта получил Нобелевскую премию по физиологии и медицине в 1971 году «за открытия, касающиеся механизмов действия гормонов, особенно адреналина, через вторичные мессенджеры (такие как циклический аденозинмонофосфат, циклический АМФ).
Синтез [ править ]
Циклический АМФ синтезируется из АТФ аденилатциклазой , расположенной на внутренней стороне плазматической мембраны и закрепляющейся в различных местах внутри клетки. [1] Аденилатциклаза активируется рядом сигнальных молекул посредством активации стимулирующих аденилатциклазу G( Gs ) -белковых рецепторов. Аденилатциклаза ингибируется агонистами ингибирующих аденилатциклазу G( Gi ) -белковых рецепторов. Аденилатциклаза печени сильнее реагирует на глюкагон, а аденилатциклаза мышц сильнее реагирует на адреналин.
Разложение цАМФ до АМФ катализируется ферментом фосфодиэстеразой .
Функции [ править ]
цАМФ — это вторичный мессенджер , используемый для внутриклеточной передачи сигналов, например, для передачи в клетки эффектов таких гормонов, как глюкагон и адреналин , которые не могут пройти через плазматическую мембрану. Он также участвует в активации протеинкиназ . Кроме того, цАМФ связывается и регулирует функцию ионных каналов, таких как каналы HCN , и некоторых других белков, связывающих циклические нуклеотиды, таких как Epac1 и RAPGEF2 .
Роль в эукариотических клетках [ править ]
цАМФ связан с функцией киназ в нескольких биохимических процессах, включая регуляцию гликогена , сахара и липидного обмена . [2]
У эукариот циклический АМФ активирует протеинкиназу А (PKA или цАМФ-зависимая протеинкиназа ). ПКА обычно неактивен как тетрамерный голофермент , состоящий из двух каталитических и двух регуляторных единиц (C 2 R 2 ), причем регуляторные единицы блокируют каталитические центры каталитических единиц.
Циклический АМФ связывается с определенными участками регуляторных единиц протеинкиназы и вызывает диссоциацию между регуляторными и каталитическими субъединицами, тем самым позволяя этим каталитическим единицам фосфорилировать белки -субстраты.
Активные субъединицы катализируют перенос фосфата от АТФ к специфическим остаткам серина или треонина белковых субстратов. Фосфорилированные белки могут действовать непосредственно на ионные каналы клетки или могут активировать или ингибировать ферменты. Протеинкиназа А также может фосфорилировать специфические белки, которые связываются с промоторными областями ДНК, вызывая усиление транскрипции. Не все протеинкиназы реагируют на цАМФ. Некоторые классы протеинкиназ , включая протеинкиназу С, не являются цАМФ-зависимыми.
Дальнейшие эффекты в основном зависят от цАМФ-зависимой протеинкиназы , которая варьируется в зависимости от типа клетки.
Тем не менее, существуют некоторые второстепенные PKA-независимые функции цАМФ, например, активация кальциевых каналов , обеспечивающая второстепенный путь, по которому гормон, высвобождающий гормон роста, вызывает высвобождение гормона роста .
Однако мнение о том, что большинство эффектов цАМФ контролируется ПКА, является устаревшим. В 1998 году было открыто семейство цАМФ-чувствительных белков с активностью фактора обмена гуаниновых нуклеотидов (GEF). Они называются обменными белками, активируемыми цАМФ (Epac), и семейство включает Epac1 и Epac2 . [3] Механизм активации аналогичен механизму активации ПКА: домен GEF обычно маскируется N-концевой областью, содержащей домен связывания цАМФ. Когда цАМФ связывается, домен диссоциирует и обнажает теперь активный домен GEF, позволяя Epac активировать небольшие Ras-подобные белки GTPase, такие как Rap1 .
цАМФ у социальных секретируемого Дополнительная роль амеб
У видов Dictyostelium discoideum цАМФ действует вне клетки как секретируемый сигнал. Хемотаксическая агрегация клеток организуется периодическими волнами цАМФ , распространяющимися между клетками на расстояния до нескольких сантиметров. Волны являются результатом регулируемого производства и секреции внеклеточного цАМФ и спонтанного биологического осциллятора, который инициирует волны в центрах территорий. [4]
Роль в бактериях [ править ]
У бактерий уровень цАМФ варьируется в зависимости от среды, используемой для роста. В частности, уровень цАМФ низкий, когда источником углерода является глюкоза. Это происходит за счет ингибирования фермента, продуцирующего цАМФ, аденилатциклазы , что является побочным эффектом транспорта глюкозы в клетку. транскрипционного фактора Белок рецептора цАМФ (CRP), также называемый CAP (белок-активатор гена катаболита), образует комплекс с цАМФ и тем самым активируется для связывания с ДНК. СРБ-цАМФ увеличивает экспрессию большого количества генов, включая некоторые кодирующие ферменты , которые могут поставлять энергию независимо от глюкозы.
цАМФ, например, участвует в позитивной регуляции lac -оперона . В среде с низкой концентрацией глюкозы цАМФ накапливается и связывается с аллостерическим сайтом СРБ ( белка-рецептора цАМФ ), белка-активатора транскрипции. Белок принимает свою активную форму и связывается со специфическим участком выше lac-промотора, что облегчает связывание РНК-полимеразы с соседним промотором и начало транскрипции lac-оперона, увеличивая скорость транскрипции lac-оперона. При высокой концентрации глюкозы концентрация цАМФ снижается, и СРБ отделяется от lac-оперона.
Патология [ править ]
Поскольку циклический АМФ является вторичным мессенджером и играет жизненно важную роль в передаче сигналов клетками, он участвует в различных нарушениях, но не ограничивается ролью, указанной ниже:
человека рака в развитии Роль
Некоторые исследования показали, что дерегуляция путей цАМФ и аберрантная активация генов, контролируемых цАМФ, связаны с ростом некоторых видов рака. [5] [6] [7]
коры префронтальной в нарушениях Роль
Недавние исследования показывают, что цАМФ влияет на функцию мышления высшего порядка в префронтальной коре посредством регуляции ионных каналов, называемых гиперполяризационно-активируемыми циклическими нуклеотидными каналами (HCN). Когда цАМФ стимулирует HCN, каналы открываются. Это исследование, особенно когнитивного дефицита при возрастных заболеваниях и СДВГ, представляет интерес для исследователей, изучающих мозг. [8]
цАМФ участвует в активации тригеминоцервикальной системы, что приводит к нейрогенному воспалению и вызывает мигрень. [9]
возбудителей инфекционных в патогенезе Роль заболеваний
Нарушение функционирования цАМФ отмечено как один из механизмов действия некоторых бактериальных экзотоксинов.
Их можно разделить на две отдельные категории: [10]
- Токсины, которые влияют на ферменты АДФ-рибозилтрансферазы и
- инвазивные аденилатциклазы .
связанные , Токсины
- Холерный токсин представляет собой токсин AB , который имеет пять субъединиц B и одну субъединицу A. Токсин действует по следующему механизму: во-первых, кольцо субъединицы B холерного токсина связывается с GM1 ганглиозидами на поверхности клеток-мишеней. Если в клетке отсутствует GM1, токсин, скорее всего, связывается с другими типами гликанов, такими как Lewis Y и Lewis X, прикрепленными к белкам, а не к липидам. [11] [12] [13] [10]
Использует [ править ]
Форсколин обычно используется в качестве инструмента в биохимии для повышения уровня цАМФ при изучении и исследовании физиологии клеток . [14]
См. также [ править ]
- Циклический гуанозинмонофосфат (цГМФ)
- 8-Бромаденозин-3',5'-циклический монофосфат (8-Br-цАМФ)
- Акрасин, специфичный для хемотаксического применения у Dictyostelium discoideum .
- фосфодиэстераза 4 (ФДЭ 4), которая разрушает цАМФ.
Ссылки [ править ]
- ^ Рахман Н., Бак Дж., Левин Л.Р. (ноябрь 2013 г.). «Определение pH с помощью регулируемой бикарбонатом «растворимой» аденилатциклазы (sAC)» . Фронт Физиол . 4 : 343. дои : 10.3389/fphys.2013.00343 . ПМЦ 3838963 . ПМИД 24324443 .
- ^ Али Э.С., Хуа Дж., Уилсон CH, Таллис Г.А., Чжоу Ф.Х., Рычков Г.Я., Барритт Г.Дж. (2016). «Аналог глюкагоноподобного пептида-1 эксендин-4 обращает вспять нарушенную внутриклеточную передачу сигналов Ca2+ в стеатотических гепатоцитах» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1863 (9): 2135–46. дои : 10.1016/j.bbamcr.2016.05.006 . ПМИД 27178543 .
- ^ Бос, Йоханнес Л. (декабрь 2006 г.). «Белки Epac: многоцелевые мишени цАМФ». Тенденции биохимических наук . 31 (12): 680–686. дои : 10.1016/j.tibs.2006.10.002 . ПМИД 17084085 .
- ^ Андерсон, Питер А.В. (11 ноября 2013 г.). Эволюция первых нервных систем . Springer Science & Business Media. ISBN 978-1-4899-0921-3 .
- ^ Абрамович, Ринат; Тавор, Эйнат; Джейкоб-Хирш, Жасмин; Зейра, Эвелин; Амариглио, Нинетт; Паппо, Орит; Рехави, Гидеон; Галун, Эйтан; Хонигман, Алик (15 февраля 2004 г.). «Американская ассоциация исследований рака (гены, реагирующие на цАМФ, и прогрессирование опухоли)» . Исследования рака . 64 (4): 1338–1346. дои : 10.1158/0008-5472.CAN-03-2089 . ПМИД 14973073 . S2CID 14047485 .
- ^ Дюмаз, Николя; Хейворд, Роберт; Мартин, Ян; Огилви, Лесли; Хедли, Дуглас; Кертин, Джон А.; Бастиан, Борис К.; Спрингер, Кэролайн; Марэ, Ришар (октябрь 2006 г.). «Американская ассоциация исследований рака (дисрегуляция цАМФ и мелонома)» . Исследования рака . 66 (19): 9483–9491. doi : 10.1158/0008-5472.CAN-05-4227 . ПМИД 17018604 .
- ^ Симпсон, Би Джей; Рэймидж, AD; Халм, MJ; Бернс, диджей; Кацарос, Д.; Лэнгдон, СП; Миллер, WR (январь 1996 г.). «Американская ассоциация исследований рака (наличие цАМФ-связывающих белков в опухолях)» . Клинические исследования рака . 2 (1): 201–206.
- ^ «ScienceDaily::Мозговые сети укрепляются за счет закрытия ионных каналов: исследования могут привести к лечению СДВГ» .
- ^ Сегатто, Марко (2021). «Нейрогенное воспаление: участник мигрени и последние достижения в области трансляционных исследований» . Биомедицины . 10 (1): 76. doi : 10.3390/biomedicines10010076 . ПМЦ 8773152 . ПМИД 35052756 .
- ^ Jump up to: Перейти обратно: а б Катер, Х; Акториес, К. (15 ноября 1983 г.). «Система цАМФ и бактериальный токсин [Система цАМФ и бактериальные токсины]» . Клин Вохеншр . 61 (22): 1109–1114. дои : 10.1007/BF01530837 . ПМИД 6317939 . S2CID 33162709 . Проверено 26 февраля 2022 г.
- ^ Эмберлин М. Вандс; Акико Фудзита (октябрь 2015 г.). «Фукозилирование и гликозилирование белков создают функциональные рецепторы для холерного токсина» . электронная жизнь . Том. 4. дои : 10.7554/eLife.09545 .
- ^ Сервин Дж., Вандс А.М., Кассельбрант А., Ву Х., Кришнамурти С., Цветкович А. и др. (2018)Ганглиозид-независимая интоксикация GM1 холерным токсином. PLoS Pathog 14(2): e1006862. https://doi.org/10.1371/journal.ppat.1006862
- ^ Фукозилированные молекулы конкурентно препятствуют связыванию холерного токсина с клетками-хозяевами; Эмберлин М. Вандс, Джейкоб Сервин, Хэ Хуанг, Е Чжан, Гьюсаанг Юн, Чад А. Бротигам, Мария Мэтсон Дзебо, Пер Бьорклунд, Вилле Валлениус, Даниэль К. Брайт, Клэй С. Беннетт, Пернилла Виттунг-Стафшеде, Николь С. Сэмпсон, Ульф Йрлид и Дженнифер Дж. Колер; Статья ACS об инфекционных заболеваниях как можно скорее, DOI: 10.1021/acsinfecdis.7b00085
- ^ Аласбахи, Р.Х.; Мельциг, МФ (январь 2012 г.). «Форсколин и производные как инструменты для изучения роли цАМФ». Die Pharmazie . 67 (1): 5–13. ПМИД 22393824 .