глюкагон
| глюкагон | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GCG(53-81)глюкагонглюкагон рекомбинантный | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Генные карты : [1] ; ОМА : - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Глюкагон – пептидный гормон , вырабатываемый альфа-клетками поджелудочной железы . Он повышает концентрацию глюкозы и жирных кислот в кровотоке и считается основным катаболическим гормоном организма. [1] Он также используется в качестве лекарства для лечения ряда заболеваний. Его действие противоположно действию инсулина , который снижает внеклеточную глюкозу. [2] Он вырабатывается из проглюкагона , кодируемого геном GCG .
Поджелудочная железа высвобождает глюкагон, когда количество глюкозы в кровотоке слишком низкое. Глюкагон заставляет печень участвовать в гликогенолизе : преобразовании накопленного гликогена в глюкозу , которая высвобождается в кровоток. [3] С другой стороны, высокий уровень глюкозы в крови стимулирует высвобождение инсулина. Инсулин позволяет глюкозе поглощаться и использоваться инсулинозависимыми тканями. Таким образом, глюкагон и инсулин являются частью системы обратной связи, которая поддерживает стабильный уровень глюкозы в крови. Глюкагон увеличивает расход энергии и повышается в условиях стресса. [4] Глюкагон принадлежит к семейству секретиновых гормонов.
Структура [ править ]
Глюкагон представляет собой из 29 аминокислот полипептид . Его первичная структура у человека: NH 2 - His - Ser - Gln - Gly - Thr - Phe - Thr - Ser - Asp - Tyr - Ser - Lys - Tyr - Leu - Asp - Ser - Arg - Arg - Ala - Gln - Asp - Phe - Val - Gln - Trp - Leu - Met - Asn - Thr - COOH (HSQGTFTSDYSKYLDSRRAQDFVQWLMNT).
Полипептид имеет молекулярную массу 3485 дальтон . [5] Глюкагон – пептидный ( нестероидный ) гормон.
Физиология [ править ]
Производство [ править ]
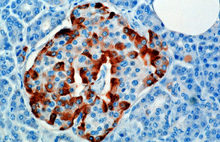
Гормон синтезируется и секретируется альфа-клетками (α-клетками) островков Лангерганса , которые расположены в эндокринной части поджелудочной железы. Глюкагон вырабатывается из гена препроглюкагона Gcg . препроглюкагона сначала Сигнальный пептид удаляется сигнальной пептидазой , образуя белок проглюкагон из 160 аминокислот . [6] Затем проглюкагон расщепляется пропротеинконвертазой 2 до глюкагона (аминокислоты 33–61) в α-клетках островков поджелудочной железы. кишечника В L-клетках проглюкагон расщепляется до альтернативных продуктов: глицентина (1–69), родственного глицентину полипептида поджелудочной железы (1–30), оксинтомодулина (33–69), глюкагоноподобного пептида 1 (72–107 или 108), и глюкагоноподобный пептид 2 (126–158). [6]
У грызунов альфа-клетки расположены по внешнему краю островка. Структура островков человека гораздо менее разделена, и альфа-клетки распределены по островку в непосредственной близости от бета-клеток. Глюкагон также вырабатывается альфа-клетками желудка. [7]
Недавние исследования показали, что производство глюкагона может происходить и за пределами поджелудочной железы, при этом кишечник является наиболее вероятным местом экстрапанкреатического синтеза глюкагона. [8]
Регламент [ править ]
Производство, которое в противном случае является свободным, подавляется/регулируется амилином , пептидным гормоном, секретируемым совместно с инсулином из β-клеток поджелудочной железы. [9] По мере снижения уровня глюкозы в плазме последующее снижение секреции амилина облегчает его подавление α-клеток, обеспечивая секрецию глюкагона.
Секрецию глюкагона стимулируют:
- Гипогликемия
- Адреналин (через β2, α2, [10] и α1 [11] адренергические рецепторы)
- Аргинин
- Аланин (часто в результате переаминирования пирувата/глутамата в мышцах (см. реакцию аланинтрансаминазы ).
- Ацетилхолин [12]
- Холецистокинин
- Желудочный ингибирующий полипептид
- Гастрин [13]
Секрецию глюкагона подавляют:
- Соматостатин
- Амилин [9]
- Инсулин (через ГАМК ) [14]
- PPARγ / ретиноидного X-рецептора Гетеродимер . [15]
- Увеличение количества свободных жирных кислот и кетокислот в крови. [16]
- Увеличение мочевины производства
- Глюкагоноподобный пептид-1
Функция [ править ]
Глюкагон обычно повышает концентрацию глюкозы в крови , способствуя глюконеогенезу и гликогенолизу . [17] Глюкагон также снижает синтез жирных кислот в жировой ткани и печени, а также способствует липолизу в этих тканях, что заставляет их высвобождать жирные кислоты в кровообращение, где они могут катаболизироваться для выработки энергии в тканях, таких как скелетные мышцы , когда это необходимо. [18]
Глюкоза хранится в печени в форме полисахарида гликогена , который представляет собой глюкан (полимер, состоящий из молекул глюкозы). Клетки печени ( гепатоциты ) имеют рецепторы глюкагона . Когда глюкагон связывается с рецепторами глюкагона, клетки печени преобразуют гликоген в отдельные молекулы глюкозы и высвобождают их в кровоток в процессе, известном как гликогенолиз . Когда эти запасы истощаются, глюкагон побуждает печень и почки синтезировать дополнительную глюкозу путем глюконеогенеза . Глюкагон выключает гликолиз в печени, в результате чего промежуточные гликолитические соединения переходят в глюконеогенез.
Глюкагон также регулирует скорость производства глюкозы посредством липолиза. Глюкагон индуцирует липолиз у людей в условиях подавления инсулина (например, при сахарном диабете 1 типа ). [19]
Производство глюкагона, по-видимому, зависит от центральной нервной системы посредством путей, которые еще предстоит определить. выработку глюкагона на . Сообщалось, что у беспозвоночных животных удаление глазных стеблей влияет Удаление глазного стебля у молодых раков , вызванной глюкагоном приводит к гипергликемии . [20]
Механизм действия [ править ]
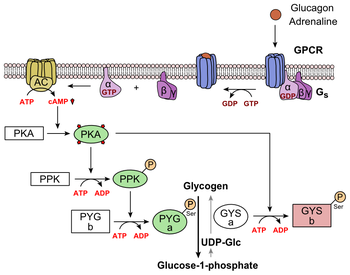
Глюкагон связывается с рецептором глюкагона , рецептором, связанным с G-белком , расположенным в плазматической мембране клетки. Изменение конформации рецептора активирует белок G , гетеротримерный белок с субъединицами αs , β и γ. Когда белок G взаимодействует с рецептором, он претерпевает конформационное изменение, которое приводит к замене молекулы GDP , связанной с α-субъединицей, на молекулу GTP . [21] Эта замена приводит к высвобождению субъединицы α из субъединиц β и γ. Альфа-субъединица специфически активирует следующий фермент каскада — аденилатциклазу .
Аденилатциклаза производит циклический аденозинмонофосфат (циклический АМФ или цАМФ), который активирует протеинкиназу А (цАМФ-зависимую протеинкиназу). Этот фермент, в свою очередь, активирует киназу фосфорилазы , которая затем фосфорилирует гликогенфосфорилазу b (PYG b), превращая ее в активную форму, называемую фосфорилазой а (PYG a). Фосфорилаза А — фермент, ответственный за высвобождение глюкозо-1-фосфата из полимеров гликогена. Примером пути может служить связывание глюкагона с трансмембранным белком. Трансмембранные белки взаимодействуют с Gɑβ𝛾. Gαs отделяется от Gβ𝛾 и взаимодействует с трансмембранной протеин-аденилатциклазой. Аденилатциклаза катализирует превращение АТФ в цАМФ. цАМФ связывается с протеинкиназой А, и комплекс фосфорилирует киназу гликогенфосфорилазы. [22] Фосфорилированная киназа гликогенфосфорилазы фосфорилирует гликогенфосфорилазу . Фосфорилированная гликогенфосфорилаза отрезает остатки глюкозы от гликогена в виде глюкозо-1-фосфата.
Кроме того, скоординированный контроль гликолиза и глюконеогенеза в печени регулируется состоянием фосфорилирования ферментов, которые катализируют образование мощного активатора гликолиза, называемого фруктозо-2,6-бисфосфатом. [23] Фермент протеинкиназа А (ПКА), который стимулировался каскадом, инициируемым глюкагоном, также фосфорилирует один остаток серина бифункциональной полипептидной цепи, содержащей как ферменты фруктозо-2,6-бисфосфатазу, так и фосфофруктокиназу-2. Это ковалентное фосфорилирование, инициируемое глюкагоном, активирует первый и ингибирует второй. Это регулирует реакцию, катализирующую фруктозо-2,6-бисфосфат (мощный активатор фосфофруктокиназы-1, фермента, который является основным регуляторным этапом гликолиза). [24] замедляя скорость его образования, тем самым ингибируя поток пути гликолиза и позволяя преобладать глюконеогенезу. Этот процесс обратим в отсутствие глюкагона (и, следовательно, в присутствии инсулина).
Стимуляция ПКА глюкагоном инактивирует гликолитический фермент пируваткиназу . [25] инактивирует гликогенсинтазу , [26] и активирует гормон-чувствительную липазу , [27] который катаболизирует глицериды в глицерин и свободные жирные кислоты в гепатоцитах.
Глюкагон также инактивирует ацетил-КоА-карбоксилазу , которая создает малонил-КоА из ацетил-КоА, посредством цАМФ-зависимых и/или цАМФ-независимых киназ. [28]
Малонил-КоА является побочным продуктом цикла Кребса (после гликолиза) и аллостерическим ингибитором карнитинпальмитоилтрансферазы I (CPT1) , митохондриального фермента, важного для доставки жирных кислот в межмембранное пространство митохондрий для β-окисления. [29] Глюкагон снижает содержание малонил-КоА за счет ингибирования ацетил-КоА-карбоксилазы и за счет снижения гликолиза за счет вышеупомянутого снижения содержания фруктозо-2,6-бисфосфата. Таким образом, снижение малонил-КоА является общим регулятором усиления эффектов глюкагона на метаболизм жирных кислот.
Патология [ править ]
Аномально повышенные уровни глюкагона могут быть вызваны опухолями поджелудочной железы , такими как глюкагонома , симптомы которой включают некролитическую мигрирующую эритему , [30] снижение аминокислот и гипергликемия. Это может произойти отдельно или в контексте множественной эндокринной неоплазии 1-го типа . [31]
Повышенный уровень глюкагона является основным фактором, способствующим гипергликемическому кетоацидозу при недиагностированном или плохо леченном диабете 1 типа. Поскольку бета-клетки перестают функционировать, инсулин и ГАМК поджелудочной железы больше не присутствуют, чтобы подавлять свободную выработку глюкагона. В результате глюкагон высвобождается из альфа-клеток в максимуме, вызывая быстрый распад гликогена до глюкозы и быстрый кетогенез . [32] Было обнаружено, что подгруппе взрослых с диабетом 1 типа потребовалось в среднем в 4 раза больше времени для достижения кетоацидоза, когда им давали соматостатин (ингибирует выработку глюкагона) без инсулина. [ нужна ссылка ] Ингибирование глюкагона было популярной идеей лечения диабета, однако некоторые предупреждают, что это приведет к хрупкому диабету у пациентов с достаточно стабильным уровнем глюкозы в крови. [ нужна ссылка ]
Считается, что отсутствие альфа-клеток (и, следовательно, глюкагона) является одним из основных факторов, влияющих на чрезвычайную нестабильность уровня глюкозы в крови в условиях тотальной панкреатэктомии .
История [ править ]
В начале 1920-х годов несколько групп отметили, что экстракты поджелудочной железы, вводимые животным с диабетом, приводят к кратковременному повышению уровня сахара в крови, а затем к снижению уровня сахара в крови, вызванному инсулином. [6] В 1922 году К. Кимбалл и Джон Р. Мерлин идентифицировали компонент экстрактов поджелудочной железы, ответственный за повышение уровня сахара в крови, назвав его «глюкагоном», что означает « » агонист глюкозы . [6] [33] В 1950-х годах ученые компании Eli Lilly выделили чистый глюкагон, кристаллизовали его и определили его аминокислотную последовательность. [6] [34] [35] Это привело к разработке первого радиоиммуноанализа для обнаружения глюкагона, описанного группой Роджера Унгера в 1959 году. [6]
Более полное понимание его роли в физиологии и заболеваниях не было установлено до 1970-х годов, когда был разработан специальный радиоиммуноанализ . [36]
См. также [ править ]
Ссылки [ править ]
- ^ Воет Д., Воет Дж.Г. (2011). Биохимия (4-е изд.). Нью-Йорк: Уайли.
- ^ Рис Дж., Кэмпбелл Н. (2002). Биология . Сан-Франциско: Бенджамин Каммингс. ISBN 978-0-8053-6624-2 .
- ^ Орсе Дж (2014). Биология 1: Молекулы . Examkrackers Inc. с. 77. ИСБН 978-1-893858-70-1 .
- ^ Джонс Б.Дж., Тан Т., Блум С.Р. (март 2012 г.). «Мини-обзор: Глюкагон в стрессе и энергетическом гомеостазе» . Эндокринология . 153 (3): 1049–54. дои : 10.1210/en.2011-1979 . ПМК 3281544 . ПМИД 22294753 .
- ^ Унгер Р.Х., Орчи Л. (июнь 1981 г.). «Глюкагон и А-клетка: физиология и патофизиология (первые две части)». Медицинский журнал Новой Англии . 304 (25): 1518–24. дои : 10.1056/NEJM198106183042504 . ПМИД 7015132 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Мюллер Т.Д., Финан Б., Клемменсен С., ДиМарчи Р.Д., Чоп М.Х. (апрель 2017 г.). «Новая биология и фармакология глюкагона». Физиол преп . 97 (2): 721–766. doi : 10.1152/physrev.00025.2016 . ПМИД 28275047 .
- ^ Унгер Р.Х., Черрингтон А.Д. (январь 2012 г.). «Глюкагоноцентрическая реструктуризация диабета: патофизиологические и терапевтические изменения» . Журнал клинических исследований . 122 (1): 4–12. дои : 10.1172/JCI60016 . ПМК 3248306 . ПМИД 22214853 .
- ^ Холст Дж.Дж., Холланд В., Громада Дж., Ли Ю., Унгер Р.Х., Ян Х., Слуп К.В., Киффер Т.Дж., Дамонд Н., Эррера П.Л. (апрель 2017 г.). «Инсулин и глюкагон: партнеры на всю жизнь» . Эндокринология . 158 (4): 696–701. дои : 10.1210/en.2016-1748 . ПМК 6061217 . ПМИД 28323959 .
- ↑ Перейти обратно: Перейти обратно: а б Чжан XX, Пан Ю.Х., Хуан Ю.М., Чжао Х.Л. (май 2016 г.). «Нейроэндокринный гормон амилин при диабете» . Всемирный журнал диабета . 7 (9): 189–197. дои : 10.4239/wjd.v7.i9.189 . ПМЦ 4856891 . ПМИД 27162583 .
- ^ Лейден Б.Т., Дурай В., Лоу В.Л. (2010). «Рецепторы, связанные с G-белком, островки поджелудочной железы и диабет» . Природное образование . 3 (9): 13.
- ^ Скоглунд Г., Лундквист И., Арен Б. (ноябрь 1987 г.). «Активация альфа-1- и альфа-2-адренорецепторов повышает уровень глюкагона в плазме у мышей». Европейский журнал фармакологии . 143 (1): 83–8. дои : 10.1016/0014-2999(87)90737-0 . ПМИД 2891547 .
- ^ Хани Р.Н., Вейр Г.К. (октябрь 1980 г.). «Ацетилхолин стимулирует высвобождение инсулина, глюкагона и соматостатина в перфузируемой куриной поджелудочной железе». Эндокринология . 107 (4): 1065–8. дои : 10.1210/эндо-107-4-1065 . ПМИД 6105951 .
- ^ РЕХФЕЛЬД, ЙЕНС (февраль 1978 г.). «Влияние гастрина на базальную и стимулируемую аминокислотами секрецию инсулина и глюкагона у человека» . Европейский журнал клинических исследований . 8 (1): 5–9. дои : 10.1111/j.1365-2362.1978.tb00800.x . ПМИД 417933 . S2CID 38154468 .
- ^ Сюй Э, Кумар М, Чжан Й, Джу В, Обата Т, Чжан Н, Лю С, Вендт А, Дэн С, Эбина Й, Уилер МБ, Браун М, Ван Кью (январь 2006 г.). «Внутриостровковый инсулин подавляет высвобождение глюкагона через систему рецепторов ГАМК-ГАМКА» . Клеточный метаболизм . 3 (1): 47–58. дои : 10.1016/j.cmet.2005.11.015 . ПМИД 16399504 .
- ^ Кретцнер Р., Фрёлих Ф., Леплер К., Шредер М., Рехер К., Дикель С., Цветков М.В., Квентин Т., Этьен Э., Кнепель В. (февраль 2008 г.). «Гетеродимер рецептора гамма-ретиноида X, активируемого пролифератором пероксисомы, физически взаимодействует с активатором транскрипции PAX6, ингибируя транскрипцию гена глюкагона». Молекулярная фармакология . 73 (2): 509–17. дои : 10.1124/моль.107.035568 . ПМИД 17962386 . S2CID 10108970 .
- ^ Джонсон Л.Р. (2003). Основная медицинская физиология . Академическая пресса. стр. 643 –. ISBN 978-0-12-387584-6 .
- ^ Воет Д., Воет Дж.Г. (2011). Биохимия (4-е изд.). Нью-Йорк: Уайли.
- ^ Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чоп М.Х. (декабрь 2010 г.). «Возврат к метаболическому действию глюкагона» . Обзоры природы. Эндокринология . 6 (12): 689–697. дои : 10.1038/nrendo.2010.187 . ПМЦ 3563428 . ПМИД 20957001 .
- ^ Лильженквист Дж. Э., Бомбой Дж. Д., Льюис С.Б., Синклер-Смит BC, Фелтс П.В., Лейси В.В., Кроффорд О.Б., Лиддл Г.В. (январь 1974 г.). «Влияние глюкагона на липолиз и кетогенез у нормальных мужчин и мужчин с диабетом» . Журнал клинических исследований . 53 (1): 190–7. дои : 10.1172/JCI107537 . ПМК 301453 . ПМИД 4808635 .
- ^ Лейнен Р.Л., Джаннини А.Дж. (1983). «Влияние удаления глазного стебля на гипергликемию, вызванную глюкагоном, у раков». Рефераты Общества нейронаук . 9 : 604.
- ^ «Сигнальный путь глюкагона» . Новости-Medical.net . 01.03.2018 . Проверено 30 марта 2021 г.
- ^ Ю Кью, Шуай Х., Ахоогхаландари П., Гилф Э., Тенгхольм А. (июль 2019 г.). «Глюкоза контролирует секрецию глюкагона путем прямой модуляции цАМФ в альфа-клетках» . Диабетология . 62 (7): 1212–1224. дои : 10.1007/s00125-019-4857-6 . ПМК 6560012 . ПМИД 30953108 .
- ^ Хюэ Л., Райдер М.Х. (июль 1987 г.). «Роль фруктозо-2,6-бисфосфата в контроле гликолиза в тканях млекопитающих» . Биохимический журнал . 245 (2): 313–24. дои : 10.1042/bj2450313 . ПМЦ 1148124 . ПМИД 2822019 .
- ^ Клаус Т.Х., Эль-Маграби М.Р., Реген Д.М., Стюарт Х.Б., МакГрейн М., Кунц П.Д., Найфелер Ф., Пилкис Дж., Пилкис С.Дж. (1984). Роль фруктозо-2,6-бисфосфата в регуляции углеводного обмена . Актуальные темы клеточной регуляции. Том. 23. С. 57–86. дои : 10.1016/b978-0-12-152823-2.50006-4 . ISBN 9780121528232 . ПМИД 6327193 .
- ^ Фелиу Дж.Э., Хюэ Л., Hers HG (август 1976 г.). «Гормональный контроль активности пируваткиназы и глюконеогенеза в изолированных гепатоцитах» . Труды Национальной академии наук Соединенных Штатов Америки . 73 (8): 2762–6. Бибкод : 1976PNAS...73.2762F . дои : 10.1073/pnas.73.8.2762 . ПМК 430732 . ПМИД 183209 .
- ^ Цзян Г, Чжан Б.Б. (апрель 2003 г.). «Глюкагон и регуляция метаболизма глюкозы» . Am J Physiol Endocrinol Metab . 284 (4): Е671-8. дои : 10.1152/ajpendo.00492.2002 . ПМИД 12626323 .
- ^ Хаяши Ю. (январь 2021 г.). «Глюкагон регулирует липолиз и окисление жирных кислот через рецептор инозитолтрифосфата 1 в печени» . Исследование диабета . 12 (1): 32–34. дои : 10.1111/jdi.13315 . ПМЦ 7779274 . ПМИД 32506830 .
- ^ Свенсон Т.Л., Портер Дж.В. (25 марта 1985 г.). «Механизм ингибирования глюкагоном ацетил-КоА-карбоксилазы печени. Взаимосвязь эффектов фосфорилирования, полимер-протомерного перехода и цитрата на активность фермента» . Журнал биологической химии . 2460 (6): 3791–3797. дои : 10.1016/S0021-9258(19)83693-1 . ПМИД 2857722 .
- ^ Ван Ю, Юй В, Ли С, Го Д, Хэ Дж, Ван Ю (11 марта 2022 г.). «Ацетил-КоА-карбоксилазы и болезни» . Границы онкологии . 12 . дои : 10.3389/fonc.2022.836058 . ПМЦ 8963101 . ПМИД 35359351 .
- ^ Джон А.М., Шварц Р.А. (декабрь 2016 г.). «Синдром глюкагономы: обзор и обновленная информация о лечении». Журнал Европейской академии дерматологии и венерологии . 30 (12): 2016–2022. дои : 10.1111/jdv.13752 . ПМИД 27422767 . S2CID 1228654 .
- ^ Оберг К. (декабрь 2010 г.). «Эндокринные опухоли поджелудочной железы». Семинары по онкологии . 37 (6): 594–618. doi : 10.1053/j.seminoncol.2010.10.014 . ПМИД 21167379 .
- ^ Фасанмаде О.А., Одения И.А., Огбера А.О. (июнь 2008 г.). «Диабетический кетоацидоз: диагностика и лечение». Африканский журнал медицины и медицинских наук . 37 (2): 99–105. ПМИД 18939392 .
- ^ Кимбалл С., Мерлин Дж (1923). «Водные экстракты поджелудочной железы III. Некоторые реакции преципитации инсулина» . Ж. Биол. Хим . 58 (1): 337–348. дои : 10.1016/S0021-9258(18)85474-6 .
- ^ Стауб А., Синн Л., Беренс ОК (июнь 1953 г.). «Очистка и кристаллизация гипергликемического гликогенолитического фактора (HGF)». Наука . 117 (3049): 628–9. Бибкод : 1953Sci...117..628S . дои : 10.1126/science.117.3049.628 . ПМИД 13056638 .
- ^ Бромер В., Винн Л., Беренс О. (1957). «Аминокислотная последовательность глюкагона V. Расположение амидных групп, исследования кислотной деградации и краткое изложение последовательных доказательств». Дж. Ам. хим. Соц . 79 (11): 2807–2810. дои : 10.1021/ja01568a038 .
- ^ Лундквист, Гудмар; Эдвардс, Джон; Уайд, Лейф (январь 1976 г.). «Твердофазный радиоиммуноанализ панкреатического глюкагона» . Упсальский журнал медицинских наук . 81 (2): 65–69. дои : 10.3109/03009737609179024 . ISSN 0300-9734 . ПМИД 785743 .
Внешние ссылки [ править ]
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для человеческого глюкагона.