Первичная структура белка


Первичная структура белка это линейная последовательность аминокислот — в пептиде или белке . [1] Обычно первичную структуру белка описывают, начиная с аминоконцевого (N) конца и заканчивая карбоксильным (С) концом. Биосинтез белка чаще всего осуществляется рибосомами в клетках. Пептиды также можно синтезировать в лаборатории. Первичные структуры белков можно секвенировать непосредственно или вывести из последовательностей ДНК .
Формирование
[ редактировать ]Биологический
[ редактировать ]Аминокислоты полимеризуются посредством пептидных связей с образованием длинной основной цепи , вдоль которой выступают различные боковые цепи аминокислот. В биологических системах белки производятся во время трансляции клетки рибосомами . Некоторые организмы также могут создавать короткие пептиды путем нерибосомального пептидного синтеза , в котором часто используются аминокислоты, отличные от стандартных 20, и которые могут подвергаться циклизации, модификации и сшиванию.
Химическая
[ редактировать ]Пептиды можно синтезировать химическим путем с помощью ряда лабораторных методов. Химические методы обычно синтезируют пептиды в порядке, противоположном (начиная с С-конца) биологическому синтезу белка (начиная с N-конца).
Обозначения
[ редактировать ]Последовательность белка обычно обозначается строкой букв, в которой перечислены аминокислоты, начиная с амино -конца и до карбоксильного конца. Для обозначения 20 встречающихся в природе аминокислот, а также смесей или неоднозначных аминокислот можно использовать либо трехбуквенный, либо однобуквенный код (аналогично нотации нуклеиновых кислот ). [1] [2] [3]
Пептиды можно секвенировать непосредственно или вывести из последовательностей ДНК . В настоящее время существуют большие базы данных последовательностей , в которых сопоставляются известные последовательности белков.
| Аминокислота | 3-буквенный [4] | 1-буква [4] |
|---|---|---|
| Аланин | Земля | А |
| Аргинин | Арг | Р |
| Аспарагин | Асн | Н |
| Аспарагиновая кислота | Асп | Д |
| Цистеин | Цис | С |
| Глутаминовая кислота | Глу | И |
| Глютамин | Глн | вопрос |
| Глицин | Гли | Г |
| Гистидин | Его | ЧАС |
| изолейцин | С | я |
| Лейцин | Лео | л |
| Лизин | Свет | К |
| Метионин | Из | М |
| Фенилаланин | Пхе | Ф |
| Пролин | Про | П |
| Серин | Быть | С |
| Треонин | чр | Т |
| Триптофан | Трп | В |
| Тирозин | Тир | И |
| Валин | Вал | V |
| Символ | Описание | Представленные остатки |
|---|---|---|
| Х | Любая аминокислота или неизвестная | Все |
| Б | Аспартат или Аспарагин | Д, Н |
| С | Глутамат или глутамин | Э, Кью |
| Дж | Лейцин или изолейцин | я, л |
| Ф | гидрофобный | В, Я, Л, Ж, Ж, М |
| Ой | Ароматный | Ф, Ш, Ю, Ч |
| P.S. | Алифатический | В, Я, Л, М |
| п | Маленький | П, Г, А, С |
| г | гидрофильный | S, T, H, N, Q, E, D, K, R, Y |
| + | Положительно заряженный | К, Р, Ч |
| - | Отрицательно заряжен | Д, Э |
Модификация
[ редактировать ]В общем, полипептиды представляют собой неразветвленные полимеры, поэтому их первичную структуру часто можно определить с помощью последовательности аминокислот вдоль их основной цепи. Однако белки могут сшиваться, чаще всего за счет дисульфидных связей , а первичная структура также требует указания сшивающих атомов, например, указания цистеинов , участвующих в дисульфидных связях белка. Другие сшивки включают десмозин .
изомеризация
[ редактировать ]Хиральные центры полипептидной цепи могут подвергаться рацемизации . Хотя это не меняет последовательность, оно влияет на химические свойства последовательности. В частности, L -аминокислоты, обычно присутствующие в белках, могут спонтанно изомеризоваться в атом с образованием D -аминокислот, которые не расщепляются большинством протеаз . Кроме того, пролин может образовывать стабильные транс-изомеры по пептидной связи.
Посттрансляционная модификация
[ редактировать ]Кроме того, белок может подвергаться множеству посттрансляционных модификаций , которые кратко суммированы здесь.
N-концевая аминогруппа полипептида может быть модифицирована ковалентно, например,
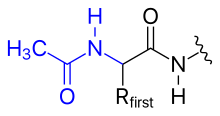
- ацетилирование
- Положительный заряд N-концевой аминогруппы можно устранить, заменив ее ацетильной группой (N-концевая блокировка).
- формилирование
- N-концевой метионин, обычно обнаруживаемый после трансляции, имеет N-конец, заблокированный формильной группой. Эта формильная группа (а иногда и сам остаток метионина, если за ним следует Gly или Ser) удаляется ферментом деформилазой .
- пироглутамат
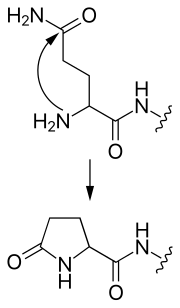
- N-концевой глютамин может атаковать сам себя, образуя циклическую пироглутаматную группу.
- миристоилирование
- Аналогично ацетилированию. Вместо простой метильной группы миристоильная группа имеет хвост из 14 гидрофобных атомов углерода, что делает ее идеальной для закрепления белков на клеточных мембранах .
С-концевая карбоксилатная группа полипептида также может быть модифицирована, например,
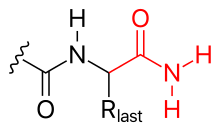
- аминирование (см. рисунок)
- С-конец также может быть заблокирован (таким образом, нейтрализуя его отрицательный заряд) путем аминирования.
- присоединение гликозилфосфатидилинозитола (GPI)
- Гликозилфосфатидилинозитол (ГФИ) представляет собой большую гидрофобную простетическую группу фосфолипидов, которая закрепляет белки на клеточных мембранах . Он прикрепляется к С-концу полипептида посредством амидной связи, которая затем соединяется с этаноламином, затем с различными сахарами и, наконец, с липидным фрагментом фосфатидилинозитола.
пептида Наконец, боковые цепи также могут быть модифицированы ковалентно, например,
- фосфорилирование
- Помимо расщепления, фосфорилирование , возможно, является наиболее важной химической модификацией белков. Фосфатная группа может быть присоединена к гидроксильной группе боковой цепи остатков серина, треонина и тирозина, добавляя отрицательный заряд в этом месте и образуя неприродную аминокислоту. Такие реакции катализируются киназами , а обратная реакция катализируется фосфатазами. Фосфорилированные тирозины часто используются в качестве «ручек», с помощью которых белки могут связываться друг с другом, тогда как фосфорилирование Ser/Thr часто вызывает конформационные изменения, предположительно из-за введенного отрицательного заряда. Эффекты фосфорилирования Ser/Thr иногда можно смоделировать путем мутации остатка Ser/Thr на глутамат.
- Обобщающее название для набора очень распространенных и очень гетерогенных химических модификаций. Фрагменты сахара могут быть присоединены к гидроксильным группам боковой цепи Ser/Thr или к амидным группам боковой цепи Asn. Такие присоединения могут выполнять множество функций: от повышения растворимости до комплексного распознавания. Любое гликозилирование можно блокировать с помощью определенных ингибиторов, таких как туникамицин .
- дезамидирование (образование сукцинимида)
- В этой модификации боковая цепь аспарагина или аспартата атакует следующую пептидную связь, образуя симметричное промежуточное соединение сукцинимида. При гидролизе промежуточного продукта образуется либо аспартат, либо β-аминокислота изо(Asp). В случае аспарагина любой продукт приводит к потере амидной группы и, следовательно, к «дезамидированию».
- Остатки пролина могут быть гидроксилированы по любому из двух атомов, как и лизин (по одному атому). Гидроксипролин является важным компонентом коллагена , который становится нестабильным при его потере. Реакция гидроксилирования катализируется ферментом, которому требуется аскорбиновая кислота (витамин С), дефицит которой приводит ко многим заболеваниям соединительной ткани, таким как цинга .
- Некоторые белковые остатки могут быть метилированы, особенно положительные группы лизина и аргинина . Остатки аргинина взаимодействуют с фосфатным остовом нуклеиновой кислоты и обычно образуют водородные связи с основными остатками, особенно гуанином , в комплексах белок-ДНК. Остатки лизина могут быть однократно, дважды и даже трижды метилированы. Однако метилирование не меняет положительный заряд боковой цепи.
- Ацетилирование аминогрупп лизина химически аналогично ацетилированию N-конца. Однако функционально ацетилирование остатков лизина используется для регуляции связывания белков с нуклеиновыми кислотами. Упразднение положительного заряда лизина ослабляет электростатическое притяжение (отрицательно заряженных) нуклеиновых кислот.
- сульфатирование
- Тирозины могут сульфатироваться на своих атом. Несколько необычно то, что эта модификация происходит в аппарате Гольджи , а не в эндоплазматическом ретикулуме . Подобно фосфорилированным тирозинам, сульфатированные тирозины используются для специфического узнавания, например, в хемокиновых рецепторах на поверхности клетки. Как и при фосфорилировании, сульфатирование добавляет отрицательный заряд к ранее нейтральному участку.
- пренилирование и пальмитоилирование
- Гидрофобные изопреновые (например, фарнезильные, геранильные и геранилгеранильные группы) и пальмитоильные группы могут быть добавлены к атом остатков цистеина для закрепления белков на клеточных мембранах . В отличие от GPI и миритоильных якорей, эти группы не обязательно добавляются на концах.
- карбоксилирование
- Относительно редкая модификация, которая добавляет дополнительную карбоксилатную группу (и, следовательно, двойной отрицательный заряд) к боковой цепи глутамата, образуя остаток Gla. Это используется для усиления связывания ионов «твердых» металлов, таких как кальций .
- АДФ-рибозилирование
- Большая группа АДФ-рибозила может переноситься на несколько типов боковых цепей белков с гетерогенными эффектами. Эта модификация является мишенью для мощных токсинов различных бактерий, например, Vibrio cholerae , Corynebacterium diphtheriae и Bordetella pertussis .
- Различные полноразмерные свернутые белки могут быть присоединены на своих С-концах к аммониевым группам боковой цепи лизинов других белков. Убикитин является наиболее распространенным из них и обычно сигнализирует о том, что белок, меченный убиквитином, должен быть разрушен.
Большинство модификаций полипептидов, перечисленных выше, происходят посттрансляционно , т.е. после того, как белок был синтезирован на рибосоме , обычно происходящей в эндоплазматическом ретикулуме , субклеточной органелле эукариотической клетки.
Многие другие химические реакции (например, цианилирование) применялись химиками к белкам, хотя они не обнаружены в биологических системах.
Расщепление и лигирование
[ редактировать ]Помимо перечисленных выше, наиболее важной модификацией первичной структуры является расщепление пептидов (путем химического гидролиза или протеазами ). Белки часто синтезируются в неактивной форме-предшественнике; обычно N-концевой или C-концевой сегмент блокирует активный центр белка, подавляя его функцию. Белок активируется путем отщепления ингибирующего пептида.
Некоторые белки даже способны расщеплять себя. Обычно гидроксильная группа серина (реже треонина) или тиоловая группа остатка цистеина атакует карбонильный углерод предыдущей пептидной связи, образуя тетраэдрически связанное промежуточное соединение [классифицируемое как гидроксиоксазолидин (Ser/Thr) или гидрокситиазолидин ( Cys) промежуточный]. Это промежуточное соединение имеет тенденцию вернуться в амидную форму, вытесняя атакующую группу, поскольку свободная энергия обычно благоприятствует амидной форме (предположительно из-за сильной резонансной стабилизации пептидной группы). Однако дополнительные молекулярные взаимодействия могут сделать амидную форму менее стабильной; вместо этого аминогруппа удаляется, в результате чего вместо пептидной связи образуется сложноэфирная (Ser/Thr) или тиоэфирная (Cys) связь. Эта химическая реакция называется NO-ацильным сдвигом .
Эфирно-тиоэфирную связь можно разрешить несколькими способами:
- Простой гидролиз расщепляет полипептидную цепь, и смещенная аминогруппа становится новым N-концом. Это видно по созреванию гликозиласпарагиназы.
- Реакция β-элиминирования также расщепляет цепь, но приводит к образованию пирувоильной группы на новом N-конце. Эту пирувоильную группу можно использовать в качестве ковалентно присоединенного каталитического кофактора в некоторых ферментах, особенно в декарбоксилазах, таких как S-аденозилметиониндекарбоксилаза (SAMDC), которые используют электроноакцепторную способность пирувоильной группы.
- Внутримолекулярная переэтерификация, приводящая к образованию разветвленного полипептида. В интеинах новая эфирная связь разрывается в результате внутримолекулярной атаки будущего С-концевого аспарагина.
- Межмолекулярная переэтерификация может передавать целый сегмент от одного полипептида к другому, как это видно при автопроцессинге белка Hedgehog.
Сжатие последовательности
[ редактировать ]Сжатие аминокислотных последовательностей является сравнительно сложной задачей. Существующие специализированные компрессоры аминокислотных последовательностей уступают компрессорам последовательностей ДНК, главным образом из-за характеристик данных. Например, моделировать инверсии сложнее из-за обратной потери информации (от аминокислот к последовательности ДНК). Текущий компрессор данных без потерь, обеспечивающий более высокий уровень сжатия, — AC2. [5] AC2 смешивает различные контекстные модели с помощью нейронных сетей и кодирует данные с помощью арифметического кодирования.
История
[ редактировать ]Предположение о том, что белки представляют собой линейные цепочки α-аминокислот, было высказано почти одновременно двумя учеными на одной и той же конференции в 1902 году, 74-м собрании Общества немецких ученых и врачей, проходившем в Карлсбаде. Франц Хофмайстер сделал это предложение утром, основываясь на своих наблюдениях за биуретовой реакцией в белках. Через несколько часов за Хофмейстером последовал Эмиль Фишер , накопивший множество химических данных, подтверждающих модель пептидной связи. Для полноты картины: предположение о наличии в белках амидных связей было сделано еще в 1882 г. французским химиком Э. Гримо. [6]
Несмотря на эти данные и более поздние доказательства того, что протеолитически расщепленные белки дают только олигопептиды, идея о том, что белки представляют собой линейные, неразветвленные полимеры аминокислот, не была принята сразу. Некоторые уважаемые ученые, такие как Уильям Эстбери, сомневались, что ковалентные связи достаточно сильны, чтобы удерживать вместе такие длинные молекулы; они боялись, что тепловые колебания расшатают такие длинные молекулы. Герман Штаудингер столкнулся с подобными предрассудками в 1920-х годах, когда утверждал, что каучук состоит из макромолекул . [6]
Таким образом, возникло несколько альтернативных гипотез. Гипотеза коллоидных белков утверждала, что белки представляют собой коллоидные совокупности более мелких молекул. Эта гипотеза была опровергнута в 1920-х годах измерениями ультрацентрифугирования Теодора Сведберга , которые показали, что белки имеют четко определенную, воспроизводимую молекулярную массу, и электрофоретическими измерениями Арне Тиселиуса , которые показали, что белки представляют собой отдельные молекулы. Вторая гипотеза, циклола гипотеза , выдвинутая Дороти Ринч , предполагала, что линейный полипептид претерпел химическую циклольную перегруппировку C=O + HN. C(OH)-N, который сшил амидные группы его основной цепи, образуя двумерную ткань . Другие первичные структуры белков были предложены различными исследователями, такими как модель дикетопиперазина и Эмиля Абдерхальдена модель пиррола/пиперидина Троэнсегаарда в 1942 году. Хотя эти альтернативные модели никогда не пользовались большим доверием, они были окончательно опровергнуты, когда Фредерик Сэнгер успешно секвенировал инсулин. [ когда? ] и кристаллографическим определением миоглобина и гемоглобина Максом Перутцем и Джоном Кендрю. [ когда? ] .
Первичная структура в других молекулах
[ редактировать ]Можно сказать, что любой гетерополимер с линейной цепью имеет «первичную структуру» по аналогии с использованием этого термина для белков, но такое использование встречается редко по сравнению с чрезвычайно распространенным использованием в отношении белков. В РНК , которая также имеет обширную вторичную структуру , линейную цепь оснований обычно называют просто «последовательностью», как и в ДНК (которая обычно образует линейную двойную спираль с небольшой вторичной структурой). Другие биологические полимеры, такие как полисахариды, также могут считаться имеющими первичную структуру, хотя их использование не является стандартным.
Связь со вторичной и третичной структурой
[ редактировать ]Первичная структура биологического полимера во многом определяет трехмерную форму ( третичная структура ). Последовательность белка можно использовать для прогнозирования локальных особенностей , таких как сегменты вторичной структуры или трансмембранные области. Однако сложность сворачивания белка в настоящее время не позволяет предсказать третичную структуру белка только на основе его последовательности. Знание структуры сходной гомологичной последовательности (например, члена одного и того же семейства белков ) позволяет с высокой точностью предсказать третичную структуру путем моделирования гомологии . Если доступна полноразмерная последовательность белка, можно оценить его общие биофизические свойства , такие как изоэлектрическая точка .
Семейства последовательностей часто определяются путем кластеризации последовательностей , а проекты структурной геномики направлены на создание набора репрезентативных структур для покрытия пространства последовательностей возможных неизбыточных последовательностей.
См. также
[ редактировать ]Примечания и ссылки
[ редактировать ]- ^ Jump up to: а б САНГЕР Ф (1952). «Расположение аминокислот в белках». В М.Л. Энсоне; Кеннет Бэйли; Джон Т. Эдсолл (ред.). Достижения в области химии белков . Том. 7. С. 1–67. дои : 10.1016/S0065-3233(08)60017-0 . ISBN 9780120342075 . ПМИД 14933251 .
- ^ Осланд, Рейн; Абрамс, Чарльз; Ампе, Кристоф; Болл, Линда Дж.; Бедфорд, Марк Т.; Чезарени, Джанни; Химона, Марио; Херли, Джеймс Х.; Жаршау, Томас (20 февраля 2002 г.). «Нормализация номенклатуры пептидных мотивов как лигандов модульных белковых доменов» . Письма ФЭБС . 513 (1): 141–144. дои : 10.1016/S0014-5793(01)03295-1 . ISSN 1873-3468 . ПМИД 11911894 .
- ^ Осланд Р., Абрамс К., Ампе К., Болл Л.Дж., Бедфорд М.Т., Чезарени Дж., Джимона М., Херли Дж.Х., Джарчау Т., Лехто В.П., Леммон М.А., Линдинг Р., Майер Б.Дж., Нагай М., Судол М., Уолтер Ю., Уиндер С.Дж. (1 июля 1968 г.). «Однобуквенное обозначение аминокислотных последовательностей *». Европейский журнал биохимии . 5 (2): 151–153. дои : 10.1111/j.1432-1033.1968.tb00350.x . ISSN 1432-1033 . ПМИД 11911894 .
- ^ Jump up to: а б Хаусман, Роберт Э.; Купер, Джеффри М. (2004). Клетка: молекулярный подход . Вашингтон, округ Колумбия: ASM Press. п. 51. ИСБН 978-0-87893-214-6 .
- ^ Сильва М., Пратас Д., Пиньо А.Дж. (апрель 2021 г.). «AC2: эффективный инструмент сжатия белковых последовательностей с использованием искусственных нейронных сетей и моделей кэш-хэша» . Энтропия . 23 (5): 530. Бибкод : 2021Entrp..23..530S . дои : 10.3390/e23050530 . ПМЦ 8146440 . ПМИД 33925812 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Фрутон Дж.С. (май 1979 г.). «Ранние теории структуры белка». Энн. Н-Й акад. Наука . 325 (1): xiv, 1–18. Бибкод : 1979NYASA.325....1F . дои : 10.1111/j.1749-6632.1979.tb14125.x . ПМИД 378063 . S2CID 39125170 .







