Туникамицин
| |
| Имена | |
|---|---|
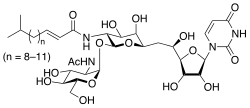
| Название ИЮПАК
(Е)-N-[(2S,3R,4R,5R,6R)-2-[(2R,3R,4R,5S,6R)-
3-ацетамидо-4,5-дигидрокси-6-(гидроксиметил)оксан-2-ил]окси- 6-[2-[(2R,3S,4R,5R)-5-(2,4-диоксопиримидин-1-ил)- 3,4-дигидроксиоксолан-2-ил]-2-гидроксиэтил]-4,5-дигидроксиоксан- 3-ил]-5-метилгекс-2-енамид | |
| Другие имена
НСК 177382
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.115.295 |
| Номер ЕС |
|
| МеШ | Туникамицин |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 39 Ч 64 Н 4 О 16 | |
| Молярная масса | Н/Д |
| Опасности | |
| СГС Маркировка : [ 1 ] | |

| |
| Опасность | |
| Н300 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Эта статья может быть слишком технической для понимания большинства читателей . ( Октябрь 2020 г. ) |
Туникамицин представляет собой смесь гомологичных нуклеозидных антибиотиков , которая ингибирует семейство ферментов UDP-HexNAc: полипренол-P HexNAc-1-P. У эукариот к ним относится фермент GlcNAc фосфотрансфераза (GPT), который катализирует перенос N -ацетилглюкозамин-1-фосфата от УДФ -N -ацетилглюкозамина к долихолфосфату на первом этапе синтеза гликопротеинов . Туникамицин блокирует N -связанное гликозилирование ( N -гликаны) , а обработка культивируемых клеток человека туникомицином вызывает остановку клеточного цикла в фазе G1 . Он используется в качестве экспериментального инструмента в биологии , например, для индукции ответа развернутого белка . [ 2 ] Туникамицин продуцируется несколькими бактериями , включая Streptomyces clavuligerus и Streptomyces lysosuperificus .
Гомологи туникамицина имеют различную молекулярную массу вследствие вариабельности жирных кислот . конъюгатов боковой цепи [ 3 ]
Биосинтез
[ редактировать ]Биосинтез туникамицинов был изучен у Streptomyceschartreusis и охарактеризован предполагаемый путь биосинтеза. Бактерии используют ферменты кластера генов tun (TunA-N) для производства туникамицинов. [ 4 ]
TunA использует стартовую единицу уридиндифосфат- N -ацетилглюкозамин (UDP-GlcNAc) и катализирует дегидратацию 6'-гидроксильной группы. Во-первых, остаток Tyr в TunA отрывает протон от 4'-гидроксильной группы, образуя в этом положении кетон. Гидрид впоследствии отрывается от 4'-углерода с помощью НАД. + , образуя НАДН. Кетон стабилизируется за счет водородной связи остатка Tyr и близлежащего остатка Thr. Остаток глутамата затем отрывает протон от 5'-углерода, подталкивая электроны вверх, образуя двойную связь между 5'- и 6'-углеродом. Соседний цистеин отдает протон гидроксильной группе, уходя в виде воды. НАДН отдает гидрид 4'-углероду, образуя гидроксид в этом положении и образуя UDP-6'-дезокси-5-6-ен-GlcNAc. Затем TunF катализирует эпимеризацию промежуточного соединения до UDP-6'-дезокси-5-6-ен-GalNAc, изменяя 4'-гидроксил с экваториального на аксиальное положение. [ 5 ]
Другой стартовой единицей туникамицина является уридин, который производится из уридинтрифосфата (УТФ). TunN представляет собой нуклеотиддифосфатазу и катализирует удаление пирофосфата из UTP с образованием уридинмонофосфата. Последний фосфат удаляется предполагаемой монофосфатазой TunG.
После образования уридина и UDP-6'-дезокси-5-6-ен-GalNAc TunB катализирует их связывание по 6'-углероду UDP-6'-дезокси-5-6-ен-GalNAc. TunB использует S -аденилметионин (SAM) для образования радикала на 5'-углероде рибозы на урациле. Считается, что TunM катализирует образование новой связи между 5'-углеродом уридина и 6'-углеродом UDP-6'-дезокси-5-6-ен-GalNAc с использованием электрона радикала уридина и одного из электронов. от двойной связи УДФ-6'-дезокси-5-6-ен-GalNAc. Радикал на UDP-6'-дезокси-5-6-ен-GalNAc затем гасится путем отделения водорода от SAM. [ 6 ] Полученная молекула представляет собой УДФ- N -ацетилтуникамин. Затем TunH катализирует гидролиз УДФ из УДФ -N -ацетилтуникамина. Вводится еще одна молекула UDP-GlcNAc, и впоследствии образуется гликозидная связь β-1,1, катализируемая TunD. Полученная молекула деацетилируется TunE. TunL и жирноацил-АСР-лигаза используются для загрузки метаболических жирных кислот на ацильный белок-переносчик TunK. Затем TunC присоединяет жирную кислоту к свободному амину, образуя туникомицин.
См. также
[ редактировать ]- Гликозилирование – туникомицин блокирует все N -гликозилирование белков.
- гликопротеин
- Стрептомицеты
Ссылки
[ редактировать ]- ^ «Инвентаризация C&L» . echa.europa.eu .
- ^ Чан С.В., Иган П.А. (2005). «Белки оболочки вируса гепатита С регулируют CHOP посредством индукции развернутого белкового ответа» . Журнал ФАСЭБ . 19 (11): 1510–1512. doi : 10.1096/fj.04-3455fje . ПМИД 16006626 .
- ^ [1] Подробности о продукте туникамицин]
- ^ Вышински Ф, Хескет А, Бибб М, Дэвис Б (2010). «Анализ биосинтеза туникамицина путем анализа генома: клонирование и гетерологичная экспрессия минимального кластера генов». Химическая наука . 1 (5): 581. doi : 10.1039/c0sc00325e .
- ^ Вышински Ф., Ли С., Ябе Т., Ван Х., Гомес-Эскрибано Дж. П., Бибб М. (июль 2012 г.). «Биосинтез антибиотиков туникамицина протекает через уникальные экзогликальные промежуточные соединения». Природная химия . 4 (7): 539–546. Бибкод : 2012NatCh...4..539W . дои : 10.1038/nchem.1351 . ПМИД 22717438 .
- ^ Гизе Б. (август 1989 г.). «Стереоселективность межмолекулярных свободнорадикальных реакций [Новые синтетические методы (78)]». Angewandte Chemie International Edition на английском языке . 28 (8): 969–980. дои : 10.1002/anie.198909693 .
Внешние ссылки
[ редактировать ]- Раздел книги «Основы гликобиологии» (1999) Туникамицин: ингибирование сборки DOL-PP-GlcNAc.
- Информационный листок туникамицина, подготовленный студентом Открытого университета, Великобритания.