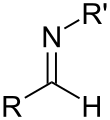
Имайне
В органической химии ( имин / ɪ ˈ m iː n / или / ˈ ɪ m ɪ n / ) — функциональная группа или органическое соединение , содержащее углерод - азот двойную связь ( С=Н ). Атом азота может быть присоединен к водороду или органической группе (R). Атом углерода имеет две дополнительные одинарные связи . [1] [2] Имины распространены в синтетических и природных соединениях и участвуют во многих реакциях. [3]
Структура [ править ]
Для кетиминов и альдиминов, соответственно, пять основных атомов (C 2 C=NX и C(H)C=NX, X = H или C) расположены в одной плоскости. Планарность является результатом sp 2 -гибридизация взаимно двойных связей углерода и атомов азота. Расстояние C=N составляет 1,29–1,31 Å для несопряженных иминов и 1,35 Å для сопряженных иминов. Напротив, расстояния C-N в аминах и нитрилах составляют 1,47 и 1,16 Å соответственно. [4] Вращение вокруг связи C=N происходит медленно. С помощью ЯМР-спектроскопии были обнаружены как E- , так и Z -изомеры альдиминов. Из-за стерических эффектов E- изомеру. предпочтение отдается [5]
Номенклатура и классификация [ править ]
Термин «имин» был придуман в 1883 году немецким химиком Альбертом Ладенбургом . [6]
Обычно имины относятся к соединениям общей формулы R 2 C=NR, как обсуждается ниже. [7] В более старой литературе имин относится к - аналогу эпоксида аза . Таким образом, этиленимин представляет собой трехчленное кольцо азиридина C 2 H 4 NH. [8] Отношения иминов с аминами можно соотнести с имидами имеющими двойные и одинарные связи , и амидами , , как в сукцинимиде по сравнению с ацетамидом .
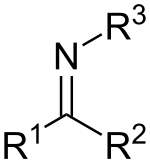
Имины связаны с кетонами и альдегидами заменой кислорода на группу NR. Когда R = H, соединение является первичным имином, когда R представляет собой гидрокарбил , соединение является вторичным имином. Если эта группа не является атомом водорода, то соединение иногда можно назвать основанием Шиффа . [9] Когда Р 3 представляет собой ОН, имин называется оксимом , а когда R 3 NH 2 имин называется гидразоном .
Первичный имин, в котором C присоединен как к гидрокарбилу, так и к H, называется первичным альдимином ; вторичный имин с такими группами называется вторичным альдимином . [10] Первичный имин, в котором С присоединен к двум гидрокарбилам, называется первичным кетимином ; вторичный имин с такими группами называется вторичным кетимином . [11]
- Первичный альдимин, E-изомер
- Вторичный альдимин, E-изомер
- Первичный кетимин
- Вторичный кетимин
- Азиридин и его производные иногда называют иминами.
N-Сульфинилимины представляют собой особый класс иминов, имеющих сульфинильную группу, присоединенную к атому азота.
Синтез иминов [ править ]
Конденсация карбониламина [ править ]
Имины обычно получают конденсацией первичных аминов и альдегидов. [12] [13] Кетоны вступают в аналогичные реакции, но реже, чем альдегиды. С точки зрения механизма, такие реакции протекают через нуклеофильное присоединение с образованием полуаминного промежуточного соединения -C(OH)(NHR)- с последующим отщеплением воды с образованием имина ( «Алкилимино-де-оксо-бизамещение подробный механизм см. в разделе »). . Равновесие в этой реакции обычно благоприятствует карбонильному соединению и амину, поэтому для содействия образованию имина требуется азеотропная перегонка или использование дегидратирующего агента, такого как молекулярные сита или сульфат магния . В последние годы несколько реагентов, таких как Трис(2,2,2-трифторэтил)борат [B(OCH 2 CF 3 ) 3 ], [14] пирролидин [15] или этоксид титана [Ti(OEt) 4 ] [16] Было показано, что он катализирует образование имина.
Реже, чем первичные амины, для получения первичного имина используется аммиак. [17] В случае гексафторацетона полуаминный промежуточный продукт. можно выделить [18]
Из нитрилов [ править ]
Первичные кетимины могут быть синтезированы реакцией Гриньяра с нитрилом . Этот метод известен как синтез кетимина Мурё-Миньонака. [19] [20] [21] Например, бензофенонимин также можно синтезировать путем добавления бромида фенилмагния к бензонитрилу с последующим осторожным гидролизом (во избежание гидролиза имина): [22]
- C 6 H 5 CN + C 6 H 5 MgBr → (C 6 H 5 ) 2 C=NMgBr
- (C 6 H 5 ) 2 C=NMgBr + H 2 O → (C 6 H 5 ) 2 C=NH + MgBr(OH)
Специализированные методы [ править ]
Существует несколько других методов синтеза иминов.
- Реакция органических азидов с карбеноидами металлов (полученными из диазокарбонильных соединений). [23]
- Реакция иминофосфоранов и органических азидов по реакции Аза-Виттига .
- Конденсация карбоновых кислот с нитрозосоединениями .
- Перегруппировка тритил-N-галогенаминов в перегруппировке Штиглица .
- Реакцией алкенов с азотистоводородной кислотой по реакции Шмидта .
- По реакции нитрила, соляной кислоты и арена по реакции Хёша .
- Многокомпонентный синтез 3-тиазолинов по реакции Асингера .
- Термическое оксимов . разложение [24]
Реакция [ править ]

Гидролиз [ править ]
Основной реакцией иминов, часто нежелательной, является их гидролиз обратно до амина и предшественника карбонила.
- R 2 C=NR' + H 2 O ⇌ R 2 C=O + R'NH 2
гетероциклов Предшественники
Имины широко используются в качестве промежуточных продуктов при синтезе гетероциклов.
- Ароматические имины реагируют с эфиром енола с образованием хинолина по реакции Поварова .
- Имины термически реагируют с кетенами в [2+2] циклоприсоединениях с образованием β-лактамов в синтезе Штаудингера . [25] Описано несколько вариантов. [26] [27]
- Реакция имина и диенов в реакции имина Дильса-Альдера с образованием тетрагидропиридина.
- тозилимины реагируют с α,β-ненасыщенным карбонильным соединением с образованием аллиловых аминов в реакции Аза-Бейлиса-Хиллмана .
Кислотно-основные реакции [ править ]
Как и исходные амины, имины являются слабоосновными и обратимо протонируются с образованием иминиевых солей:
- R 2 C=NR' + H + [R 2 C=NHR'] +
Альтернативно, первичные имины достаточно кислые, чтобы обеспечить N-алкилирование, как показано на примере бензофенонимина : [28]
- (C 6 H 5 ) 2 C=NH + CH 3 Li → (C 6 H 5 ) 2 C=NLi + CH 4
- (C 6 H 5 ) 2 C=NLi + CH 3 I → (C 6 H 5 ) 2 C=NCH 3 + LiI
Кислотно-основные реакции Льюиса [ править ]
Имины — распространенные лиганды в координационной химии . Особенно популярные примеры найдены с лигандами основания Шиффа, полученными из салицилового альдегида , саленовыми лигандами . Через такие комплексы протекают металлокализируемые реакции иминов. В классических координационных комплексах имины связывают металлы через азот. Для низковалентных металлов η 2 наблюдаются -иминные лиганды.
Нуклеофильные присоединения [ править ]
Первичные имины, во многом аналогичные кетонам и альдегидам, подвержены воздействию карбанионных эквивалентов. Метод позволяет синтезировать вторичные амины: [29] [30]
- R 2 C=NR' + R"Li → R 2 R"CN(Li)R'
- R 2 R"CN(Li)R' + H 2 O → R 2 R"CNHR' + LiOH
Снижение имина
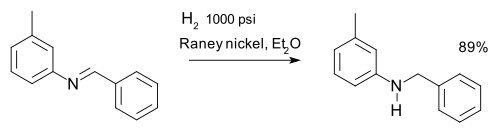
Имины восстанавливаются посредством восстановительного аминирования . Имин можно восстановить до амина путем гидрирования, например, при синтезе м -толилбензиламина: [31]
Другими восстановителями являются литийалюминийгидрид и боргидрид натрия . [32]
Асимметричное - восстановление иминов достигнуто гидросилилированием с использованием катализатора родий ДИОП . [33] Многие системы с тех пор были исследованы. [34] [35]
Из-за своей повышенной электрофильности производные иминия особенно чувствительны к восстановлению до аминов. Такого снижения можно достичь путем трансферного гидрирования или стехиометрического действия цианоборгидрида натрия . Поскольку имины, полученные из несимметричных кетонов, являются прохиральными , их восстановление определяет путь к хиральным аминам.
Полимеризация [ править ]
Беспрепятственные альдимины имеют тенденцию к циклизации, о чем свидетельствует конденсация метиламина и формальдегида , которая дает гексагидро-1,3,5-триазин .
Иминные полимеры ( полиимины ) можно синтезировать из многовалентных альдегидов и аминов . [36] Реакция полимеризации протекает непосредственно при смешивании мономеров альдегида и амина при комнатной температуре. В большинстве случаев все же могут потребоваться (небольшие) количества растворителя. Полиимины являются особенно интересными материалами из-за их применения в качестве витримеров . Благодаря динамической ковалентной природе иминных связей полиимины относительно легко поддаются вторичной переработке. Кроме того, полиимины известны своим свойством самовосстановления. [37] [38]
Разные реакции [ править ]
Подобно связям пинакола , имины подвержены восстановительному связыванию, приводящему к 1,2- диаминам . [39]
Имин окисляется метахлорпероксибензойной кислотой (mCPBA) с образованием оксазиридинов .
Имины являются промежуточными продуктами алкилирования аминов муравьиной кислотой в реакции Эшвейлера-Кларка .
Перегруппировкой в химии углеводов с участием имина является перегруппировка Амадори .
Реакция переноса метилена имина нестабилизированным илидом сульфония может дать азиридиновую систему.Реакция имина и диалкилфосфита в реакции Пудовика и реакции Кабачника-Филдса.
роль Биологическая
Имины широко распространены в природе. [40] [41] Пиридоксальфосфат - зависимые ферменты (ферменты PLP) катализируют множество реакций с участием альдиминов (или оснований Шиффа). [42] Циклические имины также являются субстратами для многих ферментов иминредуктазы . [43]

См. также [ править ]
- енамин
- База Шиффа
- Карбоксимидат
- Оксазолидин
- Другие функциональные группы с двойной связью C=N: оксимы , гидразоны.
- Другие функциональные группы с тройной связью CN: нитрилы , изонитрилы.
Ссылки [ править ]
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Имины ». дои : 10.1351/goldbook.I02957
- ^ Марш, Джерри (1985). Реакции, механизмы и структура продвинутой органической химии (3-е изд.). Нью-Йорк: Wiley, Inc. ISBN 0-471-85472-7 . OCLC 642506595 .
- ^ Сол Патай, изд. (1970). Двойные связи углерод-азот . Химия функциональных групп PATai. Джон Уайли и сыновья. дои : 10.1002/9780470771204 . ISBN 9780471669425 . OCLC 639112179 .
- ^ К. Сандорфи (1970). «Общие и теоретические аспекты». У Саула Патая (ред.). Двойные связи углерод-азот . Химия функциональных групп PATai. Джон Уайли и сыновья. стр. 1–60. дои : 10.1002/9780470771204.ch1 . ISBN 9780470771204 .
- ^ Бьорго, Йоханнес; Бойд, Дерек Р.; Уотсон, Кристофер Г.; Дженнингс, В. Брайан; Джерина, Дональд М. (1974). « E – Z -изомерия в альдиминах». Дж. Хим. Soc., Перкин Транс. 2 (9): 1081–1084. дои : 10.1039/P29740001081 .
- ^ Ладенбург, А. (1883). «Об иминах» . Отчеты Немецкого химического общества (на немецком языке). 16 :1149-1152. дои : 10.1002/cber.188301601259 .
Из стр. 1150: Видимо пиперидин также относится к искомому мной классу соединений, для которых по существующей номенклатуре указано название Имин.
[Ибо пиперидин, очевидно, также принадлежит к классу искомых мной соединений, для которых в преобладающей номенклатуре указано название «имины».] - ^ «Амины и имины». Номенклатура органических соединений . Достижения химии. Том. 126. Американское химическое общество. 1974. стр. 180–188. дои : 10.1021/ba-1974-0126.ch023 . ISBN 9780841201910 . OCLC 922539 .
- ^ «Этиленимин» . Органические синтезы . 30:38 . 1950. doi : 10.15227/orgsyn.030.0038 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « База Шиффа ». дои : 10.1351/goldbook.S05498
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Альдимины ». дои : 10.1351/goldbook.A00209.html
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Кетимины ». дои : 10.1351/goldbook.K03381.html
- ^ Г. Виттиг, А. Гессен (1970). «Направленная альдольная конденсация: b-фенилкоричный альдегид». Органические синтезы . 50:66 . дои : 10.15227/orgsyn.050.0066 .
- ^ Бигелоу, Люциус А.; Ито, Гарри (1928). «Бензаланилин». Органические синтезы . 8:22 . дои : 10.15227/orgsyn.008.0022 .
- ^ Ривз, Джонатан Т.; Виско, Майкл Д.; Марсини, Морис А.; Гринберг, Нелу; Бусакка, Карл А.; Мэттсон, Анита Э.; Сенанаяке, Крис Х. (15 мая 2015 г.). «Общий метод образования имина с использованием B(OCH 2 CF 3 ) 3 ». Органические письма . 17 (10): 2442–2445. doi : 10.1021/acs.orglett.5b00949 . ISSN 1523-7060 . ПМИД 25906082 .
- ^ Моралес, Сара; Гихарро, Фернандо Дж.; Гарсиа Руано, Хосе Луис; Сид, М. Белен (22 января 2014 г.). «Общий аминокаталитический метод синтеза альдиминов». Журнал Американского химического общества . 136 (3): 1082–1089. дои : 10.1021/ja4111418 . ISSN 0002-7863 . ПМИД 24359453 .
- ^ Колладос, Хуан Ф.; Толедано, Эстефания; Гихарро, Дэвид; Юс, Мигель (6 июля 2012 г.). «Синтез энантиомерно чистых N-(трет-бутилсульфинил)иминов без растворителей с помощью микроволновой печи». Журнал органической химии . 77 (13): 5744–5750. дои : 10.1021/jo300919x . ISSN 0022-3263 . ПМИД 22694241 .
- ^ Верардо, Г.; Джуманини, АГ; Страццолини, П.; Пояна, М. (1988). «Кетимины из кетонов и аммиака». Синтетические коммуникации . 18 (13): 1501–1511. дои : 10.1080/00397918808081307 .
- ^ Jump up to: а б Миддлтон, штат Вашингтон; Карлсон, HD (1970). «Гексафторацетонимин». Орг. Синтезы . 50 : 81–3. дои : 10.15227/orgsyn.050.0081 .
- ^ «Синтез кетимина Муро-Миньонака». Комплексные органические реакции и реагенты . Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc., 15 сентября 2010 г. стр. 1988–1990. дои : 10.1002/9780470638859.conrr446 . ISBN 9780470638859 .
- ^ Коос, Мирослав; Мошер, Гарри С. (1993). «α-амино-α-трифторметилфенилацетонитрил: потенциальный реагент для ЯМР-определения энантиомерной чистоты кислот». Тетраэдр . 49 (8): 1541–1546. дои : 10.1016/S0040-4020(01)80341-0 .
- ^ Муре, Чарльз; Миньонак, Жорж (1920). «Четимины» . Анналы химии . 9 (13): 322–359 . Проверено 18 июня 2014 г.
- ^ Пикард, Польша; Толберт, TL (декабрь 1961 г.). «Улучшенный метод синтеза кетимина». Журнал органической химии . 26 (12): 4886–4888. дои : 10.1021/jo01070a025 . ISSN 0022-3263 .
- ^ Мандлер, Майкл; Труонг, Фонг; Завалий, Питер; Дойл, Майкл (14 января 2014 г.). «Каталитическая конверсия диазокарбонильных соединений в имины: применение к синтезу тетрагидропиримидинов и β-лактамов». Органические письма . 16 (3): 740–743. дои : 10.1021/ol403427s . ПМИД 24423056 .
- ^ Артур Лахман (1930). «Дифенилметанимина гидрохлорид». Органические синтезы . 10:28 . дои : 10.15227/orgsyn.010.0028 .
- ^ Хубшверлен, Кристиан; Спеклин, Жан-Люк (1995). «(3S,4S)-3-Амино-1-(3,4-Диметоксибензил)-4-[(R)-2,2-Диметил-1,3-Диоксолан-4-ил]-2-азетидинон». Органические синтезы . 72 : 14. дои : 10.15227/orgsyn.072.0014 .
- ^ Хегедус, Лус С.; Макгуайр, Майкл А.; Шульце, Лиза М. (1987). «1,3-Диметил-3-Метокси-4-Фенилазетидинон». Органические синтезы . 65 : 140. дои : 10.15227/orgsyn.065.0140 .
- ^ Ян П. Эндрюс и Охён Квон (2011). «ФОСФИН-КАТАЛИЗИРУЕМАЯ [3+2] АННЕЛЯЦИЯ: СИНТЕЗ ЭТИЛ-5-(трет-БУТИЛ)-2-ФЕНИЛ-1-ТОЗИЛ-3-ПИРРОЛИН-3-КАРБОКСИЛАТ» . Органические синтезы . 88 : 138. дои : 10.15227/orgsyn.088.0138 .
- ^ Ноттингем, Крис; Ллойд-Джонс, Гай К. (2018). «Триметилсилилдиазо[13C]метан: универсальный 13 Реагент для мечения C» . Organic Syntheses . 95 : 374–402. doi : 10.15227/orgsyn.095.0374 . hdl : 20.500.11820/c801073c-6b4b-4a85-be68-2c4313b6e53d .
- ^ Ху, Аньцзин; Чжан, Чжан-Мин; Сяо, Юаньцзин; Чжан, Цзюньлян (2020). «Стереоселективный синтез хиральных сульфинамидных монофосфиновых лигандов (Ming-Phos)(S, Rs)-M» . Органические синтезы . 97 : 262–273. дои : 10.15227/orgsyn.097.0262 . S2CID 235020219 .
- ^ Винсент Родескини, Найджел С. Симпкинс и Фэнчжи Чжан (2007). «Хиральная литий-амидная десимметризация основания конденсированного имида кольца: образование (3aS,7aS)-2[2-(3,4-диметоксифенил)-этил]-1,3-диоксо-октагидроизоиндол-3а-метиловой кислоты Эстер». Органические синтезы . 84 : 306. дои : 10.15227/orgsyn.084.0306 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ CFH Аллен и Джеймс ВанАллан (1955). « м -толилбензиламин» . Органические синтезы : 827 ; Сборник томов , т. 3 .
- ^ Например: Иева Р. Политцер и А.И. Мейерс (1988). «Альдегиды из 2-бензил-4,4,6-триметил-5,6-дигидро-1,3(4H)-оксазина: 1-фенилциклопентанкарбоксальдегид» . Органические синтезы ; Сборник томов , т. 6, с. 905 .
- ^ Ланглуа, Н. (1973). «Асимметричный синтез аминов путем гидросилилирования иминов, катализируемого хиральным комплексом родия». Тетраэдр Летт. 14 (49): 4865–4868. дои : 10.1016/S0040-4039(01)87358-5 .
- ^ Кобаяши, Шу; Ишитани, Харуро (1999). «Каталитическое энантиоселективное добавление к иминам». хим. Откр. 99 (5): 1069–94. дои : 10.1021/cr980414z . ПМИД 11749440 .
- ^ Дж. Мартенс: Восстановление иминогрупп (C = N) в (Г. Хельмхен, Р. В. Хоффманн, Дж. Мульцер, Э. Шауманн) Стереоселективный синтез Губена-Вейля, Workbench Edition E21, том 7, S. 4199-4238, Thieme Верлаг Штутгарт, 1996 г., ISBN 3-13-106124-3 .
- ^ Шустра, Сибрен К.; Груневельд, Тимо; Смолдерс, Мартен MJ (2021). «Влияние полярности на динамику молекулярного обмена в ковалентных адаптируемых сетях на основе имина» . Полимерная химия . 12 (11): 1635–1642. дои : 10.1039/D0PY01555E .
- ^ Шустра, Сибрен К.; Дейксман, Джошуа А.; Цюйльхоф, Хан; Смолдерс, Мартен MJ (2021). «Молекулярный контроль над витримероподобной механикой - настраиваемые динамические мотивы, основанные на уравнении Хэммета в полииминовых материалах» . Химическая наука . 12 (1): 293–302. дои : 10.1039/d0sc05458e . ISSN 2041-6520 . ПМЦ 8178953 . ПМИД 34163597 .
- ^ Чжу, Цзяци (2020). «Самовосстанавливающийся прозрачный полидиметилсилоксановый эластомер на основе иминных связей» . Европейский журнал полимеров . 123 : 109382. Бибкод : 2020EurPJ.12309382W . doi : 10.1016/j.eurpolymj.2019.109382 . S2CID 214199868 .
- ^ Алексакис, Алекс; Ожар, Изабель; Кангер, Тонис; Манжени, Пьер (1999). «( R,R )- и ( S,S )-N,N'-диметил-1,2-дифенилэтилен-1,2-диамин». Органические синтезы . 76:23 . дои : 10.15227/orgsyn.076.0023 .
- ^ «Исследователи обращаются к природе, чтобы раскрыть секреты циклического расщепления имина» . ЭврекАлерт! . Проверено 22 июля 2021 г.
- ^ Борхерт, Эндрю Дж.; Эрнст, Дастин С.; Даунс, Диана М. (2019). «Реактивные енамины и имины in vivo : уроки парадигмы RidA» . Тенденции биохимических наук . 44 (10): 849–860. дои : 10.1016/j.tibs.2019.04.011 . ISSN 0968-0004 . ПМК 6760865 . ПМИД 31103411 .
- ^ Элиот, Эндрю С.; Кирш, Джек Ф. (2004). «Пиридоксальфосфатные ферменты: механистические, структурные и эволюционные соображения». Ежегодный обзор биохимии . 73 : 383–415. doi : 10.1146/annurev.biochem.73.011303.074021 . ПМИД 15189147 .
- ^ Мангас-Санчес, Хуан; Франция, Скотт П.; Монтгомери, Сара Л; Алеку, Годвин А; Чувак, Генри; Шарма, Махима; Рамсден, Джереми I; Гроган, Гидеон; Тернер, Николас Дж (2017). «Иминредуктазы (IRED)» . Современное мнение в области химической биологии . 37 : 19–25. дои : 10.1016/j.cbpa.2016.11.022 . ПМИД 28038349 .