Имид

В органической химии имид состоящая — функциональная группа, из двух ацильных групп, связанных с азотом . [1] Соединения структурно родственны ангидридам кислот , хотя имиды более устойчивы к гидролизу. С точки зрения коммерческого применения имиды наиболее известны как компоненты высокопрочных полимеров, называемых полиимидами . Неорганические имиды также известны как твердые или газообразные соединения, а имидогруппа (=NH) также может действовать как лиганд .
Номенклатура
[ редактировать ]Большинство имидов представляют собой циклические соединения, производные дикарбоновых кислот , и их названия отражают исходную кислоту. [2] Примерами являются сукцинимид , полученный из янтарной кислоты , и фталимид , полученный из фталевой кислоты . Для имидов, полученных из аминов (в отличие от аммиака), N -заместитель обозначается приставкой. Например, N-этилсукцинимид получают из янтарной кислоты и этиламина . Изоимиды изомерны нормальным имидам и имеют формулу RC(O)OC(NR')R″. Они часто являются промежуточными продуктами, которые превращаются в более симметричные имиды. Органические соединения, называемые карбодиимидами, имеют формулу RN=C=NR. Они не связаны с имидами.
Имиды дикарбоновых кислот
[ редактировать ]Ссылки на PubChem предоставляют доступ к дополнительной информации о соединениях, включая другие названия, идентификаторы, токсичность и безопасность.
н Общее имя Систематическое название Структура PubChem исходная кислота структура 2 Сукцинимид Пирролидин-2,5-дион 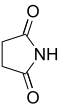
11439 Янтарная кислота 
2, ненасыщенные, двойные цис-углерод-углеродные связи. Картины Пиррол-2,5-дион 
10935 Малеиновая кислота 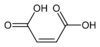
3 Глутаримид Пиперидин-2,6-дион 
70726 Глутаровая кислота 
6 Фталимид Изоиндол-1,3-дион 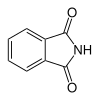
6809 Фталевая кислота 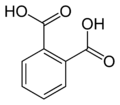
Характеристики
[ редактировать ]Будучи высокополярными, имиды хорошо растворяются в полярных средах. Центр N–H имидов, полученных из аммиака, является кислым и может участвовать в образовании водородных связей . В отличие от структурно родственных ангидридов кислот, они устойчивы к гидролизу, а некоторые даже могут быть перекристаллизованы из кипящей воды.
Возникновение и применение
[ редактировать ]Многие высокопрочные или электропроводящие полимеры содержат имидные субъединицы, т.е. полиимиды . Одним из примеров является каптон , где повторяющаяся единица состоит из двух имидных групп, полученных из ароматических тетракарбоновых кислот. [3] Другим примером полиимидов является полиглутаримид, обычно получаемый из полиметилметакрилата (ПММА) и аммиака или первичного амина путем аминолиза и циклизации ПММА при высокой температуре и давлении, обычно в экструдере. Этот метод называется реактивной экструзией. Коммерческий полиглутаримидный продукт на основе метиламинного производного ПММА под названием Камакс был произведен компанией Rohm and Haas. Прочность этих материалов отражает жесткость имидной функциональной группы.
Интерес к биологической активности имидсодержащих соединений был вызван ранним открытием высокой биологической активности циклогексимида как ингибитора биосинтеза белка в некоторых организмах. Талидомид , известный своими побочными эффектами, является одним из результатов этого исследования. Ряд фунгицидов и гербицидов содержат имидную функциональность. Примеры включают каптан , который при некоторых условиях считается канцерогенным, и процимидон . [4]

В 21 веке возник новый интерес к иммуномодулирующим эффектам талидомида, что привело к появлению класса иммуномодуляторов, известных как иммуномодулирующие имидные препараты (IMiD).
Подготовка
[ редактировать ]Наиболее распространенные имиды получают нагреванием дикарбоновых кислот или их ангидридов и аммиака или первичных аминов . В результате происходит реакция конденсации : [5]
- (RCO) 2O + R′NH2 → RCO) 2NR ′ + H2O (
Эти реакции протекают при посредничестве амидов . Внутримолекулярная реакция карбоновой кислоты с амидом протекает значительно быстрее, чем межмолекулярная реакция, что наблюдается редко.
Их также можно получить путем окисления амидов , особенно из лактамов . [6]
- R(CO)NHCH 2 R' + 2 [O] → R(CO)N(CO)R' + H 2 O
из изоимида в имид Некоторые имиды также можно получить перегруппировкой Мумма .
Реакции
[ редактировать ]У имидов, производных аммиака, N–H-центр слабокислотный. Таким образом, соли имидов щелочных металлов можно получить с помощью обычных оснований, таких как гидроксид калия. Сопряженным основанием фталимида является фталимид калия . Эти анионы могут быть алкилированы с образованием N -алкилимидов, которые, в свою очередь, могут разлагаться с высвобождением первичного амина. сильные нуклеофилы, такие как гидроксид калия или гидразин На стадии высвобождения используются .
Обработка имидов галогенами и основанием дает N -галогенпроизводные. Примерами, полезными в органическом синтезе, являются N -хлорсукцинимид и N - бромсукцинимид , которые соответственно служат источниками «Cl». + " и " Бр + «В органическом синтезе .
Имиды в координационной химии
[ редактировать ]В координационной химии имидокомплексы переходных металлов характеризуются NR. 2- лиганд. В некоторых отношениях они похожи на оксо-лиганды. В некоторых случаях угол MNC составляет 180°, но часто угол явно изогнут. Исходный имид (NH 2- ) является промежуточным продуктом фиксации азота синтетическими катализаторами. [7]

Ссылки
[ редактировать ]- ^ «Имиды» . Сборник химической терминологии ИЮПАК . 2009. doi : 10.1351/goldbook.I02948 . ISBN 978-0-9678550-9-7 .
- ^ Мартынов А.В. (06.12.2005). «Новый подход к синтезу имидов трансаконитовой кислоты». ХимИнформ . 36 (49): нет. дои : 10.1002/chin.200549068 . ISSN 1522-2667 .
- ^ Уолтер В. Райт и Майкл Холлден-Аббертон «Полиимиды» в Энциклопедии промышленной химии Ульмана , 2002, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a21_253
- ^ Питер Акерманн, Пол Марго, Франц Мюллер «Фунгициды сельскохозяйственные» в Энциклопедии промышленной химии Ульмана , 2002, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a12_085
- ^ Винсент Родескини, Найджел С. Симпкинс и Фэнчжи Чжанги (2009). «Иллюстративное образование имида из амина и ангидрида» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 11, с. 1028 . - ^ Сперри, Джонатан (27 сентября 2011 г.). «Окисление амидов в имиды: мощное синтетическое преобразование». Синтез . 2011 (22): 3569–3580. дои : 10.1055/s-0030-1260237 .
- ^ Ньюджент, Вашингтон; Майер, Дж. М., «Множественные связи металл-лиганд», Дж. Вили: Нью-Йорк, 1988.
- ^ Хазари, Н.; Маунтфорд, П., «Реакции и применение имидокомплексов титана», Acc. хим. Рез. 2005, 38, 839-849. дои : 10.1021/ar030244z





