Нитры

В химии нитрен или имен ( R−:Ṅ· ) — азотистый аналог карбена . Атом азота незаряжен и одновалентен . [1] у него всего 6 электронов поэтому на валентном уровне — два ковалентно связанных и четыре несвязанных электрона. Поэтому его считают электрофилом из-за неудовлетворенного октета . Нитрен является реакционноспособным промежуточным продуктом и участвует во многих химических реакциях . [2] [3] Простейший нитрен, HN, называется имидогеном , и этот термин иногда используется как синоним класса нитренов. [4]
Электронная конфигурация
[ редактировать ]В простейшем случае линейная молекула N–H (имидоген) имеет атом азота sp-гибридизированный , причем два из четырех несвязанных электронов представляют собой неподеленную пару на sp-орбитали, а два других занимают вырожденную пару p-орбиталей . Электронная конфигурация соответствует правилу Хунда : форма с низкой энергией представляет собой триплет с одним электроном на каждой из p-орбиталей, а форма с высокой энергией представляет собой синглет с электронной парой, заполняющей одну p-орбиталь, а другую p-орбиталь вакантной.
Как и в случае с карбенами, существует сильная корреляция между спиновой плотностью атома азота, которую можно рассчитать in silico , и параметром расщепления в нулевом поле D , который можно получить экспериментально из электронного спинового резонанса . [5] Маленькие нитрены, такие как NH или CF 3 N, имеют значения D около 1,8 см. −1 со спиновой плотностью, близкой к максимальному значению 2. На нижнем конце шкалы находятся молекулы с низкими значениями D (<0,4) и спиновой плотностью от 1,2 до 1,4, такие как 9-антрилнитрен и 9-фенантрилнитрен.
Формирование
[ редактировать ]Поскольку нитрены настолько реакционноспособны, они не изолированы. Вместо этого они образуются в качестве реакционноспособных промежуточных продуктов во время реакции. Существует два распространенных способа получения нитренов:
- Из азидов путем термолиза или фотолиза с выделением газообразного азота. Этот метод аналогичен образованию карбенов из диазосоединений .
- Из изоцианатов , с выбросом угарного газа . Этот метод аналогичен образованию карбенов из кетенов .
Реакции
[ редактировать ]Нитреновые реакции включают:
- Вставка нитрена C–H . Нитрен может легко встроиться в ковалентную связь углерод-водород, образуя амин или амид. Синглетный нитрен реагирует с сохранением конфигурации . В одном исследовании [6] нитрен, образующийся при окислении карбамата персульфатом калия , дает реакцию внедрения в палладий -азотную связь продукта реакции ацетата палладия(II) с 2-фенилпиридином до метил -N- (2-пиридилфенил)карбамата в каскаде реакция :
- Предполагается, что во вставке C – H присутствует нитреновое промежуточное соединение с участием оксима и уксусного ангидрида, приводящего к изоиндолу : [7]
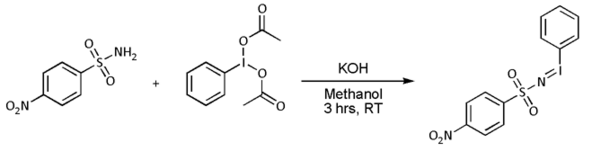
- Циклоприсоединение нитрена . С алкенами нитрены реагируют с образованием азиридинов , очень часто с предшественниками нитреноидов, такими как нозил- или тозилзамещенный [ N- (фенилсульфонил)имино]фенилиодинан (PhI=NN или PhI=NT соответственно)) но известно, что реакция протекает напрямую. с сульфонамидом в присутствии переходного металла на основе катализатора , такого как медь , палладий или золото : [8] [9] [10] [11] [12]
- Однако в большинстве случаев [ N -( п -нитрофенилсульфонил)имино]фенилиодинан (PhI=NNs) получают отдельно следующим образом:
- Перенос нитрена происходит следующим образом:
- В этой конкретной реакции как цис - стильбен показанный , так и транс- форма (не изображена) приводят к одному и тому же транс -азиридиновому продукту, что указывает на двухстадийный механизм реакции . Разница в энергии между триплетными и синглетными нитренами в некоторых случаях может быть очень небольшой, что позволяет осуществлять взаимное превращение при комнатной температуре. Триплетные нитрены термодинамически более стабильны, но реагируют ступенчато, обеспечивая свободное вращение и, таким образом, образуя смесь стереохимии. [13]
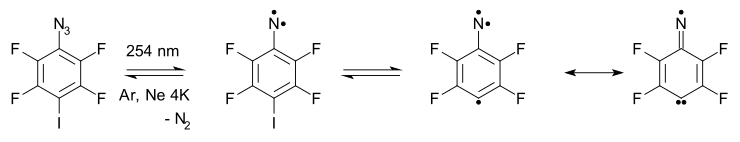
- Расширение и сжатие кольца арилнитрена . Арилнитрены демонстрируют расширение кольца до 7-членных кумуленов многократно , реакции раскрытия кольца и образование нитрила в сложных реакционных путях. Например, азид 2 на схеме ниже [5] захваченный в аргона матрице при 20 К при фотолизе, азот вытесняется в триплетный нитрен 4 (наблюдается экспериментально с помощью ЭПР и УФ-видимой спектроскопии ), который находится в равновесии с продуктом расширения кольца 6 .
- Нитрен в конечном итоге превращается в нитрил с раскрытым кольцом 5 через дирадикальный промежуточный продукт 7 . В высокотемпературной реакции FVT при 500–600 °C также образуется нитрил 5 с выходом 65%. [14]
Нитрено-радикалы
[ редактировать ]Для ряда соединений, содержащих как нитреновую группу, так и свободнорадикальную группу, зарегистрирован высокоспиновый квартет ЭПР (матрица, криогенные температуры). В один из них включена радикальная группа аминооксида , [15] другая система имеет радикальную группу углерода. [16]
В этой системе один из неспаренных электронов азота делокализован в ароматическом кольце, что делает соединение трирадикалом σ–σ–π. карбенового азотистого радикала (имидилового радикала) Резонансная структура вносит вклад в общую электронную картину.
В 2019 году Бетли и Ланкастер выделили подлинный триплет нитрена, стабилизированный путем координации с медным центром в объемистом лиганде. [17]
Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Нитрены ». дои : 10.1351/goldbook.N04145
- ^ Львовский, В., изд. (1970). Нитрены . Нью-Йорк: Межнаучный.
- ^ Вентрап, К. (1984). Реактивные промежуточные продукты . Нью-Йорк: Уайли.
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Имидогены ». дои : 10.1351/goldbook.I02951
- ^ Jump up to: а б Кваскофф, Дэвид; Беднарек, Павел; Джордж, Лиза; Вайх, Керстин; Вентрап, Курт (2006). «Нитрены, дирадикалы и илиды. Расширение кольца и раскрытие кольца в 2-хиназолилнитренах». Дж. Орг. хим. 71 (11): 4049–4058. дои : 10.1021/jo052541i . ПМИД 16709043 .
- ^ Чт, Хунг-Ят; Ю, Вин-Ю; Че, Чи-Мин (2006). «Межмолекулярное амидирование неактивированных sp. 2 и сп 3 Связи C–H через катализируемый палладием каскад активации C–H/введение нитрена». J. Am. Chem. Soc. 128 (28): 9048–9049. doi : 10.1021/ja062856v . PMID 16834374 .
- ^ Саварен, Сесиль Г.; Гризе, Кристиана; Марри, Джерри А.; Ример, Роберт А.; Хьюз, Дэвид Л. (2007). «Новая внутримолекулярная реакционная способность оксимов: синтез циклических и спироконденсированных иминов». Орг. Летт. 9 (6): 981–983. дои : 10.1021/ol0630043 . ПМИД 17319674 .
- ^ Ли, Зиганг; Дин, Сянъюй; Он, Чуан (2006). «Реакции переноса нитрена, катализируемые комплексами золота». Дж. Орг. хим. 71 (16): 5876–5880. дои : 10.1021/jo060016t . ПМИД 16872166 . S2CID 43641348 .
- ^ Эванс, Дэвид А.; Фаул, Маргарет М.; Билодо, Марк Т. (1994). «Развитие реакции азиридинирования олефинов, катализируемой медью». Дж. Ам. хим. Соц. 116 (7): 2742–2753. дои : 10.1021/ja00086a007 . S2CID 55554519 .
- ^ Брандт, Питер; Содергрен, Микаэль Дж.; Андерссон, Фер Г.; Норрби, Пер-Ола (2000). «Механистические исследования азиридинирования алкенов, катализируемого медью». Дж. Ам. хим. Соц. 122 (33): 8013–8020. дои : 10.1021/ja993246g . S2CID 98310736 .
- ^ Уотсон, Иэн Д.Г.; Ю, Лили; Юди, Андрей К. (2006). «Достижения в реакциях переноса азота с участием азиридинов». Акк. хим. Рез. 39 (3): 194–206. дои : 10.1021/ar050038m . ПМИД 16548508 .
- ^ Реагенты цис - стильбен или транс -стильбен, предшественник нитрена п -нитросульфонамид или нозиламин , который окисляется диацетатом иодзобензола . Золотой катализатор основан терпиридинтридентатном лиганде . на
- ^ Юдин, Андрей К., изд. (2007). Азиридины и эпоксиды в органическом синтезе . п. 120. ИСБН 978-3-527-31213-9 .
- ^ Хиназолин азида получают из соответствующего бромида и натрия . Азид находится в равновесии с тетразолом 3 .
- ^ Лахти, Пол М.; Эсат, Бурак; Ляо, И; Сервински, Пол; Лан, Цзян; Уолтон, Ричард (30 мая 2001 г.). «Гетероспиновые органические молекулы: нитрен-радикальные связи». Многогранник . 20 (11–14): 1647–1652. дои : 10.1016/S0277-5387(01)00667-2 .
- ^ Сандер, Вольфрам; Гроте, Дирк; Коссманн, Симона; Низ, Фрэнк (2008). «2,3,5,6-Тетрафторфенилнитрен-4-ил: Спектроскопическая характеристика электронного парамагнитного резонанса квартетного нитрено-радикала в основном состоянии». Дж. Ам. хим. Соц. 130 (13): 4396–4403. дои : 10.1021/ja078171s . ПМИД 18327939 .
- ^ Карш, КМ; ДиМуччи, ИМ; Йован, Д.А.; Ли, А.; Чжэн, С.-Л.; Титус, CJ; Ли, С.Дж.; Ирвин, К.Д.; Нордлунд, Д.; Ланкастер, КМ; Бетли, штат Калифорния (2019). «Синтез поддерживаемого медью триплетного нитренового комплекса, применимого к катализируемому медью аминированию» . Наука . 365 (6458): 1138–1143. Бибкод : 2019Sci...365.1138C . дои : 10.1126/science.aax4423 . ПМК 7256962 . ПМИД 31515388 .