Сульфенилхлорид
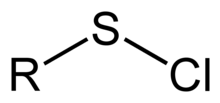
В сероорганической химии сульфенилхлорид представляет собой функциональную группу со связностью R-S-Cl , где R представляет собой алкил [1] или арил . Сульфенилхлориды представляют собой реакционноспособные соединения, которые действуют как источники РС + . Их используют при формировании RS-N и RS-O Облигации . По номенклатуре ИЮПАК они называются алкилтиогипохлоритами, т.е. эфирами тиохлорноватистой кислоты.
Обычно сульфенилгалогениды стабилизируются электроотрицательными заместителями. Эту тенденцию подтверждает стабильность CCl 3 SCl получают хлорированием сероуглерода .
Подготовка
[ редактировать ]
Сульфенилхлориды обычно хлорированием дисульфидов получают : [2] [3] Эту реакцию иногда называют дисульфидной реакцией Цинке, по признанию Теодора Цинке . [4] [5]
Некоторые тиоэфиры ( R-S-R' ) с электроноакцепторными заместителями подвергаются хлоринолизу Связь C-S с образованием сульфенилхлорида. [6] [7]
В вариации реакции Рида под действием УФ - дихлорид серы вытесняет водород излучения. [8]
Реакции
[ редактировать ]Перхлорметилмеркаптан ( CCl 3 SCl ) реагирует с Связи N-H в присутствии основания образуют сульфенамиды :
Этот метод используется при производстве фунгицидов Каптан и Фолпет .
Сульфенилхлориды присоединяются к алкенам , например этилену : [9]
Они подвергаются хлорированию до трихлоридов : [3]
Сульфенилхлориды реагируют с водой и спиртами с образованием сульфениловых эфиров ( R-S-O-R' ): [10]
Путь к сульфинилгалогенидам
[ редактировать ]Сульфенилхлориды можно превратить в сульфинилхлориды (RS(O)Cl). В одном подходе сульфинилхлорид образуется в две стадии, начиная с реакции тиола ( −SH ) с сульфурилхлоридом ( SO 2 Cl 2 ). В некоторых случаях вместо этого образуется сульфенилхлорид, как это происходит с 2,2,2-трифтор-1,1- дифенилэтантиолом . Окисление трифторперуксусной кислоты обеспечивает общий подход к образованию сульфинилхлоридов из сульфенилхлоридов: [11]

Родственные соединения
[ редактировать ]сульфенилфториды . и бромиды Известны также [12] Простые сульфенилиодиды неизвестны, поскольку они нестабильны по отношению к дисульфиду и йоду :
Сульфенилиодиды можно выделить как стабильные соединения, если они несут алкилстерические защитные группы как часть полости в форме каркаса, что иллюстрирует метод кинетической стабилизации реакционной функциональности, как в случае сульфеновых кислот . [13]
Родственным классом соединений являются трихлориды алкилсеры, примером которых является трихлорид метилсеры. СН 3 SCl 3 . [14]
Соответствующие селененилгалогениды, R-SeCl чаще встречаются в лаборатории. Сульфенилхлориды используются в производстве агентов, применяемых при вулканизации каучука.
Ссылки
[ редактировать ]- ^ Драбович Дж.; Келбасинский, П.; Лыжва, П.; Заяц, А.; Миколайчик, М. (2008). Камбе, Н. (ред.). Алкансульфенилгалогениды . Наука синтеза. Том 39. стр. 544–550. ISBN 9781588905307 .
- ^ Хубахер, Макс Х. (1943). « О -Нитрофенилсера хлорид» . Органические синтезы ; Сборник томов , т. 2, с. 455 .
- ^ Jump up to: а б Дуглас, Ирвин Б.; Нортон, Ричард В. (1973). «Метансульфинилхлорид» . Органические синтезы ; Сборник томов , т. 5, стр. 709–715 .
- ^ Зинке, Т. (1911). «О новой серии ароматических соединений серы» . Химические отчеты (на немецком языке). 44 (1): 769–771. дои : 10.1002/cber.191104401109 .
- ^ Зинке, Т. ; Фарр, о. (1912). « О хлориде о-нитрофенилсеры и продуктах его переработки» . Анналы химии Юстуса Либиха (на немецком языке). 391 (1): 57–88. дои : 10.1002/jlac.19123910106 .
- ^ Ф. Б. Уэллс, CFH Аллен (1935). «2,4-Динитроанилин». Органические синтезы . 15:22 . дои : 10.15227/orgsyn.015.0022 .
- ^ Норман Хараш, Роберт Б. Лэнгфорд (1964). «2,4-динитробензолсульфенилхлорид». Органические синтезы . 44 : 47. дои : 10.15227/orgsyn.044.0047 .
- ^ Смит (2020), Органическая химия марта , rxn. 14-9.
- ^ Бринцингер, Х.; Лангек, М., «Синтез с хлоридами алкилсеры (X. Сообщение об органических хлоридах серы)», Chemical Reports 1954, том 87, 325–330. два : 10.1002/cber.19540870306
- ^ Петрович, Горан; Сайчич, Радомир Н.; Чекович, Живорад (2005). «Фенилсульфенилирование неактивированного атома углерода фотолизом алкилбензолсульфената: получение 2-фенилтио-5-гептанола» . Органические синтезы . 81 : 244. дои : 10.15227/orgsyn.081.0244 .
- ^ Страница, печатная плата; Уилкс, Р.Д.; Рейнольдс, Д. (1995). «Алкилхалькогениды: функциональные группы на основе серы» . В Лей, Стивен В. (ред.). Синтез: углерод с одним гетероатомом, связанным одинарной связью . Комплексные преобразования органических функциональных групп. Эльзевир . стр. 113–276 . ISBN 9780080423234 .
- ^ Рено, Дэниел С.; Париза, Ричард Дж. (1998). «Фенилвинилсульфид» . Органические синтезы ; Сборник томов , т. 9, с. 662 .
- ^ Сасе, С.; Аоки, Ю.; Абэ, Н.; Гото, К. (2009). «Стабильный сульфенилйодид, несущий первичную алкильную стерическую защитную группу с полостным каркасом». Химические письма . 38 (12): 1188–1189. дои : 10.1246/кл.2009.1188 .
- ^ Браверман, С.; Черкинский, М.; Левинджер, С. (2008). «Алкилсера Тригалогениды». наук. Синтез . 39 : 187–188. ISBN 9781588905307 .



![{\displaystyle {\ce {R-SCl + Cl2 -> [R-SCl2]Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/deaf1569a9b4e7730eaea75337aa67878db5868c)


