Тиоэфир
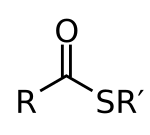
В органической химии тиоэфиры — сероорганические соединения с молекулярным строением. R-C(=O)-S-R' . Они аналогичны эфирам карбоксилатных кислот ( R-C(=O)-O-R' ), где сера в тиоэфире заменяет кислород в сложном эфире карбоксилатной кислоты, как это подразумевается префиксом тио- . Являются продуктом этерификации карбоновой кислоты ( R-C(=O)-O-H ) с тиолом ( R'-S-H ). В биохимии наиболее известными тиоэфирами являются производные кофермента А , например ацетил-КоА . [1] R и R' представляют собой органильные группы или H в случае R.
Синтез
[ редактировать ]Один путь получения тиоэфиров включает реакцию хлорангидрида с солью щелочного металла тиола: [1]
- RSNa + R'COCl → R'COSR + NaCl
Другой распространенный путь предполагает замещение галогенидов солью щелочного металла тиокарбоновой кислоты . Например, сложные эфиры тиоацетата обычно получают алкилированием тиоацетата калия : [1]
- КАН. 3 COSK + RX → КАН. 3 COSR + KX
Аналогичное алкилирование ацетатной соли практикуется редко. Алкилирование можно проводить с использованием оснований Манниха и тиокарбоновой кислоты:
- CH 3 COSH + R' 2 NCH 2 OH → CH 3 COSCH 2 NR' 2 + H 2 O
Тиоэфиры можно получить конденсацией тиолов и карбоновых кислот в присутствии дегидратирующих агентов : [2] [3]
- RSH + R'CO 2 H → RSC(O)R' + H 2 O
Типичным агентом обезвоживания является DCC . [4] Сообщалось также об усилиях по повышению устойчивости синтеза тиоэфиров с использованием более безопасного связующего реагента T3P и более экологичного растворителя циклопентанона . [5] Ангидриды кислот и некоторые лактоны также дают тиоэфиры при обработке тиолами в присутствии основания.
Тиоэфиры можно легко получить из спиртов по реакции Мицунобу с использованием тиоуксусной кислоты . [6]
Они также возникают при алкинов и в алкенов карбонилировании присутствии тиолов. [7]
Реакции
[ редактировать ]Тиоэфиры гидролизуются до тиолов и карбоновой кислоты:
- RC(O)SR' + H 2 O → RCO 2 H + RSH
Карбонильный центр в тиоэфирах более активен по отношению к амину, чем кислородные нуклеофилы, образуя амиды :
Эта реакция используется в нативном химическом лигировании , протоколе синтеза пептидов . [8]
В родственной реакции тиоэфиры можно превратить в сложные эфиры. [9] Эфиры тиоацетатной кислоты также можно расщеплять метантиолом в присутствии стехиометрического основания, как показано на примере получения пент-4-ин-1-тиола: [10]
- H 3 C(CH 2 ) 3 ОМ + KSAc → H 3 C(CH 2 ) 3 SAc + КОМ
- H 3 C(CH 2 ) 3 SAc + HSMe → H 3 C(CH 2 ) 3 SH + MeSAc
Уникальной реакцией для тиоэфиров является реакция Фукуямы , при которой тиоэфир соединяется с цинкорганическим галогенидом с помощью палладиевого катализатора с образованием кетона.

Биохимия
[ редактировать ]
Тиоэфиры являются обычными промежуточными продуктами во многих реакциях биосинтеза, включая образование и распад жирных кислот и мевалоната , предшественника стероидов. Примеры включают тиоэфиры малонил-КоА , ацетоацетил-КоА , пропионил-КоА , циннамоил-КоА и ацильный белок-носитель (ACP). Ацетогенез протекает через образование ацетил-КоА . Биосинтез лигнина , который составляет большую часть биомассы суши Земли, происходит через тиоэфирное производное кофейной кислоты . [11] Эти тиоэфиры возникают аналогично полученным синтетически, с той разницей, что дегидратирующим агентом является АТФ. Кроме того, тиоэфиры играют важную роль в мечении белков убиквитином , который маркирует белок для деградации.
Окисление атома серы в тиоэфирах ( тиолактонах ) постулируется при биоактивации антитромботических пролекарств тиклопидина , клопидогреля и прасугреля . [12] [13]
Тиоэфиры и происхождение жизни
[ редактировать ]Как утверждается в «Мире тиоэфиров», тиоэфиры являются возможными предшественниками жизни. [14] Как объясняет Кристиан де Дюв :
Показательно, что тиоэфиры являются обязательными промежуточными продуктами в нескольких ключевых процессах, в которых АТФ либо используется, либо регенерируется. Тиоэфиры участвуют в синтезе всех сложных эфиров , в том числе входящих в состав сложных липидов . Они также участвуют в синтезе ряда других клеточных компонентов, включая пептиды , жирные кислоты , стерины , терпены , порфирины и другие. Кроме того, тиоэфиры образуются в качестве ключевых промежуточных продуктов в некоторых особенно древних процессах, приводящих к сборке АТФ. В обоих случаях тиоэфир ближе, чем АТФ, к процессу, который использует или дает энергию. Другими словами, тиоэфиры могли фактически играть роль АТФ в «мире тиоэфиров», изначально лишенном АТФ. В конце концов, [эти] тиоэфиры могли способствовать образованию АТФ благодаря своей способности поддерживать образование связей между фосфатными группами .
Однако из-за высокого изменения свободной энергии при гидролизе тиоэфиров и, соответственно, их низких констант равновесия, маловероятно, что эти соединения могли аккумулироваться абиотически в сколько-нибудь значительной степени, особенно в условиях гидротермальных жерл. [15]
Тионоэфиры
[ редактировать ]

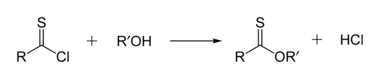
Тионоэфиры изомерны тиоэфирам. В тионоэфире сера заменяет карбонильный кислород в сложном эфире. Метилтионобензоат представляет собой C 6 H 5 C(S)OCH 3 . Такие соединения обычно получают реакцией тиоацилхлорида со спиртом. [16]
Их также можно получить реакцией реактива Лавессона со сложными эфирами или обработкой пиннер-солей сероводородом. Альтернативно, различные тионоэфиры могут быть получены путем переэтерификации существующего метилтионоэфира спиртом в условиях, катализируемых основаниями. [17]

Ксанфат [18] и тиоамиды [19] могут превращаться в тионоэфиры в условиях кросс-сочетания, катализируемого металлами.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Мэттис Дж. Янссен «Карбоновые кислоты и сложные эфиры» в книге PATAI «Химия функциональных групп: карбоновые кислоты и сложные эфиры», Сол Патай, изд. Джон Уайли, 1969, Нью-Йорк: стр. 705–764. два : 10.1002/9780470771099.ch15
- ^ Фудзивара, С.; Камбе, Н. (2005). «Эфиры тио-, селено- и теллурокарбоновых кислот». Темы современной химии . Том. 251. Берлин/Гейдельберг: Шпрингер. стр. 87–140. дои : 10.1007/b101007 . ISBN 978-3-540-23012-0 .
- ^ «Синтез тиоэфиров» . Портал органической химии.
- ^ Мори, Ю.; Секи, М. (2007). «Синтез многофункциональных кетонов посредством реакции сочетания Фукуямы, катализируемой катализатором Перлмана: получение этил-6-оксотридеканоата» . Органические синтезы . 84 :285 ; Сборник томов , т. 11, с. 281 .
- ^ Джордан, Эндрю; Снеддон, Хелен Ф. (2019). «Разработка руководства по выбору растворителя-реагента для образования тиоэфиров». Зеленая химия . 21 (8): 1900–1906. дои : 10.1039/C9GC00355J . S2CID 107391323 .
- ^ Воланте, Р. (1981). «Новый высокоэффективный метод превращения спиртов в тиоэфиры и тиолы». Буквы тетраэдра . 22 (33): 3119–3122. дои : 10.1016/S0040-4039(01)81842-6 .
- ^ Бертлефф, В.; Ропер, М.; Сава, X. «Карбонилирование». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a05_217.pub2 . ISBN 978-3527306732 .
- ^ МакГрат, Северная Каролина; Рейнс, RT (2011). «Хемоселективность в химической биологии: реакции переноса ацила с серой и селеном» . Акк. хим. Рез . 44 (9): 752–761. дои : 10.1021/ar200081s . ПМЦ 3242736 . ПМИД 21639109 .
- ^ Ван Кит Чан; С. Масамунэ; Гэри О. Спессард (1983). «Получение О-эфиров из соответствующих тиоловых эфиров: трет-бутилциклогексанкарбоксилата». Органические синтезы . 61 : 48. дои : 10.15227/orgsyn.061.0048 .
- ^ Маттео Миноцци; Даниэле Нанни; Пьеро Спаньоло (2008). «4-Пентин-1-тиол». эЭРОС . дои : 10.1002/047084289X.rn00855 . ISBN 978-0-471-93623-7 .
- ^ Ленинджер, Алабама; Нельсон, Д.Л.; Кокс, ММ (2000). Принципы биохимии (3-е изд.). Нью-Йорк: Стоит публикации. ISBN 1-57259-153-6 .
- ^ Мансуи, Д.; Дансетт, премьер-министр (2011). «Сульфеновые кислоты как реактивные интермедиаты метаболизма ксенобиотиков» . Архив биохимии и биофизики . 507 (1): 174–185. дои : 10.1016/j.abb.2010.09.015 . ПМИД 20869346 .
- ^ Дансетт, премьер-министр; Рози, Дж.; Дебернарди, Дж.; Берто, Г.; Мансуи, Д. (2012). «Метаболическая активация прасугрела: природа двух конкурентных путей, приводящих к открытию его тиофенового кольца». Химические исследования в токсикологии . 25 (5): 1058–1065. дои : 10.1021/tx3000279 . ПМИД 22482514 .
- ^ де Дюв, К. (1995). «Начало жизни на Земле» . Американский учёный . 83 (5): 428–437.
- ^ Чандру, Кухан; Гилберт, Алексис; Бутч, Кристофер; Аоно, Масаси; Кливс, Хендерсон Джеймс II (21 июля 2016 г.). «Абиотическая химия тиолированных производных ацетата и происхождение жизни» . Научные отчеты . 6 (29883): 29883. Бибкод : 2016NatSR...629883C . дои : 10.1038/srep29883 . ПМЦ 4956751 . ПМИД 27443234 .
- ^ Кремлин, Р.Дж. (1996). Введение в сероорганическую химию . Чичестер: Джон Уайли и сыновья. ISBN 0-471-95512-4 .
- ^ Ньютон, Джозайя Дж.; Бриттон, Роберт; Фризен, Чадрон М. (4 октября 2018 г.). «Катализируемая основанием переэтерификация тионоэфиров». Журнал органической химии . 83 (20): 12784–12792. дои : 10.1021/acs.joc.8b02260 . ПМИД 30235418 . S2CID 52309850 .
- ^ Монтейт, Джон Дж.; Скотчберн, Катерина; Миллс, Л. Реджинальд; Руссо, Софи А.Л. (2022). «Ni-катализируемый синтез производных тиокарбоновой кислоты» . Органические письма . 24 (2): 619–624. doi : 10.1021/acs.orglett.1c04074 . ПМИД 34978834 . S2CID 245669904 .
- ^ Лю, Инбо; Мо, Сяофэн; Маджид, Ирфан; Чжан, Мэй; Ван, Хуэй; Цзэн, Чжо (2022). «Эффективный и простой подход к получению тионоэфиров посредством катализируемого палладием C – N-расщепления тиоамидов» . Органическая и биомолекулярная химия . 20 (7): 1532–1537. дои : 10.1039/d1ob02349g . ISSN 1477-0520 . ПМИД 35129563 . S2CID 246418140 .

