Пиннер Реакция
| Пиннер Реакция | |
|---|---|
| Назван в честь | Адольф палки |
| Идентификаторы | |
| Органическая химическая портал | Пиннера-реакция |
| RSC Ontology Id | RXNO: 0000361 |
Реакция Пиннера относится к кислотной катализированной реакции нитрила с спиртом с образованием эфирной соли имино ( алкилмидальная соль ); Это иногда называют солью пиннера . [ 1 ] Реакция названа в честь Адольфа Пиннера , который впервые описал ее в 1877 году. [ 2 ] [ 3 ] [ 4 ] Соли Pinner сами являются реактивными и подвергаются дополнительным нуклеофильным дополнениям, чтобы дать различные полезные продукты: [ 5 ] [ 6 ]
- С избытком алкоголя с образованием ортоэфира
- С аммиаком или амином с образованием амидина (ди-нитрилы могут образовывать имидины , например, сукцинимидин от сукцинонитрила ) [ 7 ]
- С водой с образованием эфира
- С серо водорода с образованием тионоэстера
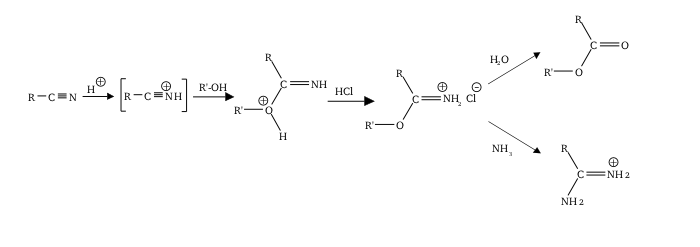
Обычно сама соль Pinner не изолирована, причем реакция продолжает давать желаемую функциональную группу (ортоэстер и т. Д.) за один раз. Соли хлорида имидия являются термодинамически нестабильными, а низкие температуры помогают предотвратить элиминацию до амида и алкилхлорида . [ 8 ]
Следует оценить, что реакция Pinner относится конкретно к кислотному катализируемому процессу, но что аналогичные результаты часто могут быть достигнуты с использованием базового катализа. Два подхода могут быть дополнительными, с нитрилами, которые нереактивны в кислотных условиях, часто дают лучшие результаты в присутствии основания и наоборот. [ 9 ] Определяющим фактором, как правило, то, насколько богатым электроном или бедным нитрил. Например: нитрил, бедный электроном, является хорошим электрофилом (легко восприимчивым к атаке из алкоксидов и т. Д.), Но плохой нуклеофил, как правило, протонат будет легче, чем участвовать в реакции, и, следовательно, ожидается, что он будет более легко реагировать под основным. чем кислые условия.
Смотрите также
[ редактировать ]- HOECH Реакция
- Оверман перестройка
- Изоцианид
- Имидоил хлорид
- Синдегид Стивен Альдегид - по существу та же реакция, но включая восстановление и с водой в качестве нуклеофила; генерирует альдегид.
Ссылки
[ редактировать ]- ^ "Пиннер -реакция". Комплексные органические реакции и реагенты (504): 2237–2240. 2010. DOI : 10.1002/9780470638859.conrr504 . ISBN 9780470638859 .
- ^ А. Пиннер, Ф. Кляйн; Кляйн (1877). «Преобразование нитрила в имиде» . Отчеты немецкого химического общества . 10 (2): 1889–1897. Doi : 10.1002/cber.187701002154 .
- ^ А. Пиннер, о. Кляйн (1878). «Преобразование нитрила в имиде» . Отчеты немецкого химического общества . 11 (2): 1475–1487. Doi : 10.1002/cber.18780110258 .
- ^ А. Пиннер (1883). «О преобразовании нитрила в имиде» . Отчеты немецкого химического общества . 16 (2): 1643–1655. Doi : 10.1002/cber.18830160235 .
- ^ Роджер, Р.; Нейлсон, Д.Г. (1961). «Химия имидатов». Химический Rev. 61 (2): 179–211. doi : 10.1021/cr60210a003 .
- ^ Адамс, Роджер; Thal, AF (1922). «Этил фенилацетат». Органические синтезы . 2 : 27. doi : 10.15227/orgsyn.002.0027 .
- ^ Элвидж, JA; Линстед, RP (1954). «Гетероциклические имины и амины. Часть III. Сукцинимидин». Журнал химического общества (возобновляется) : 442. DOI : 10.1039/jr9540000442 .
- ^ Dewolfe, Robert H. (1970). Карбоксильные ортоисгические производные . Органическая химия. Тол. 14. Нью -Йорк, Нью -Йорк: Академическая пресса. п. 5. LCCN 70-84226 .
- ^ Schaefer, FC; Петерс, Г.А. (1961). «Катализируемая основанием реакция нитрилов с спиртами. Удобный путь к имидатам и солям амидина». Журнал органической химии . 26 (2): 412. DOI : 10.1021/JO01061A034 .