Реакция Пиннера
| Реакция Пиннера | |
|---|---|
| Назван в честь | Адольф Пиннер |
| Идентификаторы | |
| Портал органической химии | пиннер-реакция |
| RSC Идентификатор онтологии | RXNO: 0000361 |
Реакция Пиннера относится к катализируемой кислотой реакции нитрила со спиртом с образованием соли иминоэфира ( алкилимидатной соли ); ее иногда называют солью Пиннера . [ 1 ] Реакция названа в честь Адольфа Пиннера , впервые описавшего ее в 1877 году. [ 2 ] [ 3 ] [ 4 ] Пиннер-соли сами по себе реакционноспособны и подвергаются дополнительным нуклеофильным присоединениям с образованием различных полезных продуктов: [ 5 ] [ 6 ]
- При избытке спирта образуется ортоэфир.
- С аммиаком или амином с образованием амидина (динитрилы могут образовывать имидины , например сукцинимидин из сукцинонитрила ) [ 7 ]
- С водой с образованием сложного эфира
- С сероводородом с образованием тионоэфира.
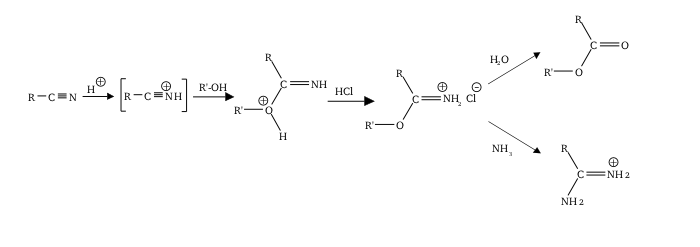
Обычно соль Пиннера сама по себе не выделяется, а реакцию продолжают с получением желаемой функциональной группы (ортоэфира и т. д.) за один прием. Следует понимать, что реакция Пиннера относится конкретно к процессу, катализируемому кислотой, но аналогичные результаты часто могут быть достигнуты с использованием основного катализа. Эти два подхода могут дополнять друг друга: нитрилы, которые нереакционноспособны в кислых условиях, часто дают лучшие результаты в присутствии основания, и наоборот. [ 8 ] Определяющим фактором обычно является то, насколько богат или беден электронами нитрил. Например: бедный электронами нитрил является хорошим электрофилом (легко восприимчивым к атаке со стороны алкоксидов и т. д.), но плохой нуклеофил обычно легче протонировать, чем участвовать в реакции, и, следовательно, можно ожидать, что он будет легче реагировать в условиях основного, а не основного действия. чем кислые условия.
См. также
[ редактировать ]- Реакция Хеша
- Перестановка Овермана
- изоцианид
- Имидоилхлорид
- Синтез альдегида Стивена - по сути та же реакция, но включая восстановление и с использованием воды в качестве нуклеофила; генерирует альдегид.
Ссылки
[ редактировать ]- ^ «Реакция Пиннера». Комплексные органические реакции и реагенты (504): 2237–2240. 2010. doi : 10.1002/9780470638859.conrr504 . ISBN 9780470638859 .
- ^ А. Пиннер, Ф. Кляйн; Малый (1877). «Превращение нитрилов в имиды» . Отчеты Немецкого химического общества . 10 (2): 1889–1897. дои : 10.1002/cber.187701002154 .
- ^ А. Пиннер, г-жа Кляйн; Малый (1878 г.). «Превращение нитрилов в имиды» . Отчеты Немецкого химического общества . 11 (2): 1475–1487. дои : 10.1002/cber.18780110258 .
- ^ А. Пиннер (1883). «О превращении нитрилов в имиды» . Отчеты Немецкого химического общества . 16 (2): 1643–1655. дои : 10.1002/cber.18830160235 .
- ^ Роджер, Р.; Нилсон, Д.Г. (1961). «Химия имидатов». хим. Откр. 61 (2): 179–211. дои : 10.1021/cr60210a003 .
- ^ Адамс, Роджер; Таль, А. Ф. (1922). «Этилфенилацетат». Органические синтезы . 2 : 27. дои : 10.15227/orgsyn.002.0027 .
- ^ Элвидж, Дж.А.; Линстед, Р.П. (1954). «Гетероциклические имины и амины. Часть III. Сукцинимидин». Журнал Химического общества (обновленный) : 442. doi : 10.1039/JR9540000442 .
- ^ Шефер, ФК; Питерс, Джорджия (1961). «Катализируемая основаниями реакция нитрилов со спиртами. Удобный путь к имидатам и амидиновым солям». Журнал органической химии . 26 (2): 412. doi : 10.1021/jo01061a034 .