Коэнзим А
 | |
 | |
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК [(2R,3S,4R,5R)-5-(6-амино-9H-пурин-9-ил)-4-гидрокси-3-(фосфоноокси)тетрагидро-2-фуранил]метил (3R)-3-гидрокси -2,2-диметил-4-оксо-4-({3-оксо-3-[(2-сульфанилэтил)амино]пропил}амино)бутилдигидрофосфат | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.001.472 |
| КЕГГ | |
| МеШ | Коэнзим+А |
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Характеристики | |
| С 21 Ч 36 Н 7 О 16 П 3 С | |
| Молярная масса | 767.535 |
| УФ-видимое излучение (λ макс .) | 259,5 нм [1] |
| Поглощение | ε 259 = 16,8 мМ −1 см −1 [1] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Коэнзим А ( CoA , SHCoA , CoASH ) — кофермент , играющий важную роль в синтезе и окислении , жирных кислот а также окислении пирувата в цикле лимонной кислоты . Все геномы, секвенированные на сегодняшний день, кодируют ферменты, которые используют кофермент А в качестве субстрата , и около 4% клеточных ферментов используют его (или тиоэфир ) в качестве субстрата. У человека биосинтез КоА требует цистеина , пантотената (витамина B 5 ) и аденозинтрифосфата (АТФ). [2]
В своей ацетильной форме коэнзим А представляет собой очень универсальную молекулу, выполняющую метаболические функции как на анаболическом, так и на катаболическом пути. КоА используется в посттрансляционной регуляции и аллостерической регуляции пируватдегидрогеназы и Ацетил - карбоксилазы для поддержания и поддержки разделения синтеза и деградации пирувата . [3]
Открытие структуры [ править ]

Коэнзим А был открыт Фрицем Липманом в 1946 году. [4] который также позже дал ему свое имя. Его структура была определена в начале 1950-х годов в Институте Листера в Лондоне совместно Липманном и другими сотрудниками Гарвардской медицинской школы и Массачусетской больницы общего профиля . [5] Липманн первоначально намеревался изучить перенос ацетила на животных, и в ходе этих экспериментов он заметил уникальный фактор, которого не было в экстрактах ферментов, но который был очевиден во всех органах животных. Ему удалось выделить и очистить этот фактор из печени свиньи и обнаружить, что его функция связана с коферментом, который активно участвует в ацетилировании холина. [6] Работа с Беверли Жирар , Натаном Капланом и другими определила, что пантотеновая кислота является центральным компонентом кофермента А. [7] [8] Коэнзим был назван коэнзимом А, что означает «активация ацетата». В 1953 году Фриц Липманн получил Нобелевскую премию по физиологии и медицине «за открытие кофермента А и его значения для промежуточного метаболизма». [6] [9]
Биосинтез [ править ]
Коэнзим А естественным образом синтезируется из пантотената (витамина В 5 ), который содержится в таких продуктах, как мясо, овощи, зерновые, бобовые, яйца и молоко. [10] В организме человека и большинства живых организмов пантотенат является важным витамином, выполняющим множество функций. [11] В некоторых растениях и бактериях, включая Escherichia coli , пантотенат может синтезироваться de novo и поэтому не считается незаменимым. Эти бактерии синтезируют пантотенат из аминокислоты аспартата и метаболита при биосинтезе валина. [12]
Во всех живых организмах коэнзим А синтезируется в пятиэтапном процессе, для которого требуются четыре молекулы АТФ, пантотената и цистеина. [13] (см. рисунок):

- Пантотенат (витамин B 5 ) фосфорилируется до 4'-фосфопантотената ферментом пантотенаткиназой (PanK; CoaA; CoaX). Это обязательный этап биосинтеза КоА, требующий АТФ. [12]
- Цистеин . присоединяется к 4'-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы (PPCS; CoaB) с образованием 4'-фосфо-N-пантотеноилцистеина (PPC) Этот этап сопровождается гидролизом АТФ. [12]
- PPC декарбоксилируется до 4'-фосфопантетеина с помощью фосфопантотеноилцистеиндекарбоксилазы (PPC-DC; CoaC).
- 4'-фосфопантетеин аденилируется (или, точнее, АМпилируется ) с образованием дефосфо-КоА с помощью фермента фосфопантетеин-аденилаттрансферазы (COASY; PPAT; CoaD).
- Наконец, дефосфо-КоА фосфорилируется до кофермента А с помощью фермента дефосфокофермент-киназы А (COASY, DPCK; CoaE). Этот последний шаг требует АТФ. [12]
Сокращения в номенклатуре ферментов в скобках обозначают ферменты млекопитающих, других эукариот и прокариот соответственно. У млекопитающих этапы 4 и 5 катализируются бифункциональным ферментом COASY . [14] Этот путь регулируется ингибированием продукта. КоА является конкурентным ингибитором пантотенаткиназы, которая в норме связывает АТФ. [12] Коэнзим А, три АДФ, один монофосфат и один дифосфат образуются в результате биосинтеза. [13]
Коэнзим А может синтезироваться альтернативными путями, когда внутриклеточный уровень коэнзима А снижается и путь de novo нарушается. [15] В этих путях коэнзим А должен поступать из внешнего источника, например, из пищи, чтобы производить 4'-фосфопантетеин . Эктонуклеотидпирофосфаты (ENPP) расщепляют кофермент А до 4'-фосфопантетеина, стабильной молекулы в организмах. Белки-ацил-переносчики (ACP) (такие как ACP-синтаза и деградация ACP) также используются для производства 4'-фосфопантетеина. Этот путь позволяет пополнять запасы 4'-фосфопантетеина в клетке и превращать его в кофермент А посредством ферментов PPAT и PPCK. [16]
Статья 2024 года [ нужна ссылка ] подробно описал вероятный механизм химического синтеза пантетеинового компонента (основной функциональной части) коэнзима А в первозданном пребиотическом мире.
Коммерческое производство [ править ]
Коэнзим А производят в промышленных масштабах путем экстракции из дрожжей, однако это неэффективный процесс (выход примерно 25 мг/кг), в результате чего продукт получается дорогой. Были исследованы различные способы синтетического или полусинтетического производства КоА, хотя ни один из них в настоящее время не работает в промышленном масштабе. [17]
Функция [ править ]
Синтез жирных кислот [ править ]
Поскольку коэнзим А с химической точки зрения является тиолом , он может реагировать с карбоновыми кислотами с образованием тиоэфиров , действуя таким образом как переносчик ацильной группы. Он помогает переносить жирные кислоты из цитоплазмы в митохондрии . Молекулу кофермента А, несущую ацильную группу, также называют ацил-КоА . Когда он не связан с ацильной группой, его обычно называют «CoASH» или «HSCoA». Этот процесс облегчает выработку в клетках жирных кислот, которые необходимы для структуры клеточных мембран.
Коэнзим А также является источником фосфопантетеиновой группы, которая добавляется в качестве простетической группы к белкам, таким как ациловый белок-носитель и формилтетрагидрофолатдегидрогеназа . [18] [19]
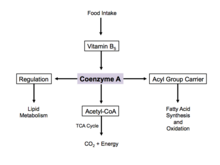
Производство энергии [ править ]
Коэнзим А является одним из пяти важнейших коферментов, которые необходимы в механизме реакции цикла лимонной кислоты . Его форма ацетил-коэнзима А является основным вкладом в цикл лимонной кислоты и получается в результате гликолиза , метаболизма аминокислот и бета-окисления жирных кислот. организма Этот процесс является основным катаболическим путем и необходим для разрушения строительных блоков клетки, таких как углеводы , аминокислоты и липиды . [20]
Регламент [ править ]
При избытке глюкозы кофермент А используется в цитозоле для синтеза жирных кислот. [21] Этот процесс реализуется путем регуляции ацетил-КоА-карбоксилазы , которая катализирует обязательную стадию синтеза жирных кислот. Инсулин стимулирует ацетил-КоА-карбоксилазу, а адреналин и глюкагон ингибируют ее активность. [22]
Во время клеточного голодания синтезируется коэнзим А, который транспортирует жирные кислоты из цитозоля в митохондрии. Здесь ацетил-КоА образуется для окисления и производства энергии. [21] В цикле лимонной кислоты коэнзим А действует как аллостерический регулятор, стимулируя фермент пируватдегидрогеназу .
и регуляция Антиоксидантная функция
Открытие новой антиоксидантной функции коэнзима А подчеркивает его защитную роль во время клеточного стресса. В клетках млекопитающих и бактерий, подвергнутых окислительному и метаболическому стрессу, наблюдается значительное увеличение ковалентной модификации белковых цистеиновых остатков коферментом А. [23] [24] Эта обратимая модификация называется белком CoAlation (Protein-S-SCoA), который играет роль, аналогичную белку S -глутатионилированию , предотвращая необратимое окисление тиоловой группы остатков цистеина.
Использование антитела против коэнзима А [25] и жидкостной хроматографии, тандемной масс-спектрометрии ( ЖХ-МС/МС ), более 2000 коалатированных белков было идентифицировано из стрессированных клеток млекопитающих и бактерий. [26] Большинство этих белков участвуют в клеточном метаболизме и реакции на стресс. [26] Различные научные исследования были сосредоточены на расшифровке регуляции белков, опосредованной коферментом А. при коАлировании белка ингибируется каталитическая активность различных белков (например, супрессора метастазов NME1 , пероксиредоксина 5 , GAPDH и других). Сообщается, что [27] [28] [24] [29] В восстановлении активности белка важную роль играют антиоксидантные ферменты, восстанавливающие дисульфидную связь между коферментом А и остатком цистеина белка. Этот процесс называется декоаляцией белка. На данный момент показано, что два бактериальных белка, тиоредоксин А и тиоредоксин-подобный белок (YtpP), декоалатируют белки. [30]
в биологических Использование исследованиях
Коэнзим А доступен у различных поставщиков химической продукции в виде свободной кислоты и солей лития или натрия . Свободная кислота коэнзима А заметно нестабильна: деградация примерно на 5% наблюдается через 6 месяцев при хранении при -20 °C. [1] и почти полная деградация через 1 месяц при 37 °C. [31] Литиевые и натриевые соли КоА более стабильны, при этом в течение нескольких месяцев при различных температурах отмечается незначительная деградация. [32] Водные растворы коэнзима А нестабильны при pH выше 8, при этом 31% активности теряется через 24 часа при 25 ° C и pH 8. Исходные растворы КоА относительно стабильны при замораживании при pH 2–6. Основным путем потери активности КоА, вероятно, является окисление КоА воздухом до дисульфидов КоА. Смешанные дисульфиды КоА, такие как КоА- S - S -глутатион, обычно являются примесями в коммерческих препаратах КоА. [1] Свободный КоА можно регенерировать из дисульфида КоА и смешанных дисульфидов КоА с помощью восстановителей, таких как дитиотреитол или 2-меркаптоэтанол .
Неисчерпывающий список ацильных групп, А коферментом активируемых
- Ацетил-КоА
- жирный ацил-КоА (активированная форма всех жирных кислот; только эфиры КоА являются субстратами для важных реакций, таких как синтез моно-, ди- и триацилглицерина, карнитинпальмитоилтрансфераза и холестерина этерификация )
- Пропионил-КоА
- Бутирил-КоА
- Миристоил-КоА
- Кротонил-КоА
- Ацетоацетил-КоА
- Кумароил-КоА (используется в флавоноидов и стильбеноидов ) биосинтезе
- Бензоил-КоА
- Фенилацетил-КоА
- Ацил, производный дикарбоновых кислот
- Малонил-КоА (важен для удлинения цепи при биосинтезе жирных кислот и биосинтезе поликетидов )
- Сукцинил-КоА (используется в биосинтезе гема )
- Гидроксиметилглутарил-КоА (используется в биосинтезе изопреноидов )
- Пимелил-КоА (используется в биосинтезе биотина )
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б с д Доусон Р.М., Эллиотт Д.К., Эллиотт У.Х., Джонс К.М. (2002). Данные для биохимических исследований (3-е изд.). Кларендон Пресс. стр. 118–119. ISBN 978-0-19-855299-4 .
- ^ Догерти М., Полануйер Б., Фаррелл М., Шолле М., Ликидис А., де Креси-Лагард В., Остерман А. (июнь 2002 г.). «Полное восстановление пути биосинтеза человеческого кофермента А посредством сравнительной геномики» . Журнал биологической химии . 277 (24): 21431–21439. дои : 10.1074/jbc.M201708200 . ПМИД 11923312 .
- ^ «Коэнзим А: когда мало, значит сильно» . www.asbmb.org . Архивировано из оригинала 20 декабря 2018 г. Проверено 19 декабря 2018 г.
- ^ Липманн Ф., Каплан Н.О. (1946). «Общий фактор ферментативного ацетилирования сульфаниламида и холина» . Журнал биологической химии . 162 (3): 743–744. дои : 10.1016/S0021-9258(17)41419-0 .
- ^ Бэддили Дж., Тейн Э.М., Новелли Г.Д., Липманн Ф. (январь 1953 г.). «Строение кофермента А» . Природа . 171 (4341): 76. Бибкод : 1953Natur.171...76B . дои : 10.1038/171076a0 . ПМИД 13025483 . S2CID 630898 .
- ^ Jump up to: Перейти обратно: а б Кресге Н., Симони Р.Д., Хилл Р.Л. (27 мая 2005 г.). «Фриц Липманн и открытие коэнзима А» . Журнал биологической химии . 280 (21): е18. ISSN 0021-9258 . Архивировано из оригинала 12 апреля 2019 г. Проверено 24 октября 2017 г.
- ^ Липманн Ф., Каплан Н.О. (март 1947 г.). «Кофермент ацетилирования, производное пантотеновой кислоты» . Журнал биологической химии . 167 (3): 869–870. дои : 10.1016/S0021-9258(17)30973-0 . ПМИД 20287921 .
- ^ Липманн Ф., Каплан Н.О., Новелли Г.Д., Таттл Л.К., Гирард Б.М. (сентябрь 1950 г.). «Выделение коэнзима А» . Журнал биологической химии . 186 (1): 235–243. дои : 10.1016/S0021-9258(18)56309-2 . ПМИД 14778827 .
- ^ «Фритц Липманн – Факты» . Нобелевская премия.org . Нобель Медиа АБ. 2014 . Проверено 8 ноября 2017 г.
- ^ «Витамин В 5 (Пантотеновая кислота)» . Медицинский центр Университета Мэриленда . Архивировано из оригинала 18 октября 2017 г. Проверено 8 ноября 2017 г.
- ^ «Пантотеновая кислота (витамин B 5 ): добавки MedlinePlus» . medlineplus.gov . Архивировано из оригинала 22 декабря 2017 г. Проверено 10 декабря 2017 г.
- ^ Jump up to: Перейти обратно: а б с д и Леонарди Р., Джековски С. (апрель 2007 г.). «Биосинтез пантотеновой кислоты и кофермента А» . ЭкоСал Плюс . 2 (2). дои : 10.1128/ecosalplus.3.6.3.4 . ПМЦ 4950986 . ПМИД 26443589 .
- ^ Jump up to: Перейти обратно: а б Леонарди Р., Чжан Ю.М., Rock CO, Джековски С. (2005). «Коэнзим А: снова в действии». Прогресс в исследованиях липидов . 44 (2–3): 125–153. дои : 10.1016/j.plipres.2005.04.001 . ПМИД 15893380 .
- ^ Эверс С., Зейтц А., Ассманн Б., Опладен Т., Карх С., Хиндерхофер К. и др. (июль 2017 г.). «Диагностика CoPAN с помощью секвенирования всего экзома: пробуждение спящего тигрового глаза». Американский журнал медицинской генетики. Часть А. 173 (7): 1878–1886. дои : 10.1002/ajmg.a.38252 . ПМИД 28489334 . S2CID 27153945 .
- ^ де Вильерс М., Штраус Э. (октябрь 2015 г.). «Метаболизм: запуск биосинтеза КоА». Химическая биология природы . 11 (10): 757–758. дои : 10.1038/nchembio.1912 . ПМИД 26379022 .
- ^ Сибон OC, Штраус Э (октябрь 2016 г.). «Коэнзим А: производить или потреблять?». Обзоры природы. Молекулярно-клеточная биология . 17 (10): 605–606. дои : 10.1038/номер.2016.110 . ПМИД 27552973 . S2CID 10344527 .
- ^ Мутерде Л.М., Стюарт Дж.Д. (19 декабря 2018 г.). «Выделение и синтез одного из важнейших кофакторов метаболизма: коэнзима А» (PDF) . Исследования и разработки органических процессов . 23 :19–30. дои : 10.1021/acs.oprd.8b00348 . S2CID 92802641 .
- ^ Эловсон Дж., Вагелос П.Р. (июль 1968 г.). «Белок-носитель ацила. X. Синтетаза белка-переносчика ацила» . Журнал биологической химии . 243 (13): 3603–3611. дои : 10.1016/S0021-9258(19)34183-3 . ПМИД 4872726 .
- ^ Стрикланд К.С., Хеферлин Л.А., Олейник Н.В., Крупенко Н.И., Крупенко С.А. (январь 2010 г.). «Специфическая к ацил-белку-переносчику 4'-фосфопантетеинилтрансфераза активирует 10-формилтетрагидрофолатдегидрогеназу» . Журнал биологической химии . 285 (3): 1627–1633. дои : 10.1074/jbc.M109.080556 . ПМК 2804320 . ПМИД 19933275 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Глава 2: Как клетки получают энергию из пищи» . Молекулярная биология клетки (4-е изд.). Гирляндная наука.
- ^ Jump up to: Перейти обратно: а б Ши Л, Ту Б.П. (апрель 2015 г.). «Ацетил-КоА и регуляция обмена веществ: механизмы и последствия» . Современное мнение в области клеточной биологии . 33 : 125–131. дои : 10.1016/j.ceb.2015.02.003 . ПМЦ 4380630 . ПМИД 25703630 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). «Ацетил-коэнзим А-карбоксилаза играет ключевую роль в контроле метаболизма жирных кислот» . Биохимия .
- ^ Цучия Ю., Пик-Чью С.Ю., Ньюэлл С., Миллер-Айду С., Мангал С., Живолуп А. и др. (июль 2017 г.). «Коаляция белков: окислительно-восстановительная модификация белка с помощью кофермента А в клетках млекопитающих» . Биохимический журнал . 474 (14): 2489–2508. дои : 10.1042/BCJ20170129 . ПМК 5509381 . ПМИД 28341808 .
- ^ Jump up to: Перейти обратно: а б Цучия Ю, Живолуп А, Бакович Дж, Томас Н, Ю БЯ, Дас С и др. (июнь 2018 г.). «Коаляция белков и антиоксидантная функция кофермента А в прокариотических клетках» . Биохимический журнал . 475 (11): 1909–1937. дои : 10.1042/BCJ20180043 . ПМЦ 5989533 . ПМИД 29626155 .
- ^ Маланчук О.М., Панасюк Г.Г., Сербин Н.М., Гоут И.Т., Филоненко В.В. (2015). «Получение и характеристика моноклональных антител, специфичных к коферменту А» . Биополимеры и клетка . 31 (3): 187–192. дои : 10.7124/bc.0008DF . ISSN 0233-7657 .
- ^ Jump up to: Перейти обратно: а б Тосунян М.А., Бачинска М., Далтон В., Ньюэлл С., Ма Ю., Дас С. и др. (июль 2022 г.). «Профилирование места коагуляции белка и взаимодействия стабилизации кофермента А» . Антиоксиданты . 11 (7): 1362. doi : 10.3390/antiox11071362 . ПМЦ 9312308 . ПМИД 35883853 .
- ^ Тосунян М.А., Чжан Б., Подагра I (декабрь 2020 г.). «Писатели, читатели и ластики в окислительно-восстановительной регуляции GAPDH» . Антиоксиданты . 9 (12): 1288. doi : 10.3390/antiox9121288 . ПМЦ 7765867 . ПМИД 33339386 .
- ^ Ю БЯ, Тосунян М.А., Христов С.Д., Лоуренс Р., Арора П., Цучия Ю. и др. (август 2021 г.). «Регуляция супрессора метастазов NME1 с помощью ключевого метаболического кофактора кофермента А» . Редокс-биология . 44 : 101978. doi : 10.1016/j.redox.2021.101978 . ПМЦ 8212152 . ПМИД 33903070 .
- ^ Бакович Дж., Ю Б.Я., Сильва Д., Чу С.П., Ким С., Ан Ш. и др. (ноябрь 2019 г.). «Ключевой метаболический интегратор, коэнзим А, модулирует активность пероксиредоксина 5 посредством ковалентной модификации» . Молекулярная и клеточная биохимия . 461 (1–2): 91–102. дои : 10.1007/s11010-019-03593-w . ПМК 6790197 . ПМИД 31375973 .
- ^ Тосунян М.А., Бачинска М., Далтон В., Пик-Чью С.Ю., Ундзенас К., Корза Г. и др. (апрель 2023 г.). « Bacillus subtilis YtpP и тиоредоксин А — новые игроки в опосредованном коэнзимом А защитном механизме против клеточного стресса» . Антиоксиданты . 12 (4): 938. doi : 10.3390/antiox12040938 . ПМЦ 10136147 . ПМИД 37107313 .
- ^ «Технические данные коэнзима А свободной кислоты» (PDF) . Восточные дрожжи, ООО.
- ^ «Технические данные литиевой соли коэнзима А» (PDF) . Восточные дрожжи, ООО.
Библиография [ править ]
- Нельсон Д.Л., Кокс М.М. (2005). Ленинджер: Принципы биохимии (4-е изд.). Нью-Йорк: W.H. Фриман. ISBN 978-0-7167-4339-2 .