Магний
 | ||||||||||||||||||||||||||
| Магний | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / m æ ɡ ˈ n iː z i ə m / | |||||||||||||||||||||||||
| Появление | блестящее серое твердое вещество | |||||||||||||||||||||||||
| Стандартный атомный вес А р °(Мг) | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Магний в таблице Менделеева | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Атомный номер ( Z ) | 12 | |||||||||||||||||||||||||
| Группа | группа 2 (щелочноземельные металлы) | |||||||||||||||||||||||||
| Период | период 3 | |||||||||||||||||||||||||
| Блокировать | S-блок | |||||||||||||||||||||||||
| Электронная конфигурация | [ Нет ] 3 секунды 2 | |||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 2 | |||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||
| Температура плавления | 923 К (650 °С, 1202 °F) | |||||||||||||||||||||||||
| Точка кипения | 1363 К (1091 °С, 1994 °F) | |||||||||||||||||||||||||
| Плотность (при 20°С) | 1,737 г/см 3 [3] | |||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 1,584 г/см 3 | |||||||||||||||||||||||||
| Теплота плавления | 8,48 кДж/моль | |||||||||||||||||||||||||
| Теплота испарения | 128 кДж/моль | |||||||||||||||||||||||||
| Молярная теплоемкость | 24.869 [4] Дж/(моль·К) | |||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||
| Стадии окисления | 0, [5] +1, [6] +2 (сильноосновный оксид ) | |||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,31. | |||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||
| Атомный радиус | эмпирический: 160 вечера | |||||||||||||||||||||||||
| Ковалентный радиус | 141±19:00 | |||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 173 вечера | |||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||
| Кристаллическая структура | гексагональная плотноупакованная (ГПУ) ( hP2 ) | |||||||||||||||||||||||||
| Константы решетки | а = 15:20,91 c = 17:21,03 (при 20 ° C) [3] | |||||||||||||||||||||||||
| Тепловое расширение | 25.91 × 10 −6 /К (при 20 °С) [3] [а] | |||||||||||||||||||||||||
| Теплопроводность | 156 [7] Вт/(м⋅К) | |||||||||||||||||||||||||
| Электрическое сопротивление | 43.9 [8] нОм⋅м (при 20 °C) | |||||||||||||||||||||||||
| Магнитный заказ | парамагнитный | |||||||||||||||||||||||||
| Молярная магнитная восприимчивость | +13.1 × 10 −6 см 3 /моль (298 К) [9] | |||||||||||||||||||||||||
| Модуль Юнга | 45 ГПа | |||||||||||||||||||||||||
| Модуль сдвига | 17 ГПа | |||||||||||||||||||||||||
| Объемный модуль | 35.4 [10] ГПа | |||||||||||||||||||||||||
| Скорость звука тонкого стержня | 4940 м/с (при комнатной температуре ) (отожженный) | |||||||||||||||||||||||||
| коэффициент Пуассона | 0.290 | |||||||||||||||||||||||||
| Твердость по шкале Мооса | 1–2.5 | |||||||||||||||||||||||||
| Твердость по Бринеллю | 44–260 МПа | |||||||||||||||||||||||||
| Номер CAS | 7439-95-4 | |||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||
| Мы | после Магнезии , Греция [11] | |||||||||||||||||||||||||
| Открытие | Джозеф Блэк (1755 г.) [11] ) | |||||||||||||||||||||||||
| Первая изоляция | Хамфри Дэви (1808 г.) [11] ) | |||||||||||||||||||||||||
| Изотопы магния | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Магний — химический элемент ; он имеет символ Mg и атомный номер 12. Это блестящий серый металл с низкой плотностью, низкой температурой плавления и высокой химической активностью. Как и другие щелочноземельные металлы (2-я группа таблицы Менделеева ), он встречается в природе только в сочетании с другими элементами и почти всегда имеет степень окисления +2. Он легко реагирует с воздухом, образуя тонкое пассивирующее покрытие из оксида магния , которое препятствует дальнейшей коррозии металла. Свободный металл горит ярко-белым светом. Металл получают главным образом электролизом магния, солей полученных из рассола . Он менее плотный, чем алюминий , и используется в основном в качестве компонента прочных и легких сплавов , содержащих алюминий.
В космосе магний производится в больших стареющих звездах путем последовательного добавления трех ядер гелия к ядру углерода . Когда такие звезды взрываются как сверхновые , большая часть магния выбрасывается в межзвездную среду , где он может переработаться в новые звездные системы. Магний — восьмой по распространенности элемент в земной коре. [13] и четвертый по распространенности элемент на Земле (после железа , кислорода и кремния планеты ), составляющий 13% массы планеты и значительную часть мантии . Это третий по распространенности элемент, растворенный в морской воде, после натрия и хлора . [14]
Этот элемент является одиннадцатым по массе элементом в организме человека и необходим для всех клеток и около 300 ферментов . [15] Ионы магния взаимодействуют с полифосфатными соединениями, такими как АТФ , ДНК и РНК . Для работы сотен ферментов необходимы ионы магния. Соединения магния используются в медицине как обычные слабительные и антациды (например, магнезиевое молоко ), а также для стабилизации аномального нервного возбуждения или спазма кровеносных сосудов при таких состояниях, как эклампсия . [15]
Характеристики
Физические свойства
Элементарный магний представляет собой серо-белый легкий металл, плотность которого составляет две трети плотности алюминия. Магний имеет самую низкую температуру плавления (923 К (650 ° C)) и самую низкую температуру кипения (1363 К (1090 ° C)) из всех щелочноземельных металлов. [16]
Чистый поликристаллический магний хрупок и легко разрушается по полосам сдвига . Он становится гораздо более податливым при легировании небольшим количеством других металлов, например, 1% алюминия. [17] Пластичность поликристаллического магния также можно значительно улучшить, уменьшив размер его зерна до ок. 1 микрон или меньше. [18]
В измельченном виде магний реагирует с водой с образованием газообразного водорода:
- Mg(s) + 2 H 2 O(г) → Mg(OH) 2 (водн.) + H 2 (г) + 1203,6 кДж/моль
Однако эта реакция гораздо менее драматична, чем реакции щелочных металлов с водой, поскольку гидроксид магния накапливается на поверхности металлического магния и ингибирует дальнейшую реакцию. [19]
Химические свойства
Окисление
Основным свойством металлического магния является его восстановительная способность. Одним из намеков является то, что он слегка тускнеет на воздухе, хотя, в отличие от более тяжелых щелочноземельных металлов , для хранения не требуется бескислородная среда, поскольку магний защищен тонким слоем оксида, который довольно непроницаем и его трудно удалить. [20]
Прямая реакция магния с воздухом или кислородом при атмосферном давлении образует только «нормальный» оксид MgO. Однако этот оксид можно объединить с пероксидом водорода с образованием пероксида магния MgO 2 , а при низкой температуре пероксид может дополнительно вступить в реакцию с озоном с образованием супероксида магния Mg(O 2 ) 2 . [21]
Магний реагирует с водой при комнатной температуре, хотя он реагирует гораздо медленнее, чем кальций, аналогичный металл 2-й группы. [20] При погружении в воду водорода на поверхности металла медленно образуются пузырьки ; эта реакция происходит гораздо быстрее с порошкообразным магнием. [20] Реакция также протекает быстрее при более высоких температурах (см. § Меры предосторожности ). Обратимую реакцию магния с водой можно использовать для хранения энергии и запуска двигателя на основе магния . Магний также экзотермически реагирует с большинством кислот, таких как соляная кислота (HCl), с образованием хлорида магния и газообразного водорода, аналогично реакции HCl с алюминием, цинком и многими другими металлами. [22] Хотя его трудно воспламенить в массе или в объеме, металлический магний воспламенится.
Магний также можно использовать в качестве воспламенителя для термита — смеси порошка оксидов алюминия и железа, которая воспламеняется только при очень высокой температуре.
Органическая химия
Магнийорганические соединения широко распространены в органической химии . Они обычно встречаются в виде реагентов Гриньяра , образующихся в результате реакции магния с галогеналканами . Примерами реактивов Гриньяра являются фенилмагнийбромид и этилмагнийбромид . Реактивы Гриньяра действуют как обычный нуклеофил , атакуя электрофильную группу, такую как атом углерода, который присутствует в полярной связи карбонильной группы.
Известным магнийорганическим реагентом, помимо реактивов Гриньяра, является антрацен магния , который используется в качестве источника высокоактивного магния. Родственный аддукт бутадиен -магний служит источником бутадиен-дианиона.
Обнаружены комплексы димагния(I). [23]
Обнаружение в растворе
Присутствие ионов магния можно обнаружить путем добавления хлорида аммония , гидроксида аммония и мононатрийфосфата к водному или разбавленному раствору HCl соли. Образование белого осадка указывает на присутствие ионов магния.
Можно также использовать азофиолетовый краситель, который в присутствии щелочного раствора магниевой соли становится темно-синим. Цвет обусловлен адсорбцией азофиолетового магнием (OH) 2 .
Формы
Сплавы

По состоянию на 2013 год потребление магниевых сплавов составляло менее одного миллиона тонн в год по сравнению с 50 миллионами тонн алюминиевых сплавов . Их использование исторически было ограничено склонностью магниевых сплавов к коррозии. [24] расползаются при высоких температурах и горят. [25]
Коррозия
В магниевых сплавах присутствие железа , никеля , меди или кобальта сильно активирует коррозию . В более чем следовых количествах эти металлы осаждаются в виде интерметаллических соединений , а места осадка действуют как активные катодные центры, которые восстанавливают воду, вызывая потерю магния. [25] Контроль количества этих металлов улучшает коррозионную стойкость. Достаточное количество марганца преодолевает коррозионное воздействие железа. Это требует точного контроля над составом, что увеличивает затраты. [25] Добавление катодного яда захватывает атомарный водород внутри структуры металла. Это предотвращает образование свободного газообразного водорода, важного фактора коррозионных химических процессов. Добавление примерно одной из трехсот частей мышьяка снижает скорость коррозии магния в солевом растворе почти в десять раз. [25] [26]
Ползучесть и воспламеняемость при высоких температурах
Склонность магния к ползучести (постепенной деформации) при высоких температурах значительно снижается за счет легирования цинком и редкоземельными элементами . [27] Горючесть значительно снижается из-за небольшого количества кальция в сплаве. [25] Используя редкоземельные элементы, можно будет производить магниевые сплавы, которые способны не загораться при более высоких температурах по сравнению с ликвидусом магния , а в некоторых случаях потенциально приближать его к температуре кипения магния. [28]
Соединения
Магний образует множество соединений, важных для промышленности и биологии, включая карбонат магния , хлорид магния , цитрат магния , гидроксид магния (магниевое молоко), оксид магния , сульфат магния и гептагидрат сульфата магния ( соли Эпсома ). [29] [30]
Совсем недавно, в 2020 году, гидрид магния исследовался как способ хранения водорода. [31] [32]
изотопы
Магний имеет три стабильных изотопа : 24
Мг , 25
мг и 26
Мг . Все они присутствуют в значительных количествах в природе (см. таблицу изотопов выше). Около 79% Mg составляет 24
Мг . Изотоп 28
Магний радиоактивен и в 1950-1970-х годах производился на нескольких атомных электростанциях для использования в научных экспериментах. Этот изотоп имеет относительно короткий период полураспада (21 час), и его использование было ограничено временем доставки.
Нуклид 26
Магний нашел применение в изотопной геологии , подобно алюминию. 26
Mg – радиогенный дочерний продукт 26
Al , период полураспада которого составляет 717 000 лет. Чрезмерное количество стабильных 26
Магний наблюдался во включениях, богатых Ca-Al, в некоторых углеродистых хондритовых метеоритах . Такое аномальное изобилие объясняется распадом его родительского объекта. 26
Al во включениях, и исследователи приходят к выводу, что такие метеориты образовались в солнечной туманности еще до 26
Ал разложился. Это одни из старейших объектов Солнечной системы , содержащие сохранившуюся информацию о ее ранней истории.
Традиционно строить график 26
мг / 24
Mg против соотношения Al/Mg. На графике изохронного датирования соотношение Al/Mg равно: 27
Ал / 24
Мг . Наклон изохроны не имеет возрастного значения, но указывает на начальную 26
Ал / 27
Соотношение Al в пробе на момент отделения систем от общего резервуара.
Производство

возникновение
Магний является восьмым по распространенности элементом в земной коре по массе и занимает седьмое место с железом по молярности . [13] Он встречается в крупных месторождениях магнезита , доломита и других минералов , а также в минеральных водах, где ион магния растворим. [33]
Хотя магний содержится более чем в 60 минералах , только доломит , магнезит , брусит , карналлит , тальк и оливин . коммерческое значение имеют [34]
мг 2+
Катион является вторым по содержанию катионом в морской воде (около 1/8 Mg . массы ионов натрия в данном образце), что делает морскую воду и морскую соль привлекательными коммерческими источниками Для извлечения магния гидроксид кальция добавляют в морскую воду для осаждения гидроксида магния . [35]
- MgCl
2 + Са(ОН)
2 → Mg(OH)
2 + CaCl
2
Гидроксид магния ( брусит ) плохо растворяется в воде и его можно собрать фильтрованием. Реагирует с соляной кислотой с образованием хлорида магния . [36]
- Мг(ОН)
2 + 2 HCl → MgCl
2 + 2 ч
22О
Из хлорида магния электролизом получают магний. [37]
Объемы производства
Мировое производство в 2017 году составило около 1100 тыс. тонн, при этом основная масса производилась в Китае (930 тыс. тонн) и России (60 тыс. тонн). [38] Соединенные Штаты были в 20-м веке основным мировым поставщиком этого металла, обеспечивая 45% мирового производства даже совсем недавно, в 1995 году. С тех пор, как китайцы освоили процесс Пиджон, доля рынка США составляет 7%, при этом единственный американский производитель слева по состоянию на 2013 год: US Magnesium, компания Renco Group, расположенная на берегу Большого Соленого озера . [39]
В сентябре 2021 года Китай предпринял шаги по сокращению производства магния в результате правительственной инициативы по снижению доступности энергии для обрабатывающих отраслей, что привело к значительному росту цен. [40]
Процессы Пиджена и Больцано

Процесс Пиджена и процесс Больцано схожи. В обоих случаях оксид магния является предшественником металлического магния. Оксид магния получают в виде твердого раствора с оксидом кальция путем прокаливания минерала доломита , который представляет собой твердый раствор карбонатов кальция и магния:
- CaCO 3 ·MgCO 3 → MgO·CaO + 2 CO 2
Снижение происходит при высоких температурах с кремнием. Вместо чистого кремния используется сплав ферросилиция, поскольку он дешевле. Железный компонент безвреден. Реакцию можно представить следующим упрощенным уравнением: [41]
- MgO·CaO +Si → 2 Mg + Ca 2 SiO 4
Оксид кальция соединяется с кремнием в качестве поглотителя кислорода, образуя очень стабильный силикат кальция. Соотношение Mg/Ca в предшественниках можно регулировать добавлением MgO или CaO. [42]
Процесс Пиджена и Больцано различаются деталями нагрева и конфигурацией реактора. Оба генерируют газообразный Mg, который конденсируется и собирается. Процесс Пиджена доминирует в мировом производстве. [43] [44] Метод Пиджена менее технологически сложен, и благодаря условиям перегонки/осаждения из паровой фазы легко получить продукт высокой чистоты. [43] Китай почти полностью зависит от силикотермического процесса Пиджена .
Процесс Доу
Помимо процесса Голубя, вторым наиболее часто используемым процессом производства магния является электролиз . Это двухэтапный процесс. Первым шагом является подготовка сырья, содержащего хлорид магния, а вторым этапом является диссоциация соединения в электролитических ячейках в виде металлического магния и газообразного хлора . [44] Основная реакция следующая:
- MgCl 2 → Mg(г) + Cl 2 (г)
Температура, при которой протекает эта реакция, составляет от 680 до 750 °C. [44]
Хлорид магния можно получить с помощью процесса Доу — процесса, при котором морская вода и доломит смешиваются во флокуляторе, или путем дегидратации рассолов хлорида магния. Электролитические ячейки частично погружены в расплавленный солевой электролит, к которому добавляют полученный хлорид магния в концентрации 6-18%. [44] У этого процесса есть свои недостатки, включая образование вредного газообразного хлора и очень энергоемкую реакцию, что создает экологические риски. [45] Процесс Пиджена более выгоден по сравнению с методом электролиза с точки зрения его простоты, более короткого периода строительства, низкого энергопотребления и общего хорошего качества магния. [20]
В Соединенных Штатах магний когда-то получали в основном с помощью процесса Доу в Корпус-Кристи, штат Техас , путем электролиза плавленого хлорида магния из рассола и морской воды . Солевой раствор, содержащий Mg 2+
ионы сначала обрабатывают известью выпавший гидроксид магния (оксидом кальция) и собирают :
- мг 2+
(водн.) + CaO (тв) + H
2 О (л) → Са 2+
(водн.) + Mg(OH)
2 (с)
Затем гидроксид превращают в хлорид магния путем обработки соляной кислотой и нагревания продукта для удаления воды:
- Mg(OH) 2 + 2 HCl → MgCl 2 + 2 H 2 O
Затем соль подвергают электролизу в расплавленном состоянии. На катоде Mg 2+
ион восстанавливается двумя электронами до металлического магния:
- мг 2+
+ 2
и −
→ Мг
На аноде каждая пара Cl −
ионы окисляются до газообразного хлора , высвобождая два электрона, замыкая цепь:
- 2 кл. −
→ Кл
2 (г) + 2
и −
Карботермический процесс
Карботермический . путь получения магния признан низкоэнергетическим, но высокопроизводительным способом извлечения магния Химия следующая:
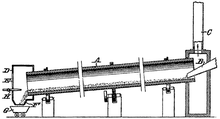
C + MgO → CO + Mg
Недостатком этого метода является то, что медленное охлаждение пара может привести к быстрому возобновлению реакции. Чтобы этого не произошло, магний можно растворить непосредственно в подходящем растворителе металлов до того, как начнется реверсия. Для предотвращения реверсии также можно выполнить быстрое гашение пара. [46]
Процесс YSZ
Более новый процесс, твердооксидная мембранная технология, включает электролитическое восстановление MgO. На катоде Mg 2+
ион восстанавливается двумя электронами до металлического магния. Электролит представляет собой стабилизированный иттрием диоксид циркония (YSZ). Анод представляет собой жидкий металл. На аноде YSZ/жидкий металл O 2−
окисляется. Слой графита граничит с жидкометаллическим анодом, и на этой границе раздела углерод и кислород реагируют с образованием монооксида углерода. Когда серебро используется в качестве жидкометаллического анода, нет необходимости в углероде-восстановителе или водороде, и на аноде выделяется только газообразный кислород. [47] В 2011 году сообщалось, что этот метод обеспечивает снижение стоимости за фунт на 40% по сравнению с методом электролитического восстановления. [48]
История
Название «магний» происходит от греческого слова, обозначающего места, связанные с племенем магнетов , либо район в Фессалии под названием Магнезия. [49] или Magnesia ad Sipylum , сейчас в Турции. [50] Он родственен магнетиту и марганцу , которые также произошли из этой области и требовали дифференциации как отдельные вещества. См. марганец для этой истории.
В 1618 году фермер из Эпсома в Англии попытался напоить своих коров водой из местного колодца. Коровы отказывались пить воду из-за горького вкуса, но фермер заметил, что вода как будто залечивает царапины и сыпь. Вещество, полученное путем выпаривания воды, стало известно как соль Эпсома , и его слава распространилась. [51] В конечном итоге его признали гидратированным сульфатом магния MgSO.
4 ·7 ч
2О . [52]
Сам металл был впервые выделен сэром Хамфри Дэви в Англии в 1808 году. Он использовал электролиз смеси магнезии и оксида ртути . [53] Антуан Бюсси подготовил его в связной форме в 1831 году. Первое название, предложенное Дэви, было «магний». [53] но название магний сейчас используется в большинстве европейских языков. [54]
Использование
Металлический магний

Магний является третьим наиболее часто используемым конструкционным металлом после железа и алюминия. [55] Основные области применения магния по порядку: алюминиевые сплавы, литье под давлением (сплав цинка ), [56] удаление серы при производстве чугуна и стали и производстве титана по процессу Кролла . [57]
Магний используется в легких материалах и сплавах. Например, при введении наночастиц карбида кремния он обладает чрезвычайно высокой удельной прочностью. [58]
Исторически магний был одним из основных металлов аэрокосмической конструкции и использовался для немецких военных самолетов еще в Первой мировой войне и широко для немецких самолетов во Второй мировой войне. Немцы придумали название « Электрон » для магниевого сплава, этот термин используется до сих пор. В коммерческой аэрокосмической промышленности магний обычно использовался только в компонентах двигателей из-за опасности возгорания и коррозии. В 21 веке использование магниевых сплавов в аэрокосмической отрасли растет, что обусловлено важностью экономии топлива. [59] Сплавы магния могут заменить алюминиевые и стальные сплавы в конструкционных целях. [60] [61]
Рике и др. разработали «общий подход к приготовлению высокореактивных металлических порошков путем восстановления солей металлов в эфирных или углеводородных растворителях с использованием щелочных металлов в качестве восстановителей», известный нам как процесс Рике . [62] В 1974 году он рассказал о Рике-магнии . [63] Рике продолжил это в 1989 году, идентифицировав металлы Рике . [64]
Самолет
- Компания Wright Aeronautical использовала магниевый картер времен Второй мировой войны в авиационном двигателе Wright R-3350 Duplex Cyclone . Это представляло серьезную проблему для самых ранних моделей тяжелого бомбардировщика Boeing B-29 Superfortress, когда в результате возгорания двигателя в полете возгорался картер двигателя. В результате возгорание имело температуру 5600 ° F (3100 ° C) и могло оторвать лонжерон крыла от фюзеляжа . [65] [66] [67]
Автомобильная промышленность

- Mercedes-Benz использовал сплав Elektron в кузове ранней модели Mercedes-Benz 300 SLR ; эти автомобили участвовали в чемпионате мира по спортивным автомобилям 1955 года, включая победу на Милле Милья и в Ле-Мане , где один из них участвовал в катастрофе в Ле-Мане 1955 года , когда зрителей осыпали горящими фрагментами электрона. [68]
- Porsche использовала рамы из магниевого сплава в модели 917/053 , выигравшей Ле-Ман в 1971 году, и продолжает использовать магниевые сплавы для блоков цилиндров из-за преимущества в весе. [69]
- Volkswagen Group уже много лет использует магний в компонентах своих двигателей. [70]
- Mitsubishi Motors использует магний для своих подрулевых переключателей . [71]
- компания BMW использовала блоки из магниевого сплава В своем двигателе N52 , в том числе вставки из алюминиевого сплава для стенок цилиндров и рубашек охлаждения, окруженные жаростойким магниевым сплавом AJ62A . Двигатель использовался по всему миру в период с 2005 по 2011 год в различных моделях серий 1, 3, 5, 6 и 7; а также Z4, X1, X3 и X5. [72]
- Chevrolet использовал магниевый сплав AE44 в Corvette Z06 2006 года . [73]
И AJ62A, и AE44 являются недавними разработками в области жаропрочных с низкой ползучестью магниевых сплавов . Общая стратегия для таких сплавов заключается в образовании интерметаллических выделений на границах зерен , например, путем добавления мишметалла или кальция . [74]
Электроника
Из-за низкой плотности и хороших механических и электрических свойств магний используется для производства мобильных телефонов, ноутбуков и планшетных компьютеров , фотоаппаратов и других электронных компонентов. [75] В некоторых ноутбуках 2020 года она использовалась как премиум-функция из-за ее легкого веса. [76]

Другой
Магний, будучи легкодоступным и относительно нетоксичным, имеет множество применений:
Источник света
При горении на воздухе магний излучает яркий белый свет, включающий сильные ультрафиолетовые волны. Порошок магния ( вспышка ) использовался для освещения объектов на заре фотографии . [77] [78] Позже магниевая нить стала использоваться в одноразовых фотовспышках с электрическим зажиганием . Порошок магния используется в фейерверках и морских ракетах , где требуется яркий белый свет. Его также использовали для различных театральных эффектов, [79] например, молния, [80] пистолетные вспышки, [81] и сверхъестественные явления. [82]
Магний легковоспламеняющийся, горит при температуре примерно 3100 ° C (3370 K; 5610 ° F). [83] а температура самовоспламенения магниевой ленты составляет примерно 473 ° C (746 K; 883 ° F). [84] Высокая температура горения магния делает его полезным инструментом для разжигания аварийных пожаров. Другие области применения включают фотографию со вспышкой , сигнальные ракеты, пиротехнику , бенгальские огни для фейерверков и трюковые свечи на день рождения. Магний также часто используется для зажигания термита или других материалов, требующих высокой температуры воспламенения. Магний продолжает использоваться в качестве зажигательного элемента в войне. [85]

.
Температура пламени магния и магниевых сплавов может достигать 3100 °C (5610 °F). [83] хотя высота пламени над горящим металлом обычно составляет менее 300 мм (12 дюймов). [86] После возгорания такие пожары трудно потушить, поскольку они устойчивы к нескольким веществам, обычно используемым для тушения пожаров; горение продолжается в азоте (образуя нитрид магния ), в углекислом газе (образуя оксид магния и углерод ) и в воде (образуя оксид магния и водород, который также сгорает за счет тепла в присутствии дополнительного кислорода). Это свойство использовалось в зажигательном оружии во время бомбардировок городов во время Второй мировой войны , когда единственной практической гражданской защитой было заглушить горящую факелку сухим песком, чтобы исключить возгорание в атмосфере.
Химический реагент
В виде стружек или лент для приготовления реактивов Гриньяра , полезных в органическом синтезе . [87]
Другой
- В качестве добавки в обычное топливо и при производстве шаровидного графита в чугуне . [88]
- В качестве восстановителя для отделения урана и других металлов от их солей . [89]
- В качестве жертвенного (гальванического) анода для защиты лодок, подземных резервуаров, трубопроводов, подземных сооружений и водонагревателей. [90]
- Сплавлен цинком для производства цинкового листа, используемого в фотогравировальных пластинах в полиграфической промышленности, стенках аккумуляторов сухих элементов и кровле . [56]
- Сплавлен алюминием, причем алюминиево-магниевые сплавы используются в основном для изготовления банок для напитков . [91] спортивное оборудование, такое как клюшки для гольфа, [92] рыболовные катушки, [93] и стрельба из лука и стрел. [94]
- Многие производители автомобилей и самолетов изготавливают детали двигателей и кузовов из магния. [95]
- Магниевые батареи коммерциализируются как первичные батареи и являются активной темой исследований в области перезаряжаемых батарей . [96]
Соединения
Соединения магния, прежде всего оксид магния (MgO), применяют в качестве огнеупорного материала в футеровке печей при производстве железа , стали , цветных металлов , стекла , цемента . Оксид магния и другие соединения магния также используются в сельскохозяйственной, химической и строительной промышленности. Оксид магния, образующийся при прокаливании, используется в качестве электрического изолятора в огнестойких кабелях . [97]
Магний реагирует с галогеналканами с образованием реактивов Гриньяра , которые используются для широкого спектра органических реакций с образованием углерод-углеродных связей . [98]
Соли магния входят в состав различных продуктов питания . [99] удобрения [100] (магний входит в состав хлорофилла [101] ) и среды для культивирования микробов . [102]
Сульфит магния используется при производстве бумаги ( сульфитный процесс ). [103]
Фосфат магния используется для огнезащиты древесины, используемой в строительстве. [104]
Гексафторосиликат магния используется для защиты тканей от моли . [105]
Биологические роли
Механизм действия
Важное взаимодействие между ионами фосфата и магния делает магний необходимым для основного химического состава нуклеиновых кислот всех клеток всех известных живых организмов. Более 300 ферментов нуждаются в ионах магния для своего каталитического действия, включая все ферменты, использующие или синтезирующие АТФ , а также те, которые используют другие нуклеотиды для синтеза ДНК и РНК . Молекула АТФ обычно находится в хелате с ионом магния. [106]
Питание
Диета

Специи, орехи, крупы , какао и овощи являются хорошими источниками магния. [15] Зеленые листовые овощи, такие как шпинат, также богаты магнием. [107]
Диетические рекомендации
В Великобритании рекомендуемая суточная норма магния составляет 300 мг для мужчин и 270 мг для женщин. [108] В США рекомендуемая диетическая норма (RDA) составляет 400 мг для мужчин в возрасте 19–30 лет и 420 мг для пожилых людей; для женщин 310 мг в возрасте 19–30 лет и 320 мг для пожилых людей. [109]
Дополнение
многочисленные фармацевтические препараты магния и пищевые добавки Доступны . В двух исследованиях на людях оксид магния, одна из наиболее распространенных форм в пищевых добавках магния из-за высокого содержания магния на вес, был менее биодоступен, чем цитрат , хлорид, лактат или аспартат магния. [110] [111]
Метаболизм
В организме взрослого человека содержится 22–26 граммов магния. [15] [112] 60% в скелете , 39% внутриклеточных (20% в скелетных мышцах) и 1% внеклеточных. [15] Уровни в сыворотке обычно составляют 0,7–1,0 ммоль/л или 1,8–2,4 мг-экв /л. Уровни магния в сыворотке могут быть нормальными даже при дефиците внутриклеточного магния. Механизмы поддержания уровня магния в сыворотке крови включают различную желудочно-кишечную абсорбцию и почечную экскрецию. Внутриклеточный магний коррелирует с внутриклеточным калием . Повышенное содержание магния снижает содержание кальция [113] и может либо предотвратить гиперкальциемию, либо вызвать гипокальциемию в зависимости от исходного уровня. [113] Условия как с низким, так и с высоким потреблением белка ингибируют всасывание магния, равно как и количество фосфатов , фитатов и жиров в кишечнике. Неабсорбированный пищевой магний выводится с калом; поглощенный магний выводится с мочой и потом. [114]
Обнаружение в сыворотке и плазме
Статус магния можно оценить путем измерения концентрации магния в сыворотке и эритроцитах в сочетании с содержанием магния в моче и фекалиях , но внутривенные нагрузочные тесты магнием более точны и практичны. [115] Удержание 20% и более от введенного количества указывает на дефицит. [116] По состоянию на 2004 год биомаркера магния не установлено. [117]
Концентрацию магния в плазме или сыворотке можно контролировать на предмет эффективности и безопасности у лиц, получающих препарат терапевтически , для подтверждения диагноза у потенциальных жертв отравления или для оказания помощи в судебно-медицинском расследовании в случае смертельной передозировки. У новорожденных детей, матери которых получали парентерально сульфат магния во время родов, может наблюдаться токсичность при нормальных уровнях магния в сыворотке. [118]
Дефицит
Низкий уровень магния в плазме ( гипомагниемия ) встречается часто: он обнаруживается у 2,5–15% населения в целом. [119] С 2005 по 2006 год 48 процентов населения США потребляли меньше магния, чем рекомендовано в рекомендуемой диетической норме . [120] Другими причинами являются повышенная почечная или желудочно-кишечная потеря, повышенный внутриклеточный сдвиг и антацидная терапия ингибиторами протонной помпы. Большинство из них протекает бессимптомно, но могут возникать симптомы, относящиеся к нервно-мышечной , сердечно-сосудистой и метаболической дисфункции. [119] Алкоголизм часто связан с дефицитом магния. Хронически низкие уровни магния в сыворотке связаны с метаболическим синдромом , сахарным диабетом 2 типа , фасцикуляцией и гипертонией. [121]
Терапия
- Внутривенное введение магния рекомендовано в Руководстве ACC/AHA/ESC 2006 года по ведению пациентов с желудочковыми аритмиями и предотвращению внезапной сердечной смерти у пациентов с желудочковой аритмией , связанной с трепетанием типа «пируэт» , у которых наблюдается синдром удлиненного интервала QT ; и для лечения пациентов с аритмиями, вызванными дигоксином. [122]
- Внутривенный сульфат магния используется для лечения преэклампсии и эклампсии . [123] [124]
- Гипомагниемия, в том числе вызванная алкоголизмом, обратима при пероральном или парентеральном введении магния в зависимости от степени дефицита. [125]
- Имеются ограниченные доказательства того, что добавки магния могут играть роль в профилактике и лечении мигрени . [126]
Другие терапевтические применения, отсортированные по типу соли магния, включают:
- Сульфат магния , в виде гептагидрата называемого английской солью, используется в качестве соли для ванн , слабительного средства и хорошо растворимого удобрения . [127]
- Гидроксид магния , суспендированный в воде, используется в магния молоке в качестве антацидов и слабительных средств .
- Хлорид магния , оксид , глюконат , малат , оротат , глицинат , аскорбат и цитрат используются в качестве пероральных добавок магния.
- борат магния , салицилат магния , сульфат магния применяют В качестве антисептиков .
- Бромид магния применяют как легкое седативное средство (это действие обусловлено бромидом , а не магнием).
- Стеарат магния представляет собой легковоспламеняющийся белый порошок со смазывающими свойствами . В фармацевтической технологии он используется в фармакологическом производстве для предотвращения прилипания таблеток к оборудованию при прессовании ингредиентов в форму таблеток.
- Порошок карбоната магния используется такими спортсменами, как гимнасты , тяжелоатлеты и альпинисты, для устранения пота ладоней, предотвращения прилипания и улучшения сцепления с гимнастическими снарядами, штангами и скалами.
Передозировка
Передозировка только из пищевых источников маловероятна, поскольку избыток магния в крови быстро фильтруется почками . [119] Передозировка более вероятна при наличии нарушения функции почек. Несмотря на это, мегадозная терапия привела к смерти маленького ребенка. [128] и тяжелая гипермагниемия у женщины [129] и молодая девушка [130] у кого были здоровые почки.Наиболее распространенными симптомами передозировки являются тошнота , рвота и диарея ; другие симптомы включают гипотонию , спутанность сознания, замедление сердечного ритма и дыхания , дефицит других минералов, кому , сердечную аритмию и смерть от остановки сердца . [113]
Функция у растений
Растениям требуется магний для синтеза хлорофилла , необходимого для фотосинтеза . [131] Магний в центре порфиринового кольца хлорофилла действует аналогично железу в центре порфиринового кольца гема . Дефицит магния у растений вызывает пожелтение в конце сезона между жилками листьев. [132] особенно на старых листьях, и это можно исправить, внося английскую соль (которая быстро выщелачивается ) или измельченный доломитовый известняк в почву .
Меры предосторожности
| Опасности | |
|---|---|
| СГС Маркировка : | |
 | |
| Опасность | |
| Х228 , Х251 , Х261 | |
| П210 , П231 , П235 , П410 , П422 [133] | |
| NFPA 704 (огненный алмаз) | |
Металлический магний и его сплавы могут быть взрывоопасными; они легко воспламеняются в чистом виде в расплавленном виде, а также в виде порошка или ленты. Горящий или расплавленный магний бурно реагирует с водой. При работе с порошкообразным магнием защитные очки с защитой глаз используются и УФ-фильтрами (например, у сварщиков), поскольку при горении магния образуется ультрафиолет , который может необратимо повредить сетчатку человеческого глаза. [135]
Магний способен восстанавливать воду и выделять легковоспламеняющийся газообразный водород : [136]
- Mg(s) + 2 H
2 О (л) → Mg(OH)
2 (с) + Ч
2 (г)
Следовательно, вода не может потушить пожары магния. Выделяющийся водород усиливает пожар. Сухой песок является эффективным удушающим средством, но только на относительно ровных и плоских поверхностях.
Магний экзотермически реагирует с углекислым газом с образованием оксида магния и углерода : [137]
- 2 Mg(s) + CO
2 (г) → 2 MgO(тв) + C(тв)
Следовательно, углекислый газ подпитывает, а не тушит магниевые пожары.
Горящий магний можно потушить, используя сухой химический огнетушитель класса D или засыпав огонь песком или магниевым литейным флюсом, чтобы удалить источник воздуха. [138]
См. также
Примечания
- ^ Тепловое расширение анизотропно : параметры (при 20 ° C) для каждой оси кристалла составляют α a = 25,31 × 10. −6 /К, α с = 27,03 × 10 −6 /K, а α среднее = α V /3 = 25,91 × 10. −6 /К. [3]
Ссылки
- ^ «Стандартные атомные массы: магний» . ЦИАВ . 2011.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: а б с д Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Рамбл, с. 4,61
- ^ Mg(0) был синтезирован в соединении, содержащем Na 2 Mg 2 2+ кластер, координированный с объемистым органическим лигандом; видеть Рёш, Б.; Гентнер, Техас; Эйселейн, Дж.; Лангер, Дж.; Элсен, Х.; Ли, В.; Хардер, С. (2021). «Сильно восстанавливающие комплексы магния (0)». Природа . 592 (7856): 717–721. Бибкод : 2021Natur.592..717R . дои : 10.1038/s41586-021-03401-w . ПМИД 33911274 . S2CID 233447380
- ^ Бернат, ПФ; Блэк, Дж. Х. и Браулт, Дж. В. (1985). «Спектр гидрида магния» (PDF) . Астрофизический журнал . 298 : 375. Бибкод : 1985ApJ...298..375B . дои : 10.1086/163620 . . См. также Соединения низковалентного магния .
- ^ Рамбл, с. 12.137
- ^ Рамбл, с. 12.28
- ^ Рамбл, с. 4,70
- ^ Гшнайдер, К.А. (1964). Физические свойства и взаимоотношения металлических и полуметаллических элементов . Физика твердого тела. Том. 16. с. 308. дои : 10.1016/S0081-1947(08)60518-4 . ISBN 9780126077162 .
- ^ Jump up to: а б с Рамбл, с. 4.19
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Jump up to: а б Рейлсбэк, Л. Брюс. «Распространение и форма наиболее распространенных элементов в континентальной коре Земли» (PDF) . Некоторые основы минералогии и геохимии . Архивировано из оригинала (PDF) 27 сентября 2011 года . Проверено 15 февраля 2008 г.
- ^ Антони, Джей Флор (2006). «Химический состав морской воды» . seafriends.org.nz .
- ^ Jump up to: а б с д и «Информационный бюллетень о пищевых добавках: магний» . Управление пищевых добавок, Национальные институты здравоохранения США. 11 февраля 2016 года . Проверено 13 октября 2016 г.
- ^ «Щелочноземельный металл – Физическое и химическое поведение | Британника» . Британская энциклопедия . Проверено 27 марта 2022 г.
- ^ Сандлёбес, С.; Фриак, М.; Корте-Керзель, С.; Пей, З.; Нойгебауэр, Дж.; Раабе, Д. (2017). «Магниевый сплав, не содержащий редкоземельных элементов, с улучшенной собственной пластичностью» . Научные отчеты . 7 (1): 10458. Бибкод : 2017НатСР...710458С . дои : 10.1038/s41598-017-10384-0 . ПМЦ 5585333 . ПМИД 28874798 .
- ^ Цзэн, Чжуоран; Не, Цзянь-Фэн; Сюй, Ши-Вэй; hj Дэвис, Крис; Бирбилис, Ник (2017). «Сверхформуемый чистый магний при комнатной температуре» . Природные коммуникации . 8 (1): 972. Бибкод : 2017NatCo...8..972Z . дои : 10.1038/s41467-017-01330-9 . ПМЦ 5715137 . ПМИД 29042555 .
- ^ «Реакции элементов 2 группы с водой» . Химия LibreTexts . 3 октября 2013 года . Проверено 27 марта 2022 г.
- ^ Jump up to: а б с д ММТА. «Магний» . ММТА . Проверено 8 ноября 2023 г.
- ^ Вольнов, И.И.; Токарева С.А.; Белевский В.Н.; Латышева Е.И. (март 1970 г.). «Образование пероксида магния Mg(O2)2 при реакции пероксида магния с озоном». Вестник Отделения химических наук АН СССР . 19 (3): 468–471. дои : 10.1007/bf00848959 .
- ^ «Скорость реакции магния с соляной кислотой» . РСК Образование . Проверено 8 ноября 2023 г.
- ^ Рёш, Б.; Гентнер, Техас; Эйселейн, Дж.; Лангер, Дж.; Элсен, Х.; Хардер, С. (29 апреля 2021 г.). «Сильно восстанавливающие комплексы магния (0)». Природа . 592 (7856): 717–721. Бибкод : 2021Natur.592..717R . дои : 10.1038/s41586-021-03401-w . ПМИД 33911274 . S2CID 233447380 .
- ^ Макар, Г.Л.; Крюгер, Дж. (1993). «Коррозия магния». Международные обзоры материалов . 38 (3): 138–153. Бибкод : 1993ИМРв...38..138М . дои : 10.1179/imr.1993.38.3.138 .
- ^ Jump up to: а б с д и Додсон, Брайан (29 августа 2013 г.). «Прорыв в области производства магния из нержавеющей стали является хорошим предзнаменованием для обрабатывающей промышленности» . Gizmag.com . Проверено 29 августа 2013 г.
- ^ Бирбилис, Н.; Уильямс, Г.; Гусиева, К.; Саманьего, А.; Гибсон, Массачусетс; МакМюррей, Х.Н. (2013). «Отравление коррозией магния». Электрохимические коммуникации . 34 : 295–298. дои : 10.1016/j.elecom.2013.07.021 .
- ^ Чоудхури, Дип; Шринивасан, Шривиллипутур Г.; Гибсон, Марк А.; Чжэн, Юфэн; Джагер, Дэвид Л.; Фрейзер, Хэмиш Л.; Банерджи, Раджарши (8 декабря 2017 г.). «Исключительное увеличение срока службы магниевых редкоземельных сплавов благодаря локализованному ужесточению связей» . Природные коммуникации . 8 (1): 2000. Бибкод : 2017NatCo...8.2000C . дои : 10.1038/s41467-017-02112-z . ПМЦ 5722870 . ПМИД 29222427 .
- ^ Червинский, Франк (сентябрь 2014 г.). «Контроль воспламенения и воспламеняемости магния для аэрокосмического применения». Коррозионная наука . 86 : 1–16. Бибкод : 2014Corro..86....1C . дои : 10.1016/j.corsci.2014.04.047 .
- ^ «8 видов магния и их польза» . www.medicalnewstoday.com . 23 марта 2021 г. Проверено 4 мая 2024 г.
- ^ «Химия магния (Z=12)» . Химия LibreTexts . 2 октября 2013 года . Проверено 4 мая 2024 г.
- ^ Рен, Чай; Фанг, З. Зак; Чжоу, Чэншан; Лу, Джун; Рен, Ян; Чжан, Сяои (25 сентября 2014 г.). «Свойства хранения водорода гидрида магния с добавками на основе V». Журнал физической химии C. 118 (38): 21778–21784. дои : 10.1021/jp504766b .
- ^ Баран, Агата; Полански, Марек (9 сентября 2020 г.). «Материалы на основе магния для хранения водорода — обзор возможностей» . Материалы . 13 (18): 3993. Бибкод : 2020Mate...13.3993B . дои : 10.3390/ma13183993 . ПМЦ 7559164 . ПМИД 32916910 .
- ^ «Магниевый сплав ЭА65РС-Т4» . АЗом . 30 апреля 2013 года . Проверено 4 мая 2024 г.
- ^ «Статистика и информация по магнию | Геологическая служба США» . www.usgs.gov . Проверено 4 мая 2024 г.
- ^ Батталья, Джузеппе; Домина, Мария Альда; Ло Брутто, Рита; Лопес Родригес, Хулио; Фернандес де Лабастида, Марк; Кортина, Хосе Луис; Петтиньяно, Альберто; Чиполлина, Андреа; Тамбурини, Алессандро; Микале, Джорджио (21 декабря 2022 г.). «Оценка чистоты гидроксида магния, извлеченного из соляной выпи» . Вода . 15 (1): 29. дои : 10.3390/w15010029 . hdl : 2117/384847 .
- ^ «Обработка магния | Техники и методы | Британника» . www.britanica.com . Проверено 4 мая 2024 г.
- ^ «Металлический магний производится электролизом расплавленного магния… | Каналы для Pearson+» . www.pearson.com . Проверено 4 мая 2024 г.
- ^ Брэй, Э. Ли (февраль 2019 г.) Металлический магний . Обзоры минерального сырья, Геологическая служба США
- ^ Варди, Натан (6 июня 2013 г.). «Человек со многими врагами» . Форбс .
- ^ «Что делать с нехваткой магния» . Управление поставками . 17 февраля 2022 года. Архивировано из оригинала 17 февраля 2022 года.
- ^ «Обзор магния» . Китайская магниевая корпорация. Архивировано из оригинала 23 марта 2021 года . Проверено 8 мая 2013 г.
- ^ Амундсен, Кетиль; Ауне, Терье Кр.; Бакке, Пер; Эклунд, Ганс Р.; Хаагенсен, Йоханна О.; Николас, Карлос; Розенкильде, Кристиан; Ван Ден Бремт, Сиа; Валлевик, Оддмунд (2003). «Магний». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a15_559 . ISBN 978-3-527-30385-4 .
- ^ Jump up to: а б Магний и его сплавы: технология и применение . Менахем Бамбергер, Лешек А. Добжаньски, Джордж Э. Тоттен (Первое изд.). Бока-Ратон, Флорида. 2020. ISBN 978-1-351-04547-6 . OCLC 1111577710 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: другие ( ссылка ) - ^ Jump up to: а б с д «Обработка магния | Техники и методы | Британника» . www.britanica.com . Проверено 16 апреля 2023 г.
- ^ Ли, Тэ Хёк; Окабе, Тору Х.; Ли, Джин Ён; Ким, Ён Мин; Кан, Юнгшин (сентябрь 2021 г.). «Разработка нового электролитического процесса получения металлического магния высокой чистоты из оксида магния с использованием жидкого оловянного катода» . Журнал магния и сплавов . 9 (5): 1644–1655. дои : 10.1016/j.jma.2021.01.004 . S2CID 233930398 .
- ^ Брукс, Джеффри; Транг, Саймон; Витт, Питер; Хан, Миннесота; Нэгл, Майкл (май 2006 г.). «Карботермический путь к магнию» . ДЖОМ . 58 (5): 51–55. Бибкод : 2006JOM....58e..51B . дои : 10.1007/s11837-006-0024-x . ISSN 1047-4838 . S2CID 67763716 .
- ^ Пал, Удай Б.; Пауэлл, Адам С. (2007). «Использование твердооксидно-мембранной технологии в электрометаллургии». ДЖОМ . 59 (5): 44–49. Бибкод : 2007JOM....59e..44P . дои : 10.1007/s11837-007-0064-x . S2CID 97971162 .
- ^ Дерезинский, Стив (12 мая 2011 г.). «Электролиз магния с помощью твердооксидной мембраны (SOM): масштабные исследования и разработки для легких транспортных средств» (PDF) . МОхСТ. Архивировано из оригинала (PDF) 13 ноября 2013 года . Проверено 27 мая 2013 г.
- ^ «Магний: историческая справка» . webelements.com . Проверено 9 октября 2014 г.
- ^ LanguageHat (28 мая 2005 г.). «Магнит» . LanguageHat.com . Проверено 18 июня 2020 г.
- ^ Эйнсворт, Стив (1 июня 2013 г.). «Глубокая ванна Эпсома». Назначение медсестры . 11 (6): 269. doi : 10.12968/npre.2013.11.6.269 .
- ^ ПабХим. «Гептагидрат сульфата магния» . pubchem.ncbi.nlm.nih.gov . Проверено 28 апреля 2024 г.
- ^ Jump up to: а б Дэви, Х. (1808). «Электрохимические исследования по разложению земель; с наблюдениями за металлами, полученными из щелочноземельных металлов, и над амальгамой, полученной из аммиака». Философские труды Лондонского королевского общества . 98 : 333–370. Бибкод : 1808RSPT...98..333D . дои : 10.1098/rstl.1808.0023 . JSTOR 107302 . S2CID 96364168 .
- ^ «Магний (Mg) — Таблица Менделеева» . www. periodictable.one . Проверено 4 мая 2024 г.
- ^ Сигал, Дэвид (2017). Материалы XXI века . Издательство Оксфордского университета. ISBN 978-0192526090 .
- ^ Jump up to: а б Бейкер, Хью Д.Р.; Аведесян, Майкл (1999). Магний и магниевые сплавы . Materials Park, Огайо: Информационное общество материалов. п. 4. ISBN 978-0871706577 .
- ^ Кетиль Амундсен; Терье Кр. Ауне; Пер Бакке; Ганс Р. Эклунд; Йоханна О. Хаагенсен; Карлос Николас; и др. (2002). «Магний». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ. дои : 10.1002/14356007.a15_559 . ISBN 978-3527306732 .
- ^ Чин, Мэтью (23 декабря 2015 г.). «Исследователи Калифорнийского университета в Лос-Анджелесе создают сверхпрочный металлический магний» . ucla.edu.
- ^ Агион, Э.; Бронфин, Б. (2000). «Развитие магниевых сплавов на пути к 21 веку». Форум по материаловедению . 350–351: 19–30. doi : 10.4028/www.scientific.net/MSF.350-351.19 . S2CID 138429749 .
- ^ Шу, Донг Вэй; Ахмад, Ирам Раза (декабрь 2010 г.). «Магниевые сплавы: альтернатива алюминию в конструкционных целях». Передовые исследования материалов . 168–170: 1631–1635. дои : 10.4028/www.scientific.net/amr.168-170.1631 .
- ^ «Магниевый сплав как более легкая альтернатива алюминиевому сплаву» . Физика.орг . 29 ноября 2017 г.
- ^ «Магний». Химический синтез с использованием высокореактивных металлов . 2017. С. 161–208. дои : 10.1002/9781118929124.ch4 . ISBN 978-1-118-92911-7 .
- ^ Рике, Рубен Д.; Бэйлз, Стивен Э. (1974). "ХимИнформ Резюме: АКТИВИРОВАННЫЕ МЕТАЛЛЫ ЧАСТЬ 4. ПОЛУЧЕНИЕ И РЕАКЦИИ ВЫСОКОРЕАКЦИОННОГО МЕТАЛЛИЧЕСКОГО МАГНИЯ". Chemischer Informationsdienst . 5 (21). дои : 10.1002/chin.197421315 .
- ^ Рике, Рубен Д.; Селл, Мэтью С.; Кляйн, Уолтер Р.; Чен, Тянь-Ань; Браун, Джеффри Д.; Хэнсон, Марк В. (1995). «Rieke Metals: высокореактивные металлические порошки, полученные щелочным восстановлением солей металлов». Активные металлы . стр. 1–59. дои : 10.1002/9783527615179.ch01 . ISBN 978-3-527-29207-3 .
- ^ Дрейзин, Эдвард Л.; Берман, Чарльз Х.; Виченци, Эдвард П. (2000). «Модификации конденсированной фазы при горении частиц магния на воздухе». Скрипта Материалия . 122 (1–2): 30–42. Бибкод : 2000CoFl..122...30D . CiteSeerX 10.1.1.488.2456 . дои : 10.1016/S0010-2180(00)00101-2 .
- ^ Дорр, Роберт Ф. (2012). Миссия в Токио: американские летчики, которые довели войну до самого сердца Японии . Зенит Пресс. стр. 40–41. ISBN 978-1610586634 .
- ^ Журнал ААХС . Том. 44–45. Американское историческое общество авиации. 1999.
- ^ Сперджен, Брэд (11 июня 2015 г.). «В самый смертоносный день автогонок» . Нью-Йорк Таймс .
- ^ Перкинс, Крис (1 июля 2021 г.). «У Porsche 917 KH 1971 года было шасси из сверхлегковоспламеняющегося магния» . Дорога и трек . Проверено 7 мая 2023 г.
- ^ «1950: Металл — магний, машина — Жук» . гидро.com . 18 августа 2020 г. Проверено 5 апреля 2021 г.
- ^ «Mitsubishi Outlander 2007 года привносит динамику спортивного седана в сегмент компактных внедорожников; характеристики производительности включают двигатель V-6 мощностью 220 л.с., 6-ступенчатую коробку передач Sportronic(R) и алюминиевую крышу» . Отдел новостей Мицубиси . 12 апреля 2006 г. Проверено 7 мая 2023 г.
- ^ Кумар, Сачин; Ву, Чуаньсун (2017). «Обзор: Mg и его сплав — область применения, перспективы на будущее и последние достижения в области сварки и обработки». Журнал Харбинского технологического института . 24 (6): 1–37. дои : 10.11916/j.issn.1005-9113.17065 .
- ^ Арагонес, Джонатон; Гундан, Каси; Колп, Скотт; Осборн, Ричард; Уимет, Ларри; Пинч, Уильям (11 апреля 2005 г.). «Разработка поперечины из литого магния для Corvette Z06 2006 года» . Серия технических документов SAE . Том. 1. Уоррендейл, Пенсильвания. дои : 10.4271/2005-01-0340 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Луо, Алан А. и Пауэлл, Боб Р. (2001). Ползучесть при растяжении и сжатии сплавов на основе магния, алюминия и кальция (PDF) (Отчет). Лаборатория материалов и процессов, Центр исследований и разработок General Motors. Архивировано из оригинала (PDF) 28 сентября 2007 года . Проверено 21 августа 2007 г.
- ^ «Оценка механических свойств магния [AZ91], армированного углеродными нанотрубками и Sic/Al2O3» (PDF) . Начальное образование онлайн . 19 (4): 6907. 2020. Архивировано из оригинала (PDF) 7 мая 2023 года . Проверено 7 мая 2023 г.
- ^ Диньян, Ларри (2 января 2020 г.). «Ноутбуки из синего магниевого сплава: цена премиум-класса, ощущение пластика, но легкий вес» . ЗДНет.
- ^ Ханнави, Джон (2013). Энциклопедия фотографии девятнадцатого века . Рутледж. п. 84. ИСБН 978-1-135-87327-1 .
- ^ Scientific American: Приложение . Том. 48. Манн и компания. 1899. с. 20035.
- ^ Рекламный щит . Nielsen Business Media, Inc., 1974. с. 20 .
- ^ Альтман, Рик (2004). Звук немого кино . Издательство Колумбийского университета. п. 41. ИСБН 978-0-231-11663-3 .
- ^ Линдси, Дэвид (2005). Безумие в процессе становления: триумфальный взлет и безвременное падение американских изобретателей шоу . iUniverse. п. 210. ИСБН 978-0-595-34766-7 .
- ^ Маккормик, Джон; Пратасик, Бенни (2005). Популярный театр кукол в Европе, 1800-1914 гг . Издательство Кембриджского университета. п. 106. ИСБН 978-0-521-61615-7 .
- ^ Jump up to: а б Дрейзин, Эдвард Л.; Берман, Чарльз Х. и Виченци, Эдвард П. (2000). «Модификации конденсированной фазы при горении частиц магния на воздухе». Скрипта Материалия . 122 (1–2): 30–42. Бибкод : 2000CoFl..122...30D . CiteSeerX 10.1.1.488.2456 . дои : 10.1016/S0010-2180(00)00101-2 .
- ^ «Магний (Порошок)» . Международная программа по химической безопасности (IPCS) . ИПКС ИНХЕМ. Апрель 2000 года . Проверено 21 декабря 2011 г.
- ^ «Суббоеприпас 9Н510 (МЛ-5)» . Коллективная осведомленность о неразорвавшихся боеприпасах . Проверено 22 ноября 2022 г.
- ^ Справочник Министерства энергетики – Учебник по самопроизвольному нагреву и пирофорности . Министерство энергетики США . Декабрь 1994 г. с. 20. DOE-HDBK-1081-94. Архивировано из оригинала 15 апреля 2012 года . Проверено 21 декабря 2011 г.
- ^ Эшенхерст, Джеймс (14 октября 2011 г.). «Реагенты Гриньяра для присоединения к альдегидам и кетонам» . Магистр органической химии . Проверено 4 мая 2024 г.
- ^ «Периодическая таблица элементов: Национальная лаборатория Лос-Аламоса» . period.lanl.gov . Проверено 4 мая 2024 г.
- ^ Эйнскоу, Дж. Б.; Ригби, Ф (июль 1974 г.). «Магниевое восстановление оксида урана». Журнал неорганической и ядерной химии . 36 (7): 1531–1534. дои : 10.1016/0022-1902(74)80618-4 .
- ^ «Жертвенный анод» . Химия LibreTexts . 2 октября 2013 года . Проверено 4 мая 2024 г.
- ^ Мультивью (17 декабря 2019 г.). «Прочный и пластичный: магний добавляет преимуществ алюминиевым сплавам» . Белмонт Металс . Проверено 4 мая 2024 г.
- ^ «Гольф-клюшки: материальные различия» .
- ^ Пурнелл, Росс. «Как алюминий навсегда изменил нахлыстовую рыбалку» . Летучий рыбак . Проверено 4 мая 2024 г.
- ^ «Благотворный лук – факты и история современных луков» . www.historyofarchery.com . Проверено 4 мая 2024 г.
- ^ «Автомобильная промышленность – Международная ассоциация магния» . www.intlmag.org . Проверено 4 мая 2024 г.
- ^ Леонг, Ки Ва; Пан, Вендинг; Ван, Ифэй (21 июля 2022 г.). «Реверсивность высоковольтной Cl-регулируемой водной магниевой металлической батареи с использованием водно-солевого электролита» . ACS Energy Lett . 7 (8): 2657–2666. doi : 10.1021/acsenergylett.2c01255 . S2CID 250965568 . Проверено 25 июня 2023 г.
- ^ Линсли, Тревор (2011). «Свойства проводников и изоляторов». Основные электромонтажные работы . Тейлор и Фрэнсис. п. 362. ИСБН 978-0080966281 .
- ^ Уэйд-младший, LG (2012). Органическая химия (8-е изд.). Пирсон. п. 441. ИСБН 978-0321768414 .
- ^ «Информация о продуктах, богатых магнием» . Кливлендская клиника . Проверено 4 мая 2024 г.
- ^ «Магний для растениеводства» . расширение.umn.edu . Проверено 4 мая 2024 г.
- ^ Ишфак, Мухаммед; Ван, Юнци; Ян, Минвен; Ван, Чжэн; У, Лянцюань; Ли, Чуньцзян; Ли, Сюэсянь (25 апреля 2022 г.). «Физиологическая сущность магния в растениях и его широко распространенный дефицит в сельскохозяйственной системе Китая» . Границы в науке о растениях . 13 . дои : 10.3389/fpls.2022.802274 . ПМЦ 9085447 . ПМИД 35548291 .
- ^ Кристенсен, Дэвид Г.; Орр, Джеймс С.; Рао, Кристофер В.; Вулф, Алан Дж. (15 марта 2017 г.). «Повышение урожайности роста и снижение ацетилирования в Escherichia coli за счет оптимизации соотношения углерода и магния в средах на основе пептидов» . Прикладная и экологическая микробиология . 83 (6). Бибкод : 2017ApEnM..83E3034C . дои : 10.1128/АЕМ.03034-16 . ПМЦ 5335519 . ПМИД 28062462 .
- ^ «Сульфит магния – Опасные вещества | Карта опасностей» . haz-map.com . Проверено 4 мая 2024 г.
- ^ Ян, Лонг; Сюй, Чжишэн; Лю, Дингли (апрель 2019 г.). «Синтез и применение новых антипиренов на основе эфиров фосфорной кислоты магния для прозрачных вспучивающихся огнезащитных покрытий, наносимых на деревянные основания». Прогресс в области органических покрытий . 129 : 327–337. doi : 10.1016/j.porgcoat.2019.01.013 .
- ^ «NCATS Inxight Drugs — МАГНИЯ ГЕКСАФТОРОСИЛИКАТ» . Drugs.ncats.io . Проверено 4 мая 2024 г.
- ^ Романи, Андреа, член парламента (2013). «Магний в здоровье и болезни». В Астрид Сигел; Хельмут Сигель; Роланд К.О. Сигел (ред.). Взаимосвязь между ионами незаменимых металлов и заболеваниями человека . Ионы металлов в науках о жизни. Том. 13. Спрингер. стр. 49–79. дои : 10.1007/978-94-007-7500-8_3 . ISBN 978-94-007-7499-5 . ПМИД 24470089 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ «Магний в рационе» . MedlinePlus, Национальная медицинская библиотека США, Национальные институты здравоохранения. 2 февраля 2016 г. Проверено 13 октября 2016 г.
- ^ «Витамины и минералы – Прочее – Выбор Национальной службы здравоохранения» . Nhs.uk. 26 ноября 2012 года . Проверено 19 сентября 2013 г.
- ^ «6, Магний» . Рекомендуемая диетическая норма кальция, фосфора, магния, витамина D и фторида . Национальная Академия Пресс. 1997. стр. 190–249.
- ^ Фироз М; Грабер М. (2001). «Биодоступность коммерческих препаратов магния в США». Магнес Рес . 14 (4): 257–262. ПМИД 11794633 .
- ^ Линдберг Дж.С.; Зобиц М.М.; Пойндекстер-младший; Пак С.Й. (1990). «Биодоступность магния из цитрата магния и оксида магния». J Am Coll Nutr . 9 (1): 48–55. дои : 10.1080/07315724.1990.10720349 . ПМИД 2407766 .
- ^ Сарис Н.Е., Мерваала Э., Карппанен Х., Хаваджа Дж.А., Левенстам А. (апрель 2000 г.). «Магний. Обновленная информация о физиологических, клинических и аналитических аспектах». Клин Чим Акта . 294 (1–2): 1–26. дои : 10.1016/S0009-8981(99)00258-2 . ПМИД 10727669 .
- ^ Jump up to: а б с «Магний» . Умм.edu . Медицинский центр Университета Мэриленда. 7 мая 2013 года. Архивировано из оригинала 16 февраля 2017 года . Проверено 19 сентября 2013 г.
- ^ Вестер П.О. (1987). «Магний». Являюсь. Дж. Клин. Нутр . 45 (5 дополнений): 1305–1312. дои : 10.1093/ajcn/45.5.1305 . ПМИД 3578120 .
- ^ Арно МЖ (2008). «Дополнительная информация об оценке статуса магния» . Бр. Дж. Нутр . 99 (Приложение 3): S24–S36. дои : 10.1017/S000711450800682X . ПМИД 18598586 .
- ^ Роб ПМ; Дик К; Блей Н; Сейферт Т; Бринкманн С; Хёльригель В; и др. (1999). «Можно ли действительно измерить дефицит магния с помощью кратковременного нагрузочного теста магнием?» . Дж. Стажер. Мед . 246 (4): 373–378. дои : 10.1046/j.1365-2796.1999.00580.x . ПМИД 10583708 . S2CID 6734801 .
- ^ Франц КБ (2004). «Для диагностики дефицита магния необходим функциональный биологический маркер». J Am Coll Nutr . 23 (6): 738С–741С. дои : 10.1080/07315724.2004.10719418 . ПМИД 15637224 . S2CID 37427458 .
- ^ Базелт, Р. (2008). Удаление токсичных препаратов и химикатов в организме человека (8-е изд.). Биомедицинские публикации. стр. 875–877. ISBN 978-0962652370 .
- ^ Jump up to: а б с Аюк Дж.; Gittoes, Нью-Джерси (март 2014 г.). «Современный взгляд на клиническую значимость гомеостаза магния» . Анналы клинической биохимии . 51 (2): 179–188. дои : 10.1177/0004563213517628 . ПМИД 24402002 . S2CID 21441840 .
- ^ Розанофф, Андреа; Уивер, Конни М; Руд, Роберт К. (март 2012 г.). «Неоптимальный статус магния в США: недооценены ли последствия для здоровья?» (PDF) . Обзоры питания . 70 (3): 153–164. дои : 10.1111/j.1753-4887.2011.00465.x . ПМИД 22364157 .
- ^ Гейгер Х; Ваннер С. (2012). «Магний в болезнях» . Клин Кидни Дж . 5 (Приложение 1): i25–i38. doi : 10.1093/ndtplus/sfr165 . ПМЦ 4455821 . ПМИД 26069818 .
- ^ Зипес ДП; Кэмм Эй Джей; Борггрефе М; и др. (2012). «Руководство ACC/AHA/ESC 2006 г. по ведению пациентов с желудочковыми аритмиями и предотвращению внезапной сердечной смерти: отчет Рабочей группы Американского колледжа кардиологов/Американской кардиологической ассоциации и Комитета по практическим рекомендациям Европейского общества кардиологов (писательский комитет) разработать «Руководство по ведению пациентов с желудочковыми аритмиями и профилактике внезапной сердечной смерти»), разработанное в сотрудничестве с Европейской ассоциацией сердечного ритма и Обществом сердечного ритма» . Тираж . 114 (10): е385–е484. doi : 10.1161/CIRCULATIONAHA.106.178233 . ПМИД 16935995 .
- ^ Джеймс МФ (2010). «Магний в акушерстве». Лучшая практика Res Clin Obstet Gynaecol . 24 (3): 327–337. дои : 10.1016/j.bpobgyn.2009.11.004 . ПМИД 20005782 .
- ^ Эйзер, АГ; Чиполла, MJ (2009). «Сульфат магния для лечения эклампсии: краткий обзор» . Гладить . 40 (4): 1169–1175. дои : 10.1161/СТРОКЕАХА.108.527788 . ПМЦ 2663594 . ПМИД 19211496 .
- ^ Джаннини, AJ (1997). Наркотики, вызывающие злоупотребление (второе изд.). Лос-Анджелес: ISBN компании Physicians Management Information Co. 978-0874894998 .
- ^ Тейген Л., Боес CJ (2014). «Обоснованный обзор пероральных добавок магния в профилактическом лечении мигрени». Цефалгия (обзор). 35 (10): 912–922. дои : 10.1177/0333102414564891 . ПМИД 25533715 . S2CID 25398410 .
Существует убедительное количество доказательств, демонстрирующих связь между статусом магния и мигренью. Магний, вероятно, играет роль в развитии мигрени на биохимическом уровне, но роль пероральных добавок магния в профилактике и лечении мигрени еще предстоит полностью выяснить. В настоящее время убедительность доказательств в пользу перорального приема добавок магния ограничена.
- ^ Говарикер, Васант; Кришнамурти, вице-президент; Говарикер, Судха; Дханоркар, Маник; Паранджапе, Кальяни (8 апреля 2009 г.). Энциклопедия удобрений . Джон Уайли и сыновья. п. 224. ИСБН 978-0470431764 .
- ^ Макгуайр, Джон К.; Кулкарни, Мона Шах; Баден, Харрис П. (1 февраля 2000 г.). «Фатальная гипермагниемия у ребенка, получавшего мегавитаминную/мегаминеральную терапию». Педиатрия . 105 (2): е18. дои : 10.1542/peds.105.2.e18 . ПМИД 10654978 .
- ^ Контани М; Хара А; Охта С; Икеда Т. (2005). «Гипермагниемия, вызванная массивным приемом слабительных средств у пожилой женщины без ранее существовавшей почечной дисфункции» . Стажер. Мед . 44 (5): 448–452. дои : 10.2169/internalmedicine.44.448 . ПМИД 15942092 .
- ^ Куцал, Эбру; Айдемир, Джумхур; Элдес, Нилуфер; Демирель, Фатма; Полат, Реджеп; Таспынар, Озан; Кулах, Эйюп (февраль 2000 г.). «Тяжелая гипермагниемия как результат чрезмерного приема слабительных средств у ребенка без почечной недостаточности». Педиатрия . 205 (2): 570–572. дои : 10.1097/PEC.0b013e31812eef1c . ПМИД 17726419 .
- ^ «Магний» (PDF) . Институт удобрений . Проверено 14 июля 2023 г.
- ^ «Какова связь между хлорофиллом и магнием?» . Все вещи природы . 12 июня 2023 г. Проверено 14 июля 2023 г.
- ^ «Магниевый стержень диам. 6мм, 99,9+ микроэлементов 7439-95-4» . МиллипорСигма .
- ^ «МАГНИЙ» . КАМЕО Химические вещества . Национальное управление океанических и атмосферных исследований .
- ^ «Научная безопасность: Глава 8» . Правительство Манитобы . Проверено 21 августа 2007 г.
- ^ «Химия: Таблица Менделеева: магний: данные химических реакций» . webelements.com . Проверено 26 июня 2006 г.
- ^ «Реакция между магнием и CO 2 » . Университет Пердью . Проверено 15 июня 2016 г.
- ^ Кот, Артур Э. (2003). Эксплуатация систем противопожарной защиты . Джонс и Бартлетт Обучение. п. 667. ИСБН 978-0877655848 .
Цитируемые источники
- Рамбл, Джон Р., изд. (2018). Справочник CRC по химии и физике (99-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 978-1-1385-6163-2 .
Внешние ссылки
- Магний в Периодической таблице видео (Ноттингемский университет)
- Подкаст «Химия в своем элементе» (MP3) от химического общества Королевского Мира химии : Магний
- «Магний — универсальный и часто упускаемый из виду элемент: новые перспективы с акцентом на хроническую болезнь почек» . Клинический журнал почек . 5 (Приложение 1): НП. Февраль 2012 г. doi : 10.1093/ndtplus/sfs035 . ПМЦ 4455823 . ПМИД 26069823 .

