Кетобемидон
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Кетоган |
| Другие имена | Кетобемидон, Клирадон, Цимидон, Кетоган, Кеторакс |
| AHFS / Drugs.com | Международные названия лекарств |
| Маршруты администрация | Внутрь , ректально , внутривенно |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | 34~40% (перорально), 44% (ректально) |
| Период полувыведения | 2–4 часа |
| Продолжительность действия | 3–5 часов |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.006.748 |
| Химические и физические данные | |
| Формула | С 15 Н 21 Н О 2 |
| Молярная масса | 247.338 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Кетобемидон , продаваемый, среди прочего, под торговой маркой Кетоган , является мощным синтетическим опиоидным обезболивающим . Его эффективность против боли находится в том же диапазоне, что и у морфина , и он также обладает некоторыми свойствами антагониста NMDA , частично обусловленными его метаболитом норкетобемидоном. [2] Это может сделать его полезным при некоторых типах боли, которые плохо поддаются лечению другими опиоидами. [2] Он продается в Дании , Исландии , Норвегии и Швеции и используется при сильной боли. [3]
История
[ редактировать ]Кетобемидон был впервые синтезирован в 1942 году Эйслебом и его коллегами. [4] в лаборатории IG Farbenindustrie в Хёхсте во время Второй мировой войны. Первое исследование этого явления на людях было опубликовано в 1946 году. [5] и вскоре после этого он был внедрен в клиническую медицину. На момент обнародования Закона о контролируемых веществах 1970 года он не использовался в клинических целях и был отнесен к Списку I с номером ASCCN 9628. По состоянию на 2013 год DEA не установило никаких ежегодных производственных квот. [6]
Pfizer производит кетобемидон под торговыми марками Кетоган и Кеторакс. Он доступен в виде таблеток , суппозиториев и жидкости для инъекций. В некоторых странах существует форма пролонгированного действия, продаваемая под названием Кетодур, и она содержит 10 или 25 мг кетобемидона.
Фармакология
[ редактировать ]Эксперименты на бывших наркоманах показали, что он вызывает сильную зависимость и в высоких дозах, по сравнению с другими опиоидами, может увеличивать вероятность злоупотребления у бывших и нынешних опиоидных наркоманов. Хотя сначала были предложены некоторые усилия по разработке резолюции, призывающей правительства прекратить производство и использование кетобемидона, [7] этот результат не соответствовал клиническим наблюдениям, и другое исследование, проведенное в 1958 году, не показало, что он вызывает более сильное привыкание, чем морфин. В этом исследовании было отмечено, что, хотя доза морфина для эйфории такая же, как и для аналгезии, для кетобемидона обезболивающая доза была значительно ниже дозы, вызывающей эйфорию. Таким образом, даже по сравнению с морфином, кетобемидон может быть гораздо более эффективным, не вызывая значительной эйфории и, следовательно, имея меньший риск развития зависимости под наблюдением квалифицированного врача. [8] Кетобемидон в основном используется в скандинавских странах, причем Дания . лидером по статистике является [9]
Анальгезия после приема 5–10 мг перорально или 5–7,5 мг внутривенно продолжается 3–5 часов. Кетобемидон также доступен в препаратах со спазмолитическим действием , что позволяет улучшить анальгезию.
Метаболизм
[ редактировать ]Кетобемидон метаболизируется главным образом путем конъюгации фенольной гидроксильной группы и N -деметилирования. Лишь около 13-24% выводится в неизмененном виде после внутривенного введения. [10]
Химия
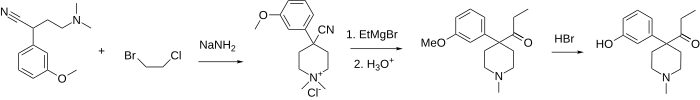
[ редактировать ]Кетобемидон представляет собой 1-метил-4-(3-гидроксифенил)-4-пропионилпиперидин. Обычно он доступен в виде гидрохлорида , который представляет собой белый порошок. Его синтезируют путем алкилирования (3-метоксифенил)ацетонитрила бис(2-хлорэтил)метиламином с последующей реакцией с этилмагнийбромидом и, наконец, O-деметилированием бромистоводородной кислотой . [11]
Из-за сильного нарывистого характера бис(2-хлорэтил)метиламина разработано множество других способов получения кетобемидона. Путь, изображенный ниже, лежит через первое алкилирование того же (3-метоксифенил)ацетонитрила 2-хлор- N , N -диметилэтиламином или 2-хлор- N -бензил- N -метилэтиламином. [12] Затем эти амины еще раз алкилируются с использованием смешанного 1-бром-2-хлорэтана, завершая таким образом пиперидиновое кольцо и получая соль четвертичного аммония, которую можно декватернизировать с помощью соли тиофенола. [13] (для N , N -диметиламмония) или каталитическое гидрирование [14] (для обоих соединений) к обычному 4-(3-метоксифенил)-4-циано-1-метилпиперидину. Последний дает кетобемидон после реакции Гриньяра с этилмагнийбромидом и расщепления эфира.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ https://www.ema.europa.eu/documents/psusa/ketobemidone-list-nationally-authorized-medicinal-products-psusa/0001807/202005_en.pdf [ пустой URL PDF ]
- ^ Перейти обратно: а б Эберт Б., Торкильдсен С., Андерсен С., Криструп Л.Л., Хьедс Х. (сентябрь 1998 г.). «Опиоидные анальгетики как неконкурентные антагонисты N-метил-D-аспартата (NMDA)». Биохимическая фармакология . 56 (5): 553–9. дои : 10.1016/S0006-2952(98)00088-4 . ПМИД 9783723 .
- ^ Брейфилд А, изд. (9 января 2017 г.). «Кетобемидона гидрохлорид: Мартиндейл: полный справочник лекарств» . ЛекарстваПолный . Лондон, Великобритания: Фармацевтическая пресса . Проверено 6 сентября 2017 г.
- ^ Патент Великобритании 609763 «Производство пиперидилкетонов», опубликованный 6 октября 1948 г., передан Ciba Ltd.
- ^ патент США 2486796 , Мейшер К.; Каеги, Х., «Эфиры 1-алкил-4-гидроксифенилпиперидил-4-кетонов», выпущено 1 ноября 1949 г.
- ^ «Отдел контроля утечки DEA» . Архивировано из оригинала 14 мая 2017 г. Проверено 3 мая 2014 г.
- ^ «Разработка синтетических наркотических средств» . Бюллетень о наркотических средствах . 1956 (1): 11–14. 1956 год . Проверено 5 июля 2012 г.
- ^ Бондессон, У. (1982). Биологическая судьба кетобемидона у человека Том. 68. ИСБН 978-91-554-1243-2 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ «Статистическая информация о наркотических средствах» (PDF) . МККН . 2004. Архивировано из оригинала (PDF) 7 октября 2006 г. Проверено 7 сентября 2006 г.
- ^ Бондессон У, Хартвиг П., Дэниелссон Б (1981). «Количественное определение выведения с мочой кетобемидона и четырех его метаболитов после внутривенного и перорального введения у человека». Метаболизм и распределение лекарств . 9 (4): 376–80. ПМИД 6114838 .
- ^ Издательство Уильяма Эндрю (2013). «Цетобемидон» (отрывок) . Энциклопедия фармацевтического производства . Эльзевир. ISBN 9780815518563 .
- ^ Ависон А.В., Моррисон А.Л. (1950). «303. Синтетические анальгетики. Часть VI. Синтез кетобемидона». Журнал Химического общества (возобновленное) . 1950 : 1469–1471. дои : 10.1039/JR9500001469 .
- ^ Шамма М., Дено, Северная Каролина, Ремар Дж. Ф. (1966). «Селективное деметилирование четвертичных аммониевых солей». Буквы тетраэдра . 7 (13): 1375–1379. дои : 10.1016/s0040-4039(01)99725-4 .
- ^ Кеги Х, Мишер К (1949). «О новом синтезе морфиноподобных 4-фенилпиперидин-4-алкилкетонов и родственных соединений». Helvetica Chimica Acta . 32 (7): 2489–2507. дои : 10.1002/hlca.19490320736 .
Внешние ссылки
[ редактировать ]- «Кетобемидон» . Информационный портал о наркотиках . Национальная медицинская библиотека США.