Бифалин
 | |
 | |
| Клинические данные | |
|---|---|
| код АТС |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ХимическийПаук | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
| Формула | С 46 Ч 56 Н 10 О 10 |
| Молярная масса | 909.014 g·mol −1 |
| 3D model ( JSmol ) | |
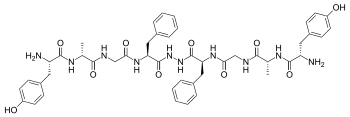
Бифалин представляет собой димерный энкефалина эндогенный пептид (Tyr- D -Ala-Gly-Phe-NH) 2, состоящий из двух тетрапептидов, полученных из энкефалинов , соединенных «хвост к хвосту» гидразидным мостиком. [1] Наличие двух различных фармакофоров придает бифалину высокое сродство как к μ, так и опиоидным рецепторам к δ (с ЕС 50 около 1–5 нМ как для рецепторов μ, так и для δ), поэтому он обладает анальгетической активностью. [2] Бифалин обладает значительным антиноцицептивным профилем. Фактически, при интрацеребровентрикулярном введении мышам бифалин проявляет эффективность почти в 7 раз большую, чем у сверхмощного алкалоидного агониста эторфина , и в 7000 раз большую, чем у морфина ; Бифалин и морфин оказались равносильными после внутрибрюшинного введения. Необычайная эффективность этого соединения in vivo сочетается с низким уровнем побочных эффектов, в частности, не вызывает зависимости при хроническом применении. [3] По этим причинам было предпринято несколько попыток получить больше информации о взаимосвязи структура-активность ( SAR ). Результаты ясно показывают, что, по крайней мере, для связывания мю-рецептора присутствие двух фармакофоров не является необходимым; [2] Тир 1 незаменим для анальгетической активности, при этом замена Phe в положениях 4 и 4' на неароматические, но липофильные аминокислоты не сильно меняет связывающие свойства [2] и в целом обнаружено, что положения 4,4' важны для создания аналогов бифалина с повышенной эффективностью и модифицированной селективностью μ/δ. [4] [5] Гидразидный линкер не является основным для активности или связывания, и его можно легко заменить различными конформационно ограниченными циклоалифатическими диаминовыми линкерами. [6]
Ссылки
[ редактировать ]- ^ Флиппен-Андерсон Дж.Л., Дешам-младший, Джордж К., Груби В.Дж., Мисицка А., Липковски А.В. (март 2002 г.). «Кристаллическая структура сульфата бифалина: мультирецепторный опиоидный пептид». Журнал исследований пептидов . 59 (3): 123–33. дои : 10.1034/j.1399-3011.2002.01967.x . ПМИД 11985706 .
- ^ Jump up to: а б с Липковски А.В., Мисицка А., Дэвис П., Стропова Д., Джандерс Дж., Лахва М. и др. (сентябрь 1999 г.). «Биологическая активность фрагментов и аналогов мощного димерного опиоидного пептида бифалина». Письма по биоорганической и медицинской химии . 9 (18): 2763–6. дои : 10.1016/S0960-894X(99)00464-3 . ПМИД 10509931 .
- ^ Хоран П.Дж., Маттиа А., Бильски Э.Дж., Вебер С., Дэвис Т.П., Ямамура Х.И. и др. (июнь 1993 г.). «Антиноцицептивный профиль бифалина, димерного аналога энкефалина». Журнал фармакологии и экспериментальной терапии . 265 (3): 1446–54. ПМИД 8389867 .
- ^ Ли Г., Хак В., Сян Л., Лу Б.С., Хьюз Р., Де Леон И.А. и др. (март 1998 г.). «Модификации 4,4'-остатков и исследования SAR бифалина, высокоэффективного пептида, активного для опиоидных рецепторов». Письма по биоорганической и медицинской химии . 8 (5): 555–60. дои : 10.1016/S0960-894X(98)00065-1 . ПМИД 9871617 .
- ^ Моллика А., Пиннен Ф., Феличиани Ф., Стефануччи А., Лусенте Г., Дэвис П. и др. (май 2011 г.). «Новые мощные аналоги бифалина, содержащие п-фтор-L-фенилаланин в положениях 4,4' и негидразиновые линкеры» . Аминокислоты . 40 (5): 1503–11. дои : 10.1007/s00726-010-0760-7 . ПМК 5689474 . ПМИД 20924622 .
- ^ Моллика А., Дэвис П., Ма С.В., Лай Дж., Поррека Ф., Хруби В.Дж. (май 2005 г.). «Синтез и биологическая оценка новых аналогов бифалина с негидразиновыми линкерами». Письма по биоорганической и медицинской химии . 15 (10): 2471–5. дои : 10.1016/j.bmcl.2005.03.067 . ПМИД 15863299 .