аппарицин
 | |
| Имена | |
|---|---|
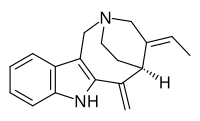
| Название ИЮПАК (19 E )-2,7,16,17,19,20-Гексадегидро-3,7-секо-6-норкуран | |
| Систематическое название ИЮПАК (2R , 4E , 5S ) -4-Этилиден-6-метилиден-1,3,4,5,6,7-гексагидро-2,5-этаноазоцино[4,3- b ]индол | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 3DMeet | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| КЕГГ | |
ПабХим CID | |
| Характеристики | |
| С 18 Ч 20 Н 2 | |
| Молярная масса | 264.372 g·mol −1 |
| Плотность | 0.945875 |
| войти P | 3.404 |
| Кислотность ( pKa ) | 8.37 |
Показатель преломления ( n D ) | 1.665 |
| 0.552121 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Аппарицин — монотерпеноидный трициклический индольный алкалоид . [1] Он назван в честь Аппарисио Дуарте, бразильского ботаника , изучавшего вид Aspidosperma, из которого впервые был выделен аппарицин. [2] [3] Это был первый член группы индольных алкалоидов валлесамина , который был выделен и установлена его структура. [3] который был впервые опубликован в 1965 году. [4] Он также известен под синонимами гомезин , перикалин и таберношизин . [5]
Биохимия
[ редактировать ]
Алкалоид был выделен из семи видов Aspidosperma . [6] Это основной алкалоид, обнаруженный в каллусе Tabernaemontana elegans , а также был обнаружен у других видов Tabernaemontana , включая T. africana , T. divaricata , T. orientalis и T. pachysiphon . [7] [8] В исследованиях T. pachysiphon было обнаружено, что содержание алкалоидов, в том числе аппарицина, было наибольшим в молодых листьях и листьях, получающих большую тень, и варьировалось в зависимости от возраста листьев, возраста растения и происхождения. [9]
Исследования Aspidosperma piricollum привели к открытию, что аппарицин биосинтезируется из триптофана за счет «потери C-2 и сохранения C-3». [10] Биосинтез аппарицина требует изменения обычной триптамина боковой цепи с потерей C-1. [1]
Определение структуры
[ редактировать ]Его структура была установлена с помощью методов химического разложения и развязки возникающего поля ядерного магнитного резонанса (ЯМР) с использованием 1 H изотоп водорода. [11] Ультрафиолетово-видимая спектроскопия показала, что аппарицин имеет такое же УФ-поглощение, что и улеин . [12] и их хромофоры оказались идентичными. [11]
Эксперименты по развязке ЯМР показали, что аппарицин лишен N -метилового сигнала и имеет один метиленовый атом углерода между атомом азота и индольными кольцами, что позволяет исследователям отличить его от улеина. [12] Это было примечательное раннее использование метода ЯМР-развязки для определения химической структуры. [12] Было обнаружено, что его углеродный скелет родственен, но отличается от скелета улеина, а структуры валлезамина и О-ацетилваллезамина родственны аппарицину. [13]
Дегидрирование аппарицина с последующим окислением перманганатом кольце позволило обнаружить два углеродных заместителя в пиперидиновом . [14]
Приложения
[ редактировать ]Аппарицин может иметь несколько потенциальных применений. В клеточных культурах он показал цитотоксичность в отношении экспериментальной лимфоцитарного лейкоза P388 клеточной линии . [15] Он проявляет сильную активность в отношении полиовируса типа 3 (PV3), [15] и обладает умеренной или сильной активностью против некоторых патогенов человека . [16] Он также активен в отношении опиоидных рецепторов. [15] и имеет микромолярное сродство к аденозиновым рецепторам . [17] Аппарицин обладает местными анальгезирующими свойствами. [16] Он ингибировал ксантиноксидазу так же сильно, как и аллопуринол (IC 50 = 0,65 мкМ). [18]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Jump up to: а б Герберт 1983 , с. 13.
- ^ Элия 2008 , стр. 594.
- ^ Jump up to: а б Джоуль 1983 , с. 286.
- ^ Джоуль и др. 1965 , с. 4773.
- ^ Гилберт 1968 , с. 273.
- ^ Монтейро 1966 , с. 39.
- ^ Верпоорте и др. 1989 , с. 139.
- ^ Элия 2008 , стр. 593.
- ^ Элия 2008 , стр. 596.
- ^ Шамма 1970 , с. 324.
- ^ Jump up to: а б Джоуль и др. 1980 , с. 230.
- ^ Jump up to: а б с Джоуль 1983 , с. 287.
- ^ Биманн 1966 , с. 40.
- ^ Джоуль 1983 , с. 288.
- ^ Jump up to: а б с Шмельцер 2008 , с. 592.
- ^ Jump up to: а б Майура и Шмельцер 2008 , с. 590.
- ^ Инканинан и др. 1999 , с. 1441.
- ^ Ши Б.Б., Чен Дж., Бао М.Ф., Цзэн Ю., Цай С.Х. (октябрь 2019 г.). «Алкалоиды, выделенные из Tabernamontana bufalina, проявляют ингибирующую активность ксантиноксидазы». Фитохимия . 166 : 112060. doi : 10.1016/j.phytochem.2019.112060 . ПМИД 31302343 . S2CID 196613130 .
Ссылки
[ редактировать ]- Биманн, Клаус (1966). «Масс-спектрометрия избранных натуральных продуктов». В Цехмайстере, Л. (ред.). Достижения химии органических природных продуктов . Том 24. Шпрингер-Верлаг . стр. 2–98. дои : 10.1007/978-3-7091-8143-0_1 . ISBN 978-3-7091-8145-4 . ПМИД 5958065 .
- Элиа, Дж. (2008). «Табернамонтана пахисифон Штапф». В Шмельцере, штат Джорджия; Гуриб-Факим А. (ред.). Лекарственные растения 1 . Растительные ресурсы Тропической Африки . Том. 11. Фонд ПРОТА; Издательство Backhuys; СТА . стр. 593–596. ISBN 978-90-5782-204-9 .
- Гилберт, Б. (1968). «Алкалоиды Aspidosperma , Ochrosia , Pleiocarpa , Melodinus и родственных родов». В Манске, РХФ (ред.). Алкалоиды: химия и физиология . Том. 11. Академическая пресса . стр. 205–306. дои : 10.1016/S1876-0813(08)60121-9 . ISBN 978-0-12-469511-5 .
- Герберт, Ричард Б. (1983). «Структурные и биосинтетические отношения». В Сакстоне, Дж. Эдвин (ред.). Индолы: Часть четвертая: Монотерпеноидные индольные алкалоиды . Химия гетероциклических соединений. Том. 25. Джон Уайли и сыновья . стр. 1–46. дои : 10.1002/9780470186954.ch1 . ISBN 0-471-89748-5 .
- Ингканинан, К.; Эйзерман, АП; Таэсотикул, Т.; Верпорте, Р. (1999). «Выделение опиоидно-активных соединений из Tabernamontana pachysiphon листьев » . Журнал фармации и фармакологии . 51 (12): 1441–1446. дои : 10.1211/0022357991777092 . ПМИД 10678501 . S2CID 45544097 .
- Джоуль, Джон А. (1983). «Группа улеин-эллиптицин-валлезамин» . В Сакстоне, Дж. Эдвин (ред.). Индолы: Часть четвертая: Монотерпеноидные индольные алкалоиды . Химия гетероциклических соединений. Том. 25. Джон Уайли и сыновья. стр. 265–292 . дои : 10.1002/9780470186954.ch1 . ISBN 0-471-89748-5 .
- Джоуль, Дж.А.; Аллен, MS; Бишоп, ДИ; Харрис, М.; и др. (1980). «Подходы к синтезу апарицина». В Филлипсоне, Джон Дэвид; Зенк, М.Х. (ред.). Индол и биогенетически родственные алкалоиды . Ежегодные труды Европейского фитохимического общества. Том. 17. Академическая пресса. стр. 229–248. ISBN 0-12-554450-2 .
- Джоуль, Дж.А.; Монтейро, Х.; Дарем, LJ; Гилберт, Б.; и др. (1965). «Исследование алкалоидов. Часть XLVIII. Структура аппарицина, нового алкалоида Aspidosperma». Журнал Химического общества (4): 4773–4780. дои : 10.1039/JR9650004773 . ПМИД 5891947 .
- Майура, Ф.С.; Шмельцер, GH (2008). «Tabernaemontana crassa Benth». В Шмельцере, штат Джорджия; Гуриб-Факим А. (ред.). Лекарственные растения 1 . Растительные ресурсы Тропической Африки. Том. 11. Фонд ПРОТА; Издательство Backhuys; СТА. стр. 589–592. ISBN 978-90-5782-204-9 .
- Монтейро, Уго Хорхе (1966). Исследования некоторых индольных алкалоидов: структура валезиахотамина. аппарицин, индольный алкалоид новой структуры. Строение и химия нервобскурина. тубулозин и его химическая корреляция с дезокситубулозином, части 1–4 .
- Шмельцер, GH (2008). «Табернамонтана Элеганс Стапф». В Шмельцере, штат Джорджия; Гуриб-Факим А. (ред.). Лекарственные растения 1 . Растительные ресурсы Тропической Африки. Том. 11. Фонд ПРОТА; Издательство Backhuys; СТА. стр. 592–593. ISBN 978-90-5782-204-9 .
- Шамма, Морис (1970). «Алкалоиды». В Каине, Корнелиус К.; и др. (ред.). Годовые отчеты по медицинской химии, 1969 г. Академическая пресса. стр. 323–332. doi : 10.1016/S0065-7743(08)60353-X . ISBN 978-0-12-040505-3 .
- Верпорте, Р.; ван дер Хейден, Р.; Шрипсема, Дж.; Сьерра, М.; и др. (1989). «Вторичные метаболиты в культурах клеток видов Teabernaemontana ». В Курце, Вольфганг Г.В. (ред.). Первичный и вторичный метаболизм культур растительных клеток II . Спрингер-Верлаг. стр. 138–148. дои : 10.1007/978-3-642-74551-5_16 . ISBN 978-3-642-74553-9 .
Внешние ссылки
[ редактировать ]- (-)-Аппарицин в Агентства по охране окружающей среды США. базе данных CompTox
- (-)-Аппарицин в KNApSack