Биосинтез
В молекулярной биологии биосинтез представляет собой многоэтапный превращаются субстраты в процесс, катализируемый ферментами, в ходе которого более сложные продукты в живых организмах. В биосинтезе простые соединения модифицируются, превращаются в другие соединения или соединяются с образованием макромолекул . Этот процесс часто состоит из метаболических путей . Некоторые из этих путей биосинтеза расположены внутри одной клеточной органеллы , тогда как другие включают ферменты, расположенные в нескольких клеточных органеллах. Примеры этих путей биосинтеза включают производство компонентов липидных мембран и нуклеотидов . обычно является синонимом анаболизма . Биосинтез
Необходимые элементы для биосинтеза включают: соединения- предшественники , химическую энергию (например, АТФ ) и каталитические ферменты, которым могут потребоваться коферменты (например, НАДН , НАДФН ). Эти элементы создают мономеры — строительные блоки макромолекул. Некоторые важные биологические макромолекулы включают: белки , которые состоят из мономеров аминокислот , соединенных пептидными связями , и молекулы ДНК , которые состоят из нуклеотидов, соединенных фосфодиэфирными связями .
Свойства химических реакций [ править ]
Биосинтез происходит за счет ряда химических реакций. Для того, чтобы эти реакции имели место, необходимы следующие элементы: [1]
- Соединения-предшественники : эти соединения являются исходными молекулами или субстратами реакции. Их также можно рассматривать как реагенты в данном химическом процессе.
- Химическая энергия : химическую энергию можно найти в виде молекул высокой энергии. Эти молекулы необходимы для энергетически невыгодных реакций. Более того, гидролиз этих соединений ускоряет реакцию. Молекулы высокой энергии, такие как АТФ , имеют три фосфата . Часто концевой фосфат при гидролизе отщепляется и переносится на другую молекулу.
- Катализаторы : это могут быть, например, ионы металлов или коферменты , которые катализируют реакцию, увеличивая скорость реакции и снижая энергию активации .
В самом простом смысле реакции, протекающие при биосинтезе, имеют следующий формат: [2]
Некоторые варианты этого основного уравнения, которые будут обсуждаться более подробно позже: [3]
- Простые соединения, которые превращаются в другие соединения, обычно в рамках многостадийной реакции. происходят во время образования нуклеиновых кислот и зарядки тРНК Два примера реакций этого типа перед трансляцией . Для некоторых из этих шагов требуется химическая энергия:
- Простые соединения, которые превращаются в другие соединения с помощью кофакторов. Например, для синтеза фосфолипидов требуется ацетил-КоА, тогда как для синтеза другого компонента мембраны, сфинголипидов , необходимы НАДН и ФАДН для образования основной цепи сфингозина . Общее уравнение для этих примеров:
- Простые соединения, которые соединяются, образуя макромолекулу. Например, жирные кислоты объединяются с образованием фосфолипидов. В свою очередь, фосфолипиды и холестерин взаимодействуют нековалентно , образуя липидный бислой . Эту реакцию можно изобразить следующим образом:
Липид [ править ]

Многие сложные макромолекулы синтезируются в виде простых повторяющихся структур. [4] Например, простейшими структурами липидов являются жирные кислоты . Жирные кислоты являются углеводородов производными ; они содержат «голову» карбоксильной группы и «хвост» углеводородной цепи. [4] Эти жирные кислоты создают более крупные компоненты, которые, в свою очередь, включают нековалентные взаимодействия, образуя липидный бислой. [4] Цепи жирных кислот встречаются в двух основных компонентах мембранных липидов: фосфолипидах и сфинголипидах . Третий основной компонент мембраны, холестерин , не содержит этих жирных кислот. [5]
Эукариотические фосфолипиды [ править ]
Основу всех биомембран составляет двухслойная структура фосфолипидов. [6] Молекула фосфолипида является амфипатической ; он содержит гидрофильную полярную головку и гидрофобный неполярный хвост. [4] Фосфолипидные головки взаимодействуют между собой и водными средами, а углеводородные хвосты ориентируются в центре, вдали от воды. [7] Эти последние взаимодействия управляют двухслойной структурой, которая действует как барьер для ионов и молекул. [8]
Существуют различные типы фосфолипидов; следовательно, пути их синтеза различаются. Однако первый этап синтеза фосфолипидов включает образование фосфатидата или диацилглицерин-3-фосфата в эндоплазматическом ретикулуме и внешней мембране митохондрий . [7] Путь синтеза представлен ниже:

Путь начинается с глицерин-3-фосфата, который превращается в лизофосфатидат путем добавления цепи жирной кислоты, обеспечиваемой ацил-коэнзимом А. [9] Затем лизофосфатидат превращается в фосфатидат путем добавления другой цепи жирной кислоты, вносимой вторым ацил-КоА; все эти этапы катализируются ферментом глицеринфосфатацилтрансферазой . [9] Синтез фосфолипидов продолжается в эндоплазматическом ретикулуме, причем путь биосинтеза расходится в зависимости от компонентов конкретного фосфолипида. [9]
Сфинголипиды [ править ]
Подобно фосфолипидам, эти производные жирных кислот имеют полярную головку и неполярные хвосты. [5] В отличие от фосфолипидов, сфинголипиды имеют сфингозиновый остов. [10] Сфинголипиды существуют в эукариотических клетках и особенно распространены в центральной нервной системе . [7] Например, сфингомиелин входит в состав миелиновой оболочки нервных волокон. [11]
Сфинголипиды образуются из церамидов , которые состоят из цепи жирных кислот, присоединенной к аминогруппе основной цепи сфингозина. Эти церамиды синтезируются в результате ацилирования сфингозина. [11] Путь биосинтеза сфингозина описан ниже:

Как видно на изображении, во время синтеза сфингозина пальмитоил-КоА и серин подвергаются реакции конденсации , которая приводит к образованию 3-дегидросфинганина. [7] Этот продукт затем восстанавливается с образованием дигидроспингозина, который превращается в сфингозин в результате реакции окисления с помощью FAD . [7]
Холестерин [ править ]
Этот липид принадлежит к классу молекул, называемых стеролами . [5] Стеролы имеют четыре слитых кольца и гидроксильную группу . [5] Холестерин является особенно важной молекулой. Он не только служит компонентом липидных мембран, но также является предшественником нескольких стероидных гормонов, включая кортизол , тестостерон и эстроген . [12]
Холестерин синтезируется из ацетил-КоА . [12] Путь показан ниже:

В более общем плане этот синтез происходит в три стадии: первая стадия происходит в цитоплазме , а вторая и третья стадии - в эндоплазматическом ретикулуме. [9] Этапы следующие: [12]
- 1. Синтез изопентенилпирофосфата , «строительного блока» холестерина.
- 2. Образование сквалена путем конденсации шести молекул изопентенилфосфата.
- 3. Превращение сквалена в холестерин посредством нескольких ферментативных реакций.
Нуклеотиды [ править ]
Биосинтез нуклеотидов включает реакции , катализируемые ферментами , которые превращают субстраты в более сложные продукты. [1] Нуклеотиды являются строительными блоками ДНК и РНК . Нуклеотиды состоят из пятичленного кольца, образованного сахаром рибозы в РНК и сахаром дезоксирибозы в ДНК; эти сахара связаны с пуриновым или пиримидиновым основанием гликозидной связью и фосфатной группой в 5'-положении сахара. [13]
Пуриновые нуклеотиды [ править ]

Нуклеотиды ДНК аденозин и гуанозин состоят из пуринового основания, присоединенного к рибозному сахару гликозидной связью. В случае нуклеотидов РНК дезоксиаденозин и дезоксигуанозин пуриновые основания присоединены к сахару дезоксирибозе гликозидной связью. Пуриновые основания на нуклеотидах ДНК и РНК синтезируются по двенадцатиступенчатому механизму реакции, присущему большинству одноклеточных организмов. Высшие эукариоты используют аналогичный механизм реакции , состоящий из десяти стадий. Пуриновые основания синтезируются путем превращения фосфорибозилпирофосфата (PRPP) в инозинмонофосфат (IMP), который является первым ключевым промежуточным продуктом в биосинтезе пуриновых оснований. [14] Дальнейшая ферментативная модификация IMP приводит к образованию аденозиновых и гуанозиновых оснований нуклеотидов.
- Первым этапом биосинтеза пуринов является реакция конденсации , осуществляемая глутамин-PRPP-амидотрансферазой . Этот фермент переносит аминогруппу от глутамина к PRPP, образуя 5-фосфорибозиламин . Следующий шаг требует активации глицина путем добавления фосфатной группы АТФ .
- GAR-синтетаза [15] осуществляет конденсацию активированного глицина на PRPP, образуя глицинамидрибонуклеотид (GAR).
- Трансформилаза GAR добавляет формильную группу к аминогруппе GAR, образуя формилглицинамидрибонуклеотид (FGAR).
- FGAR амидотрансфераза [16] катализирует присоединение азотистой группы к FGAR, образуя формилглицинамидинрибонуклеотид (FGAM).
- FGAM-циклаза катализирует замыкание кольца, которое включает удаление молекулы воды, образуя 5-членное имидазольное кольцо 5-аминоимидазолрибонуклеотид (AIR).
- N5-CAIR-синтетаза переносит карбоксильную группу, образуя промежуточный N5-карбоксиминоимидазолрибонуклеотид (N5-CAIR). [17]
- Мутаза N5-CAIR перестраивает карбоксильную функциональную группу и переносит ее на имидазольное кольцо, образуя карбоксиаминоимидазольный рибонуклеотид (CAIR). Двухэтапный механизм образования CAIR из AIR чаще всего встречается у одноклеточных организмов. Высшие эукариоты содержат фермент АИР-карбоксилазу, [18] который переносит карбоксильную группу непосредственно на имидазольное кольцо AIR, образуя CAIR.
- SAICAR-синтетаза образует пептидную связь между аспартатом и добавленной карбоксильной группой имидазольного кольца, образуя N-сукцинил-5-аминоимидазол-4-карбоксамид рибонуклеотид (SAICAR).
- Лиаза SAICAR удаляет углеродный скелет добавленного аспартата, оставляя аминогруппу и образуя 5-аминоимидазол-4-карбоксамид рибонуклеотид (AICAR).
- Трансформилаза AICAR переносит карбонильную группу на AICAR, образуя N-формиламиноимидазол-4-карбоксамидрибонуклеотид (FAICAR).
- На последнем этапе участвует фермент IMP-синтаза , который замыкает пуриновое кольцо и образует промежуточный продукт инозинмонофосфата. [5]
Пиримидиновые нуклеотиды [ править ]

Другими нуклеотидными основаниями ДНК и РНК, которые связаны с сахаром рибозы посредством гликозидной связи, являются тимин , цитозин и урацил (который встречается только в РНК). Биосинтез уридинмонофосфата включает фермент, расположенный во внутренней мембране митохондрий , и многофункциональные ферменты, расположенные в цитозоле . [19]
- На первом этапе фермент карбамоилфосфатсинтаза объединяет глутамин с CO2 образованием в АТФ-зависимой реакции с карбамоилфосфата .
- Аспартаткарбамоилтрансфераза конденсирует карбамоилфосфат с аспартатом с образованием уридосукцината.
- Дигидрооротаза осуществляет замыкание кольца — реакцию, при которой теряется вода с образованием дигидрооротата .
- Дигидрооротатдегидрогеназа , локализованная во внутренней мембране митохондрий. [19] окисляет дигидрооротат до оротата .
- Оротатфосфорибозилгидролаза (OMP-пирофосфорилаза) конденсирует оротат с PRPP с образованием оротидин-5'-фосфата .
- Декарбоксилаза OMP катализирует превращение оротидин-5'-фосфата в UMP . [20]
После синтеза уридинового нуклеотидного основания синтезируются другие основания, цитозин и тимин. Биосинтез цитозина представляет собой двухэтапную реакцию, которая включает превращение UMP в UTP . Присоединение фосфата к UMP катализируется ферментом киназой . Фермент CTP-синтаза катализирует следующую стадию реакции: превращение UTP в CTP путем переноса аминогруппы от глутамина к уридину; это образует цитозиновое основание CTP. [21] Механизм, который изображает реакцию УТФ + АТФ + глутамин ⇔ ЦТФ + АДФ + глутамат, приведен ниже:


Цитозин – это нуклеотид, который присутствует как в ДНК, так и в РНК. Однако урацил содержится только в РНК. Следовательно, после синтеза UTP его необходимо преобразовать в дезокси -форму для включения в ДНК. В этом преобразовании участвует фермент рибонуклеозидтрифосфатредуктаза . На эту реакцию, которая удаляет 2'-ОН сахара рибозы с образованием дезоксирибозы, не влияют основания, присоединенные к сахару. Эта неспецифичность позволяет рибонуклеозидтрифосфатредуктазе превращать все нуклеотидтрифосфаты в дезоксирибонуклеотиды по аналогичному механизму. [21]
В отличие от урацила, тиминовые основания встречаются преимущественно в ДНК, а не в РНК. Клетки обычно не содержат тиминовых оснований, которые связаны с сахарами рибозы в РНК, что указывает на то, что клетки синтезируют только тимин, связанный с дезоксирибозой. Фермент тимидилатсинтетаза отвечает за синтез остатков тимина из dUMP в dTMP . Эта реакция переносит метильную группу на урациловое основание dUMP с образованием dTMP. [21] Реакция тимидилатсинтазы, dUMP + 5,10-метилентетрагидрофолат ⇔ dTMP + дигидрофолат, показана справа.
ДНК [ править ]

Хотя существуют различия между синтезом ДНК эукариот и прокариот , в следующем разделе обозначены ключевые характеристики репликации ДНК, общие для обоих организмов.
ДНК состоит из нуклеотидов , соединенных фосфодиэфирными связями . [4] Синтез ДНК , происходящий в ядре , представляет собой полуконсервативный процесс, означающий, что полученная молекула ДНК содержит исходную цепь родительской структуры и новую цепь. [22] Синтез ДНК катализируется семейством ДНК-полимераз , которым требуются четыре дезоксинуклеозидтрифосфата, матричная цепь и праймер со свободным 3'-ОН для включения нуклеотидов. [23]
Чтобы произошла репликация ДНК, репликационная вилка создается с помощью ферментов, называемых хеликазами, , которая раскручивает спираль ДНК. [23] Топоизомеразы в репликационной вилке удаляют суперспирали , вызванные раскручиванием ДНК, а одноцепочечные ДНК-связывающие белки поддерживают две одноцепочечные ДНК-матрицы, стабилизированные перед репликацией. [13]
Синтез ДНК инициируется РНК-полимеразой- примазой , которая образует праймер РНК со свободным 3'-ОН. [23] Этот праймер прикрепляется к одноцепочечной матрице ДНК, а ДНК-полимераза удлиняет цепь за счет включения нуклеотидов; ДНК-полимераза также корректирует вновь синтезированную цепь ДНК. [23]
Во время реакции полимеризации, катализируемой ДНК-полимеразой, происходит нуклеофильная атака 3'-ОН растущей цепи на самый внутренний атом фосфора дезоксинуклеозидтрифосфата; это приводит к образованию фосфодиэфирного мостика , который присоединяет новый нуклеотид и высвобождает пирофосфат . [9]
Во время репликации одновременно создаются два типа цепей: ведущая цепь , которая синтезируется непрерывно и растет к репликационной вилке, и отстающая цепь , которая образуется прерывисто во фрагментах Окадзаки и растет в направлении от репликационной вилки. [22] Фрагменты Окадзаки ковалентно соединяются ДНК-лигазой с образованием непрерывной цепи. [22] Затем для завершения репликации ДНК праймеры РНК удаляются, а образовавшиеся пробелы заменяются ДНК и соединяются с помощью ДНК-лигазы. [22]
Аминокислоты [ править ]
Белок – это полимер, состоящий из аминокислот , связанных пептидными связями . В природе обнаружено более 300 аминокислот , из которых только двадцать две, известные как протеиногенные аминокислоты , являются строительными блоками белка. [24] Только зеленые растения и большинство микробов способны синтезировать все 20 стандартных аминокислот, необходимых всем живым видам. Млекопитающие могут синтезировать только десять из двадцати стандартных аминокислот. Остальные аминокислоты: валин , метионин , лейцин , изолейцин , фенилаланин , лизин , треонин и триптофан для взрослых и гистидин и аргинин для детей получают с пищей. [25]
Основная структура аминокислот [ править ]

Общая структура стандартных аминокислот включает первичную аминогруппу , карбоксильную группу и функциональную группу, присоединенную к α-углероду . Различные аминокислоты идентифицируются по функциональной группе. В результате того, что к α-углероду присоединены три разные группы, аминокислоты представляют собой асимметричные молекулы . Для всех стандартных аминокислот, кроме глицина , α-углерод является хиральным центром . В случае глицина α-углерод имеет два атома водорода, что добавляет симметрии этой молекуле. За исключением пролина , все аминокислоты, встречающиеся в жизни, имеют конформацию L-изоформы . Пролин имеет функциональную группу на α-углероде, которая образует кольцо с аминогруппой. [24]

Источник азота [ править ]
Один из основных этапов биосинтеза аминокислот включает включение азотистой группы в α-углерод. В клетках существует два основных пути включения групп азота. Один путь включает фермент глутамин-оксоглутарат-аминотрансферазу (GOGAT), который удаляет амидную аминогруппу глутамина и переносит ее на 2-оксоглутарат , образуя две глутамата молекулы . В этой реакции катализа глутамин служит источником азота. Изображение, иллюстрирующее эту реакцию, находится справа.
Другой путь включения азота в α-углерод аминокислот включает фермент глутаматдегидрогеназу (GDH). GDH способна переносить аммиак на 2-оксоглутарат и образовывать глутамат. Кроме того, фермент глютаминсинтетаза (GS) способен переносить аммиак на глутамат и синтезировать глютамин, восполняя глутамин. [26]
Семейство аминокислот глутамата [ править ]
Семейство аминокислот глутамата включает аминокислоты, полученные из аминокислоты глутамата. В это семейство входят: глутамат, глютамин , пролин и аргинин . В это семейство также входит аминокислота лизин , полученная из α-кетоглутарата . [27]
Биосинтез глутамата и глутамина является ключевым этапом ассимиляции азота, обсуждавшейся выше. Ферменты GOGAT и GDH катализируют реакции ассимиляции азота .
У бактерий фермент глутамат-5-киназа инициирует биосинтез пролина путем переноса фосфатной группы с АТФ на глутамат. Следующая реакция катализируется ферментом пирролин-5-карбоксилатсинтазой (P5CS), который катализирует восстановление ϒ-карбоксильной группы L-глутамат-5-фосфата. Это приводит к образованию полуальдегида глутамата, который самопроизвольно циклизуется до пирролин-5-карбоксилата. Пирролин-5-карбоксилат далее восстанавливается ферментом пирролин-5-карбоксилатредуктазой (P5CR) с образованием аминокислоты пролин. [28]
На первом этапе биосинтеза аргинина у бактерий глутамат ацетилируется путем переноса ацетильной группы от ацетил-КоА в положение N-α; это предотвращает спонтанную циклизацию. Фермент N-ацетилглутаматсинтаза (глутамат-N-ацетилтрансфераза) отвечает за катализацию стадии ацетилирования. Последующие этапы катализируются ферментами N-ацетилглутаматкиназой , N-ацетилгаммаглутамилфосфатредуктазой и ацетилорнитин/сукцинилдиаминопимелатаминотрансферазой и дают N-ацетил-L-орнитин. Ацетильная группа ацетилорнитина удаляется ферментом ацетилорнитиназой (АО) или орнитинацетилтрансферазой (ОАТ), в результате чего образуется орнитин . Затем ферменты цитруллин и аргининосукцинат превращают орнитин в аргинин. [29]

Существует два различных пути биосинтеза лизина: путь диаминопимелиновой кислоты и путь α-аминоадипата . Наиболее распространенным из двух путей синтеза является путь диаминопимелиновой кислоты; он состоит из нескольких ферментативных реакций, в ходе которых к аспартату добавляются углеродные группы с образованием лизина: [30]
- Аспартаткиназа инициирует путь диаминопимелиновой кислоты путем фосфорилирования аспартата и образования аспартилфосфата.
- Аспартатполуальдегиддегидрогеназа катализирует НАДФН -зависимое восстановление аспартилфосфата с образованием аспартатполуальдегида.
- 4-гидрокси-тетрагидродипиколинатсинтаза присоединяет пируватную группу к β-аспартил-4-полуальдегиду и удаляет молекулу воды. Это вызывает циклизацию и дает (2S,4S)-4-гидрокси-2,3,4,5-тетрагидродипиколинат.
- 4-гидрокси-тетрагидродипиколинатредуктаза катализирует восстановление (2S,4S)-4-гидрокси-2,3,4,5-тетрагидродипиколината НАДФН с образованием Δ'-пиперидин-2,6-дикарбоксилата (2,3,4, 5-тетрагидродипиколинат) и H 2 O.
- Тетрагидродипиколинат-ацилтрансфераза катализирует реакцию ацетилирования, которая приводит к раскрытию кольца и дает N-ацетил α-амино-ε-кетопимелат.
- N-сукцинил-α-амино-ε-кетопимелат-глутамат-аминотрансаминаза катализирует реакцию трансаминирования, которая удаляет кетогруппу N-ацетил-α-амино-ε-кетопилата и заменяет ее аминогруппой с образованием N-сукцинил-L-диаминопимелата. . [31]
- N-ацилдиаминопимелатдеацилаза катализирует деацилирование N-сукцинил-L-диаминопимелата с образованием L,L-диаминопимелата. [32]
- DAP-эпимераза катализирует превращение L,L-диаминопимелата в мезоформу L,L-диаминопимелата. [33]
- DAP-декарбоксилаза катализирует удаление карбоксильной группы с образованием L-лизина.
Семейство аминокислот серина [ править ]
Семейство серина аминокислот включает: серин, цистеин и глицин . Большинство микроорганизмов и растений получают серу для синтеза метионина из аминокислоты цистеина. Кроме того, превращение серина в глицин обеспечивает углероды, необходимые для биосинтеза метионина и гистидина . [27]
В ходе биосинтеза серина [34] Фермент фосфоглицератдегидрогеназа катализирует начальную реакцию, которая окисляет 3-фосфо-D-глицерат с образованием 3-фосфонооксипирувата . [35] Следующая реакция катализируется ферментом фосфосеринаминотрансферазой , которая переносит аминогруппу с глутамата на 3-фосфонооксипируват с образованием L-фосфосерина . [36] Последний этап катализируется ферментом фосфосеринфосфатазой , который дефосфорилирует L-фосфосерин с образованием L-серина . [37]
Известны два пути биосинтеза глицина. Организмы, которые используют этанол и ацетат в качестве основного источника углерода, используют гликонеогенный путь для синтеза глицина . Другой путь биосинтеза глицина известен как гликолитический путь. Этот путь превращает серин, синтезированный из промежуточных продуктов гликолиза, в глицин. В гликолитическом пути фермент серингидроксиметилтрансфераза катализирует расщепление серина с образованием глицина и переносит отщепленную углеродную группу серина на тетрагидрофолат , образуя 5,10-метилентетрагидрофолат . [38]
Биосинтез цистеина представляет собой двухэтапную реакцию, которая включает в себя включение неорганической серы . У микроорганизмов и растений фермент серинацетилтрансфераза катализирует перенос ацетильной группы с ацетил-КоА на L-серин с образованием О-ацетил-L-серина . [39] Следующий этап реакции, катализируемый ферментом О-ацетилсерин(тиол)лиазой , заменяет ацетильную группу O-ацетил-L-серина на сульфид с образованием цистеина. [40]
аминокислот Аспартатное семейство
Семейство аспартатных аминокислот включает в себя: треонин , лизин , метионин , изолейцин и аспартат. Лизин и изолейцин считаются частью семейства аспартатов, хотя часть их углеродного скелета происходит из пирувата . В случае метионина метиловый углерод образуется из серина и группы серы, но у большинства организмов он образуется из цистеина. [27]
Биосинтез аспартата представляет собой одностадийную реакцию, катализируемую одним ферментом. Фермент аспартатаминотрансфераза катализирует перенос аминогруппы от аспартата на α-кетоглутарат с образованием глутамата и оксалоацетата . [41] Аспарагин синтезируется путем АТФ-зависимого добавления аминогруппы к аспартату; аспарагинсинтетаза катализирует присоединение азота из глутамина или растворимого аммиака к аспартату с образованием аспарагина. [42]

Путь биосинтеза лизина диаминопимелиновой кислоты принадлежит к семейству аминокислот аспартата. Этот путь включает девять реакций, катализируемых ферментами, которые превращают аспартат в лизин. [43]
- Аспартаткиназа катализирует начальную стадию пути диаминопимелиновой кислоты путем переноса фосфорила из АТФ на карбоксилатную группу аспартата, что дает аспартил-β-фосфат. [44]
- Аспартат-полуальдегиддегидрогеназа катализирует реакцию восстановления путем дефосфорилирования аспартил-β-фосфата с образованием аспартат-β-полуальдегида. [45]
- Дигидродипиколинатсинтаза катализирует реакцию конденсации аспартат-β-полуальдегида с пируватом с образованием дигидродипиколиновой кислоты. [46]
- 4-гидрокси-тетрагидродипиколинатредуктаза катализирует восстановление дигидродипиколиновой кислоты с образованием тетрагидродипиколиновой кислоты. [47]
- Тетрагидродипиколинат-N-сукцинилтрансфераза катализирует перенос сукцинильной группы от сукцинил-СоА на тетрагидродипиколиновую кислоту с образованием N-сукцинил-L-2,6-диаминогептандиоата. [48]
- N-сукцинилдиаминопимелатаминотрансфераза катализирует перенос аминогруппы с глутамата на N-сукцинил-L-2,6-диаминогептандиоат с образованием N-сукцинил-L,L-диаминопимелиновой кислоты. [49]
- Сукцинилдиаминопимелатдесукцинилаза катализирует удаление ацильной группы у N-сукцинил-L,L-диаминопимелиновой кислоты с образованием L,L-диаминопимелиновой кислоты. [50]
- Диаминопимелатэпимераза катализирует инверсию α-углерода L,L-диаминопимелиновой кислоты с образованием мезо-диаминопимелиновой кислоты . [51]
- Сиаминопимелатдекарбоксилаза катализирует заключительную стадию биосинтеза лизина, которая удаляет группу диоксида углерода из мезо-диаминопимелиновой кислоты с образованием L-лизина. [52]
Белки [ править ]
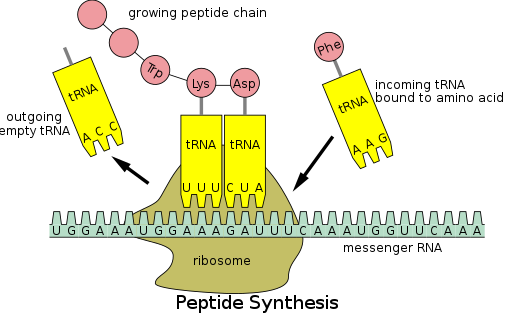

Синтез белка происходит посредством процесса, называемого трансляцией . [53] Во время трансляции генетический материал, называемый мРНК , считывается рибосомами для создания белковой полипептидной цепи. [53] Для этого процесса требуется транспортная РНК (тРНК), которая служит адаптером, связывая аминокислоты на одном конце и взаимодействуя с мРНК на другом конце; последнее спаривание тРНК и мРНК гарантирует добавление к цепи нужной аминокислоты. [53] Синтез белка происходит в три фазы: инициация, элонгация и терминация. [13] Прокариотический ( архейный и бактериальный ) перевод отличается от эукариотического перевода ; однако в этом разделе основное внимание будет уделено сходствам между этими двумя организмами.
Дополнительная информация [ править ]
Прежде чем трансляция сможет начаться, должен произойти процесс связывания конкретной аминокислоты с соответствующей тРНК. Эта реакция, называемая зарядкой тРНК, катализируется аминоацил-тРНК-синтетазой . [54] Специфическая тРНК-синтетаза отвечает за распознавание и зарядку определенной аминокислоты. [54] Кроме того, этот фермент имеет специальные дискриминационные области, обеспечивающие правильное связывание тРНК с родственной ей аминокислотой. [54] Первым шагом присоединения аминокислоты к соответствующей тРНК является образование аминоацил-АМФ: [54]
После этого происходит перенос аминоацильной группы с аминоацил-АМФ на молекулу тРНК. Полученная молекула представляет собой аминоацил-тРНК : [54]
Сочетание этих двух этапов, оба из которых катализируются аминоацил-тРНК-синтетазой, приводит к образованию заряженной тРНК, которая готова добавлять аминокислоты к растущей полипептидной цепи.
Помимо связывания аминокислоты, тРНК имеет трехнуклеотидную единицу, называемую антикодоном , которая образует пары оснований со специфическими тройками нуклеотидов на мРНК, называемыми кодонами ; кодоны кодируют определенную аминокислоту. [55] Такое взаимодействие возможно благодаря рибосоме, которая служит местом синтеза белка. Рибосома имеет три сайта связывания тРНК: аминоацильный сайт (сайт А), пептидильный сайт (сайт Р) и сайт выхода (сайт Е). [56]
В транскрипте мРНК имеется множество кодонов, и очень часто аминокислота определяется более чем одним кодоном; это явление называется вырождением . [57] Всего имеется 64 кодона, по 61 каждого из которых кодирует одну из 20 аминокислот, а остальные кодоны определяют обрыв цепи. [57]
Перевод по шагам [ править ]
Как упоминалось ранее, трансляция происходит в три фазы: инициация, элонгация и терминация.

Шаг 1: Инициация [ править ]
Завершение фазы инициации зависит от следующих трех событий: [13]
1. Рекрутирование рибосомы на мРНК.
2. Связывание заряженной инициаторной тРНК с Р-сайтом рибосомы.
3. Правильное выравнивание рибосомы со стартовым кодоном мРНК.
Шаг 2: Удлинение [ править ]
После инициации полипептидная цепь удлиняется за счет взаимодействий антикодон:кодон, при этом рибосома добавляет аминокислоты к полипептидной цепи по одной за раз. Для обеспечения правильного добавления аминокислот необходимо выполнить следующие шаги: [58]
1. Связывание правильной тРНК с А-сайтом рибосомы.
2. Образование пептидной связи между тРНК в А-сайте и полипептидной цепью, прикрепленной к тРНК в Р-сайте.
3. Транслокация или продвижение комплекса тРНК-мРНК на три нуклеотида.
Транслокация «отключает» тРНК в сайте E и перемещает тРНК из сайта A в сайт P, оставляя сайт A свободным для входящей тРНК, которая может добавить еще одну аминокислоту.
Шаг 3: Прекращение действия [ править ]
Последний этап трансляции происходит, когда стоп-кодон попадает в сайт А. [1] Затем происходят следующие шаги:
1. Распознавание кодонов факторами высвобождения , что вызывает гидролиз полипептидной цепи от тРНК, расположенной в Р-сайте. [1]
2. Высвобождение полипептидной цепи [57]
3. Диссоциация и «переработка» рибосомы для будущих процессов трансляции. [57]
Сводную таблицу ключевых игроков в сфере перевода можно найти ниже:
| Ключевые игроки в сфере перевода | Этап перевода | Цель |
|---|---|---|
| тРНК-синтетаза | перед началом | Отвечает за зарядку тРНК. |
| мРНК | инициация, элонгация, завершение | Шаблон для синтеза белка; содержит области, называемые кодонами, которые кодируют аминокислоты |
| тРНК | инициация, элонгация, завершение | Связывает сайты рибосом A, P, E; пары оснований антикодона с кодоном мРНК, чтобы гарантировать включение правильной аминокислоты в растущую полипептидную цепь. |
| рибосома | инициация, элонгация, завершение | Направляет синтез белка и катализирует образование пептидной связи. |
Заболевания, связанные с дефицитом макромолекул [ править ]

Ошибки в путях биосинтеза могут иметь пагубные последствия, включая нарушение формирования макромолекул или недостаточное производство функциональных молекул. Ниже приведены примеры, иллюстрирующие сбои, возникающие из-за такой неэффективности.
- Семейная гиперхолестеринемия это заболевание характеризуется отсутствием функциональных рецепторов ЛПНП : . [59] Недостаток образования рецепторов ЛПНП может вызвать дефекты рецепторов, которые нарушают эндоцитарный путь, подавляя проникновение ЛПНП в печень и другие клетки. [59] Это вызывает накопление ЛПНП в плазме крови, что приводит к образованию атеросклеротических бляшек , которые сужают артерии и повышают риск сердечных приступов. [59]
- Синдром Леша-Нихана : это генетическое заболевание характеризуется членовредительством , умственной отсталостью и подагрой . [60] Это вызвано отсутствием гипоксантин-гуанинфосфорибозилтрансферазы , которая является необходимым ферментом для образования пуриновых нуклеотидов. [60] Отсутствие фермента снижает уровень необходимых нуклеотидов и вызывает накопление промежуточных продуктов биосинтеза , что приводит к вышеупомянутому необычному поведению. [60]
- Тяжелый комбинированный иммунодефицит (ТКИД) : ТКИД характеризуется потерей Т-клеток . [61] Нехватка этих компонентов иммунной системы увеличивает восприимчивость к инфекционным агентам, поскольку у пораженных людей не может развиться иммунологическая память . [61] Это иммунологическое расстройство возникает в результате дефицита активности аденозиндезаминазы , что вызывает накопление dATP . Эти молекулы dATP затем ингибируют рибонуклеотидредуктазу, что предотвращает синтез ДНК. [61]
- Болезнь Хантингтона : это неврологическое заболевание вызвано ошибками, возникающими во время синтеза ДНК. [62] Эти ошибки или мутации приводят к экспрессии мутантного белка хантингтина , который содержит повторяющиеся остатки глутамина , которые кодируются расширением тринуклеотидных повторов CAG в гене. [62] Болезнь Хантингтона характеризуется гибелью нейронов и глиозом . Симптомы заболевания включают: двигательные расстройства, снижение когнитивных функций и поведенческие расстройства. [63]
См. также [ править ]
- Липиды
- Фосфолипидный бислой
- Нуклеотиды
- ДНК
- репликация ДНК
- Протеиногенная аминокислота
- Таблица кодонов
- Простагландин
- Порфирины
- Хлорофиллы и бактериохлорофиллы
- Витамин В 12
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д Альбертс, Брюс (2008). Молекулярная биология клетки (5-е изд.). Нью-Йорк: Garland Science. ISBN 978-0815341055 .
- ^ Зумдал, Стивен С. Зумдал, Сьюзен А. (2008). Химия (8-е изд.). КА: Cengage Learning. ISBN 978-0547125329 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Воэт, Дональд; Воэт, Джудит Г.; Пратт, Шарлотта В. (2013). Основы биохимии: жизнь на молекулярном уровне (4-е изд.). Хобокен, Нью-Джерси: Уайли. ISBN 978-0470547847 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Лодиш, Харви; и др. (2007). Молекулярно-клеточная биология (6-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0716743668 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Кокс, Дэвид Л. Нельсон, Майкл М. (2008). Ленингерские принципы биохимии (5-е изд.). Нью-Йорк: WH Freeman. ISBN 9780716771081 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ханин, Израиль (2013). Фосфолипиды: биохимические, фармацевтические и аналитические аспекты . Спрингер. ISBN 978-1475713664 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Вэнс, Деннис Э.; Вэнс, Джин Э. (2008). Биохимия липидов, липопротеинов и мембран (5-е изд.). Амстердам: Эльзевир. ISBN 978-0444532190 .
- ^ Катсарас, Дж.; и др. (2001). Липидные бислои: структура и взаимодействие; с 6 столами . Берлин [ua]: Шпрингер. ISBN 978-3540675556 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Страйер, Джереми М. Берг; Джон Л. Тимочко; Люберт (2007). Биохимия (6-е изд., 3-е печатное изд.). Нью-Йорк: Фриман. ISBN 978-0716787242 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Голт, ЧР; Л. М. Обейд; Ю.А. Ханнун (2010). «Обзор метаболизма сфинголипидов: от синтеза к распаду». Сфинголипиды как сигнальные и регуляторные молекулы . Достижения экспериментальной медицины и биологии. Том. 688. стр. 1–23. дои : 10.1007/978-1-4419-6741-1_1 . ISBN 978-1-4419-6740-4 . ПМК 3069696 . ПМИД 20919643 .
- ↑ Перейти обратно: Перейти обратно: а б Сигел, Джордж Дж. (1999). Основная нейрохимия: молекулярные, клеточные и медицинские аспекты (6-е изд.). Филадельфия, Пенсильвания [ua]: Липпинкотт Уильямс и Уилкинс. ISBN 978-0397518203 .
- ↑ Перейти обратно: Перейти обратно: а б с Харрис, Дж. Робин (2010). Белки, связывающие холестерин и транспортирующие холестерин: структура и функции в здоровом состоянии и при заболеваниях . Дордрехт: Спрингер. ISBN 978-9048186211 .
- ↑ Перейти обратно: Перейти обратно: а б с д Уотсон, Джеймс Д.; и др. (2007). Молекулярная биология гена (6-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN 978-0805395921 .
- ^ Каппок, Ти Джей; Илик, SE; Стуббе, Дж. (октябрь 2000 г.). «Модульная эволюция пути биосинтеза пуринов». Современное мнение в области химической биологии . 4 (5): 567–72. дои : 10.1016/s1367-5931(00)00133-2 . ПМИД 11006546 .
- ^ Сампей, Г; Баба, С; Канагава, М; Янаи, Х; Исии, Т; Каваи, Х; Фукай, Ю; Эбихара, А; Накагава, Н.; Каваи, Дж. (октябрь 2010 г.). «Кристаллические структуры глицинамидрибонуклеотидсинтетазы PurD из термофильных эубактерий». Журнал биохимии . 148 (4): 429–38. дои : 10.1093/jb/mvq088 . ПМИД 20716513 .
- ^ Хоскинс, А.А.; Ананд, Р; Илик, SE; Стуббе, Дж. (17 августа 2004 г.). «Комплекс формилглицинамид-рибонуклеотид-амидотрансферазы из Bacillus subtilis: образование комплекса, опосредованное метаболитами». Биохимия . 43 (32): 10314–27. дои : 10.1021/bi049127h . ПМИД 15301530 .
- ^ Мюллер, Э.Дж.; Мейер, Э; Рудольф, Дж; Дэвиссон, виджей; Стуббе, Дж. (1 марта 1994 г.). «N5-карбоксиминоимидазолрибонуклеотид: доказательства наличия нового промежуточного соединения и двух новых ферментативных активностей в пути биосинтеза пуринов de novo Escherichia coli». Биохимия . 33 (8): 2269–78. дои : 10.1021/bi00174a038 . ПМИД 8117684 .
- ^ Файерстин, С.М.; Пун, Юго-Запад; Мюллер, Э.Дж.; Стуббе, Дж; Дэвиссон, виджей (4 октября 1994 г.). «Реакции, катализируемые 5-аминоимидазолрибонуклеотидкарбоксилазами из Escherichia coli и Gallus Gallus: случай расхождения каталитических механизмов». Биохимия . 33 (39): 11927–34. дои : 10.1021/bi00205a031 . ПМИД 7918411 .
- ↑ Перейти обратно: Перейти обратно: а б Срере, Пенсильвания (1987). «Комплексы последовательных метаболических ферментов». Ежегодный обзор биохимии . 56 (1): 89–124. дои : 10.1146/annurev.bi.56.070187.000513 . ПМИД 2441660 .
- ^ Броуч, под редакцией Джеффри Н. Стратерна, Элизабет В. Джонс, Джеймса Р. (1981). Молекулярная биология дрожжей Saccharomyces . Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. ISBN 978-0879691394 .
{{cite book}}:|first=имеет общее имя ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б с О'Донован, Джорджия; Нойхард, Дж (сентябрь 1970 г.). «Пиримидиновый обмен у микроорганизмов» . Бактериологические обзоры . 34 (3): 278–343. дои : 10.1128/MMBR.34.3.278-343.1970 . ПМЦ 378357 . ПМИД 4919542 .
- ↑ Перейти обратно: Перейти обратно: а б с д Гир, Джеральд Карп; ответственный за пересмотр главы 15 Питер ван дер (2004). Клеточная и молекулярная биология: концепции и эксперименты (4-е изд., Изд. Wiley International). Нью-Йорк: Дж. Уайли и сыновья. ISBN 978-0471656654 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б с д Гриффитс, Энтони Дж. Ф. (1999). Современный генетический анализ (2-е печатное изд.). Нью-Йорк: Фриман. ISBN 978-0716731184 .
- ↑ Перейти обратно: Перейти обратно: а б Ву, Дж. (май 2009 г.). «Аминокислоты: обмен веществ, функции и питание». Аминокислоты . 37 (1): 1–17. дои : 10.1007/s00726-009-0269-0 . ПМИД 19301095 . S2CID 1870305 .
- ^ Мусдейл, DM; Коггинс, младший (1991). «Синтез аминокислот». Целевые участки для действия гербицидов . стр. 29–56. дои : 10.1007/978-1-4899-2433-9_2 . ISBN 978-1-4899-2435-3 .
- ^ Мифлин, Б.Дж.; Леа, Пи Джей (1977). «Метаболизм аминокислот». Ежегодный обзор физиологии растений . 28 : 299–329. дои : 10.1146/annurev.pp.28.060177.001503 .
- ↑ Перейти обратно: Перейти обратно: а б с Умбаргер, HE (1978). «Биосинтез аминокислот и его регуляция». Ежегодный обзор биохимии . 47 (1): 532–606. дои : 10.1146/annurev.bi.47.070178.002533 . ПМИД 354503 .
- ^ Перес-Арельяно, я; Кармона-Альварес, Ф; Мартинес, А.И.; Родригес-Диас, Дж; Сервера, Дж. (март 2010 г.). «Пирролин-5-карбоксилатсинтаза и биосинтез пролина: от осмотолерантности к редкому метаболическому заболеванию» . Белковая наука . 19 (3): 372–82. дои : 10.1002/pro.340 . ПМЦ 2866264 . ПМИД 20091669 .
- ^ Сюй, Ю; Лабедан, Б; Глансдорф, Н. (март 2007 г.). «Удивительный биосинтез аргинина: переоценка ферментологии и эволюции этого пути у микроорганизмов» . Обзоры микробиологии и молекулярной биологии . 71 (1): 36–47. дои : 10.1128/MMBR.00032-06 . ПМЦ 1847373 . ПМИД 17347518 .
- ^ «MetaCyc: биосинтез L-лизина I» .
- ^ ПЕТЕРКОФСКИЙ, Б; ГИЛВАРГ, К. (май 1961 г.). «N-Сукцинил-L-диаминопимелик-глутаминовая трансаминаза» . Журнал биологической химии . 236 (5): 1432–8. дои : 10.1016/S0021-9258(18)64192-4 . ПМИД 13734750 .
- ^ КИНДЛЕР, Ш.; ГИЛВАРГ, К. (декабрь 1960 г.). «Деацилаза N-сукцинил-L-2,6-диаминопимелиновой кислоты» . Журнал биологической химии . 235 : 3532–5. дои : 10.1016/S0021-9258(18)64502-8 . ПМИД 13756049 .
- ^ Борн, ТЛ; Бланшар, Дж. С. (октябрь 1999 г.). «Исследование структуры/функции ферментов диаминопимелатного пути биосинтеза клеточной стенки бактерий». Современное мнение в области химической биологии . 3 (5): 607–13. дои : 10.1016/s1367-5931(99)00016-2 . ПМИД 10508663 .
- ^ «Эшерихия coli К-12 субстр. MG1655» . биосинтез серина . НИИ Интернешнл . Проверено 12 декабря 2013 г.
- ^ Белл, Дж. К.; Грант, Джорджия; Банасзак, LJ (30 марта 2004 г.). «Мультиконформационные состояния фосфоглицератдегидрогеназы». Биохимия . 43 (12): 3450–8. дои : 10.1021/bi035462e . ПМИД 15035616 .
- ^ Дубновицкий А.П.; Капетаниу, Е.Г.; Папагеоргиу, AC (январь 2005 г.). «Адаптация фермента к щелочному pH: структура атомного разрешения (1,08 А) фосфосеринаминотрансферазы из Bacillus alcalophilus» . Белковая наука . 14 (1): 97–110. дои : 10.1110/ps.041029805 . ПМЦ 2253317 . ПМИД 15608117 .
- ^ Ван, В; Ким, Р; Джанкарик, Дж; Йокота, Х; Ким, С.Х. (10 января 2001 г.). «Кристаллическая структура фосфосеринфосфатазы из Methanococcus jannaschii, гипертермофила, при разрешении 1,8 А» . Структура . 9 (1): 65–71. дои : 10.1016/s0969-2126(00)00558-x . ПМИД 11342136 .
- ^ Моншау, Н.; Стаманн, КП; Сам, Х; Макнил, Дж. Б.; Богнар, Ал. (1 мая 1997 г.). «Идентификация Saccharomyces cerevisiae GLY1 как треонинальдолазы: ключевого фермента в биосинтезе глицина» . Письма FEMS по микробиологии . 150 (1): 55–60. дои : 10.1111/j.1574-6968.1997.tb10349.x . ПМИД 9163906 .
- ^ Пай, ВЕ; Тинги, AP; Робсон, РЛ; Муди, ПК (24 сентября 2004 г.). «Строение и механизм действия серин-ацетилтрансферазы Escherichia coli» . Журнал биологической химии . 279 (39): 40729–36. дои : 10.1074/jbc.M403751200 . ПМИД 15231846 .
- ^ Хуанг, Б; Веттинг, МВт; Родерик, СЛ (май 2005 г.). «Активный центр О-ацетилсеринсульфгидрилазы является опорной точкой для образования биферментного комплекса с серин-ацетилтрансферазой» . Журнал бактериологии . 187 (9): 3201–5. дои : 10.1128/JB.187.9.3201-3205.2005 . ПМЦ 1082839 . ПМИД 15838047 .
- ^ Макфален, Калифорния; Винсент, Миннесота; Пико, Д; Янсониус, Ю.Н .; Леск, AM; Чотия, К. (5 сентября 1992 г.). «Закрытие домена в митохондриальной аспартатаминотрансферазе». Журнал молекулярной биологии . 227 (1): 197–213. дои : 10.1016/0022-2836(92)90691-C . ПМИД 1522585 .
- ^ Ларсен, ТМ; Бёлейн, СК; Шустер, С.М.; Ричардс, штат Нью-Йорк; Тоден, Дж.Б.; Холден, HM; Рэймент, I (7 декабря 1999 г.). «Трехмерная структура аспарагинсинтетазы B Escherichia coli: короткий путь от субстрата к продукту». Биохимия . 38 (49): 16146–57. CiteSeerX 10.1.1.453.5998 . дои : 10.1021/bi9915768 . ПМИД 10587437 .
- ^ Веласко, AM; Легина, Дж.И.; Ласкано, А. (октябрь 2002 г.). «Молекулярная эволюция путей биосинтеза лизина». Журнал молекулярной эволюции . 55 (4): 445–59. Бибкод : 2002JMolE..55..445В . дои : 10.1007/s00239-002-2340-2 . ПМИД 12355264 . S2CID 19460256 .
- ^ Котака, М; Рен, Дж; Локьер, М; Хокинс, Арканзас; Стаммерс, ДК (20 октября 2006 г.). «Структуры R- и Т-состояний аспартокиназы III Escherichia coli. Механизмы аллостерического перехода и ингибирования лизином» . Журнал биологической химии . 281 (42): 31544–52. дои : 10.1074/jbc.M605886200 . ПМИД 16905770 .
- ^ Хэдфилд, А; Крайгер, Г; Оуян, Дж; Пецко, Г.А.; Ринге, Д; Виола, Р. (18 июня 1999 г.). «Структура аспартат-бета-полуальдегиддегидрогеназы из Escherichia coli, ключевого фермента в семействе аспартатов биосинтеза аминокислот». Журнал молекулярной биологии . 289 (4): 991–1002. дои : 10.1006/jmbi.1999.2828 . ПМИД 10369777 .
- ^ Мирвальдт, К; Корндорфер, я; Хубер, Р. (10 февраля 1995 г.). «Кристаллическая структура дигидродипиколинатсинтазы из Escherichia coli при разрешении 2,5 А». Журнал молекулярной биологии . 246 (1): 227–39. дои : 10.1006/jmbi.1994.0078 . ПМИД 7853400 .
- ^ Чирилли, М; Чжэн, Р; Скапен, Г; Бланшар, Дж. С. (16 сентября 2003 г.). «Трехмерные структуры комплексов дигидродипиколинатредуктаза-НАДН-2,6-ПДК и -НАДФН-2,6-ПДК микобактерии туберкулеза. Структурный и мутагенный анализ расслабленной нуклеотидной специфичности». Биохимия . 42 (36): 10644–50. дои : 10.1021/bi030044v . ПМИД 12962488 .
- ^ Биман, ТВ; Биндер, Д.А.; Бланшар, Дж.С.; Родерик, СЛ (21 января 1997 г.). «Трехмерная структура тетрагидродипиколинат-N-сукцинилтрансферазы». Биохимия . 36 (3): 489–94. дои : 10.1021/bi962522q . ПМИД 9012664 .
- ^ Вейанд, С; Кефала, Г; Вайс, М.С. (30 марта 2007 г.). «Трёхмерная структура N-сукцинилдиаминопимелатаминотрансферазы микобактерии туберкулеза». Журнал молекулярной биологии . 367 (3): 825–38. дои : 10.1016/j.jmb.2007.01.023 . ПМИД 17292400 .
- ^ Ночек, БП; Гиллнер, DM; Фан, Ю; Хольц, RC; Иоахимиак, А. (2 апреля 2010 г.). «Структурные основы катализа моно- и диметаллизированными формами десукцинилазы N-сукцинил-L,L-диаминопимелиновой кислоты, кодируемой dapE» . Журнал молекулярной биологии . 397 (3): 617–26. дои : 10.1016/j.jmb.2010.01.062 . ПМК 2885003 . ПМИД 20138056 .
- ^ Пиллаи, Б; Черный, М; Подгузник, см; Сазерленд, А; Бланшар, Дж.С.; Ведерас, Дж. К.; Джеймс, Миннесота (23 ноября 2007 г.). «Динамика катализа, выявленная на кристаллических структурах мутантов диаминопимелат эпимеразы». Связь с биохимическими и биофизическими исследованиями . 363 (3): 547–53. дои : 10.1016/j.bbrc.2007.09.012 . ПМИД 17889830 .
- ^ Гокулан, К; Рупп, Б; Павелка М.С., младший; Джейкобс В.Р., младший; Саккеттини, JC (16 мая 2003 г.). «Кристаллическая структура диаминопимелатдекарбоксилазы микобактерии туберкулеза, важного фермента бактериального биосинтеза лизина» . Журнал биологической химии . 278 (20): 18588–96. дои : 10.1074/jbc.M301549200 . ПМИД 12637582 .
- ↑ Перейти обратно: Перейти обратно: а б с Уивер, Роберт Ф. (2005). Молекулярная биология (3-е изд.). Бостон: Высшее образование Макгроу-Хилла. ISBN 978-0-07-284611-9 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Купер, Джеффри М. (2000). Клетка: молекулярный подход (2-е изд.). Вашингтон (округ Колумбия): ASM Press. ISBN 978-0878931064 .
- ^ Джексон, Р.Дж.; и др. (февраль 2010 г.). «Механизм инициации эукариотической трансляции и принципы его регуляции» . Молекулярно-клеточная биология . 10 (2): 113–127. дои : 10.1038/nrm2838 . ПМЦ 4461372 . ПМИД 20094052 .
- ^ Грин, Рэйчел; Гарри Ф. Ноллер; и др. (1997). «Рибосомы и трансляция». Анну. Преподобный Биохим . 66 : 679–716. doi : 10.1146/annurev.biochem.66.1.679 . ПМИД 9242921 .
- ↑ Перейти обратно: Перейти обратно: а б с д Вайсбах, Герберт; Пестка, Сидней (1977). Молекулярные механизмы биосинтеза белка . Нью-Йорк: Академическая пресса. ISBN 978-0127442501 .
- ^ Фрэнк, Дж; Хайсяо Гао; и др. (сентябрь 2007 г.). «Процесс транслокации мРНК-тРНК» . ПНАС . 104 (50): 19671–19678. дои : 10.1073/pnas.0708517104 . ПМК 2148355 . ПМИД 18003906 .
- ↑ Перейти обратно: Перейти обратно: а б с Бандели, Салман Дж.; Дай, Джад; Вирани, Салим С. (30 ноября 2013 г.). «Новые методы лечения семейной гиперхолестеринемии». Текущие отчеты об атеросклерозе . 16 (1): 382. дои : 10.1007/s11883-013-0382-0 . ПМИД 24293346 . S2CID 8903481 .
- ↑ Перейти обратно: Перейти обратно: а б с Кан, Тэ Хёк; Пак, Ёнджин; Бадер, Джоэл С.; Фридманн, Теодор; Куни, Остин Джон (9 октября 2013 г.). «Ген домашнего хозяйства гипоксантингуанинфосфорибозилтрансфераза (HPRT) регулирует многочисленные пути развития и метаболизма дифференцировки нейронов эмбриональных стволовых клеток мышей» . ПЛОС ОДИН . 8 (10): е74967. Бибкод : 2013PLoSO...874967K . дои : 10.1371/journal.pone.0074967 . ПМК 3794013 . ПМИД 24130677 .
- ↑ Перейти обратно: Перейти обратно: а б с Уолпорт, Кен Мерфи, Пол Трэверс, Марк (2011). Иммунобиология Джейнвей (8-е изд.). Оксфорд: Тейлор и Фрэнсис. ISBN 978-0815342434 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б Хьюз, под редакцией Дональда К. Ло, Роберта Э. (2010). Нейробиология болезни Хантингтона: применение к открытию лекарств (2-е изд.). Бока-Ратон: CRC Press/Taylor & Francisco Group. ISBN 978-0849390005 .
{{cite book}}:|first=имеет общее имя ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Биглан, Кевин М.; Росс, Кристофер А.; Лангбен, Дуглас Р.; Эйлуорд, Элизабет Х.; Стаут, Джули С.; Квеллер, Сара; Карлоцци, Ноэль Э.; Дафф, Кевин; Беглингер, Ли Дж.; Полсен, Джейн С. (26 июня 2009 г.). «Моторные нарушения у преманифестных людей с болезнью Хантингтона: исследование PREDICT-HD» . Двигательные расстройства . 24 (12): 1763–1772. дои : 10.1002/mds.22601 . ПМК 3048804 . ПМИД 19562761 .
![{\displaystyle {\ce {Реагент ->[][фермент] Продукт}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d97fbef58f64fb0b7d05d90fa0a73b05f5919fc8)

![{\displaystyle {\ce {{Прекурсор~молекула}+кофактор->[][фермент]макромолекула}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b192f25eec9ceebed179bfeb43ae27795f3a91be)


