Металл


| Часть серии о |
| Периодическая таблица |
|---|
Металл «шахта, карьер (от древнегреческого μέταλλον ( métallon ) , металл») — это материал , который при полировке или разрушении приобретает блестящий вид и проводит электричество и тепло относительно хорошо . Все эти свойства связаны с наличием электронов на уровне Ферми , в отличие от неметаллических материалов, у которых их нет. [1] : Главы 8 и 19 [2] : Главы 7 и 8 Металлы обычно пластичны (их можно тянуть в проволоку) и ковкие (их можно заковывать в тонкие листы). [3]
Металл может быть химическим элементом, например железом ; сплав , такой как нержавеющая сталь ; или молекулярное соединение, такое как полимерный нитрид серы . [4] Общая наука о металлах называется металлургией и является подразделом материаловедения ; аспекты электронных и тепловых свойств также входят в сферу физики конденсированного состояния и химии твердого тела , это междисциплинарная тема. В разговорной речи такие материалы, как стальные сплавы, называются металлами, тогда как другие, такие как полимеры, дерево или керамика, являются неметаллическими материалами .
Металл проводит электричество при температуре абсолютного нуля . [5] что является следствием делокализованных состояний при энергии Ферми. [1] [2] Многие элементы и соединения становятся металлическими под высоким давлением, например, йод постепенно становится металлом при давлении от 40 до 170 тысяч раз атмосферного давления . Натрий становится неметаллом при давлении, чуть менее чем в два миллиона раз превышающем атмосферное давление, а при еще более высоких давлениях он, как ожидается, снова станет металлом.
При обсуждении таблицы Менделеева и некоторых химических свойств термин «металл» часто используется для обозначения тех элементов, которые в чистом виде и при стандартных условиях являются металлами в смысле упомянутой выше электропроводности. Сопутствующий термин «металлический» также может использоваться для типов атомов легирующей примеси или легирующих элементов.
В астрономии металлом называют все химические элементы звезды, которые тяжелее гелия . В этом смысле первыми четырьмя «металлами», собирающимися в ядрах звезд посредством нуклеосинтеза, являются углерод , азот , кислород и неон . В течение своей жизни звезда превращает более легкие атомы, в основном водород и гелий, в более тяжелые атомы. Металличность . астрономического объекта — это доля его вещества, состоящего из более тяжелых химических элементов [6] [7]
Прочность и устойчивость некоторых металлов привели к их частому использованию, например, в высотном строительстве и строительстве мостов , а также в большинстве транспортных средств, многих бытовых приборах , инструментах, трубах и железнодорожных путях. Драгоценные металлы исторически использовались в качестве монет , но в современную эпоху металлы для чеканки распространились как минимум на 23 химических элемента. [8] Также широко используются многоэлементные металлы, такие как нитрид титана. [9] или вырожденные полупроводники в полупроводниковой промышленности.
Считается, что история рафинированных металлов началась с использования меди около 11 000 лет назад. Золото, серебро, железо (в виде метеоритного железа), свинец и латунь также использовались до первого известного появления бронзы в пятом тысячелетии до нашей эры. Последующие разработки включают производство ранних форм стали; открытие натрия — первого легкого металла — в 1809 году; появление современных легированных сталей ; а после окончания Второй мировой войны - разработка более сложных сплавов.
Характеристики
Форма и структура

Большинство металлов блестящие и блестящие , по крайней мере, когда их полируют или ломают. Листы металла толщиной более нескольких микрометров кажутся непрозрачными, но сусальное золото пропускает зеленый свет. Это происходит из-за свободно движущихся электронов, которые отражают свет. [1] [2]
Хотя большинство элементарных металлов имеют более высокую плотность, чем неметаллы , [10] их плотность сильно варьируется, литий (0,534 г/см). причем наименьшую плотность имеет 3 ) и осмий (22,59 г/см 3 ) самый плотный. Ожидается, что некоторые из 6d-переходных металлов будут плотнее осмия, но их известные изотопы слишком нестабильны, чтобы было возможно массовое производство. [11] Магний, алюминий и титан — легкие металлы , имеющие важное коммерческое значение. Их соответствующая плотность 1,7, 2,7 и 4,5 г/см. 3 можно сравнить с показателями более старых конструкционных металлов, таких как железо с плотностью 7,9 и медь с плотностью 8,9 г/см. 3 . Самый распространенный легкий металл – алюминий. [12] [13] и магний [14] [15] сплавы.

а) хрупкий перелом
(б) Пластическое разрушение
(c) Полностью пластичное разрушение
Металлы обычно пластичны и пластичны, деформируются под напряжением, не раскалываясь . [10] Ненаправленный характер металлической связи способствует пластичности большинства металлических твердых тел, где напряжение Пайерлса относительно низкое, что позволяет двигаться дислокациям , а также существует множество комбинаций плоскостей и направлений пластической деформации . [16] Из-за плотной упаковки атомов вектор Бюргерса дислокаций довольно мал, а это также означает, что энергия, необходимая для их создания, мала. [3] [16] Напротив, в ионном соединении, таком как поваренная соль, векторы Бюргерса намного больше, а энергия перемещения дислокации намного выше. [3] Обратимая упругая деформация в металлах хорошо описывается законом Гука для восстанавливающих сил, где напряжение линейно пропорционально деформации . [17]
Изменение температуры может привести к перемещению структурных дефектов в металле, таких как границы зерен , точечные вакансии , линейные и винтовые дислокации , дефекты упаковки и двойники как в кристаллических , так и в некристаллических металлах. внутреннее проскальзывание , ползучесть и усталость металла . Также могут возникнуть [3] [16]
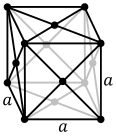
Атомы простых металлических веществ часто находятся в одной из трех распространенных кристаллических структур : объемноцентрированной кубической (ОЦК), гранецентрированной кубической (ГЦК) и гексагональной плотноупакованной (ГПУ). В ОЦК каждый атом расположен в центре куба из восьми других. В ГЦК и ГПУ каждый атом окружен двенадцатью другими, но укладка слоев различается. Некоторые металлы принимают различные структуры в зависимости от температуры. [18]
- Объемно-центрированная кубическая кристаллическая структура с двухатомной элементарной ячейкой, как, например, в хроме, железе и вольфраме.
- Гранецентрированная кубическая кристаллическая структура с 4-атомной элементарной ячейкой, как, например, в алюминии, меди и золоте.
- Шестиугольная плотноупакованная кристаллическая структура с элементарной ячейкой из 6 атомов, как, например, в титане, кобальте и цинке.
- Расположение атомов в кристалле каменной соли, например TiN.
Многие другие металлы с различными элементами имеют более сложную структуру, например, структуру каменной соли в нитриде титана или перовскит (структуру) в некоторых никелатах. [19]
Электрические и тепловые

Электронная структура металлов означает, что они являются относительно хорошими проводниками электричества . Все электроны имеют разные импульсы , которые в среднем равны нулю при отсутствии внешнего напряжения . Когда прикладывается напряжение, некоторые из них движутся немного быстрее в заданном направлении, некоторые немного медленнее, поэтому существует чистая скорость дрейфа , которая приводит к возникновению электрического тока. [1] [2] Это включает в себя небольшие изменения волновых функций , в которых находятся электроны, в сторону волновых функций с более высокими импульсами. Квантовая механика диктует, что в данном состоянии может быть только один электрон — принцип Паули . [20] Следовательно, должны быть пустые делокализованные электронные состояния (с более высокими импульсами), доступные при самых высоких занятых энергиях, как показано на рисунке. В полупроводнике, таком как кремний, или неметалле, таком как титанат стронция, существует энергетическая щель между самыми высокими заполненными состояниями электронов и самыми низкими незаполненными состояниями, поэтому нет доступных состояний с немного более высокими импульсами. Следовательно, полупроводники и неметаллы являются плохими проводниками, хотя они могут проводить некоторый ток при допировании элементами, которые вводят дополнительные частично занятые энергетические состояния при более высоких температурах. [21]
Элементарные металлы имеют значения электропроводности от 6,9 × 10. 3 См /см для марганца до 6,3×10. 5 С/см для серебра . Напротив, полупроводниковый металлоид, такой как бор, имеет электропроводность 1,5 × 10 −6 С/см. За одним исключением, металлические элементы уменьшают свою электропроводность при нагревании. Плутоний увеличивает свою электропроводность при нагревании в диапазоне температур от -175 до +125 °С, с аномально большим коэффициентом теплового расширения и переходом фазы от моноклинной к гранецентрированной кубической около 100 °С. [22]

Все металлические сплавы, а также проводящая керамика и полимеры являются металлами по одному и тому же определению; например, нитрид титана имеет делокализованные состояния на уровне Ферми. Они имеют электропроводность, подобную электропроводности элементарных металлов. Жидкие формы также являются металлическими проводниками электричества, например ртуть . В нормальных условиях никакие газы не являются металлическими проводниками. Однако плазма (физика) является металлическим проводником, и заряженные частицы в плазме имеют много общих свойств со свойствами электронов в элементарных металлах, особенно для звезд белых карликов. [23]
Металлы являются относительно хорошими проводниками тепла , которое в металлах переносится главным образом электронами проводимости. [24] При более высоких температурах электроны могут занимать несколько более высокие энергетические уровни, определяемые статистикой Ферми – Дирака . [2] [21] Они имеют немного более высокий импульс ( кинетическую энергию ) и могут передавать тепловую энергию. Эмпирический закон Видемана-Франца гласит, что во многих металлах соотношение теплопроводности и электропроводности пропорционально температуре, причем константа пропорциональности примерно одинакова для всех металлов. [2]

Вклад электронов металла в его теплоемкость и теплопроводность, а также электропроводность самого металла можно приближенно рассчитать на основе модели свободных электронов . [2] Однако при этом не учитывается детальное строение ионной решетки металла. Учет положительного потенциала, обусловленного расположением ионных остовов, позволяет учитывать электронную зонную структуру и энергию связи металла. Применимы различные модели, самой простой из которых является модель почти свободных электронов . [2] современные методы, такие как теория функционала плотности . Обычно используются [26] [27]
Химическая
Элементы, образующие металлы, обычно образуют катионы за счет потери электронов. [10] Большинство из них вступает в реакцию с кислородом воздуха с образованием оксидов в течение различных временных интервалов ( калий сгорает за секунды, а железо ржавеет в течение многих лет), что зависит от того, образует ли природный оксид пассивирующий слой , который действует как диффузионный барьер . [28] [29] Некоторые другие, например палладий , платина и золото , вообще не вступают в реакцию с атмосферой; золото может образовывать соединения, в которых оно приобретает электрон (ауриды, например аурид цезия ). Оксиды являются элементарных металлов часто основными . Однако оксиды с очень высокими степенями окисления , такие как CrO 3 , Mn 2 O 7 и OsO 4 , часто имеют строго кислые реакции; а оксиды менее электроположительных металлов, таких как BeO, Al 2 O 3 и PbO, могут проявлять как основные, так и кислотные свойства. Последние называются амфотерными оксидами.
Распределение таблицы Менделеева
Элементы, образующие в обычных условиях исключительно металлические структуры, в таблице Менделеева ниже показаны желтым цветом. Остальные элементы либо образуют ковалентные сетевые структуры (голубой), молекулярные ковалентные структуры (темно-синий), либо остаются в виде отдельных атомов (фиолетовый). [30] Астат (At), франций (Fr) и элементы, начиная с фермия (Fm), показаны серым цветом, поскольку они чрезвычайно радиоактивны и никогда не производились в больших количествах. Теоретические и экспериментальные данные свидетельствуют о том, что почти все эти неисследованные элементы должны быть металлами. [31] хотя есть некоторые сомнения в отношении оганессона (Ог). [32]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → | ||||||||||||||||||||||||||||||||
| ↓ Период | ||||||||||||||||||||||||||||||||
| 1 | ЧАС | Он | ||||||||||||||||||||||||||||||
| 2 | Что | Быть | Б | С | Н | ТО | Ф | Ne | ||||||||||||||||||||||||
| 3 | Уже | мг | Ал | И | П | С | кл. | С | ||||||||||||||||||||||||
| 4 | К | Что | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн | Здесь | Ге | Как | Се | Бр | НОК | ||||||||||||||
| 5 | руб. | старший | И | Зр | Нб | Мо | Тс | Ру | резус | ПД | В | компакт-диск | В | Сн | Сб | Te | я | Машина | ||||||||||||||
| 6 | Cs | Нет | La | Этот | Пр | Нд | вечера | см | Евросоюз | Б-г | Тб | Те | К | Является | Тм | Ыб | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть | Тл | Pb | С | Po | В | Рн |
| 7 | Пт | Солнце | И | че | Хорошо | В | Например | Мог | Являюсь | См | Бк | См. | Является | Фм | Мэриленд | Нет | лр | РФ | ДБ | Сг | Бх | Хс | гора | Дс | Рг | Сп | Нх | В | Мак | Лев | Ц | И |
Ковалентная металлическая сеть Молекулярная ковалентная связь Одиночные атомы Неизвестно Цвет фона показывает связь простых веществ в периодической таблице . Если их несколько, считается наиболее стабильный аллотроп.
Ситуация меняется с давлением: при чрезвычайно высоких давлениях ожидается металлизация всех элементов (да и вообще всех веществ). [31] Мышьяк (As) имеет как стабильный металлический аллотроп, так и метастабильный полупроводниковый аллотроп при стандартных условиях. Похожая ситуация и с углеродом (С): графит — металл, а алмаз — нет.
Сплавы

В контексте металлов сплав — это вещество, обладающее металлическими свойствами и состоящее из двух или более элементов . Часто по крайней мере один из них представляет собой металлический элемент; Термин «сплав» иногда используется в более общем смысле, например, в кремний-германий сплавах . Сплав может иметь переменный или фиксированный состав. Например, золото и серебро образуют сплав, в котором пропорции золота и серебра могут варьироваться; титан и кремний образуют сплав TiSi 2, в котором соотношение двух компонентов фиксировано (также известное как интерметаллическое соединение). [33] [34] ).

Большинство чистых металлов слишком мягкие, хрупкие или химически активные для практического использования. Сочетание различных соотношений металлов и других элементов в сплавах изменяет свойства для получения желаемых характеристик, например, большей пластичности, твердости, устойчивости к коррозии или более желательного цвета и блеска. Из всех используемых сегодня металлических сплавов сплавы железа ( сталь , нержавеющая сталь , чугун , инструментальная сталь , легированная сталь ) составляют наибольшую долю как по количеству, так и по коммерческой ценности. Железо, легированное различным содержанием углерода, дает низко-, средне- и высокоуглеродистые стали, при этом увеличение содержания углерода снижает пластичность и ударную вязкость. Добавление кремния дает чугуны, а добавление хрома , никеля и молибдена к углеродистым сталям (более 10%) приводит к получению нержавеющих сталей с повышенной коррозионной стойкостью.
Другими важными металлическими сплавами являются сплавы алюминия , титана , меди и магния . Медные сплавы известны с доисторических времен ( бронза дала название бронзовому веку ) и сегодня находят множество применений, особенно в электропроводке. Сплавы трех других металлов разработаны относительно недавно; из-за их химической активности они нуждаются в процессах электролитической экстракции. Сплавы алюминия, титана и магния ценятся за высокое соотношение прочности и веса; магний также может обеспечивать электромагнитное экранирование . [35] [36] Эти материалы идеально подходят для ситуаций, когда высокое соотношение прочности к весу важнее стоимости материала, например, в аэрокосмической и некоторых автомобильных отраслях.
Сплавы, специально разработанные для применений с высокими требованиями, таких как реактивные двигатели , могут содержать более десяти элементов.
Категории
Металлы можно классифицировать по их составу, физическим или химическим свойствам. Категории, описанные в подразделах ниже, включают черные и цветные металлы; хрупкие металлы и тугоплавкие металлы ; белые металлы; тяжелые и легкие металлы; недрагоценные , благородные и драгоценные металлы, а также металлическую керамику и полимеры .
Черные и цветные металлы
Термин «железо» происходит от латинского слова, означающего «содержащий железо». Это может быть чистое железо, например кованое железо , или сплав, например сталь . Черные металлы часто обладают магнитными свойствами , но не только. Цветные металлы и сплавы лишены заметного количества железа.
Хрупкий элементарный металл
Хотя почти все элементарные металлы ковкие или пластичные, некоторые из них — бериллий, хром, марганец, галлий и висмут — хрупкие. [37] Мышьяк и сурьма, если их признать металлами, хрупкие. Низкие значения отношения объемного модуля упругости к модулю сдвига ( критерий Пью ) свидетельствуют о внутренней хрупкости. Материал считается хрупким, если дислокациям трудно перемещаться, что часто связано с большими векторами Бюргерса и лишь ограниченным числом плоскостей скольжения. [38]
Тугоплавкий металл
Тугоплавкий металл — это металл, который очень устойчив к нагреву и износу. Какие металлы относятся к этой категории, различаются; наиболее распространенное определение включает ниобий, молибден, тантал, вольфрам и рений, а также их сплавы. Все они имеют температуру плавления выше 2000 °C и высокую твердость при комнатной температуре. Некоторые соединения, такие как нитрид титана, также относятся к тугоплавким металлам.
- Кристаллы ниобия и 1 см 3 анодированный ниобиевый кубик для сравнения
- 3D-печать фрикадельки НАСА, изготовленной из GRX-810, жаростойкого сплава, упрочненного оксидной дисперсией.
- Монокристалл рения, переплавленный слиток и 1 см 3 кубик рения для сравнения
- Порошок нитрида титана
Белый металл
Белый металл — это любой из ряда сплавов белого цвета с относительно низкой температурой плавления, используемых в основном в декоративных целях. [39] [40] В Великобритании в торговле изобразительным искусством в каталогах аукционов используется термин «белый металл» для описания иностранных серебряных изделий, на которых нет клейм Британской пробирной палаты. [41] но которые, тем не менее, считаются серебром и оцениваются соответственно.
Тяжелые и легкие металлы
Тяжелый металл — это любой относительно плотный металл или металлоид . [42] Были предложены более конкретные определения, но ни одно из них не получило широкого признания. Некоторые тяжелые металлы имеют нишевое применение или особенно токсичны; некоторые необходимы в следовых количествах. Все остальные металлы — легкие металлы.
Цветные, благородные и драгоценные металлы
Термин « неблагородный металл» относится к металлу, который легко окисляется или подвергается коррозии , например, легко реагирует с разбавленной соляной кислотой (HCl) с образованием хлорида металла и водорода . Примеры включают железо, никель , свинец и цинк. Медь считается недрагоценным металлом, так как относительно легко окисляется, хотя и не реагирует с HCl.

Термин «благородный металл» обычно используется в противоположность недрагоценному металлу . Благородные металлы менее реакционноспособны, устойчивы к коррозии и окислению . [43] в отличие от большинства недрагоценных металлов . Обычно это драгоценные металлы, часто из-за кажущейся редкости. Примеры включают золото, платину, серебро, родий , иридий и палладий.
В алхимии и нумизматике термин «недрагоценный металл» противопоставляется драгоценному металлу , то есть металлу высокой экономической ценности. [44] Большинство монет сегодня сделаны из недрагоценных металлов с низкой внутренней стоимостью ; в прошлом ценность монет часто определялась в первую очередь содержанием в них драгоценных металлов ; золото , серебро , платина и палладий имеют код валюты ISO 4217 . В настоящее время они используются в промышленности, например, в качестве платины и палладия в каталитических конвертерах , используются в ювелирных изделиях , а также используются в качестве инвестиций и средства сбережения . [45] По состоянию на лето 2024 года палладий и платина стоили чуть меньше половины цены золота, а серебро значительно дешевле.
Арматурные металлы
В электрохимии вентильный металл — это металл, который пропускает ток только в одном направлении из-за последующего образования изолирующего оксида. [46]
Металлическая керамика

Существует множество керамических соединений, которые обладают металлической электропроводностью, но не представляют собой простые комбинации металлических элементов. (Они не то же самое, что керметы , которые представляют собой композиты непроводящей керамики и проводящего металла.) Во-первых, нитриды переходных металлов имеют значительный ионный характер связи, поэтому их можно классифицировать как как керамику, так и как металлы. [9] Они имеют частично заполненные состояния на уровне Ферми. [9] так же они являются хорошими тепловыми и электрическими проводниками, и часто происходит значительная передача заряда от атомов переходного металла к азоту. [9] Однако, в отличие от большинства элементарных металлов, керамические металлы часто не особенно пластичны. Их применение широко распространено, например, нитрид титана находит применение в ортопедических устройствах. [47] и в качестве износостойкого покрытия. [48] Во многих случаях их полезность зависит от наличия эффективных методов нанесения, позволяющих использовать их в качестве тонкопленочных покрытий. [49]
Металлические полимеры

Существует множество полимеров, обладающих металлической электропроводностью. [51] [52] обычно ассоциируется с расширенными ароматическими компонентами, такими как полимеры, указанные на фигуре. Проводимость ароматических областей аналогична проводимости графита, поэтому она имеет высокую направленность. [53]
Половина металла
Полуметалл — это любое вещество, которое действует как проводник для электронов с одной ориентацией спина , но как изолятор или полупроводник для электронов с противоположным спином. Впервые они были описаны в 1983 году как объяснение электрических свойств марганца на основе сплавов Гейслера . [54] Хотя все полуметаллы ферромагнитны (или ферримагнитны ), большинство ферромагнетиков не являются полуметаллами. Многие из известных примеров полуметаллов представляют собой оксиды , сульфиды или сплавы Гейслера . [55]
Полуметалл
Полуметалл — это материал с небольшим энергетическим перекрытием нижней части проводимости зоны и верхней части валентной зоны , но они не перекрываются в пространстве импульсов . В отличие от обычного металла , полуметаллы имеют носители заряда обоих типов (дырки и электроны), поэтому можно также утверждать, что их следует называть «двойными металлами», а не полуметаллами. Однако носителей заряда обычно встречается в гораздо меньшем количестве, чем в реальном металле. В этом отношении они напоминают вырожденные полупроводники больше . Это объясняет, почему электрические свойства полуметаллов занимают промежуточное положение между свойствами металлов и полупроводников . Существуют дополнительные типы, в частности Вейля и полуметаллы Дирака . [56]
Классическими элементными полуметаллическими элементами являются мышьяк , сурьма , висмут , α- олово (серое олово) и графит . Существуют также химические соединения , такие как теллурид ртути (HgTe), [57] а некоторые проводящие полимеры могут вести себя как полуметаллы. [58]
Жизненный цикл
Формирование
| численность и основное распространение или источник, по весу [n 1] | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | ЧАС | Он | |||||||||||||||||
| 2 | Что | Быть | Б | С | Н | ТО | Ф | Ne | |||||||||||
| 3 | Уже | мг | Ал | И | П | С | кл. | С | |||||||||||
| 4 | К | Что | наук | Из | V | Кр | Мин. | Фе | Ко | В | С | Зн | Здесь | Ге | Как | Се | Бр | НОК | |
| 5 | руб. | старший | И | Зр | Нб | Мо | Ру | резус | ПД | В | компакт-диск | В | Сн | Сб | Te | я | Машина | ||
| 6 | Cs | Нет | Лу | хф | Облицовка | В | Ре | Ты | И | Пт | В | ртуть | Тл | Pb | С | ||||
| 7 | |||||||||||||||||||
| La | Этот | Пр | Нд | см | Евросоюз | Б-г | Тб | Те | К | Является | Тм | Ыб | |||||||
| че | В | ||||||||||||||||||
Самый обильный (до 82 000 ppm) | |||||||||||||||||||
Обильный ( 100 – 999 частей на миллион) | |||||||||||||||||||
Нечасто (1–99 частей на миллион) | |||||||||||||||||||
( 0,01–0,99 ) ppm Редко | |||||||||||||||||||
редко ( 0,0001–0,0099 Очень ppm ) | |||||||||||||||||||
| Металлы слева от разделительной линии встречаются (или добываются) главным образом в виде литофилов ; те, что справа, относятся к халькофилам, за исключением золота ( сидерофил ) и олова (литофил). | |||||||||||||||||||
Металлические элементы вплоть до железа (в периодической таблице) в основном производятся посредством звездного нуклеосинтеза . В этом процессе более легкие элементы, от водорода до кремния, подвергаются последовательным реакциям синтеза внутри звезд, выделяя свет и тепло и образуя более тяжелые элементы с более высокими атомными номерами. [59]
Более тяжелые элементы обычно не образуются таким образом, поскольку реакции синтеза с участием таких ядер будут потреблять, а не выделять энергию. [60] Скорее, они в основном синтезируются (из элементов с меньшим атомным номером) путем захвата нейтронов , причем двумя основными режимами этого повторяющегося захвата являются s-процесс и r-процесс . В s-процессе («s» означает «медленный») отдельные захваты разделены годами или десятилетиями, что позволяет менее стабильным ядрам подвергаться бета-распаду . [61] в то время как в r-процессе («быстром») захват происходит быстрее, чем ядра могут распасться. Таким образом, s-процесс идет более или менее ясным путем: например, стабильные ядра кадмия-110 последовательно бомбардируются свободными нейтронами внутри звезды, пока не образуются ядра кадмия-115, которые нестабильны и распадаются с образованием индия-115. (который почти стабилен, период полураспада в 30 000 раз превышает возраст Вселенной). Эти ядра захватывают нейтроны и образуют индий-116, который нестабилен и распадается с образованием олова-116 и так далее. [59] [62] [n 2] Напротив, в r-процессе такого пути нет. S-процесс останавливается на висмуте из-за короткого периода полураспада следующих двух элементов, полония и астата, которые распадаются на висмут или свинец. R-процесс настолько быстр, что может пропустить эту зону нестабильности и продолжить создание более тяжелых элементов, таких как торий и уран. [64]
Металлы конденсируются на планетах в результате звездной эволюции и процессов разрушения. Звезды теряют большую часть своей массы, когда она выбрасывается в конце своей жизни, а иногда и позже в результате слияния нейтронных звезд . [65] [n 3] элементов тяжелее гелия тем самым увеличивая содержание в межзвездной среде . Когда гравитационное притяжение заставляет эту материю сливаться и коллапсировать, образуются новые звезды и планеты . [67]
Численность и возникновение

Земная кора состоит примерно из 25% металлических элементов по весу, из которых 80% составляют легкие металлы, такие как натрий, магний и алюминий. Несмотря на общую нехватку некоторых более тяжелых металлов, таких как медь, они могут концентрироваться в экономически извлекаемых количествах в результате горообразования, эрозии или других геологических процессов.
Металлические элементы в основном встречаются в виде литофилов (любящих камни) или халькофилов (любящих руду). Литофильными элементами являются в основном элементы s-блока, более реакционноспособные из элементов d-блока и элементы f-блока. Они имеют сильное сродство к кислороду и в основном существуют в виде силикатных минералов относительно низкой плотности. Халькофильными элементами являются в основном менее реакционноспособные элементы d-блока и металлы p-блока периода 4–6. Обычно они встречаются в (нерастворимых) сульфидных минералах. Будучи более плотными, чем литофилы, и, следовательно, погружаясь ниже в кору во время ее затвердевания, халькофилы, как правило, менее распространены, чем литофилы.
С другой стороны, золото является сидерофилом или железолюбивым элементом. Он с трудом образует соединения с кислородом или серой. Во время образования Земли золото, как самый благородный (инертный) из металлических элементов, погрузилось в ядро из-за его склонности образовывать металлические сплавы высокой плотности. Следовательно, это относительно редко. Некоторые другие (менее) благородные — молибден, рений, металлы платиновой группы (рутений, родий, палладий, осмий, иридий, платина), германий, олово — можно отнести к сидерофилам, но только с точки зрения их первичного появления в Земля (ядро, мантия и кора), а не кора. В остальном они встречаются в земной коре в небольших количествах, главным образом в виде халькофилов (в меньшей степени в своей естественной форме). [n 4]
Вращающееся жидкое внешнее ядро Земли, состоящее в основном из железа, считается источником защитного магнитного поля Земли. [n 5] Ядро находится над твердым внутренним ядром Земли и под ее мантией. Если бы его можно было переставить в колонну высотой 5 м. 2 Площадь объекта (54 квадратных фута) будет иметь высоту почти 700 световых лет. Магнитное поле защищает Землю от заряженных частиц солнечного ветра и космических лучей, которые в противном случае разрушили бы верхние слои атмосферы (включая озоновый слой, ограничивающий передачу ультрафиолетового излучения).
Добыча
Металлические элементы часто добываются из Земли путем добычи руд, которые являются богатыми источниками необходимых элементов, таких как бокситы . Руды находятся поисковыми методами с последующей разведкой и изучением месторождений. Источники полезных ископаемых обычно делятся на открытые шахты , которые добываются путем раскопок с использованием тяжелой техники, и подземные шахты . В некоторых случаях цена продажи соответствующего металла(ов) делает экономически целесообразным добычу источников с более низкой концентрацией.
После того, как руда добыта, элементы необходимо извлечь , обычно путем химического или электролитического восстановления. В пирометаллургии для превращения руды в сырые металлы используются высокие температуры, а в гидрометаллургии применяется водная с той же целью химия.
Если металлическая руда представляет собой ионное соединение, ее обычно необходимо плавить — нагревать с восстановителем — для извлечения чистого металла. Многие распространенные металлы, такие как железо, выплавляются с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий , не имеют коммерчески практичного восстановителя и вместо этого извлекаются с помощью электролиза . [68] [69]
Сульфидные руды не восстанавливаются непосредственно до металла, а обжигаются на воздухе для превращения их в оксиды.
Переработка

Спрос на металлы тесно связан с экономическим ростом, поскольку они используются в инфраструктуре, строительстве, производстве и производстве потребительских товаров. В течение 20-го века разнообразие металлов, используемых в обществе, быстро росло. Сегодня развитие крупных стран, таких как Китай и Индия, а также технологические достижения стимулируют все больший спрос. В результате горнодобывающая деятельность расширяется, и все больше и больше мировых запасов металлов находятся в эксплуатации над землей, а не под землей в качестве неиспользованных резервов. Примером являются используемые запасы меди . В период с 1932 по 1999 год потребление меди в США выросло с 73 г до 238 г на человека. [70]
Металлы по своей природе подлежат вторичной переработке, поэтому, в принципе, их можно использовать снова и снова, сводя к минимуму негативное воздействие на окружающую среду и экономя энергию. Например, 95% энергии, используемой для производства алюминия из бокситовой руды, экономится за счет использования переработанного материала. [71]
Во всем мире объем переработки металлов в целом находится на низком уровне. В 2010 году Международная группа ресурсов , организованная Программой ООН по окружающей среде, опубликовала отчеты о запасах металлов, существующих в обществе. [72] и уровень их переработки. [70] Авторы доклада отмечают, что запасы металла в обществе могут служить огромными надземными шахтами. Они предупредили, что уровень переработки некоторых редких металлов, используемых в таких устройствах, как мобильные телефоны, аккумуляторные батареи для гибридных автомобилей и топливные элементы, настолько низок, что, если в будущем темпы переработки по окончании срока службы не будут резко увеличены, эти критические металлы станут недоступными для использование в современной технике.
История
Предыстория
Медь, встречающаяся в самородной форме, возможно, была первым обнаруженным металлом, учитывая ее характерный внешний вид, тяжесть и ковкость. Золото, серебро, железо (в виде метеоритного железа) и свинец также были обнаружены в доисторические времена. К этому периоду относятся формы латуни , сплава меди и цинка, полученного путем одновременной плавки руд этих металлов (хотя чистый цинк не был выделен до 13 века). Податливость твердых металлов привела к первым попыткам изготовления металлических украшений, инструментов и оружия. Время от времени обнаруживалось метеоритное железо, содержащее никель, и в некоторых отношениях оно превосходило любую промышленную сталь, производившуюся до 1880-х годов, когда легированные стали стали широко распространены. [73]
- Золотые кристаллы
- Кристаллическое серебро
- Кусок метеоритного железа
- Латунная гиря (35 г)
Античность

Открытие бронзы (сплава меди с мышьяком или оловом) позволило людям создавать металлические предметы, которые были более твердыми и долговечными, чем это было возможно раньше. Бронзовые инструменты, оружие, доспехи и строительные материалы, такие как декоративная плитка, были тверже и долговечнее, чем их каменные и медные (« энеолитические ») предшественники. Первоначально бронзу изготавливали из меди и мышьяка (образуя мышьяковистую бронзу ) путем выплавки природных или искусственно смешанных руд меди и мышьяка. [74] Самые ранние известные на сегодняшний день артефакты происходят с Иранского нагорья в пятом тысячелетии до нашей эры. [75] Лишь позже начали использовать олово , которое в конце третьего тысячелетия до нашей эры стало основным немедным компонентом бронзы. [76] Чистое олово было впервые выделено в 1800 году до нашей эры китайскими и японскими мастерами по металлу.
Ртуть была известна древним китайцам и индийцам еще до 2000 г. до н.э. и была найдена в египетских гробницах, датируемых 1500 г. до н.э.
Самое раннее известное производство стали, железо-углеродистого сплава, можно увидеть в кусках железа, раскопанных на археологических раскопках в Анатолии ( Каман-Калехойюк ), возраст которых составляет около 4000 лет и датируется 1800 годом до нашей эры. [77] [78]
Примерно с 500 г. до н.э. производители мечей в Толедо, Испания , изготавливали ранние формы легированной стали , добавляя к железной руде (и углероду) минерал под названием вольфрамит , который содержал вольфрам и марганец. Полученная в результате сталь Толедо привлекла внимание Рима, когда Ганнибал использовал ее в Пунических войнах . Вскоре он стал основой вооружения римских легионов; такие мечи были «сильнее по составу, чем любой существующий меч, и, поскольку… [они] не ломались, давали римскому солдату психологическое преимущество». [79]
В доколумбовой Америке предметы из тумбаги , сплава меди и золота, начали производиться в Панаме и Коста-Рике между 300 и 500 годами нашей эры. Небольшие металлические скульптуры были обычным явлением, а широкий спектр украшений тумбага (и золотых) составлял обычные регалии лиц высокого статуса.
Примерно в то же время коренные жители Эквадора комбинировали золото с природным платиновым сплавом, содержащим небольшое количество палладия, родия и иридия, для производства миниатюр и масок из сплава белого золота и платины. Металлисты нагревали золото с зернами платинового сплава до тех пор, пока золото не расплавилось. После охлаждения полученный конгломерат многократно молотили и повторно нагревали, пока он не стал однородным, что эквивалентно плавлению всех металлов (достижение температур плавления соответствующих металлов платиновой группы выходило за рамки технологий того времени). [80] [n 7]
- Капля застывшего расплавленного олова
- Электрум, природный сплав серебра и золота, часто использовался для изготовления монет. На лицевой стороне изображен римский бог Аполлон, а на лицевой стороне — дельфийский треножник ( ок. 310–305 гг. до н. э.).
- Пластина из олова , сплава 85–99% олова и (обычно) меди. Впервые олово начали использовать примерно в начале бронзового века на Ближнем Востоке.
- Пектораль (декоративный нагрудник) из тумбаги — сплава золота и меди.
Средний возраст
Золото хозяйке, серебро служанке.
Медь для мастера, хитрого в своем ремесле.
"Хороший!" - сказал барон, сидя у себя в зале,
«Но Железо, Холодное Железо — хозяин их всех».
из «Холодного железа» Редьярда Киплинга [81]
Арабские и средневековые алхимики считали, что все металлы и материя состоят из принципа серы, отца всех металлов и обладающего горючими свойствами, и принципа ртути, матери всех металлов. [№ 8] и носитель свойств ликвидности, плавкости и волатильности. Эти принципы не обязательно совпадали с обычными веществами серой и ртутью, обнаруженными в большинстве лабораторий. Эта теория укрепила веру в то, что всем металлам суждено стать золотом в недрах земли посредством правильного сочетания тепла, пищеварения, времени и удаления загрязняющих веществ, все из которых можно развить и ускорить с помощью знаний и методов алхимии. . [n 9]
Стали известны мышьяк, цинк, сурьма и висмут, хотя их сначала называли полуметаллами или металлами-бастардами из-за их нековкости. Считается, что Альберт Великий был первым, кто выделил мышьяк из соединения в 1250 году, нагревая мыло вместе с трисульфидом мышьяка . Металлический цинк, который в нечистом виде является хрупким, был выделен в Индии к 1300 году нашей эры. Первое описание процедуры выделения сурьмы содержится в книге la pirotechnia De Ванноччио Бирингуччо 1540 года . Висмут был описан Агриколой в De Natura Fossilium (ок. 1546 г.); В древние времена его путали с оловом и свинцом из-за сходства с этими элементами.
- Мышьяк, запечатанный в контейнере для предотвращения потускнения.
- Фрагменты цинка и 1 см 3 куб
- Сурьма, демонстрирующая свой блестящий блеск
- Висмут в кристаллической форме, с очень тонким слоем окисления и толщиной 1 см. 3 куб висмута
Ренессанс




Первым систематическим текстом по горному делу и металлургии был De la Pirotechnia (1540) Ванноччо Бирингуччо , в котором рассказывается об исследовании, плавлении и обработке металлов.
Шестнадцать лет спустя Георгиус Агрикола опубликовал в 1556 году «De Re Metallica» , отчет о горнодобывающей промышленности, металлургии, а также сопутствующих искусствах и науках, обширный трактат о химической промышленности в шестнадцатом веке.
он дал следующее описание металла В своей книге «De Natura Fossilium » (1546 г.) :
Металл — это минеральное тело, по своей природе либо жидкое, либо несколько твердое. Последний может быть расплавлен от жара огня, но когда он снова остынет и потеряет весь жар, он снова станет твердым и примет свою правильную форму. В этом отношении он отличается от камня, плавящегося в огне, поскольку последний хотя и восстанавливает свою твердость, но теряет свою первозданную форму и свойства.
Традиционно существует шесть различных видов металлов: золото, серебро, медь, железо, олово и свинец. На самом деле есть и другие, ибо ртуть — металл, хотя алхимики с нами не согласны в этом вопросе, да и висмут тоже. Древнегреческие писатели, по-видимому, ничего не знали о висмуте, поэтому Аммоний справедливо утверждает, что существует множество неизвестных нам видов металлов, животных и растений. Сурьма , выплавленная в тигле и очищенная, имеет такое же право считаться настоящим металлом, как авторы признают свинец. Если при выплавке определенную часть добавить к олову, то получится книготорговый сплав, из которого изготавливается шрифт, которым пользуются те, кто печатает книги на бумаге.
Каждый металл имеет свою форму, которую он сохраняет при отделении от тех металлов, которые были с ним смешаны. Следовательно, ни электрум , ни олово [не имея в виду наше олово] сами по себе не являются настоящим металлом, а скорее сплавом двух металлов. Электрум — сплав золота и серебра, олово — свинца и серебра. И все же, если серебро отделить от электрума, то останется золото, а не электрум; если у олова отнять серебро, то останется свинец, а не олово.
Однако невозможно установить с какой-либо уверенностью, является ли латунь самородным металлом или нет. Нам известна только искусственная латунь, состоящая из меди, окрашенной в цвет минерала каламина . И все же, если что-то и удастся выкопать, то это будет настоящий металл. Черная и белая медь кажутся отличными от красной.
Следовательно, металл по своей природе либо тверд, как я уже говорил, либо жидок, как в уникальном случае с ртутью.
Но хватит теперь о простых видах. [82]
Платина, третий драгоценный металл после золота и серебра, была открыта в Эквадоре в период с 1736 по 1744 год испанским астрономом Антонио де Уллоа и его коллегой математиком Хорхе Хуаном-и-Сантасилией. Уллоа был первым человеком, написавшим научное описание металла в 1748 году.
В 1789 году немецкий химик Мартин Генрих Клапрот выделил оксид урана, который, по его мнению, и был самим металлом. Клапрот впоследствии был признан первооткрывателем урана. Лишь в 1841 году французский химик Эжен-Мельхиор Пелиго получил первый образец металлического урана. Анри Беккерель впоследствии открыл радиоактивность в 1896 году, используя уран.
В 1790-х годах Джозеф Пристли и голландский химик Мартинус ван Марум наблюдали влияние металлических поверхностей на дегидрирование спирта, что впоследствии привело в 1831 году к промышленному синтезу серной кислоты с использованием платинового катализатора.
В 1803 году церий был первым из металлов-лантанидов , открытых в Бастнесе, Швеция, Йёнсом Якобом Берцелиусом и Вильгельмом Хизингером, а также независимо Мартином Генрихом Клапротом в Германии. Металлы-лантаниды считались диковинкой до 1960-х годов, когда были разработаны методы более эффективного отделения их друг от друга. Впоследствии они нашли применение в сотовых телефонах, магнитах, лазерах, освещении, батареях, каталитических нейтрализаторах и в других приложениях, обеспечивающих использование современных технологий.
Другими металлами, открытыми и полученными в это время, были кобальт, никель, марганец, молибден, вольфрам и хром; и некоторые металлы платиновой группы , палладий, осмий, иридий и родий.
Легкие металлы
Все элементарные металлы, открытые до 1809 г., имели относительно высокую плотность; их тяжесть рассматривалась как отличительный критерий. Начиная с 1809 года, были выделены легкие металлы, такие как натрий, калий и стронций. Их низкая плотность бросила вызов общепринятым представлениям о природе металлов. Однако химически они вели себя как металлы и впоследствии были признаны таковыми.
Алюминий был открыт в 1824 году, но только в 1886 году был разработан метод промышленного крупномасштабного производства. Цены на алюминий упали, и в 1890-х и начале 20-го века алюминий стал широко использоваться в ювелирных изделиях, предметах повседневного обихода, оправах для очков, оптических инструментах, посуде и фольге. Способность алюминия образовывать твердые, но легкие сплавы с другими металлами в то время обеспечила этому металлу множество применений. Во время Первой мировой войны правительства крупнейших стран требовали больших поставок алюминия для легких и прочных планеров.
Хотя чистый металлический титан (99,9%) был впервые получен в 1910 году, он не использовался за пределами лаборатории до 1932 года. Война. С начала 1950-х годов титан начал использоваться в военной авиации, особенно в высокопроизводительных реактивных самолетах, начиная с таких самолетов, как F-100 Super Sabre и Lockheed A-12 и SR-71 .
Металлический скандий был впервые произведен в 1937 году. Первый фунт металлического скандия чистотой 99% был произведен в 1960 году. Производство алюминиево-скандиевых сплавов началось в 1971 году по патенту США. В СССР также разрабатывались алюминиево-скандиевые сплавы.
- Кусочки натрия
- Калиевые жемчужины под парафиновым маслом. Размер самой крупной жемчужины 0,5 см.
- Кристаллы стронция
- Алюминиевый кусок,
2,6 грамм, 1 х 2 см - Слиток кристаллов титана
- Скандий, в том числе 1 см 3 куб
Эпоха стали

Современная эра в производстве стали началась с внедрением Генри Бессемера в 1855 году бессемеровского процесса , сырьем для которого был чугун. Его метод позволил ему дешево производить сталь в больших количествах, поэтому мягкая сталь стала использоваться для большинства целей, для которых раньше использовалось кованое железо. Процесс Гилкриста-Томаса (или базовый бессемеровский процесс ) представлял собой усовершенствование бессемеровского процесса, основанное на футеровке конвертера основным материалом для удаления фосфора.
Благодаря своей высокой прочности на разрыв и низкой стоимости сталь стала основным компонентом, используемым в зданиях , инфраструктуре , инструментах , кораблях , автомобилях , машинах , приборах и оружии .
В 1872 году англичане Кларк и Вудс запатентовали сплав, который сегодня можно назвать нержавеющей сталью . Коррозионная стойкость железохромовых сплавов была признана в 1821 году французским металлургом Пьером Бертье . Он отметил их устойчивость к воздействию некоторых кислот и предложил использовать их в столовых приборах. Металлурги 19-го века не смогли создать сочетание низкого содержания углерода и высокого содержания хрома, присутствующее в большинстве современных нержавеющих сталей, а сплавы с высоким содержанием хрома, которые они могли производить, были слишком хрупкими, чтобы их можно было использовать на практике. Лишь в 1912 году индустриализация сплавов нержавеющей стали произошла в Англии, Германии и США.
Последние стабильные металлические элементы
три металла с атомными номерами К 1900 году оставалось открыть меньше свинца (#82), самого тяжелого стабильного металла: элементы 71, 72, 75.
Фон Вельсбах в 1906 году доказал, что старый иттербий также содержит новый элемент (№71), который он назвал кассиопеем . Урбен одновременно доказал это, но его образцы были очень загрязнены и содержали лишь следовые количества нового элемента. Несмотря на это, выбранное им имя лютеций было принято.
В 1908 году Огава обнаружил в торианите элемент 75, но присвоил ему элемент 43 вместо 75 и назвал его ниппонием . В 1925 году Уолтер Ноддак, Ида Ева Таке и Отто Берг объявили о его отделении от гадолинита и дали ему нынешнее название — рений .
Жорж Урбен утверждал, что нашел 72-й элемент в остатках редкоземельных элементов, а Владимир Вернадский независимо нашел его в ортите. Ни одно из утверждений не было подтверждено из-за Первой мировой войны, и ни одно из них не могло быть подтверждено позже, поскольку химический состав, о котором они сообщили, не соответствует тому, который сейчас известен для гафния . После войны, в 1922 году, Костер и Хевеши обнаружили его с помощью рентгеновского спектроскопического анализа в норвежском цирконе. Таким образом, гафний был последним открытым стабильным элементом, хотя рений был последним, который был правильно распознан.
- Париж, включая 1 см. 3 куб
- Рений, в том числе 1 см 3 куб
- Гафний, в форме батончика массой 1,7 кг.
К концу Второй мировой войны ученые синтезировали четыре постурановых элемента, все из которых являются радиоактивными (нестабильными) металлами: нептуний (в 1940 г.), плутоний (1940–41 гг.), а также кюрий и америций (1944 г.), представляющие собой элементы 93. до 96. Первые два из них в конечном итоге были обнаружены и в природе. Кюрий и америций были побочными продуктами Манхэттенского проекта, в результате которого в 1945 году была создана первая в мире атомная бомба. Бомба была основана на ядерном делении урана, металла, который, как считается, был открыт почти 150 лет назад.
События после Второй мировой войны
Суперсплавы

Суперсплавы, состоящие из комбинаций Fe, Ni, Co и Cr и меньших количеств W, Mo, Ta, Nb, Ti и Al, были разработаны вскоре после Второй мировой войны для использования в высокопроизводительных двигателях, работающих при повышенных температурах (выше 650 ° C (1200 ° F)). Они сохраняют большую часть своей прочности в этих условиях в течение длительного периода времени и сочетают в себе хорошую пластичность при низких температурах с устойчивостью к коррозии или окислению. Суперсплавы теперь можно найти в широком спектре применений, включая наземные, морские и аэрокосмические турбины, а также химические и нефтяные заводы.
Транкуриевые металлы
Успешная разработка атомной бомбы в конце Второй мировой войны вызвала дальнейшие усилия по синтезу новых элементов, почти все из которых являются или, как ожидается, будут металлами, и все из которых являются радиоактивными. Лишь в 1949 году элемент 97 ( берклий ), следующий после элемента 96 ( кюрий ), был синтезирован путем запуска альфа-частиц в мишень из америция. В 1952 году элемент 100 ( фермий ) был обнаружен в обломках первого взрыва водородной бомбы; водород, неметалл, был идентифицирован как элемент почти 200 лет назад. элементы от 101 ( менделевий ) до 118 ( оганессон С 1952 года синтезированы ).
Объемные металлические очки

Металлическое стекло (также известное как аморфный или стеклообразный металл) представляет собой твердый металлический материал, обычно сплав, с неупорядоченной структурой атомного масштаба. Большинство чистых и легированных металлов в твердом состоянии имеют атомы, расположенные в высокоупорядоченной кристаллической структуре. Напротив, они имеют некристаллическую стеклоподобную структуру. Но в отличие от обычных стекол, например оконных, которые обычно являются электрическими изоляторами, аморфные металлы обладают хорошей электропроводностью. Аморфные металлы производятся несколькими способами, включая чрезвычайно быстрое охлаждение, физическое осаждение из паровой фазы, твердофазную реакцию, ионное облучение и механическое легирование. Первым зарегистрированным металлическим стеклом был сплав (Au 75 Si 25 ), произведенный в Калифорнийском технологическом институте в 1960 году. Совсем недавно были произведены партии аморфной стали, прочность которой в три раза превышает прочность обычных стальных сплавов. В настоящее время наиболее важные приложения основаны на особых магнитных свойствах некоторых ферромагнитных металлических стекол. Низкие потери намагничивания используются в высокоэффективных трансформаторах. В идентификационных бирках для борьбы с кражами и в других схемах наблюдения за предметами часто используются металлические стекла из-за этих магнитных свойств.
Сплавы с памятью формы
Сплав с памятью формы (SMA) — это сплав, который «запоминает» свою первоначальную форму и при деформации возвращается к своей предварительно деформированной форме при нагревании. Хотя эффект памяти формы был впервые обнаружен в 1932 году в сплаве Au-Cd, серьезные исследования начались только в 1962 году, когда этот эффект был случайно обнаружен в сплаве Ni-Ti, и еще за десять лет до начала коммерческого использования. появились приложения. SMA находят применение в робототехнике, автомобильной, аэрокосмической и биомедицинской промышленности. Существует другой тип SMA, называемый ферромагнитным сплавом с памятью формы (FSMA), который меняет форму под действием сильных магнитных полей. Эти материалы представляют интерес, поскольку магнитный отклик имеет тенденцию быть более быстрым и эффективным, чем отклик, вызванный температурой.
Квазикристаллические сплавы

В 1984 году израильский металлург Дэн Шехтман обнаружил алюминиево-марганцевый сплав, имеющий пятикратную симметрию, что нарушило кристаллографическую конвенцию того времени, согласно которой кристаллические структуры могут иметь только двух-, трех-, четырех- или шестикратную симметрию. Из-за сдержанности относительно реакции научного сообщества ему потребовалось два года, чтобы опубликовать результаты, за которые он был удостоен Нобелевской премии по химии в 2011 году. С тех пор были зарегистрированы и подтверждены сотни квазикристаллов. Они существуют во многих металлических сплавах (и некоторых полимерах). Квазикристаллы чаще всего встречаются в алюминиевых сплавах (Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V и др.), но известны также многочисленные другие составы (Cd-Yb, Ti-Zr-Ni, Zn-Mg-Ho, Zn-Mg-Sc, In-Ag-Yb, Pd-U-Si и др.). Квазикристаллы фактически имеют бесконечно большие элементарные ячейки. Икосаэдрит Al 63 Cu 24 Fe 13 , первый квазикристалл, обнаруженный в природе, был обнаружен в 2009 году. Большинство квазикристаллов обладают керамическими свойствами, включая низкую электропроводность (приближающуюся к значениям, наблюдаемым в изоляторах) и низкую теплопроводность, высокую твердость, хрупкость и сопротивление. к коррозии и антипригарным свойствам. Квазикристаллы использовались для разработки теплоизоляции, светодиодов, дизельных двигателей и новых материалов, преобразующих тепло в электричество. Новые применения могут использовать преимущества низкого коэффициента трения и твердости некоторых квазикристаллических материалов, например, внедрение частиц в пластик для изготовления прочных, износостойких пластиковых шестерен с низким коэффициентом трения. Другие потенциальные применения включают селективные поглотители солнечной энергии для преобразования энергии, широковолновые отражатели, а также восстановление костей и протезирование, где требуются биосовместимость, низкое трение и коррозионная стойкость.
Сложные металлические сплавы
Сложные металлические сплавы (CMA) представляют собой интерметаллические соединения, характеризующиеся крупными элементарными ячейками, содержащими от нескольких десятков до тысяч атомов; наличие четко выраженных скоплений атомов (часто с икосаэдрической симметрией); и частичный беспорядок внутри их кристаллических решеток. Они состоят из двух или более металлических элементов, иногда с добавлением металлоидов или халькогенидов . К ним относится, например, NaCd2, имеющий в элементарной ячейке 348 атомов натрия и 768 атомов кадмия. Лайнус Полинг попытался описать структуру NaCd 2 в 1923 году, но ему это не удалось до 1955 года. Интерес к CMA, как их стали называть, который сначала назывался «кристаллами с гигантскими элементарными ячейками», не возобновился до 2002 года, когда публикация доклада «Структурно сложные фазы сплавов», представленного на 8-й Международной конференции по квазикристаллам. Потенциальные применения CMA включают в себя теплоизоляцию; солнечное отопление; магнитные холодильники; использование отработанного тепла для производства электроэнергии; и покрытия для лопаток турбин военных двигателей.
Высокоэнтропийные сплавы
Сплавы с высокой энтропией (ВЭА), такие как AlLiMgScTi, состоят из равных или почти равных количеств пяти или более металлов. По сравнению с обычными сплавами, содержащими только один или два основных металла, HEA имеют значительно лучшее соотношение прочности к весу, более высокую прочность на разрыв и большую устойчивость к разрушению, коррозии и окислению. Хотя HEEA были описаны еще в 1981 году, значительный интерес к ним возник только в 2010-х годах; они продолжают оставаться в центре внимания исследований в области материаловедения и техники из-за их желаемых свойств.
Фаза МАКС.
| МАКС | М | А | Х |
|---|---|---|---|
| Hf 2 SnC | хф | Сн | С |
| Ti4AlNТи4АлН3 | Из | Ал | Н |
| Ти 3 Карбид кремния 2 | Из | И | С |
| Ти 2 АлК | Из | Ал | С |
| Кр 2 AlC 2 | Кр | Ал | С |
| Ti3AlCTi3AlC2 | Из | Ал | С |
В фазе Max M представляет собой ранний переходный металл, A представляет собой элемент группы A (в основном группы IIIA и IVA или группы 13 и 14), а X представляет собой либо углерод, либо азот. Примерами являются Hf 2 SnC и Ti 4 AlN 3 . Такие сплавы обладают высокой электро- и теплопроводностью, термостойкостью, устойчивостью к повреждениям, обрабатываемостью, высокой упругой жесткостью и низкими коэффициентами теплового расширения. [83] Их можно полировать до металлического блеска из-за их превосходной электропроводности. В ходе механических испытаний установлено, что поликристаллические цилиндры Ti 3 SiC 2 могут многократно сжиматься при комнатной температуре до напряжений 1 ГПа и полностью восстанавливаться после снятия нагрузки. Некоторые фазы MAX также обладают высокой устойчивостью к химическому воздействию (например, Ti 3 SiC 2 ) и высокотемпературному окислению на воздухе (Ti 2 AlC, Cr 2 AlC 2 и Ti 3 AlC 2 ). Потенциальные области применения сплавов фазы MAX включают: в качестве прочных, механически обрабатываемых, термостойких огнеупоров; высокотемпературные нагревательные элементы; покрытия для электрических контактов; и детали, устойчивые к нейтронному облучению, для ядерных применений.
См. также
Примечание
- ^ Микроэлементы, содержание которых равно или намного меньше одной части на триллион (а именно Tc , Pm , Po , At , Ra , Ac , Pa , Np и Pu ), не показаны.
- ^ В некоторых случаях, например, при наличии высокоэнергетических гамма-лучей или в очень высокотемпературной среде, богатой водородом , рассматриваемые ядра могут испытывать потерю нейтронов или прирост протонов, что приводит к образованию (сравнительно редких) изотопов с дефицитом нейтронов . [63]
- ^ Выброс вещества при столкновении двух нейтронных звезд объясняется взаимодействием их приливных сил , возможным разрушением земной коры и ударным нагревом (что происходит, если нажать на педаль газа в автомобиле при холодном двигателе). [66]
- ^ Железо, кобальт, никель и олово также являются сидерофилами с точки зрения Земли в целом.
- ^ Еще одна жизненно важная роль железа заключается в том, что он является ключевым компонентом гемоглобина , который обеспечивает транспортировку кислорода из легких в остальную часть тела.
- ^ Бронза — это сплав, состоящий в основном из меди, обычно с содержанием олова около 12% и часто с добавлением других металлов (таких как алюминий, марганец, никель или цинк), а иногда и неметаллов или металлоидов, таких как мышьяк, фосфор или кремний.
- ^ В Дамаске, Сирия, кузнецы ковали ножи и мечи с характерным рисунком поверхности, состоящим из закрученных узоров светлых выгравированных участков на почти черном фоне. Эти лезвия обладали легендарными режущими способностями. Железо, которое использовали кузнецы, было привезено из Индии и содержало один или несколько карбидообразующих элементов, таких как V, Mo, Cr, Mn и Nb. Современный анализ этого оружия показал, что эти элементы поддерживают каталитическое образование углеродных нанотрубок, что, в свою очередь, способствует образованию цементитных (Fe 3 C) нанопроволок. Пластичность углеродных нанотрубок компенсировала хрупкость цементита и наделила полученную сталь уникальным сочетанием прочности и гибкости. Знания о том, как делать то, что впоследствии стали называть булатом, угасли в восемнадцатом веке, возможно, из-за истощения источников руды с правильным сочетанием примесей. Используемые методы не были заново открыты до 2009 года.
- ↑ В древние времена свинец считался отцом всех металлов.
- ^ Парацельс , более поздний немецкий писатель эпохи Возрождения, добавил третий принцип соли, несущей нелетучие и негорючие свойства, в свою tria prima доктрину . Эти теории сохранили четыре классических элемента, лежащих в основе состава серы, ртути и соли.
Ссылки
- ^ Перейти обратно: а б с д Киттель, Чарльз (2018). Введение в физику твердого тела . Пол МакЮэн (глобальное издание, [9-е издание] изд.). Хобокен, Нью-Джерси: Уайли. ISBN 978-1-119-45416-8 .
- ^ Перейти обратно: а б с д и ж г час Эшкрофт, Нил В.; Мермин, Н. Дэвид (1976). Физика твердого тела . Нью-Йорк: Холт, Райнхарт и Уинстон. ISBN 978-0-03-083993-1 .
- ^ Перейти обратно: а б с д Каллистер, Уильям Д. (1997). Материаловедение и инженерия: введение (4-е изд.). Нью-Йорк: Джон Уайли и сыновья. ISBN 978-0-471-13459-6 .
- ^ Чан, СК (1977). «Транспортные и оптические свойства политиазилбромидов: (SNBr 0,4 )x». Твердотельные коммуникации . 23 (9): 607–612. Бибкод : 1977SSCom..23..607C . дои : 10.1016/0038-1098(77)90530-0 . ; Гринвуд, штат Нью-Йорк; Эрншоу, А. (1998). Химия элементов . Оксфорд: Баттерворт-Хайнеманн. п. 727. ИСБН 978-0-7506-3365-9 . ; Мутлу, Х; Теато, П. (2021). «Полимеры со связями сера-азот». В Чжане X; Теато, П. (ред.). Серосодержащие полимеры: от синтеза к функциональным материалам . Вайнхайм: Wiley-VCH. стр. 191–234 (191). ISBN 978-3-527-34670-7 .
- ^ Ёнезава, Ф. (2017). Физика переходов металл-неметалл . Амстердам: IOS Press. п. 257. ИСБН 978-1-61499-786-3 .
Сэр Невилл Мотт (1905–1996) написал письмо своему коллеге-физику, профессору Питеру П. Эдвардсу , в котором отмечает... Я много думал о том, «Что такое металл?» и я думаю, что ответить на этот вопрос можно только при Т = 0 (абсолютный ноль температуры). Там металл проводит, а неметалл нет.
- ^ Мартин, Джон К. «Что мы узнаем из металлического содержания звезды» . Домашняя страница Джона К. Мартина . Проверено 25 марта 2021 г.
- ^ Мартин, Джон К.; Моррисон, Хизер Л. (18 мая 1998 г.) [1998]. «Новый анализ кинематики RR Лиры в окрестностях Солнца» . Астрономический журнал . 116 (4) (опубликовано 1 октября 1998 г.): 1724–1735. arXiv : astro-ph/9806258 . Бибкод : 1998AJ....116.1724M . дои : 10.1086/300568 . S2CID 18530430 — через IOPscience.
- ^ Роу, Дж.; Роу, М. (1992). «В чеканке монет мира используются 24 химических элемента». Мировые новости монетного дела . 19 (4, 5): 24–25, 18–19.
- ^ Перейти обратно: а б с д Стампфл, К.; Маннштадт, В.; Асахи, Р.; Фриман, Эй Джей (2001). «Электронная структура и физические свойства мононитридов ранних переходных металлов: расчеты LDA, GGA и экранированного обмена LDA FLAPW по теории функционала плотности» . Физический обзор B . 63 (15): 155106. Бибкод : 2001PhRvB..63o5106S . дои : 10.1103/PhysRevB.63.155106 .
- ^ Перейти обратно: а б с Мортимер, Чарльз Э. (1975). Химия: концептуальный подход (3-е изд.). Нью-Йорк: Компания Д. Ван Нострада.
- ^ Моллер, П.; Никс, младший (1994). Свойства деления самых тяжелых элементов (PDF) . Симпозиум Dai 2 Kai Hadoron Tataikei no Simposium, Токай-мура, Ибараки, Япония. Университет Северного Техаса . Проверено 16 февраля 2020 г.
- ^ Бенедик, Дж.К. (01.01.2010), Маллик, П.К. (редактор), «3 - Алюминиевые сплавы для легких автомобильных конструкций» , «Материалы, проектирование и производство для легких транспортных средств » , Серия публикаций Woodhead по науке и технике композитов, Woodhead Publishing , стр. 79–113, doi : 10.1533/9781845697822.1.79 , ISBN. 978-1-84569-463-0 , получено 23 июля 2024 г.
- ^ Ли, Шуан-Шуан; Ли, Цин-Юань; Пэн, Хэ-Ли, Бай-Синь; Ян, Хун-Юй; Цю, Фэн; Ци-Чуань (01.11.2023). «Разработка и применение алюминиевых сплавов для аэрокосмической промышленности» . Журнал исследований материалов и технологий . 27 : 944–983. doi : 10.1016/j.jmrt. 2023.09.274 . ISSN 2238-7854
- ^ Гупта, М.; Вонг, WLE (01 июля 2015 г.). «Нанокомпозиты на основе магния: легкие материалы будущего» . Характеристика материалов . 105 : 30–46. дои : 10.1016/j.matchar.2015.04.015 . ISSN 1044-5803 .
- ^ Огава, Юкико; Андо, Дайсуке; Суто, Юджи; Койке, Дзюнъити (22 июля 2016 г.). «Легкий магниевый сплав с памятью формы» . Наука . 353 (6297): 368–370. doi : 10.1126/science.aaf6524 . ISSN 0036-8075 .
- ^ Перейти обратно: а б с Вертман, Йоханнес; Вертман, Джулия Р. (1992). Элементарная теория дислокаций . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-506900-6 .
- ^ Тимошенко, Стивен (1 января 1983 г.). История сопротивления материалов: с кратким изложением истории теории упругости и теории конструкций . Курьерская корпорация. ISBN 978-0-486-61187-7 .
- ^ Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 0-12-352651-5 .
- ^ Костер, Г. (2015). Эпитаксиальный рост сложных оксидов металлов . Бостон, Массачусетс: Эльзевир. ISBN 978-1-78242-245-7 .
- ^ Шифф, Леонард (1959). Квантовая механика (PDF) . МакГроу-Хилл .
- ^ Перейти обратно: а б Солимар, Л.; Уолш, Д. (2004). Электрические свойства материалов (7-е изд.). Оксфорд; Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-926793-4 .
- ^ Хеккер, Зигфрид С. (2000). «Плутоний и его сплавы: от атомов к микроструктуре» (PDF) . Лос-Аламосская наука . 26 : 290–335. Архивировано (PDF) из оригинала 24 февраля 2009 г. Проверено 15 февраля 2009 г.
- ^ Кестер, Д; Чанмугам, Дж. (1990). «Физика звезд белых карликов» . Отчеты о прогрессе в физике . 53 (7): 837–915. дои : 10.1088/0034-4885/53/7/001 . ISSN 0034-4885 .
- ^ Скоскевич, Т. (2005). «Теплопроводность при низких температурах». Энциклопедия физики конденсированного состояния . Эльзевир. стр. 159–164. дои : 10.1016/b0-12-369401-9/01168-2 . ISBN 978-0-12-369401-0 .
- ^ «Нобелевская премия по химии 2000 года» . NobelPrize.org . Проверено 23 июля 2024 г.
- ^ Берк, Кирон (2007). «Азбука ДПФ» (PDF) .
- ^ Гросс, Эберхард КУ; Дрейцлер, Райнер М. (2013). Теория функционала плотности . Springer Science & Business Media. ISBN 978-1-4757-9975-0 .
- ^ Бокрис, Дж. О'М; Редди, Амуля К.Н. (1977). Современная электрохимия. 2 (3-е печатное изд.). Нью-Йорк: Пленум Пр. ISBN 978-0-306-25002-6 .
- ^ Келли, Роберт Г.; Скалли, Джон Р.; Обувьсмит, Дэвид; Бухейт, Рудольф Г. (13 сентября 2002 г.). Электрохимические методы в коррозионной науке и технике (0-е изд.). ЦРК Пресс. дои : 10.1201/9780203909133 . ISBN 978-0-203-90913-3 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Перейти обратно: а б Секерский, С.; Берджесс, Дж. (2002). Краткая химия элементов . Хорвуд. стр. 60–66. ISBN 978-1-898563-71-6 .
- ^ Мьюз, Ян Майкл; Смитс, Одиль Розетт; Джерабек, Пол; Швердтфегер, Питер (25 июля 2019 г.). «Оганессон - полупроводник: о релятивистском сужении запрещенной зоны в самых тяжелых твердых телах благородных газов» . Прикладная химия . 58 (40): 14260–14264. дои : 10.1002/anie.201908327 . ПМК 6790653 . ПМИД 31343819 .
- ^ Лю, Коннектикут; Стиглер, Дж. О. (9 ноября 1984 г.). «Пластичные упорядоченные интерметаллические сплавы» . Наука . 226 (4675): 636–642. дои : 10.1126/science.226.4675.636 . ISSN 0036-8075 .
- ^ Синка, Нурия; Лима, Карлос Роберто Камелло; Гилемани, Хосе Мария (2013). «Обзор исследований и применения интерметаллидов: состояние покрытий, напыляемых термическим способом» . Журнал исследований материалов и технологий . 2 (1): 75–86. дои : 10.1016/j.jmrt.2013.03.013 . ISSN 2238-7854 .
- ^ Джанг, Дж. М.; Ли, HS; Сингх, Дж. К. (17 декабря 2020 г.). «Эффективность электромагнитного экранирования различных металлических покрытий, нанесенных методом дугового термического напыления» . Материалы . 13 (24): 5776. Бибкод : 2020Mate...13.5776J . дои : 10.3390/ma13245776 . ПМЦ 7767199 . ПМИД 33348891 .
- ^ «Обзор программы металлов» (PDF) . arpa-e.energy.gov . Проверено 4 июня 2024 г.
- ^ Рассел, AM; Ли, КЛ (2005). Соотношения структура-свойство в цветных металлах . Хобокен, Нью-Джерси: John Wiley & Sons. пп. пассим. Бибкод : 2005srnm.book.....R . ISBN 978-0-471-64952-6 .
- ^ Введение в дислокации . Эльзевир. 2001. дои : 10.1016/b978-0-7506-4681-9.x5000-7 . ISBN 978-0-7506-4681-9 .
- ^ «Бельмонт Металс – Белые Металлы» . Белмонт Металс . 17 апреля 2019 г. Проверено 8 июля 2024 г.
- ^ Роден, Арабелла (04 ноября 2019 г.). «Более пристальный взгляд на мир белых металлов» . Ювелирный журнал.com . Проверено 8 июля 2024 г.
- ^ Практическое руководство в отношении Закона о клеймении 1973 г. (PDF) . Пробирные палаты Великобритании.
- ^ Металлическое загрязнение . Издания Quae. 2006. ISBN 978-2-7592-0011-5 .
- ^ Тунай, Олкай; Кабдасли, Исик; Арслан-Алатон, Идил; Олмез-Ханчи, Тугба (2010). Применение химического окисления промышленных сточных вод . Издательство ИВА. ISBN 978-1-84339-307-8 .
- ^ Вальтер, Джон В. (2013). Природные ресурсы Земли . Издательство Джонс и Бартлетт. ISBN 978-1-4496-3234-2 .
- ^ Абдул-Рахман, Яхия (2014). Искусство исламского банкинга и финансов в РФ (без риба): инструменты и методы для банковского дела на уровне сообществ . Джон Уайли и сыновья. ISBN 978-1-118-77096-2 .
- ^ Ясуда, Кодзи; Мачак, Ян М.; Бергер, Штеффен; Жиков, Андрей; Шмуки, Патрик (2007). «Механистические аспекты процесса самоорганизации образования оксидных нанотрубок на вентильных металлах» . Журнал Электрохимического общества . 154 (9): C472. дои : 10.1149/1.2749091 .
- ^ ван Хов, Рууд П.; Зиревельт, Ингер Н.; ван Ройен, Баренд Дж.; Нолте, Питер А. (2015). «Титано-нитридное покрытие ортопедических имплантатов: обзор литературы» . БиоМед Исследования Интернэшнл . 2015 : 1–9. дои : 10.1155/2015/485975 . ISSN 2314-6133 . ПМЦ 4637053 . ПМИД 26583113 .
- ^ Сантеккья, Элеонора; Хамуда, AMS; Мушаравати, Фарайи; Залнежад, Эрфан; Кабиббо, Марчелло; Спигарелли, Стефано (2015). «Исследование износостойкости покрытий на основе нитрида титана» . Керамика Интернешнл . 41 (9, Часть А): 10349–10379. doi : 10.1016/j.ceramint.2015.04.152 . ISSN 0272-8842 .
- ^ Мэтьюз, А. (1985). «Технология PVD-покрытия нитридом титана» . Поверхностная инженерия . 1 (2): 93–104. дои : 10.1179/sur.1985.1.2.93 . ISSN 0267-0844 .
- ^ К. Намшир; Разгром, Чандра Секха (2021). «Проводящие полимеры: всесторонний обзор последних достижений в области синтеза, свойств и применений» . РСК Прогресс . 11 (10): 5659–5697. Бибкод : 2021RSCAd..11.5659K . дои : 10.1039/D0RA07800J . ПМЦ 9133880 . ПМИД 35686160 .
- ^ Дас, Тапан К.; Прасти, Смита (2012). «Обзор проводящих полимеров и их применения» . Технология и машиностроение полимерных пластмасс . 51 (14): 1487–1500. дои : 10.1080/03602559.2012.710697 . ISSN 0360-2559 .
- ^ Свагер, Тимоти М. (2017). «Перспектива к 50-летию: проводящие/полупроводниковые сопряженные полимеры. Личный взгляд на прошлое и будущее» . Макромолекулы . 50 (13): 4867–4886. Бибкод : 2017МаМол..50.4867S . doi : 10.1021/acs.macromol.7b00582 . ISSN 0024-9297 .
- ^ Бейгисангчин, Махнуш; Абдул Рашид, Сурая; Шафи, Сухайди; Садролхоссейни, Амир Реза; Лим, Хонг Нги (18 июня 2021 г.). «Приготовление, свойства и применение полианилина и тонких пленок полианилина — обзор» . Полимеры . 13 (12): 2003. doi : 10.3390/polym13122003 . ISSN 2073-4360 . ПМЦ 8234317 . ПМИД 34207392 .
- ^ де Гроот, РА; Мюллер, FM; Энген, ПГ фургон; Бушоу, KHJ (20 июня 1983 г.). «Новый класс материалов: полуметаллические ферромагнетики» . Письма о физических отзывах . 50 (25): 2024–2027. doi : 10.1103/PhysRevLett.50.2024 . ISSN 0031-9007 .
- ^ Коуи, JMD; Венкатесан, М. (15 мая 2002 г.). «Полуметаллический ферромагнетизм: пример CrO2 (приглашен)» . Журнал прикладной физики . 91 (10): 8345–8350. дои : 10.1063/1.1447879 . ISSN 0021-8979 .
- ^ Армитидж, Северная Каролина; Мел, Э.Дж.; Вишванат, Ашвин (22 января 2018 г.). «Полуметаллы Вейля и Дирака в трехмерных твердых телах» . Обзоры современной физики . 90 (1). arXiv : 1705.01111 . дои : 10.1103/RevModPhys.90.015001 . ISSN 0034-6861 .
- ^ Ван, Ян; Н. Мансур; А. Салем; К. Ф. Бреннан и П. П. Руден (1992). «Теоретическое исследование потенциального малошумящего лавинного фотодетектора на полуметаллической основе». Журнал IEEE по квантовой электронике . 28 (2): 507–513. Бибкод : 1992IJQE...28..507W . дои : 10.1109/3.123280 .
- ^ Бубнова, Ольга; Зия, Улла Хан; Ван, Хуэй (2014). «Полуметаллические полимеры» . Природные материалы . 13 (2): 190–4. Бибкод : 2014NatMa..13..190B . дои : 10.1038/nmat3824 . ПМИД 24317188 . S2CID 205409397 .
- ^ Перейти обратно: а б Кокс 1997 , стр. 73–89.
- ^ Кокс 1997 , стр. 32, 63, 85.
- ^ Подосек 2011 , с. 482
- ^ Падманабхан 2001 , с. 234
- ^ Редер 2010 , стр. 32, 33.
- ^ Хофманн 2002 , стр. 23–24.
- ^ Хадхази 2016
- ^ Choptuik, Lehner & Pretorias 2015 , стр. 383
- ^ Кокс 1997 , стр. 83, 91, 102–103.
- ^ «Национальная лаборатория Лос-Аламоса – натрий» . Проверено 8 июня 2007 г.
- ^ «Национальная лаборатория Лос-Аламоса – алюминий» . Проверено 8 июня 2007 г.
- ^ Перейти обратно: а б Уровень переработки металлов: отчет о состоянии, заархивированный 1 января 2016 г. в Wayback Machine 2010, Международная группа ресурсов , Программа Организации Объединенных Наций по окружающей среде.
- ↑ Ступайте осторожно: алюминиевая атака Кэролин Фрай, Guardian.co.uk, 22 февраля 2008 г.
- ^ Запасы металлов в обществе: научный синтез. Архивировано 1 января 2016 г. в Wayback Machine 2010, Международная группа ресурсов , Программа Организации Объединенных Наций по окружающей среде.
- ^ Рирдон, Артур К. (2011). Металлургия для неметаллурга . Парк материалов, Огайо: ASM International. стр. 73–84. ISBN 978-1-61503-845-9 . OCLC 780082219 .
- ^ Тайлекот, РФ (1992). История металлургии, второе издание . Лондон: Maney Publishing, Институт материалов. ISBN 978-1-902653-79-2 . Архивировано из оригинала 02 апреля 2015 г.
- ^ Торнтон, К.; Ламберг-Карловский, CC; Лизерс, М.; Молодой, СММ (2002). «На иголках: прослеживание эволюции легирования на основе меди в Тепе Яхья, Иран, с помощью анализа ICP-MS обычных предметов». Журнал археологической науки . 29 (12): 1451–1460. Бибкод : 2002JArSc..29.1451T . дои : 10.1006/jasc.2002.0809 .
- ^ Кауфман, Бретт. «Металлургия и археологические изменения на древнем Ближнем Востоке». Backdirt: Ежегодный обзор . 2011 : 86.
- ^ Аканума, Х. (2005). «Значение состава раскопанных фрагментов железа, взятых из слоя III на стоянке Каман-Калехойюк, Турция». Анатолийские археологические исследования . 14 . Токио: Японский институт анатолийской археологии: 147–158.
- ^ «Часть железа, обнаруженная в Турции, оказалась древнейшей сталью» . Индус . Ченнаи, Индия. 26 марта 2009 г. Архивировано из оригинала 29 марта 2009 г. Проверено 27 марта 2009 г.
- ^ Габриэль, РА (1990). Культура войны: изобретение и раннее развитие . Вестпорт, Коннектикут: Издательская группа Greenwood. п. 108. ИСБН 978-0-313-26664-5 .
- ^ Кнаут, П. (1976). Кузнецы по металлу, исправленное издание . Лондон: Time-Life International. стр. 133, 137.
- ↑ Опубликовано в The Delineator , сентябрь 1909 г. Перепечатано как введение в книгу «Награды и феи» в 1910 г.
- ^ Георгиус Агрикола, De Re Metallica (1556) Tr. Герберт Кларк Гувер и Лу Генри Гувер (1912); Сноска цитирует De Natura Fossilium (1546), стр. 180
- ^ Ханаор, ДАХ; Ху, Л.; Кан, Вашингтон; Пруст, Г.; Фоли, М.; Караман, И.; Радович, М. (2016). «Производительность при сжатии и распространение трещин в композитах сплав Al/Ti2AlC» . Материаловедение и инженерия: А. 672 : 247–256. arXiv : 1908.08757 . дои : 10.1016/j.msea.2016.06.073 .
Дальнейшее чтение
- Чоптуик М.В. , Ленер Л. и Преторияс Ф. 2015, «Исследование гравитации сильного поля посредством численного моделирования», в книге А. Аштекар , Б.К. Бергер , Дж. Изенберг и М. МакКаллум (редакторы), Общая теория относительности и гравитация: столетняя перспектива , Издательство Кембриджского университета, Кембридж, ISBN 978-1-107-03731-1 .
- Кокс, Пенсильвания (1997). Элементы: их происхождение, распространенность и распространение . Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-855298-7 .
- Crow JM 2016, « Невозможные сплавы: как создавать невиданные ранее металлы », New Scientist, 12 октября.
- Хадхази А. 2016, « Галактический «золотой рудник» объясняет происхождение самых тяжелых элементов природы », Science Spotlights , 10 мая 2016 г., по состоянию на 11 июля 2016 г.
- Хофманн С. 2002, «За гранью урана: путешествие к концу периодической таблицы» , Тейлор и Фрэнсис , Лондон, ISBN 978-0-415-28495-0 .
- Падманабхан Т. 2001, Теоретическая астрофизика , том. 2, Звезды и звездные системы, Издательство Кембриджского университета , Кембридж, ISBN 978-0-521-56241-6 .
- Пэриш Р.В. 1977, Металлические элементы, Лонгман, Лондон, ISBN 978-0-582-44278-8
- Подосек Ф.А. 2011, «Благородные газы», в HD Holland и KK Turekian (редакторы), Изотопная геохимия: Из трактата о геохимии , Elsevier, Амстердам, стр. 467–492, ISBN 978-0-08-096710-3 .
- Раймонд Р. 1984, Из огненной печи: влияние металлов на историю человечества, Macmillan Australia, Мельбурн, ISBN 978-0-333-38024-6
- Редер Д. 2010, Химия в космосе: от межзвездной материи к происхождению жизни , Wiley-VCH, Вайнхайм, ISBN 978-3-527-32689-1 .
- Рассел А.М. и Ли К.Л., 2005 г., Отношения структура-свойство в цветных металлах, John Wiley & Sons, Хобокен, Нью-Джерси, ISBN 978-0-471-64952-6
- Стрит А. и Александр В. 1998, Металлы на службе человека, 11 -е изд., Penguin Books, Лондон, ISBN 978-0-14-025776-2
- Уилсон А.Дж., 1994, Живой камень: история металлов с древнейших времен и их влияние на развивающуюся цивилизацию , Woodhead Publishing, Кембридж, ISBN 978-1-85573-154-7
Внешние ссылки
- Официальный сайт ASM International (ранее Американского общества металлов)
- Официальный сайт Общества минералов, металлов и материалов