Никель
 | ||||||||||||||||||||||||||||||||||||||||||||||
| Никель | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Появление | Блестящий, металлический и серебристый с золотым оттенком | |||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(В) | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Никель в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 28 | |||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 10 | |||||||||||||||||||||||||||||||||||||||||||||
| Период | период 4 | |||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | |||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Ар ] 3d 8 4 с 2 или [Ar]3d 9 4 с 1 | |||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 16, 2 или 2, 8, 17, 1 | |||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | |||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1728 К (1455 °С, 2651 °F) | |||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 3003 К (2730 °С, 4946 °F) | |||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 8,907 г/см 3 [3] | |||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 7,81 г/см 3 | |||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 17,48 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 379 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 26,07 Дж/(моль·К) | |||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| ||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||
| Стадии окисления | −2, −1, 0, +1, [4] +2 , +3, +4 [5] (слабоосновный оксид ) | |||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,91. | |||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 124 вечера | |||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 124±16.00 | |||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 163 вечера | |||||||||||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | ||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | первобытный | |||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) ( cF4 ) | |||||||||||||||||||||||||||||||||||||||||||||
| Постоянная решетки | а = 352,41 вечера (при 20 ° C) [3] | |||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 12.83 × 10 −6 /К (при 20 °С) [3] | |||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 90,9 Вт/(м⋅К) | |||||||||||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 69,3 нОм⋅м (при 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | ферромагнитный | |||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 200 ГПа | |||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 76 ГПа | |||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 180 ГПа | |||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 4900 м/с (при комнатной температуре ) | |||||||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.31 | |||||||||||||||||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 4.0 | |||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 638 МПа | |||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 667–1600 МПа | |||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-02-0 | |||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Аксель Фредрик Кронштедт (1751) | |||||||||||||||||||||||||||||||||||||||||||||
| Изотопы никеля | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Никель — химический элемент ; он имеет символ Ni и атомный номер 28. Это серебристо-белый блестящий металл с легким золотистым оттенком. Никель – твердый и пластичный переходный металл . Чистый никель химически активен, но крупные куски медленно вступают в реакцию с воздухом при стандартных условиях , поскольку пассивирующий слой оксида никеля на поверхности образуется , который предотвращает дальнейшую коррозию. Несмотря на это, чистый самородный никель встречается в земной коре лишь в небольших количествах, обычно в ультраосновных породах . [7] [8] и внутри более крупных никель-железных метеоритов , которые не подвергались воздействию кислорода за пределами атмосферы Земли.
Метеоритный никель встречается в сочетании с железом , что отражает происхождение этих элементов как основных конечных продуктов нуклеосинтеза сверхновых . Считается, что смесь железа и никеля составляет Земли внешнее и внутреннее ядра . [9]
Использование никеля (как природного метеоритного сплава никеля и железа) было прослежено еще в 3500 году до нашей эры. Никель был впервые выделен и классифицирован как элемент в 1751 году Акселем Фредриком Кронстедтом , который первоначально принял руду за медный минерал , в кобальтовых рудниках Лоса, Хельсингланд, Швеция . Название элемента происходит от озорного духа из немецкой шахтерской мифологии Никеля (похожего на Старого Ника ). Никелевые минералы могут быть зелеными, как медные руды, и были известны как купферникель – медь никеля – потому что они не производят меди.
Хотя большая часть никеля в земной коре существует в виде оксидов, экономически более важными никелевыми рудами являются сульфиды, особенно пентландит . Основные места производства включают регион Садбери , Канада (который, как полагают, имеет метеоритное происхождение), Новую Каледонию в Тихом океане , Западную Австралию и Норильск , Россия. [10]
Никель — один из четырех элементов (остальные — железо , кобальт и гадолиний ). [11] которые являются ферромагнитными при температуре около комнатной. Alnico Постоянные магниты , частично основанные на никеле, имеют промежуточную силу между постоянными магнитами на основе железа и редкоземельными магнитами . Металл используется главным образом в сплавах и коррозионностойких покрытиях.
Около 68% мирового производства приходится на нержавеющую сталь . Еще 10% используется для сплавов на основе никеля и меди, 9% для гальванического покрытия, 7% для легированных сталей, 3% в литейном производстве и 4% в других приложениях, например, в перезаряжаемых батареях. [12] в том числе в электромобилях (EV). [13] Никель широко используется в монетах , хотя никелированные предметы иногда вызывают аллергию на никель . Как соединение, никель имеет ряд нишевых применений в химической промышленности, таких как катализатор гидрирования , катоды для аккумуляторных батарей, пигменты и обработка поверхности металлов. [14] Никель является важным питательным веществом для некоторых микроорганизмов и растений, у которых есть ферменты с никелем в качестве активного центра . [15]
Характеристики
Атомные и физические свойства

Никель — серебристо-белый металл с легким золотистым оттенком, который требует полировки. Это один из четырех элементов, которые являются ферромагнитными при комнатной температуре или около нее; остальные — железо, кобальт и гадолиний . Его температура Кюри составляет 355 ° C (671 ° F), что означает, что объемный никель немагнитен при температуре выше этой температуры. [17] [11] Элементарная ячейка никеля представляет собой гранецентрированный куб ; он имеет параметр решетки 0,352 нм, что дает атомный радиус 0,124 нм. Эта кристаллическая структура устойчива к давлению не менее 70 ГПа. Никель тверд, ковок и пластичен и имеет относительно высокую электро- и теплопроводность для переходных металлов. [18] Высокая прочность на сжатие 34 ГПа, предсказанная для идеальных кристаллов, никогда не достигается в реальном объемном материале из-за образования и движения дислокаций . Однако это было достигнуто в наночастицах Ni . [19]
Спор о конфигурации электрона
Никель имеет две атомные электронные конфигурации , [Ar] 3d 8 4 с 2 и [Ar]3d 9 4 с 1 , которые очень близки по энергии; [Ar] обозначает полную структуру ядра аргона . Существуют некоторые разногласия по поводу того, какая конфигурация имеет меньшую энергию. [20] В учебниках химии электронная конфигурация никеля указана как [Ar] 4s. 2 3d 8 , [21] также пишется [Ar] 3d 8 4 с 2 . [22] Эта конфигурация согласуется с правилом энергетического упорядочения Маделунга , которое предсказывает, что 4s заполняется раньше 3d. Это подтверждается экспериментальным фактом, что самым низким энергетическим состоянием атома никеля является 3d 8 4 с 2 энергетический уровень, особенно 3D 8 ( 3 Е) 4с 2 3 F, J = 4 уровень. [23] [24]
Однако каждая из этих двух конфигураций распадается на несколько энергетических уровней из-за тонкой структуры . [23] [24] и два набора энергетических уровней перекрываются. Средняя энергия состояний с [Ar] 3d 9 4 с 1 фактически ниже средней энергии состояний с [Ar] 3d 8 4 с 2 . Поэтому в исследовательской литературе по атомным расчетам конфигурация основного состояния цитируется как [Ar] 3d 9 4 с 1 . [20]
изотопы
изотопов никеля варьируется Атомный вес от 48 u ( 48
Ni ) до 82 u ( 82
В ). [6]
Природный никель состоит из пяти стабильных изотопов . 58
В , 60
В , 61
В , 62
Ни и 64
Ни , из них 58
Ni является наиболее распространенным (68,077% естественного содержания ). [6]
Никель-62 имеет самую высокую энергию связи на нуклон среди всех нуклидов : 8,7946 МэВ/нуклон. [25] [26] Его энергия связи больше, чем у обоих 56
Фе и 58
Fe , более распространенные нуклиды, которые часто ошибочно называют имеющими самую высокую энергию связи. [27] Хотя это, казалось бы, предсказывает, что никель является самым распространенным тяжелым элементом во Вселенной, высокая скорость фотораспада никеля в недрах звезд приводит к тому, что железо является самым распространенным. [27]
Никель-60 — дочерний продукт вымершего радионуклида. 60
Fe (период полураспада 2,6 млн лет). Из-за длительного периода полураспада 60
Fe , его сохранение в материалах Солнечной системы может привести к наблюдаемым изменениям в изотопном составе 60
Ни . Поэтому обилие 60
Ni во внеземном материале может дать представление о происхождении Солнечной системы и ее ранней истории. [28]
не менее 26 радиоизотопов Охарактеризовано никеля; наиболее стабильными являются 59
Ni с периодом полураспада 76 000 лет, 63
Ни (100 лет) и 56
Ни (6 дней). Все остальные радиоизотопы имеют период полураспада менее 60 часов, а у большинства из них период полураспада менее 30 секунд. Этот элемент также имеет одно метасостояние . [6]
Радиоактивный никель-56 производится в процессе сжигания кремния и позже высвобождается в больших количествах в типа Ia сверхновых . Форма кривой блеска этих сверхновых в средние и поздние времена соответствует распаду за счет электронного захвата 56
Ni в кобальт -56 и, в конечном итоге, в железо-56. [29] Никель-59 — долгоживущий космогенный радионуклид ; период полураспада 76 000 лет. 59
Ni нашел множество применений в изотопной геологии . 59
Ni использовался для определения земного возраста метеоритов и для определения содержания внеземной пыли во льду и отложениях . Никель-78 с периодом полураспада 110 миллисекунд считается важным изотопом в нуклеосинтезе сверхновых элементов тяжелее железа. [30] 48 Ni, открытый в 1999 году, является самым богатым из известных изотопов тяжелых элементов. Имея 28 протонов и 20 нейтронов , 48 Ni – это « двойное волшебство », как и 78 Ni с 28 протонами и 50 нейтронами. Поэтому оба они необычайно стабильны для ядер с таким большим протон-нейтронным дисбалансом . [6] [31]
Никель-63 — загрязнитель, обнаруженный в опорных конструкциях ядерных реакторов. Он производится путем захвата нейтронов никелем-62. Небольшие количества были также обнаружены вблизи полигонов ядерного оружия в южной части Тихого океана. [32]
возникновение

Никелевые руды классифицируются как оксиды или сульфиды. К оксидам относятся латериты , где основными минеральными смесями являются никельсодержащий лимонит , (Fe, Ni)O(OH) и гарниерит (смесь различных водного никеля и богатых никелем силикатов). [33] Сульфиды никеля обычно существуют в виде твердых растворов с железом в таких минералах, как пентландит и пирротин с формулами Fe 9-x Ni x S 8 и Fe 7-x Ni x S 6 соответственно. Другими распространенными Ni-содержащими минералами являются миллерит и арсенид- никколит . [34] [35]
Выявленные наземные ресурсы по всему миру со средним содержанием никеля 1% или выше включают не менее 130 миллионов тонн никеля (примерно вдвое больше известных запасов). Около 60% приходится на латериты и 40% на сульфидные месторождения. [36]
Согласно геофизическим данным, большая часть никеля на Земле находится во внешнем и внутреннем ядрах Земли . Камасит и тэнит — это встречающиеся в природе сплавы железа и никеля. Для камасита соотношение сплава обычно составляет от 90:10 до 95:5, хотя примеси (например, кобальт или углерод могут присутствовать ). Тенит содержит от 20% до 65% никеля. Камасит и тэнит встречаются также в железо-никелевых метеоритах . [37]
Никель обычно встречается в железных метеоритах в виде сплавов камасита и тэнита . Никель в метеоритах впервые обнаружил в 1799 году Жозеф-Луи Пруст , французский химик, работавший тогда в Испании. Пруст проанализировал образцы метеорита из Кампо-дель-Сьело (Аргентина), полученные в 1783 году Мигелем Рубином де Селисом, обнаружив в них присутствие никеля (около 10%) наряду с железом. [38]
Соединения
Наиболее распространенная степень окисления никеля +2, но соединения В 0 , В + , и В 3+ хорошо известны, а экзотические степени окисления В 2− и В − были охарактеризованы. [39]
Никель(0)

Никель тетракарбонил (Ni(CO) 4 ), открытый Людвигом Мондом , [40] представляет собой летучую, высокотоксичную жидкость при комнатной температуре. При нагревании комплекс разлагается обратно на никель и окись углерода:
- Ni(CO) 4 ⇌ Ni + 4 CO
Это поведение используется в процессе Монда для очистки никеля, как описано выше. Родственный комплекс никеля (0) бис (циклооктадиен) никель (0) является полезным катализатором в никельорганической химии, поскольку циклооктадиеновые (или тресковые ) лиганды легко замещаются.
Никель(I)

Комплексы никеля (I) встречаются редко, но одним из примеров является тетраэдрический комплекс. NiBr(PPh 3 ) 3 . Многие комплексы никеля (I) имеют связи Ni-Ni, например темно-красный диамагнитный K 4 [Ni 2 (CN) 6 ] получен восстановлением K 2 [Ni 2 (CN) 6 ] с амальгамой натрия . Это соединение окисляется в воде, высвобождая Н 2 . [41]
Считается, что степень окисления никеля(I) важна для никельсодержащих ферментов, таких как [NiFe]-гидрогеназа , которая катализирует обратимое восстановление протонов до Н 2 . [42]
Никель(II)


Никель(II) образует соединения со всеми распространенными анионами, включая сульфид , сульфат , карбонат, гидроксид, карбоксилаты и галогениды. Сульфат никеля (II) производится в больших количествах путем растворения металлического никеля или оксидов в серной кислоте с образованием как гекса-, так и гептагидрата. [43] полезен для гальваники никеля. Обычные соли никеля, такие как хлорид, нитрат и сульфат, растворяются в воде с образованием зеленых растворов аквакомплекса металла. [Ни(Н 2 О) 6 ] 2+ . [44]
Четыре галогенида образуют соединения никеля, которые представляют собой твердые вещества с молекулами с октаэдрическими центрами Ni. Хлорид никеля (II) является наиболее распространенным, и его поведение характерно для других галогенидов. Хлорид никеля(II) получают растворением никеля или его оксида в соляной кислоте . Обычно он встречается в виде зеленого гексагидрата, формула которого обычно записывается NiCl 2 ·6H 2 O . При растворении в воде эта соль образует аквакомплекс металла. [Ни(Н 2 О) 6 ] 2+ . Обезвоживание NiCl 2 ·6H 2 O дает желтый безводный NiCl 2 . [45]
Некоторые тетракоординированные комплексы никеля (II), например бис (трифенилфосфин) хлорид никеля , существуют как в тетраэдрической, так и в плоско-квадратной геометрии. Тетраэдрические комплексы парамагнитны ; плоские квадратные комплексы диамагнитны . Обладая свойствами магнитного равновесия и образования октаэдрических комплексов, они контрастируют с двухвалентными комплексами более тяжелых металлов 10-й группы, палладия (II) и платины (II), которые образуют только плоскоквадратную геометрию. [39]
Никелоцен имеет количество электронов 20. Многие химические реакции никелоцена имеют тенденцию давать 18-электронные продукты. [46]
Никель(III) и (IV)

Известны многие соединения Ni(III). Ni(III) образует простые соли с фторидом. [47] или оксид- ионы. Ni(III) можно стабилизировать σ-донорными лигандами, такими как тиолы и органофосфины . [41]
Ni(III) содержится в гидроксиде оксида никеля , который используется в качестве катода во многих аккумуляторных батареях , включая никель-кадмиевые , никель-железные , никель-водородные и никель-металлогидридные , и используется некоторыми производителями в литий-ионных батареях. . [48]
Ni(IV) остается редкой степенью окисления, и известно очень мало соединений. Ni(IV) встречается в смешанном оксиде BaNiO3 . [49] [50] [51] [52]
История
Непреднамеренное использование никеля можно проследить еще в 3500 году до нашей эры. Было обнаружено, что бронзы из территории современной Сирии содержат до 2% никеля. [53] Некоторые древние китайские рукописи предполагают, что «белая медь» ( мельхиор , известная как байтонг ) использовалась здесь в 1700–1400 годах до нашей эры. Белая медь из Пактонга была экспортирована в Великобританию еще в 17 веке, но содержание никеля в этом сплаве было обнаружено только в 1822 году. [54] Монеты из никель-медного сплава чеканили бактрийские цари Агафокл , Евтидем II и Панталеон во II веке до нашей эры, возможно, из китайского медно-никелевого сплава. [55]

был найден металлический желтый минерал, В средневековой Германии в Рудных горах напоминающий медную руду. Но когда горняки не смогли получить из него медь, они обвинили озорного духа немецкой мифологии Никеля (похожего на Старого Ника ) в том, что он окружил медь. Эту руду они назвали Kupfernickel от немецкого Kupfer «медь». [56] [57] [58] [59] Эта руда теперь известна как минерал никелин (ранее никколит) . [60] никеля ), арсенид . В 1751 году барон Аксель Фредрик Кронстедт попытался извлечь медь из купферникеля на кобальтовой шахте в деревне Лос, Швеция , и вместо этого получил белый металл, который он назвал никелем в честь духа, давшего минералу свое название. [61] В современном немецком языке Kupfernickel или Kupfer-Nickel обозначает сплав медно - никелевого сплава . [18]
Первоначально единственным источником никеля был редкий купферникель. Начиная с 1824 года никель стали получать как побочный продукт производства синего кобальта . Первая крупномасштабная выплавка никеля началась в Норвегии в 1848 году из богатого никелем пирротина . Внедрение никеля в производство стали в 1889 г. увеличило спрос на никель; месторождения никеля в Новой Каледонии , открытые в 1865 году, обеспечивали большую часть мировых запасов в период с 1875 по 1915 год. Открытие крупных месторождений в бассейне Садбери в Канаде в 1883 году, в Норильске -Талнахе в России в 1920 году и в Меренском бассейне Риф в Южной Африке в 1924 году сделал возможным крупномасштабное производство никеля. [54]
Чеканка монет

За исключением вышеупомянутых бактрийских монет, никель не входил в состав монет до середины XIX века. [62]
Канада
Пятицентовые монеты из никеля на 99,9% были отчеканены в Канаде (крупнейшем в мире производителе никеля в то время) в невоенные годы с 1922 по 1981 год; содержание металла делало эти монеты магнитными. [63] Во время войны 1942–1945 годов большая часть или весь никель был удален из монет Канады и США, чтобы сохранить его для изготовления доспехов. [57] Канада использовала 99,9% никеля с 1968 года в своих монетах более высокой стоимости до 2000 года. [64]
Швейцария
Монеты из почти чистого никеля впервые были использованы в 1881 году в Швейцарии. [65]
Великобритания
Бирмингем подделывал никелевые монеты в ок. 1833 г. для торговли в Малайзии. [66]
Соединенные Штаты
В Соединенных Штатах термин «никель» или «никель» первоначально применялся к медно-никелевому центу Flying Eagle , который заменил медь на 12% никеля в 1857–1858 годах, а затем к центу Indian Head из того же сплава с 1859 по 1864 год. Еще позже, в 1865 году, этот термин обозначал трехцентовый никель , при этом содержание никеля увеличилось до 25%. В 1866 году пятицентовый щитовой никель (25% никеля, 75% меди) получил обозначение, которое с тех пор используется для последующих монет номиналом 5 центов. Эта часть сплава не является ферромагнитной .
Никелевая монета США содержит 0,04 унции (1,1 г) никеля, который по цене в апреле 2007 года стоил 6,5 цента, а также 3,75 грамма меди стоимостью около 3 центов, при общей стоимости металла более 9 центов. Поскольку номинальная стоимость никеля составляет 5 центов, это сделало его привлекательной целью для переплавки людьми, желающими продать металл с прибылью. Монетный двор США , предвидя эту практику, 14 декабря 2006 года ввел новые временные правила, подлежащие общественному обсуждению в течение 30 дней, которые установили уголовную ответственность за переплавку и экспорт центов и никелей. [67] Нарушители могут быть наказаны штрафом в размере до 10 000 долларов США и/или лишением свободы на срок до пяти лет. [68] По состоянию на 19 сентября 2013 г. стоимость плавки американского никеля (включая медь и никель) составляет 0,045 доллара США (90% номинальной стоимости). [69]
Текущее использование
В 21 веке высокая цена на никель привела к некоторой замене металла в монетах по всему миру. Монеты, все еще изготавливаемые из никелевых сплавов, включают монеты достоинством в один и два евро достоинством 5, 10, 25, 50 центов и 1 доллар , монеты США . [70] номиналом 20, 50 пенсов, 1 и 2 фунта стерлингов и британские монеты . С 2012 года никелевый сплав, используемый для изготовления монет Великобритании номиналом 5 и 10 пенсов, был заменен никелированной сталью. Это вызвало общественную полемику относительно проблем людей с аллергией на никель . [65]
Мировое производство


По оценкам, во всем мире добывается 3,3 миллиона тонн (т) никеля в год; Индонезия (1 600 000 т), Филиппины (330 000 т), Россия (220 000 т), Новая Каледония ( Франция ) (190 000 т), Австралия (160 000 т) и Канада (130 000 т) являются крупнейшими производителями по состоянию на 2022 год. [72] Крупнейшие месторождения никеля в нероссийской Европе находятся в Финляндии и Греции . Выявленные наземные источники со средним содержанием никеля не менее 1% содержат не менее 130 миллионов тонн никеля. Около 60% приходится на латериты и 40% на сульфидные месторождения. Кроме того, обширные источники никеля обнаружены в глубинах Тихого океана , особенно в районе, называемом зоной Кларион-Клиппертон, в виде полиметаллических конкреций, усеивающих морское дно на глубине 3,5–6 км ниже уровня моря . [73] [74] Эти конкреции состоят из многочисленных редкоземельных металлов и, по оценкам, содержат 1,7% никеля. [75] Благодаря достижениям в области науки и техники в настоящее время вводит правила, , Международный орган по морскому дну гарантирующие, что сбор этих конкреций осуществляется экологически безопасным образом и в соответствии с Организации Объединенных Наций Целями устойчивого развития . [76]
Единственное место в Соединенных Штатах, где прибыльно добывается никель, — это Риддл, штат Орегон , где расположены несколько квадратных миль никельсодержащих поверхностных месторождений гарниерита . Шахта закрылась в 1987 году. [77] [78] Проект рудника Игл Мичигана — это новый никелевый рудник на Верхнем полуострове . Строительство было завершено в 2013 году, а эксплуатация началась в третьем квартале 2014 года. [79] За первый полный год работы рудник «Игл» добыл 18 000 т. [79]
Производство

Никель получают посредством добывающей металлургии : его извлекают из руды обычными процессами обжига и восстановления, в результате которых получается металл с чистотой более 75%. Во многих случаях применения нержавеющей стали можно использовать никель с чистотой 75% без дальнейшей очистки, в зависимости от примесей. [43]
Традиционно большинство сульфидных руд перерабатываются пирометаллургическими методами с получением штейна для дальнейшего рафинирования. гидрометаллургические технологии Используются также . Большинство сульфидных месторождений традиционно перерабатывались путем обогащения посредством процесса пенной флотации с последующей пирометаллургической экстракцией. Никелевый штейн дополнительно обрабатывается процессом Шерритта-Гордона . Сначала медь удаляют добавлением сероводорода , оставляя концентрат кобальта и никеля. Затем экстракцией растворителем отделяют кобальт и никель, при этом конечное содержание никеля превышает 86%. [80]
Второй распространенный процесс рафинирования - это выщелачивание металлического штейна в раствор соли никеля с последующим электролитическим извлечением никеля из раствора путем нанесения его на катод в виде электролитического никеля. [81]
Процесс Монда

Самый чистый металл получают из оксида никеля по процессу Монда , который дает чистоту более 99,99%. Этот процесс был запатентован Людвигом Мондом и использовался в промышленности еще до начала 20 века. [82] В этом процессе никель обрабатывается окисью углерода в присутствии серного катализатора при температуре около 40–80 ° C с образованием карбонила никеля . В аналогичной реакции с железом может образоваться пентакарбонил железа , но эта реакция протекает медленно. При необходимости никель можно отделить перегонкой. Октакарбонил дикобальта также образуется при перегонке никеля в качестве побочного продукта, но при температуре реакции он разлагается до додекакарбонила тетракобальта с образованием нелетучего твердого вещества. [10]
Никель получают из карбонила никеля одним из двух процессов. Его можно пропускать через большую камеру при высоких температурах, в которой постоянно перемешиваются десятки тысяч никелевых сфер (гранул). Карбонил разлагается и откладывает на сферы чистый никель. В альтернативном процессе карбонил никеля разлагается в камере меньшего размера при температуре 230 ° C с образованием мелкодисперсного порошка никеля. Побочный продукт оксид углерода рециркулируется и используется повторно. Продукт из никеля высокой чистоты известен как «карбонильный никель». [83]
Рыночная стоимость
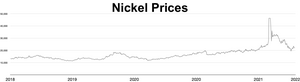
Рыночная цена никеля росла на протяжении 2006 г. и в первые месяцы 2007 г.; по состоянию на 5 апреля 2007 г. [update]металл торговался по цене 52 300 долларов США за тонну или 1,47 доллара США за унцию. [84] Позже цена резко упала; по состоянию на сентябрь 2017 г. [update]Металл торговался по цене $11 000/тонна, или $0,31/унция. [85] Во время российского вторжения в Украину в 2022 году опасения по поводу санкций в отношении экспорта российского никеля спровоцировали короткое сжатие , в результате чего цена на никель выросла в четыре раза всего за два дня, достигнув 100 000 долларов США за тонну. [86] [87] Лондонская биржа металлов аннулировала контракты на сумму $3,9 млрд и приостановила торговлю никелем более чем на неделю. [88] Аналитик Энди Хоум утверждал, что такие ценовые шоки усугубляются требованиями к чистоте, предъявляемыми рынками металлов: только металл класса I (чистота 99,8%) может использоваться в качестве товара на биржах, но большая часть мировых поставок приходится либо на ферроникель, либо на ферроникель. сплавы или более низкой чистоты. [89]
Приложения

В настоящее время глобальное использование никеля составляет 68% в производстве нержавеющей стали, 10% в цветных сплавах , 9% в гальванике , 7% в легированной стали, 3% в литейном производстве и 4% в других отраслях (включая батареи). [12]
Никель используется во многих известных промышленных и потребительских товарах, включая нержавеющую сталь , магниты из алнико , чеканку монет, аккумуляторные батареи (например, никель-железные ), струны электрогитар, микрофонные капсюли, покрытие сантехнических приборов, [90] и специальные сплавы, такие как пермаллой , элинвар и инвар . Используется для гальванического покрытия и в качестве зеленого оттенка в стекле. Никель в основном является легированным металлом, и его основное применение приходится на никелевые стали и никелевые чугуны, в которых он обычно увеличивает прочность на разрыв, ударную вязкость и предел упругости. Он широко используется во многих других сплавах, включая никелевые латуни и бронзы, а также сплавы с медью, хромом, алюминием, свинцом, кобальтом, серебром и золотом ( Инконель , Инколой , Монель , Нимоник ). [81]

Поскольку никель устойчив к коррозии, его иногда использовали вместо декоративного серебра. Никель также иногда использовался в некоторых странах после 1859 года в качестве дешевого металла для чеканки монет (см. выше), но в последние годы 20-го века он был заменен более дешевыми сплавами нержавеющей стали (т.е. железа), за исключением Соединенных Штатов и Канада. [62]
Никель является отличным легирующим агентом для некоторых драгоценных металлов и используется в огневой пробе в качестве коллектора элементов платиновой группы (ЭПГ). Таким образом, никель может полностью собрать все шесть ЭПГ из руд и частично собрать золото. Высокопроизводительные никелевые рудники также могут производить добычу ЭПГ (в основном платины и палладия ); примерами являются Норильск, Россия и бассейн Садбери, Канада. [91]
Пенопласт никеля или никелевая сетка используются в газодиффузионных электродах щелочных топливных элементов . [92] [93]
Никель и его сплавы часто используются в качестве катализаторов реакций гидрирования . Никель Ренея , мелкодисперсный никель-алюминиевый сплав, является одной из распространенных форм, хотя также используются родственные катализаторы, в том числе катализаторы типа Ренея. [94]
Никель по природе своей магнитострикционен: в присутствии магнитного поля материал претерпевает небольшое изменение длины. [95] [96] Магнитострикция никеля составляет порядка 50 частей на миллион и является отрицательной, что указывает на его сжатие. [97]
Никель используется в качестве связующего в промышленности по производству цементированного карбида вольфрама или твердых сплавов и применяется в пропорциях от 6% до 12% по весу. Никель придает карбиду вольфрама магнитность и повышает коррозионную стойкость склеенных деталей, хотя твердость у них меньше, чем у сплавов с кобальтовой связкой. [98]
63
Ni с периодом полураспада 100,1 года полезен в на основе критрона устройствах в качестве эмиттера бета-частиц (высокоскоростных электронов ), чтобы сделать ионизацию с помощью поддерживающего электрода более надежной. [99] Его исследуют в качестве источника питания для бетавольтаических батарей . [100] [101]
Около 27% всего производства никеля используется в машиностроении, 10% в строительстве, 14% в трубной продукции, 20% в производстве металлических изделий, 14% в транспорте, 11% в производстве электронных товаров и 5% в других целях. [12]
Никель Ренея широко используется для гидрогенизации ненасыщенных качестве масел с целью производства маргарина , а некондиционный маргарин и остатки масла могут содержать никель в примеси . Форте и др. обнаружили, что у пациентов с диабетом 2 типа содержание Ni в крови составляет 0,89 нг/мл по сравнению с 0,77 нг/мл у контрольной группы. [102]
Никель-титан представляет собой сплав примерно равных атомных процентов входящих в его состав металлов, который демонстрирует два тесно связанных и уникальных свойства: эффект памяти формы и сверхэластичность .
Биологическая роль
Он не был признан до 1970-х годов, но известно, что никель играет важную роль в биологии некоторых растений, бактерий , архей и грибов . [103] [104] [105] Никелевые ферменты, такие как уреаза, считаются факторами вирулентности у некоторых организмов. [106] [107] Уреаза катализирует гидролиз мочевины с образованием аммиака и карбамата . [104] [103] Гидрогеназы NiFe могут катализировать окисление H 2 с образованием протонов и электронов; а также обратная реакция — восстановление протонов с образованием газообразного водорода. [104] [103] Никель-тетрапиррольный кофермент, кофактор F430 , присутствует в метилкоферменте М- редуктазе, который может катализировать образование метана или обратную реакцию у метаногенных архей (в степени окисления +1). [108] Один из ферментов дегидрогеназы монооксида углерода состоит из кластера Fe -Ni -S . [109] Другие никельсодержащие ферменты включают редкий бактериальный класс супероксиддисмутазы. [110] и ферменты глиоксалаза I у бактерий и некоторых эукариотических трипаносомных паразитов. [111] (у других организмов, в том числе дрожжей и млекопитающих, этот фермент содержит двухвалентный Зн 2+ ). [112] [113] [114] [115] [116]
Диетический никель может влиять на здоровье человека через инфекции, вызванные никель-зависимыми бактериями, но никель также может быть важным питательным веществом для бактерий, живущих в толстом кишечнике, фактически действуя как пребиотик . [117] Институт медицины США не подтвердил, что никель является важным питательным веществом для человека, поэтому не ни рекомендуемая диетическая норма установлены (RDA), ни адекватное потребление. Допустимый верхний уровень потребления никеля с пищей составляет 1 мг/день в виде растворимых солей никеля. Предполагаемое потребление с пищей составляет от 70 до 100 мкг/день; всасывается менее 10%. То, что всасывается, выводится с мочой. [118] Относительно большие количества никеля – сравнимые с указанными выше средними показателями его поступления в организм – попадают в пищу, приготовленную из нержавеющей стали. Например, количество никеля, выщелоченного после 10 циклов приготовления в одну порцию томатного соуса, составляет в среднем 88 мкг. [119] [120]
Предполагается, что никель, высвобождаемый в результате извержений вулканов Сибирских траппов, способствует росту Methanosarcina , рода эвриархеотных архей, производивших метан во время пермско-триасового вымирания , крупнейшего из известных массовых вымираний . [121]
Токсичность
| Опасности | |
|---|---|
| СГС Маркировка : | |
   | |
| Опасность | |
| Х317 , Х351 , Х372 , Х412 | |
| P201 , P202 , P260 , P264 , P270 , P272 , P273 , P280 , P302+P352 , P308+P313 , P333+P313 , P363 , P405 , P501 [122] | |
| NFPA 704 (огненный алмаз) | |
Основным источником воздействия никеля является пероральное употребление, поскольку никель необходим растениям. [123] Типичные фоновые концентрации никеля не превышают 20 нг/м. 3 в воздухе, 100 мг/кг в почве, 10 мг/кг в растительности, 10 мкг/л в пресной воде и 1 мкг/л в морской воде. [124] Концентрации в окружающей среде могут увеличиваться из-за загрязнения окружающей среды человеком . Например, никелированные смесители могут загрязнять воду и почву; горнодобывающая и металлургическая промышленность может сбрасывать никель в сточные воды ; никеля и стали Посуда из сплава и посуда, окрашенная никелем, могут выделять никель в пищу. Воздух может быть загрязнен в результате переработки никелевой руды и сжигания ископаемого топлива . Люди могут поглощать никель непосредственно из табачного дыма и при контакте кожи с ювелирными изделиями, шампунями , моющими средствами и монетами . Менее распространенной формой хронического воздействия является гемодиализ , поскольку следы ионов никеля могут абсорбироваться в плазму в результате хелатирующего действия альбумина . [ нужна ссылка ]
Среднесуточная экспозиция не представляет угрозы для здоровья человека. Большая часть никеля, усваиваемого человеком, выводится почками и выводится из организма с мочой или выводится через желудочно-кишечный тракт, не всасываясь. Никель не является кумулятивным ядом, но большие дозы или хроническое ингаляционное воздействие могут быть токсичными, даже канцерогенными и представлять собой профессиональную опасность . [125]
Соединения никеля отнесены к канцерогенам для человека. [126] [127] [128] [129] на основании повышенного риска рака органов дыхания, наблюдаемого в эпидемиологических исследованиях среди рабочих предприятий по переработке сульфидной руды. [130] Это подтверждается положительными результатами биоанализа NTP с субсульфидом и оксидом Ni на крысах и мышах. [131] [132] Данные о людях и животных неизменно указывают на отсутствие канцерогенности при пероральном пути воздействия и ограничивают канцерогенность соединений никеля в отношении опухолей дыхательных путей после вдыхания. [133] [134] Металлический никель классифицируется как подозреваемый канцероген; [126] [127] [128] существует закономерность в отсутствии повышенного риска рака дыхательных путей у работников, преимущественно подвергающихся воздействию металлического никеля [130] и отсутствие опухолей органов дыхания в исследовании канцерогенности при вдыхании порошка металлического никеля на протяжении всей жизни крыс. [135] В исследованиях ингаляционного воздействия на грызунах различных соединений никеля и металлического никеля наблюдалось усиление воспаления легких с гиперплазией или фиброзом бронхиальных лимфатических узлов или без них. [129] [131] [135] [136] В исследованиях на крысах пероральный прием водорастворимых солей никеля может вызвать перинатальную смертность у беременных животных. [137] Неясно, имеют ли эти последствия отношение к человеку, поскольку эпидемиологические исследования работниц, подвергшихся сильному воздействию, не выявили неблагоприятных последствий токсичности для развития. [138]
Люди могут подвергнуться воздействию никеля на рабочем месте при вдыхании, проглатывании и контакте с кожей или глазами. Управление по охране труда (OSHA) установило законный предел ( допустимый предел воздействия ) для рабочего места на уровне 1 мг/м. 3 за 8-часовой рабочий день, без учета карбонила никеля. Национальный институт охраны труда (NIOSH) устанавливает рекомендуемый предел воздействия (REL) на уровне 0,015 мг/м. 3 за 8-часовой рабочий день. При 10 мг/м 3 Никель непосредственно опасен для жизни и здоровья . [139] Карбонил никеля [Ni(CO) 4 ] — чрезвычайно токсичный газ. Токсичность карбонилов металлов зависит как от токсичности металла, так и от выделения моноксида углерода из карбонильных функциональных групп; Карбонил никеля также взрывоопасен на воздухе. [140] [141]
У чувствительных людей может наблюдаться контактная аллергия на никель, известная как контактный дерматит . Люди с высокой чувствительностью также могут реагировать на продукты с высоким содержанием никеля. [142] Пациенты с помфоликсом также могут быть чувствительны к никелю. Никель является наиболее подтвержденным контактным аллергеном во всем мире, отчасти из-за его использования в украшениях для проколотых ушей . [143] Аллергия на никель, поражающая проколотые уши, часто проявляется зудом и покраснением кожи. Многие серьги сейчас изготавливаются без никеля или с никелем с низким выделением. [144] для решения этой проблемы. Количество, разрешенное в продуктах, контактирующих с кожей человека, теперь регулируется Европейским Союзом . В 2002 году исследователи обнаружили, что никель, выпущенный в монетах номиналом 1 и 2 евро, намного превышает эти стандарты. Считается, что это происходит из-за гальванической реакции. [145] признало никель аллергеном года . В 2008 году Американское общество контактного дерматита [146] В августе 2015 года Американская академия дерматологии приняла заявление о безопасности никеля: «По оценкам, контактный дерматит, включающий сенсибилизацию к никелю, обходится примерно в 1,918 миллиарда долларов и поражает почти 72,29 миллиона человек». [142]
Отчеты показывают, что как индуцированная никелем активация фактора, индуцируемого гипоксией (HIF-1), так и активация генов, индуцируемых гипоксией, вызваны истощением внутриклеточного аскорбата . Добавление аскорбата в культуральную среду увеличивало внутриклеточный уровень аскорбата и обращало вспять индуцированную металлами стабилизацию HIF-1- и HIF-1α-зависимой экспрессии генов. [147] [148]
Никель в популярной культуре
Во второй книге страны Оз, «Чудесная страна Оз» (Л. Фрэнк Баум, опубликованная издательством Reilly & Britton , 1904 г.), Железный Дровосек утверждает, что его оловянное тело никелировано. После этого он очень осторожен, чтобы не допустить, чтобы его никелированное покрытие было поцарапано, надрезано или повреждено. [149]
Ссылки
- ^ «Стандартные атомные массы: никель» . ЦИАВ . 2007.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Пфиррманн, Стефан; Лимберг, Кристиан; Хервиг, Кристиан; Штёсер, Рейнхард; Цимер, Буркхард (2009). «Биядерный комплекс никеля (I) с азотом и его восстановление по одноэлектронным стадиям». Международное издание «Прикладная химия» . 48 (18): 3357–61. дои : 10.1002/anie.200805862 . ПМИД 19322853 .
- ^ Карнс, Мэтью; Буччелла, Даниэла; Чен, Джуди Ю.-К.; Рамирес, Артур П.; Турро, Николас Дж.; Наколлс, Колин; Штайгервальд, Майкл (2009). «Стабильный тетраалкильный комплекс никеля (IV)». Angewandte Chemie, международное издание . 48 (2): 290–4. дои : 10.1002/anie.200804435 . ПМИД 19021174 .
- ^ Jump up to: Перейти обратно: а б с д и Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Энтони, Джон В.; Бидо, Ричард А.; Блад, Кеннет В.; Николс, Монте К., ред. (1990). «Никель» (PDF) . Справочник по минералогии . Том. И. Шантильи, Вирджиния, США: Минералогическое общество Америки. ISBN 978-0962209703 .
- ^ «Никель: информация и данные о минералах никеля» . Mindat.org . Архивировано из оригинала 3 марта 2016 года . Проверено 2 марта 2016 г.
- ^ Стиксруд, Ларс; Васерман, Евгений; Коэн, Рональд (ноябрь 1997 г.). «Состав и температура внутреннего ядра Земли». Журнал геофизических исследований . 102 (Б11): 24729–24740. Бибкод : 1997JGR...10224729S . дои : 10.1029/97JB02125 .
- ^ Jump up to: Перейти обратно: а б Керфут, Дерек Дж.Е. (2005). «Никель». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_157 . ISBN 978-3527306732 .
- ^ Jump up to: Перейти обратно: а б Коуи, JMD; Скумрыев В.; Галлахер, К. (1999). «Редкоземельные металлы: действительно ли гадолиний ферромагнитен?». Природа . 401 (6748): 35–36. Бибкод : 1999Natur.401...35C . дои : 10.1038/43363 . S2CID 4383791 .
- ^ Jump up to: Перейти обратно: а б с «Никель в аккумуляторах» . Никелевский институт . Архивировано из оригинала 21 сентября 2017 года.
- ^ Тредголд, Тим. «Золото горячо, но никель горячее, поскольку спрос на аккумуляторы для электромобилей растет» . Форбс . Проверено 14 октября 2020 г.
- ^ «Соединения никеля» (PDF) . Никелевский институт . Архивировано из оригинала 31 августа 2018 года.
- ^ Малруни, Скотт Б.; Хаузингер, Роберт П. (1 июня 2003 г.). «Поглощение и утилизация никеля микроорганизмами» . Обзоры микробиологии FEMS . 27 (2–3): 239–261. дои : 10.1016/S0168-6445(03)00042-1 . ISSN 0168-6445 . ПМИД 12829270 .
- ^ Сиодзава, Хидэцугу; Брионес-Леон, Антонио; Доманов Олег; Зехнер, Георг; и др. (2015). «Кластеры никеля, встроенные в углеродные нанотрубки, служат высокоэффективными магнитами» . Научные отчеты . 5 : 15033. Бибкод : 2015NatSR...515033S . дои : 10.1038/srep15033 . ПМК 4602218 . ПМИД 26459370 .
- ^ Киттель, Чарльз (1996). Введение в физику твердого тела . Уайли. п. 449. ИСБН 978-0-471-14286-7 .
- ^ Jump up to: Перейти обратно: а б Хаммонд, Чехия; Лиде, ЧР (2018). «Стихии». В Рамбле, Джон Р. (ред.). Справочник CRC по химии и физике (99-е изд.). Бока-Ратон, Флорида: CRC Press . п. 4.22. ISBN 9781138561632 .
- ^ Шарма, А.; Хикман, Дж.; Газит, Н.; Рабкин Э.; Мишин Ю. (2018). «Наночастицы никеля установили новый рекорд прочности» . Природные коммуникации . 9 (1): 4102. Бибкод : 2018NatCo...9.4102S . дои : 10.1038/s41467-018-06575-6 . ПМК 6173750 . ПМИД 30291239 .
- ^ Jump up to: Перейти обратно: а б Шерри, Эрик Р. (2007). Таблица Менделеева: ее история и значение . Издательство Оксфордского университета. стр. 239–240 . ISBN 978-0-19-530573-9 .
- ^ Мисслер, Г.Л. и Тарр, Д.А. (1999) Неорганическая химия , 2-е изд., Прентис-Холл. п. 38. ISBN 0138418918 .
- ^ Петруччи, Р.Х. и др. (2002) Общая химия , 8-е изд., Прентис-Холл. п. 950. ISBN 0130143294 .
- ^ Jump up to: Перейти обратно: а б Корлисс, Чарльз; Шугар, Джек (15 октября 2009 г.). «Энергетические уровни никеля, от Ni I до Ni XXVIII» (PDF) . Журнал физических и химических справочных данных. п. 200 . Проверено 5 марта 2023 г.
В этой таблице Ni I = нейтральный атом Ni, Ni II = Ni+ и т. д.
- ^ Jump up to: Перейти обратно: а б База данных атомного спектра NIST. Архивировано 20 марта 2011 г. в Wayback Machine . Чтобы узнать уровни атомов никеля, введите «Ni 0» или «Ni I» в поле «Спектр» и нажмите «Получить данные».
- ^ Шертлефф, Ричард; Дерринг, Эдвард (1989). «Самые прочно связанные ядра» . Американский журнал физики . 57 (6): 552. Бибкод : 1989AmJPh..57..552S . дои : 10.1119/1.15970 . Архивировано из оригинала 14 мая 2011 года . Проверено 19 ноября 2008 г.
- ^ «Ядерный синтез» . гиперфизика.phy-astr.gsu.edu . Проверено 15 октября 2020 г.
- ^ Jump up to: Перейти обратно: а б Фьюэлл, член парламента (1995). «Атомный нуклид с самой высокой средней энергией связи». Американский журнал физики . 63 (7): 653. Бибкод : 1995AmJPh..63..653F . дои : 10.1119/1.17828 .
- ^ Колдуэлл, Эрик. «Ресурсы по изотопам» . Геологическая служба США . Проверено 20 мая 2022 г.
- ^ Пейгель, Бернард Эфраим Юлиус (1997). «Дальнейшие стадии горения: эволюция массивных звезд» . Нуклеосинтез и химическая эволюция галактик . Издательство Кембриджского университета. стр. 154–160 . ISBN 978-0-521-55958-4 .
- ^ Кастельвекки, Давиде (22 апреля 2005 г.). «Атомные крушители проливают свет на сверхновые и Большой взрыв» . Архивировано из оригинала 23 июля 2012 года . Проверено 19 ноября 2008 г.
- ^ В. П. (23 октября 1999 г.). «Дебютирует дважды магический металл – изотоп никеля» . Новости науки . Архивировано из оригинала 24 мая 2012 года . Проверено 29 сентября 2006 г.
- ^ Карбоно, ML; Адамс, JP (1995). «Никель-63» . Серия отчетов по радионуклидам Национальной программы управления низкоактивными отходами . 10 . дои : 10.2172/31669 .
- ^ Мадд, Гэвин М. (2010). «Глобальные тенденции и экологические проблемы в добыче никеля: сульфиды против латеритов». Обзоры рудной геологии . 38 (1–2). Эльзевир Б.В.: 9–26. Бибкод : 2010ОГРв...38....9М . doi : 10.1016/j.oregeorev.2010.05.003 . ISSN 0169-1368 .
- ↑ Национальный реестр загрязнителей — информационный бюллетень по никелю и соединениям. Архивировано 8 декабря 2011 г., в Wayback Machine . Npi.gov.au. Проверено 9 января 2012 г.
- ^ «Запасы никеля в мире по странам 2020» . Статистика . Проверено 29 марта 2021 г.
- ^ Кук, Питер Х. «Обзоры минеральных сырьевых товаров за 2019 год: никель» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 21 апреля 2019 г. Проверено 18 марта 2019 г.
- ^ Расмуссен, КЛ; Малвин, диджей; Уоссон, Дж. Т. (1988). «Распределение микроэлементов между тэнитом и камаситом - Связь со скоростью остывания железных метеоритов». Метеоритика . 23 (2): а107–112. Бибкод : 1988Metic..23..107R . дои : 10.1111/j.1945-5100.1988.tb00905.x .
- ^ Кальво, Мигель (2019). Построение таблицы Менделеева . Сарагоса, Испания: Прамес. п. 118. ИСБН 978-84-8321-908-9 .
- ^ Jump up to: Перейти обратно: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ «Извлечение никеля из руд методом Монда» . Природа . 59 (1516): 63–64. 1898. Бибкод : 1898Natur..59...63. . дои : 10.1038/059063a0 .
- ^ Jump up to: Перейти обратно: а б с Хаускрофт, CE; Шарп, AG (2008). Неорганическая химия (3-е изд.). Прентис Холл. п. 729. ИСБН 978-0-13-175553-6 .
- ^ Хаускрофт, CE; Шарп, AG (2012). Неорганическая химия (4-е изд.). Прентис Холл. п. 764. ИСБН 978-0273742753 .
- ^ Jump up to: Перейти обратно: а б Ласселлес, Кейт; Морган, Линдси Г.; Николлс, Дэвид и Бейерсманн, Детмар (2019) «Соединения никеля» в Энциклопедии промышленной химии Ульмана . Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a17_235.pub3
- ^ «Обзор металлического комплекса никелевой (Ii) салицилгидроксамовой кислоты и ее анилинового аддукта» . www.heraldopenaccess.us . Проверено 19 июля 2022 г.
- ^ «Металл - Реакция никеля с соляной кислотой» . Обмен стеками химии . Проверено 19 июля 2022 г.
- ^ Мисслер, Гэри Л.; Тарр, Дональд А. (1999). Неорганическая химия (2-е изд.). Прентис-Холл. стр. 456–457. ISBN 0-13-841891-8 .
- ^ Суд, ТЛ; Дав, МИД (1973). «Фторсодержащие соединения никеля(III)». Журнал Химического общества, Dalton Transactions (19): 1995. doi : 10.1039/DT9730001995 .
- ^ «Корпорация Imara представляет новую технологию литий-ионных аккумуляторов для приложений высокой мощности» . Конгресс зеленых автомобилей. 18 декабря 2008. Архивировано из оригинала 22 декабря 2008 года . Проверено 22 января 2009 г.
- ^ Спокойный, Александр Михайлович ; Ли, Тина С.; Фарха, Омар К.; Мачан, Чарльз М.; Она, Чуньсин; Стерн, Шарлотта Л.; Маркс, Тобин Дж.; Хапп, Джозеф Т.; Миркин, Чад А. (28 июня 2010 г.). «Электронная настройка окислительно-восстановительных челноков бис (дикарболлида) на основе никеля в сенсибилизированных красителем солнечных элементах». Энджью. хим. Межд. Эд . 49 (31): 5339–5343. дои : 10.1002/anie.201002181 . ПМИД 20586090 .
- ^ Хоторн, М. Фредерик (1967). «(3)-1,2-дикарболлильные комплексы никеля (III) и никеля (IV)». Журнал Американского химического общества . 89 (2): 470–471. дои : 10.1021/ja00978a065 .
- ^ Камассо, Нью-Мексико; Сэнфорд, Миссисипи (2015). «Проектирование, синтез и реакции сочетания углерод-гетероатом металлорганических комплексов никеля (IV)». Наука . 347 (6227): 1218–20. Бибкод : 2015Sci...347.1218C . CiteSeerX 10.1.1.897.9273 . дои : 10.1126/science.aaa4526 . ПМИД 25766226 . S2CID 206634533 .
- ^ Бауком, Э.И.; Драго, RS (1971). «Комплексы никеля (II) и никеля (IV) диоксима 2,6-диацетилпиридина». Журнал Американского химического общества . 93 (24): 6469–6475. дои : 10.1021/ja00753a022 .
- ^ Розенберг, Сэмюэл Дж. (1968). Никель и его сплавы . Национальное бюро стандартов. Архивировано из оригинала 23 мая 2012 года.
- ^ Jump up to: Перейти обратно: а б Макнил, Ян (1990). «Появление никеля» . Энциклопедия истории техники . Тейлор и Фрэнсис. стр. 96–100 . ISBN 978-0-415-01306-2 .
- ^ Нидхэм, Джозеф ; Ван, Линг; Лу, Гвей-Джен; Цянь, Цуэнь-сюй; Кун, Дитер и Голас, Питер Дж. (1974) Наука и цивилизация в Китае. Архивировано 3 мая 2016 года в Wayback Machine . Издательство Кембриджского университета. ISBN 0-521-08571-3 , стр. 237–250.
- ^ Словарь Чемберса двадцатого века , стр. 888, W&R Chambers Ltd., 1977.
- ^ Jump up to: Перейти обратно: а б Болдуин, WH (1931). «История Никеля. I. Как перехитрили гномов «Старого Ника». Журнал химического образования . 8 (9): 1749. Бибкод : 1931ЖЧЭд...8.1749Б . дои : 10.1021/ed008p1749 .
- ^ Болдуин, WH (1931). «История никеля. II. Никель достигает совершеннолетия». Журнал химического образования . 8 (10): 1954. Бибкод : 1931ЖЧЭд...8.1954Б . дои : 10.1021/ed008p1954 .
- ^ Болдуин, WH (1931). «История никеля. III. Руда, штейн и металл». Журнал химического образования . 8 (12): 2325. Бибкод : 1931ЖЧЭд...8.2325Б . дои : 10.1021/ed008p2325 .
- ^ Флейшер, Майкл и Мандарино, Джоэл. Словарь минеральных видов . Тусон, Аризона: Минералогическая летопись, 7-е изд. 1995.
- ^ Уикс, Мария Эльвира (1932). «Открытие элементов: III. Некоторые металлы восемнадцатого века». Журнал химического образования . 9 (1): 22. Бибкод : 1932ЖЧЭд...9...22Вт . дои : 10.1021/ed009p22 .
- ^ Jump up to: Перейти обратно: а б «Факты о никеле» . Дартмутские токсичные металлы . Проверено 19 февраля 2023 г.
- ^ «Трудолюбивый, выносливый – монета в 5 центов» . Королевский монетный двор Канады. 2008. Архивировано из оригинала 26 января 2009 года . Проверено 10 января 2009 г.
- ^ Маклин, Лианна; Евчук, Лила; Израиль, Дэвид М.; Прендивиль, Джули С. (январь 2011 г.). «Острое начало генерализованной зудящей сыпи у малыша» . Детская дерматология . 28 (1): 53–54. дои : 10.1111/j.1525-1470.2010.01367.x . ПМИД 21276052 . S2CID 207688 . Проверено 13 марта 2023 г.
С 1968 по 1999 год канадские четвертаки и десятицентовые монеты чеканились из 99,9% никеля, а пятицентовые монеты - из 25-99,9% никеля.
- ^ Jump up to: Перейти обратно: а б Лейси, Анна (22 июня 2013 г.). «Плохая копейка? Новые монеты и аллергия на никель» . Проверка здоровья BBC . Архивировано из оригинала 7 августа 2013 года . Проверено 25 июля 2013 г.
- ^ «никелевый двойной герб Утрехта» . nederlandsemunten.nl . Архивировано из оригинала 7 января 2015 года . Проверено 7 января 2015 г.
- ↑ Монетный двор США стремится ограничить экспорт и переплавку монет. Архивировано 27 мая 2016 г., в Wayback Machine , Монетный двор США, пресс-релиз, 14 декабря 2006 г.
- ^ «Запрет на вывоз, переплавку или обработку монет достоинством 5 и 1 цент» . Федеральный реестр . 16 апреля 2007 года . Проверено 28 августа 2021 г.
- ^ «Таблица внутренней стоимости монет, находящихся в обращении США» . Coininflation.com. Архивировано из оригинала 17 июня 2016 года . Проверено 13 сентября 2013 г.
- ^ «Характеристики монет» . usmint.gov . 20 сентября 2016 г. Проверено 13 октября 2021 г.
- ^ Келли, Т.Д.; Матос, Г.Р. «Статистика никеля» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 12 августа 2014 г. Проверено 11 августа 2014 г.
- ^ «Обзоры минеральных сырьевых товаров на 2023 год — никель» (PDF) . Геологическая служба США . Проверено 2 марта 2023 г.
- ^ «Никель» (PDF) . Геологическая служба США, Обзоры полезных ископаемых . Январь 2013 г. Архивировано (PDF) из оригинала 9 мая 2013 г. . Проверено 20 сентября 2013 г.
- ^ Газли, Майкл Ф.; Тэй, Стефи; Олдрич, Шон. «Полиметаллические конкреции» . Исследовательские ворота . Форум полезных ископаемых Новой Зеландии . Проверено 27 января 2021 г.
- ^ Меро, Дж. Л. (1 января 1977 г.). «Глава 11. Экономические аспекты добычи конкреций». Морские месторождения марганца . Серия Elsevier Oceanography. Том. 15. С. 327–355. дои : 10.1016/S0422-9894(08)71025-0 . ISBN 9780444415240 .
- ^ Международный орган по морскому дну. «Стратегический план на 2019-2023 годы» (PDF) . isa.org . Международный орган по морскому дну. Архивировано из оригинала (PDF) 12 апреля 2022 г. Проверено 27 января 2021 г.
- ^ «Проект Никель-Маунтин» (PDF) . Рудный бункер . 15 (10): 59–66. 1953. Архивировано из оригинала (PDF) 12 февраля 2012 года . Проверено 7 мая 2015 г.
- ^ «Писатель окружающей среды: Никель» . Совет национальной безопасности. 2006. Архивировано из оригинала 28 августа 2006 года . Проверено 10 января 2009 г.
- ^ Jump up to: Перейти обратно: а б «Операция и развитие» . Лундинская горнодобывающая корпорация. Архивировано из оригинала 18 ноября 2015 года . Проверено 10 августа 2014 г.
- ^ Ихлас, Зела Танлега; Пурвадария, Сунара (2017). «Экстракционное отделение никеля и кобальта из сульфатного раствора, содержащего железо(II) и магний, с использованием Версатика 10» . 1-я Международная конференция по процессной металлургии . Материалы конференции AIP. 1805 (1): 030003. Бибкод : 2017AIPC.1805c0003I . дои : 10.1063/1.4974414 .
- ^ Jump up to: Перейти обратно: а б Дэвис, Джозеф Р. (2000). «Использование никеля» . Справочник по специальности ASM: никель, кобальт и их сплавы . АСМ Интернешнл. стр. 7–13. ISBN 978-0-87170-685-0 .
- ^ Монд, Л.; Лангер, К.; Квинке, Ф. (1890). «Действие угарного газа на никель» . Журнал Химического общества . 57 : 749–753. дои : 10.1039/CT8905700749 .
- ^ Нейков Олег Дмитриевич; Набойченко Станислав; Гопиенко, Виктор Г и Фришберг, Ирина В (15 января 2009 г.). Справочник по порошкам цветных металлов: технологии и применение . Эльзевир. стр. 371–. ISBN 978-1-85617-422-0 . Архивировано из оригинала 29 мая 2013 года . Проверено 9 января 2012 г.
- ^ «Графики цен на никель на LME» . Лондонская биржа металлов. Архивировано из оригинала 28 февраля 2009 года . Проверено 6 июня 2009 г.
- ^ «Лондонская биржа металлов» . LME.com. Архивировано из оригинала 20 сентября 2017 года.
- ^ Хьюм, Нил; Локетт, Хадсон (8 марта 2022 г.). «LME вводит чрезвычайные меры, поскольку стоимость никеля достигает $100 000 за тонну» . Файнэншл Таймс . Архивировано из оригинала 10 декабря 2022 года . Проверено 8 марта 2022 г.
- ^ Бертон, Марк; Фарчи, Джек; Цанг, Альфред. «LME прекращает торговлю никелем после беспрецедентного скачка на 250%» . Новости Блумберга . Проверено 8 марта 2022 г.
- ^ Фарчи, Джек; Цанг, Альфред; Бертон, Марк (14 марта 2022 г.). «18 минут торгового хаоса, разрушившего рынок никеля» . Новости Блумберга .
- ^ Домой, Энди (10 марта 2022 г.). «Колонка: Никель, дьявольский металл с историей плохого поведения» . Рейтер . Проверено 10 марта 2022 г.
- ^ Американская сантехническая практика: из инженерных отчетов (до 1887 года, «Санитарный инженер»). Избранное переиздание статей, описывающих известные водопроводные сооружения в Соединенных Штатах, а также вопросы и ответы по проблемам, возникающим в водопроводе и канализации домов. С пятьюстами тридцатью шестью иллюстрациями . Инженерная запись. 1896. с. 119 . Проверено 28 мая 2016 г.
- ^ «Элемент Platinum-Group – обзор» . Темы ScienceDirect . Архивировано из оригинала 18 октября 2022 года . Проверено 18 октября 2022 г.
- ^ Хартон, Владислав В. (2011). Электрохимия твердого тела II: электроды, интерфейсы и керамические мембраны . Вайли-ВЧ. стр. 166–. ISBN 978-3-527-32638-9 . Архивировано из оригинала 10 сентября 2015 года . Проверено 27 июня 2015 г.
- ^ Бидо, Ф.; Бретт, DJL; Миддлтон, штат Пенсильвания; Брэндон, Н.П. «Новая конструкция катода для щелочных топливных элементов (AFC)» (PDF) . Имперский колледж Лондона. Архивировано из оригинала (PDF) 20 июля 2011 года.
- ^ Такер, С. Хорвуд (сентябрь 1950 г.). «Каталитическое гидрирование с использованием никеля Ренея» . Журнал химического образования . 27 (9): 489. Бибкод : 1950ЖЧЭд..27..489Т . дои : 10.1021/ed027p489 . Проверено 21 апреля 2023 г.
- ^ Обзор магнитострикционных материалов . Калифорнийский университет, Лос-Анджелес .
- ^ Ангара, Рагхавендра (2009). Высокочастотная система возбуждения магнитного поля высокой амплитуды для магнитострикционных приводов . Издательство диссертации Уми. п. 5. ISBN 9781109187533 .
- ^ Софрони, Михаэла; Толеа, Мугурель; Попеску, Богдан; Энкулеску, Моника; Толеа, Фелиция (7 сентября 2021 г.). «Магнитные и магнитострикционные свойства быстрозакаленных лент Ni50Mn20Ga27Cu3» . Материалы . 14 (18): 5126. Бибкод : 2021Mate...14.5126S . дои : 10.3390/ma14185126 . ISSN 1996-1944 гг . ПМЦ 8471753 . ПМИД 34576350 .
- ^ Чебураева, РФ; Чапорова И.Н.; Красина, Т.И. (1992). «Структура и свойства твердосплавов карбида вольфрама с легированной никелевой связкой». Советская порошковая металлургия и металлокерамика . 31 (5): 423–425. дои : 10.1007/BF00796252 . S2CID 135714029 .
- ^ «Крайтронные импульсные лампы переключения мощности» . Кремниевые исследования. 2011. Архивировано из оригинала 16 июля 2011 года.
- ^ Хм, ЮР; и др. (июнь 2016 г.). «Исследование бетавольтаической батареи с использованием гальванического покрытия никеля-63 на никелевой фольге в качестве источника питания» . Ядерная инженерия и технологии . 48 (3): 773–777. дои : 10.1016/j.net.2016.01.010 .
- ^ Бормашов В.С.; и др. (апрель 2018 г.). «Прототип ядерной батареи высокой плотности на основе алмазных диодов Шоттки» . Алмаз и родственные материалы . 84 : 41–47. Бибкод : 2018DRM....84...41B . дои : 10.1016/j.diamond.2018.03.006 .
- ^ Хан, Абдул Рехман; Аван, раввин Фазли (8 января 2014 г.). «Металлы в патогенезе сахарного диабета 2 типа» . Журнал диабета и метаболических нарушений . 13 (1): 16. дои : 10.1186/2251-6581-13-16 . ПМЦ 3916582 . ПМИД 24401367 .
- ^ Jump up to: Перейти обратно: а б с Астрид Сигел; Хельмут Сигель; Роланд К.О. Сигел, ред. (2008). Никель и его удивительное влияние на природу . Ионы металлов в науках о жизни. Том. 2. Уайли. ISBN 978-0-470-01671-8 .
- ^ Jump up to: Перейти обратно: а б с Сидор, Эндрю; Замбл, Дебора (2013). «Металломика никеля: общие темы, определяющие гомеостаз никеля». В Банки, Люсия (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Дордрехт: Спрингер. стр. 375–416. дои : 10.1007/978-94-007-5561-1_11 . ISBN 978-94-007-5561-1 . ПМИД 23595678 .
- ^ Замбл, Дебора ; Ровиньска-Жирек, Магдалена; Козловский, Генрик (2017). Биологическая химия никеля . Королевское химическое общество. ISBN 978-1-78262-498-1 .
- ^ Коваччи, Антонелло; Телфорд, Джон Л.; Джудиче, Джузеппе Дель; Парсонне, Джули ; Раппуоли, Рино (21 мая 1999 г.). « Вирулентность Helicobacter pylori и генетическая география». Наука . 284 (5418): 1328–1333. Бибкод : 1999Sci...284.1328C . дои : 10.1126/science.284.5418.1328 . ПМИД 10334982 . S2CID 10376008 .
- ^ Кокс, Гэри М.; Мукерджи, Джин; Коул, Гарри Т.; Касадеваль, Артуро; Прекрасно, Джон Р. (1 февраля 2000 г.). «Уреаза как фактор вирулентности при экспериментальном криптококкозе» . Инфекция и иммунитет . 68 (2): 443–448. дои : 10.1128/IAI.68.2.443-448.2000 . ПМК 97161 . ПМИД 10639402 .
- ^ Стивен В., Рэгдейл (2014). «Биохимия метилкофермента М-редуктазы: никелевый металлофермент, который катализирует заключительный этап синтеза и первый этап анаэробного окисления метана парникового газа». У Питера М.Х. Кронека; Марта Э. Соса Торрес (ред.). Металлозависимая биогеохимия газообразных соединений в окружающей среде . Ионы металлов в науках о жизни. Том. 14. Спрингер. стр. 125–145. дои : 10.1007/978-94-017-9269-1_6 . ISBN 978-94-017-9268-4 . ПМИД 25416393 .
- ^ Ван, Винсент К.-К.; Рэгсдейл, Стивен В.; Армстронг, Фрейзер А. (2014). «Исследование эффективных электрокаталитических взаимопревращений диоксида углерода и оксида углерода никельсодержащими дегидрогеназами моноксида углерода». У Питера М.Х. Кронека; Марта Э. Соса Торрес (ред.). Металлозависимая биогеохимия газообразных соединений в окружающей среде . Ионы металлов в науках о жизни. Том. 14. Спрингер. стр. 71–97. дои : 10.1007/978-94-017-9269-1_4 . ISBN 978-94-017-9268-4 . ПМК 4261625 . ПМИД 25416391 .
- ^ Силадьи, РК; Брингельсон, Пенсильвания; Марони, MJ; Хедман, Б.; и др. (2004). «Рентгеновское абсорбционно-спектроскопическое исследование S K-Edge активного центра Ni-содержащей супероксиддисмутазы: новый структурный взгляд на механизм». Журнал Американского химического общества . 126 (10): 3018–3019. дои : 10.1021/ja039106v . ПМИД 15012109 .
- ^ Грейг Н; Уилли С; Викерс Т.Дж.; Фэрламб А.Х. (2006). «Трипанотион-зависимая глиоксалаза I в Trypanosoma cruzi» . Биохимический журнал . 400 (2): 217–23. дои : 10.1042/BJ20060882 . ПМЦ 1652828 . ПМИД 16958620 .
- ^ Аронссон АС; Мармстол Е; Маннервик Б (1978). «Глиоксалаза I, металлофермент цинка млекопитающих и дрожжей». Связь с биохимическими и биофизическими исследованиями . 81 (4): 1235–1240. дои : 10.1016/0006-291X(78)91268-8 . ПМИД 352355 .
- ^ Риддерстрем М; Маннервик Б (1996). «Оптимизированная гетерологичная экспрессия человеческого фермента цинка глиоксалазы I» . Биохимический журнал . 314 (Часть 2): 463–467. дои : 10.1042/bj3140463 . ПМК 1217073 . ПМИД 8670058 .
- ^ Сен-Жан АП; Филлипс КР; Крейтон диджей; Стоун MJ (1998). «Активные мономерные и димерные формы глиоксалазы I Pseudomonas putida: доказательства трехмерной замены доменов». Биохимия . 37 (29): 10345–10353. дои : 10.1021/bi980868q . ПМИД 9671502 .
- ^ Торнелли, Пи Джей (2003). «Глиоксалаза I - структура, функция и решающая роль в ферментативной защите от гликирования» . Труды Биохимического общества . 31 (Часть 6): 1343–1348. дои : 10.1042/BST0311343 . ПМИД 14641060 .
- ^ Вандер Ягт Д.Л. (1989). «Неизвестное название главы». В Д Дельфин; Р. Поулсон; О Аврамович (ред.). Коферменты и кофакторы VIII: Глутатион, часть А. Нью-Йорк: Джон Уайли и сыновья.
- ^ Замбелли, Барбара; Чюрли, Стефано (2013). «Никель и здоровье человека». В Астрид Сигел; Хельмут Сигель; Роланд К.О. Сигел (ред.). Взаимосвязь между ионами незаменимых металлов и заболеваниями человека . Ионы металлов в науках о жизни. Том. 13. Спрингер. стр. 321–357. дои : 10.1007/978-94-007-7500-8_10 . ISBN 978-94-007-7499-5 . ПМИД 24470096 .
- ^ Никель. IN: Справочная норма потребления витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и меди. Архивировано 22 сентября 2017 г. в Wayback Machine . Национальная Академия Пресс. 2001, ПП. 521–529.
- ^ Камеруд К.Л.; Хобби КА; Андерсон К.А. (28 августа 2013 г.). «Нержавеющая сталь выделяет никель и хром в продукты во время приготовления» . Журнал сельскохозяйственной и пищевой химии . 61 (39): 9495–501. дои : 10.1021/jf402400v . ПМЦ 4284091 . ПМИД 23984718 .
- ^ Флинт Г.Н.; Пакирисами С (1997). «Чистота еды, приготовленной в посуде из нержавеющей стали». Пищевые добавки и загрязнители . 14 (2): 115–26. дои : 10.1080/02652039709374506 . ПМИД 9102344 .
- ^ Ширбер, Майкл (27 июля 2014 г.). «Инновации микробов, возможно, положили начало крупнейшему вымиранию на Земле» . Space.com . Журнал астробиологии. Архивировано из оригинала 29 июля 2014 года . Проверено 29 июля 2014 г.
.... Этот скачок уровня никеля позволил резкому росту выбросов метаногенов.
- ^ «Никель 203904» . Сигма Олдрич. Архивировано из оригинала 26 января 2020 года . Проверено 26 января 2020 г.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ Хабер, Линн Т; Бейтс, Хадсон К.; Аллен, Брюс С; Винсент, Мелисса Дж; Оллер, Адриана Р. (2017). «Вычисление эталонного значения пероральной токсичности никеля» . Нормативная токсикология и фармакология . 87 : С1–С18. дои : 10.1016/j.yrtph.2017.03.011 . ПМИД 28300623 .
- ^ Риувертс, Джон (2015). Элементы загрязнения окружающей среды . Лондон и Нью-Йорк: Earthscan Routledge. п. 255. ИСБН 978-0-415-85919-6 . OCLC 886492996 .
- ^ Буттиче, Клаудио (2015). «Соединения никеля». В Кольдице, Грэм А. (ред.). Энциклопедия рака и общества SAGE (второе изд.). Таузенд-Оукс: SAGE Publications, Inc., стр. 828–831. ISBN 9781483345734 .
- ^ Jump up to: Перейти обратно: а б МАИР (2012). «Никель и соединения никеля». Архивировано 20 сентября 2017 г. в Wayback Machine в IARC Monogr Eval Carcinog Risks Hum . Объем 100С. стр. 169–218.
- ^ Jump up to: Перейти обратно: а б Регламент (ЕС) № 1272/2008 Европейского парламента и Совета от 16 декабря 2008 г. о классификации, маркировке и упаковке веществ и смесей, вносящий поправки и отменяющий Директивы 67/548/EEC и 1999/45/EC и вносящий поправки в Регламент ( ЕС) № 1907/2006 [ОЖ L 353, 31.12.2008, с. 1]. Приложение VI. Архивировано 14 марта 2019 г. в Wayback Machine . По состоянию на 13 июля 2017 г.
- ^ Jump up to: Перейти обратно: а б Согласованная на глобальном уровне система классификации и маркировки химических веществ (СГС). Архивировано 29 августа 2017 г. в Wayback Machine , 5-е изд., Организация Объединенных Наций, Нью-Йорк и Женева, 2013 г.
- ^ Jump up to: Перейти обратно: а б Национальная программа токсикологии. (2016). «Отчет о канцерогенах». Архивировано 20 сентября 2017 г. в Wayback Machine , 14-е изд. Research Triangle Park, Северная Каролина: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения.
- ^ Jump up to: Перейти обратно: а б «Отчет Международного комитета по никелевому канцерогенезу у человека» . Скандинавский журнал труда, окружающей среды и здоровья . 16 (1 номер спецификации): 1–82. 1990. doi : 10.5271/sjweh.1813 . JSTOR 40965957 . ПМИД 2185539 .
- ^ Jump up to: Перейти обратно: а б Национальная программа токсикологии (1996). «Исследования токсикологии и канцерогенеза NTP субсульфида никеля (№ CAS 12035-72-2) у крыс F344 и мышей B6C3F1 (исследования при вдыхании)». Серия технических отчетов Национальной программы токсикологии . 453 : 1–365. ПМИД 12594522 .
- ^ Национальная программа токсикологии (1996). «Исследования токсикологии и канцерогенеза NTP оксида никеля (№ CAS 1313-99-1) у крыс F344 и мышей B6C3F1 (исследования при вдыхании)». Серия технических отчетов Национальной программы токсикологии . 451 : 1–381. ПМИД 12594524 .
- ^ Коглиано, В.Дж.; Баан, Р; Стрейф, К; Гросс, Ю; Лауби-Секретан, Б; Эль Гиссасси, Ф; Бувар, В; Бенбрахим-Таллаа, Л; Гуха, Н; Фриман, К; Галичет, Л; Уайлд, CP (2011). «Предотвратимые воздействия, связанные с раком человека» . Журнал JNCI Национального института рака . 103 (24): 1827–39. дои : 10.1093/jnci/djr483 . ПМЦ 3243677 . ПМИД 22158127 .
- ^ Хайм, К.Э; Бейтс, Гонконг; Раш, Р.Э.; Оллер, AR (2007). «Исследование пероральной канцерогенности гексагидрата сульфата никеля на крысах Фишера 344». Токсикология и прикладная фармакология . 224 (2): 126–37. дои : 10.1016/j.taap.2007.06.024 . ПМИД 17692353 .
- ^ Jump up to: Перейти обратно: а б Оллер, А.Р.; Киркпатрик, Д.Т.; Радовский, А; Бейтс, Гонконг (2008). «Исследование канцерогенности при вдыхании порошка металлического никеля на крысах Вистар». Токсикология и прикладная фармакология . 233 (2): 262–75. дои : 10.1016/j.taap.2008.08.017 . ПМИД 18822311 .
- ^ Национальная программа токсикологии (1996). «Исследования токсикологии и канцерогенеза NTP гексагидрата сульфата никеля (номер CAS 10101-97-0) на крысах F344 и мышах B6C3F1 (исследования при вдыхании)». Серия технических отчетов Национальной программы токсикологии . 454 : 1–380. ПМИД 12587012 .
- ^ Springborn Laboratories Inc. (2000). «Исследование репродуктивной токсичности двух поколений при пероральном приеме (через желудочный зонд) на крысах Спрэг-Доули с использованием гексагидрата сульфата никеля». Заключительный отчет. Springborn Laboratories Inc., Спенсервилл. Исследование SLI № 3472.4.
- ^ Вактшельд, А; Талыкова Л. В.; Чащин В.П.; Одланд, Дж.О.; Нибоер, Э (2008). «Воздействие никеля на мать и врожденные дефекты опорно-двигательного аппарата». Американский журнал промышленной медицины . 51 (11): 825–33. дои : 10.1002/ajim.20609 . ПМИД 18655106 .
- ^ «Карманный справочник NIOSH по химическим опасностям – металлический никель и другие соединения (например, Ni)» . CDC . Архивировано из оригинала 18 июля 2017 года . Проверено 20 ноября 2015 г.
- ^ Стеллман, Жанна Магер (1998). Энциклопедия охраны труда и техники безопасности: Химическая промышленность, отрасли и профессии . Международная организация труда. стр. 133–. ISBN 978-92-2-109816-4 . Архивировано из оригинала 29 мая 2013 года . Проверено 9 января 2012 г.
- ^ Барселу, Дональд Г.; Барселу, Дональд (1999). «Никель». Клиническая токсикология . 37 (2): 239–258. дои : 10.1081/CLT-100102423 . ПМИД 10382559 .
- ^ Jump up to: Перейти обратно: а б Заявление о позиции по чувствительности к никелю. Архивировано 8 сентября 2015 г. в Wayback Machine . Американская академия дерматологии (22 августа 2015 г.)
- ^ Тиссен Дж.П.; Линнеберг А.; Менне Т.; Йохансен Дж.Д. (2007). «Эпидемиология контактной аллергии среди населения в целом – распространенность и основные выводы» . Контактный дерматит . 57 (5): 287–99. дои : 10.1111/j.1600-0536.2007.01220.x . ПМИД 17937743 . S2CID 44890665 .
- ^ Воздействие на кожу: никелевые сплавы. Архивировано 22 февраля 2016 г., в Ассоциации экологических исследований производителей никеля Wayback Machine (NiPERA), по состоянию на 11 февраля 2016 г.
- ^ Нестле, О.; Шпайдел, Х.; Спайдел, Миссури (2002). «Выделение высокого содержания никеля из монет номиналом 1 и 2 евро» . Природа . 419 (6903): 132. Бибкод : 2002Natur.419..132N . дои : 10.1038/419132а . ПМИД 12226655 . S2CID 52866209 .
- ^ Доу, Ли (3 июня 2008 г.). «Никель назван контактным аллергеном 2008 года» . Информация об аллергии на никель . Архивировано из оригинала 3 февраля 2009 года.
- ^ Сальников, к.; Дональд, СП; Бруик, РК; Житкович А.; и др. (сентябрь 2004 г.). «Истощение внутриклеточного аскорбата канцерогенными металлами никелем и кобальтом приводит к индукции гипоксического стресса» . Журнал биологической химии . 279 (39): 40337–44. дои : 10.1074/jbc.M403057200 . ПМИД 15271983 .
- ^ Дас, К.К.; Дас, С.Н.; Дхундаси, Ю.А. (2008). «Никель, его вредное воздействие на здоровье и окислительный стресс» (PDF) . Индийский журнал медицинских исследований . 128 (4): 117–131. ПМИД 19106437 . Архивировано из оригинала (PDF) 10 апреля 2009 г. Проверено 22 августа 2011 г.
- ^ Чудесная страна Оз, Л. Фрэнк Баум. Глава: «Никелированный император», с. 121 и последующие
Внешние ссылки
- Никелевое видео из серии «Периодические видео» (Ноттингемский университет)
- Запись о никеле (последний пересмотр 30 октября 2019 г.) в Карманном справочнике NIOSH по химическим опасностям , опубликованном CDC . Национальным институтом безопасности и гигиены труда
- Токсикологический профиль никеля (проект для общественного обсуждения) (PDF) (август 2023 г.) - 422-страничный отчет Министерства здравоохранения и социальных служб США , Службы общественного здравоохранения, Агентства по регистрации токсичных веществ и заболеваний.
- Металл, который принес вам дешевые авиабилеты , BBC News (2015)


