NiFe гидрогеназа
[NiFe] гидрогеназа — это тип гидрогеназы , который представляет собой окислительный фермент , который обратимо превращает молекулярный водород в прокариотах , включая бактерии и археи . [1] [2] Каталитический центр фермента обеспечивает простым микроорганизмам, метаболизирующим водород, окислительно-восстановительный механизм, с помощью которого можно хранить и использовать энергию посредством реакции.
Это особенно важно для анаэробных сульфатредуцирующих бактерий рода Desulfovibrio. [3] [4] а также патогенные микроорганизмы Escherichia coli и Helicobacter pylori . [2] Механизмы, созревание и функции гидрогеназ [NiFe] активно исследуются на предмет применения в водородной экономике и в качестве потенциальных мишеней для антибиотиков.
Структура
[ редактировать ]
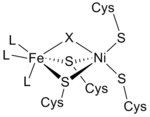
Структура [NiFe]-гидрогеназы была получена в результате рентгеноструктурного исследования пяти различных сульфатредуцирующих бактерий: Desulfovibrio vulgaris Miyazaki F, [6] Д. Гигас , [7] Д.фрусоворанс , [8] [9] Д. десульфуриканс, [10] и Desulfomicrobium baculatum . [11] [NiFe]-гидрогеназа, выделенная из D. vulgaris Справа показана Miyazaki F. Более крупная субъединица выделена синим цветом, имеет молекулярную массу 62,5 кДа и содержит активный центр Ni-Fe . Меньшая субъединица окрашена в пурпурный цвет, имеет молекулярную массу 28,8 кДа и содержит кластеры Fe-S .
По данным инфракрасных спектров и рентгеновской кристаллографии активным центром гидрогеназы [NiFe] было обнаружено (S-Cys) 4 Ni(μ-X)Fe(CO)(CN) 2 , в котором родовой лиганд X представляет собой либо оксид , сера , гидропероксид или гидроксид , встречающийся только в окисленном состоянии. [12] В то время как атом никеля участвует в окислительно-восстановительных реакциях, атом железа постоянно находится в степени окисления Fe(II). [12] Точная геометрия трех небелковых лигандов (обозначенных как L), координирующих ион Fe, не известна; однако они были идентифицированы как одна молекула монооксида углерода (C≡O) и две молекулы цианида ( − C≡N) молекулы. [13]
Кластеры Fe-S
[ редактировать ]Почти все гидрогеназы содержат по крайней мере один железо-серный кластер (кластер Fe-S). Как упоминалось ранее, эти кластеры Fe-S соединяют активный центр никеля фермента с поверхностью белка, поскольку они служат цепью переноса электронов от редокс-сайта Ni-Fe к акцептору электронов цитохрому с 3 (см. цитохромов с) семейство . ). [13] Эти электроны образуются в результате гетеролитического расщепления молекулы водорода в активном центре Ni-Fe. Кристаллические структуры гидрогеназы демонстрируют Fe 3 S 4 в центре цепи и кластер Fe 4 S 4 на поверхности молекулы. Расстояние между внутренним кластером Fe 4 S 4 и активным центром составляет примерно 12 Å. [13]
Гидрогеназы [NiFe] и [NiFeSe] имеют удивительно схожую структуру, что позволяет предположить, что одна сера в кластере Fe-S была заменена атомом селена , но эти гидрогеназы различаются каталитической реакционной способностью и чувствительностью к ингибиторам ферментов . [4]

Ион Mg и пути протонов
[ редактировать ][NiFe] гидрогеназа имеет Mg 2+ катион связан в С-концевой области более крупной субъединицы. Этот катион связан с тремя молекулами воды и тремя аминокислотами и стабилизирует эту область, свободную от растворителя. На расстоянии примерно 13 Å от фрагмента [NiFe] этот катион соединяет активный центр с сетью водородных связей и служит протоном (H + ) путь передачи. [13]
Канал доступа газа
[ редактировать ]Исследования, в которых ксенон был связан с гидрогеназой, предполагают гидрофобный газовый канал, через который газы H 2 , CO и O 2 могут достигать глубоко скрытого активного центра внутри фермента. Кристаллическая структура выявила несколько небольших каналов на поверхности, которые объединились в один более крупный канал, достигающий активного центра [Ni-Fe]. [13]
Поскольку хорошо известно, что гидрогеназы чувствительны к кислороду , диффузия газа к активному центру зависит от размера и окружения канала доступа газа, реакции молекулярного кислорода (O 2 ) в активном центре и восстановления активный центр после окисления. [13]
Механизм
[ редактировать ]Точный механизм реакции гидрогеназ [NiFe] вызывает большие споры. В 2009 году Хигучи и его коллеги предложили механизм, основанный на рентгеновской кристаллографии и спектроскопических данных Desulfovibrio vulgaris Miyazaki F. [13] В ходе каталитического процесса ион Fe в активном центре не меняет свою степень окисления , тогда как ион металлического Ni участвует в окислительно-восстановительной химии. Существует две основные группы окислительно-восстановительных состояний, через которые проходят гидрогеназы [NiFe] во время катализа:
- Неактивные окислительно-восстановительные состояния и
- Активные окислительно-восстановительные состояния.
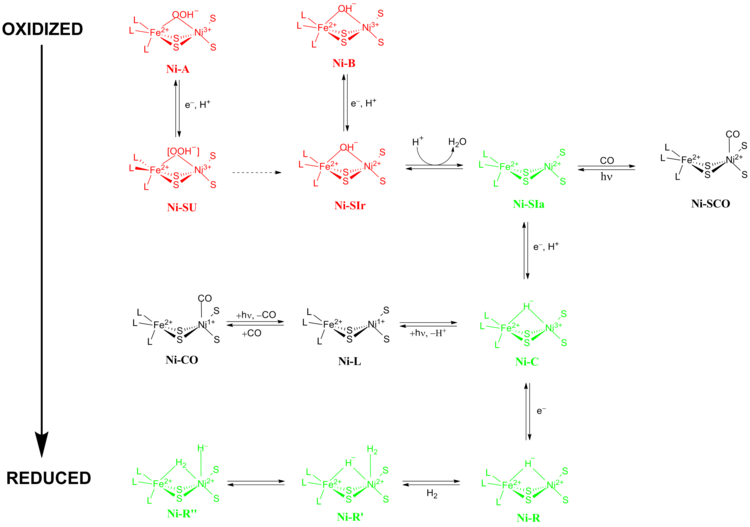
Неактивные окислительно-восстановительные состояния
[ редактировать ]Ni-A («неготовое» состояние) и Ni-B («готовое» состояние) являются наиболее окисленными формами металлоцентра [NiFe] и активируются путем одноэлектронного восстановления с переносом протона. Скорость восстановительной активации Ni-A в Ni-SU может занять несколько часов, тогда как скорость восстановительной активации Ni-B в Ni-SIr происходит за секунды. [14] Было предложено , что причина этого несоответствия в кинетике активации между Ni-A и Ni-B является результатом разницы в мостиковых лигандах между двумя разными окислительно-восстановительными состояниями. В состоянии Ni-SIr молекула воды высвобождалась с образованием состояния Ni-SIa , первого каталитического окислительно-восстановительного активного состояния гидрогеназ [NiFe].
Активные окислительно-восстановительные состояния
[ редактировать ]Тремя наиболее важными каталитически активными окислительно-восстановительными состояниями гидрогеназ [NiFe] являются Ni-SIa , Ni-C и Ni-R (которые имеют три различных варианта). [13] Светочувствительное состояние Ni-C можно получить путем одноэлектронного восстановления Ni-SIa . электронного парамагнитного резонанса Спектроскопические исследования состояния Ni-C , содержащего Ni 3+ с S = 1/2 и гидридом, соединяющим два металла, Ni и Fe, показали, что гетеролитическое расщепление H 2 происходит в активном центре гидрогеназы [NiFe].
СО-ингибированные состояния
[ редактировать ]Состояние Ni-SIa может ингибироваться CO, который напрямую связывается с ионом металла Ni в изогнутой конформации с образованием Ni-SCO (см. Ниже). [15] Поскольку Ni-C светочувствителен, освещение при температуре 100 К приводит к Ni-L окислительно-восстановительному состоянию . В ходе этого процесса никель восстанавливается. В присутствии CO Ni-L образует состояние Ni-CO .
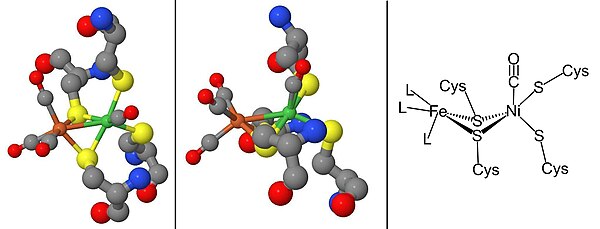
Созревание и генетическое расположение
[ редактировать ]Для созревания гидрогеназ [NiFe] необходим набор дополнительных белков, которые синтезируют активный центр NiFe и модифицируют фермент-предшественник, чтобы он имел правильную структуру и расположение. [2] [16] [17] Созревание активного центра представляет особый интерес из-за синтеза металлических лигандов цианида (CN) и монооксида углерода (CO), которые обычно токсичны для живого организма. [16] Этот этап завершают белки HypC, HypD, HypE и HypF. [17] [18] После синтеза железного центра никель внедряется с помощью металлошаперонов HypA, HypB и SlyD. [17] [18] Как только каталитический центр завершен, предшественник гидрогеназы подвергается С-концевому расщеплению, что вызывает перестройку его структуры и ассоциацию с малой субъединицей. [16] [17] [18] Наконец, готовый фермент транспортируется в правильное положение внутри клетки. [16] [17] [18] Промотор гидрогеназы, PSH , можно изучить, создав PSH промотора и gfp слияние с использованием зеленого флуоресцентного белка ( gfp) репортерного гена . [19]
Приложение
[ редактировать ]Поскольку [NiFe] гидрогеназа является членом семейства гидрогеназ , эти ферменты могут катализировать как потребление, так и производство водорода. [1] Изучая [NiFe] гидрогеназу, ученые могут оптимизировать условия, при которых белок будет производить только водород. небольшой фермент, имитирующий Кроме того, также можно синтезировать [NiFe] гидрогеназу, который будет действовать как генератор газообразного водорода. Растворимая гидрогеназа [NiFe] из Ralstonia eutrofa H16 является многообещающим ферментом-кандидатом для применения в биотопливе на основе H 2 , поскольку она способствует окислению H 2 и относительно толерантна к кислороду. Его можно производить на гетеротрофных питательных средах. [20] и очищали с помощью анионообменной и эксклюзионной хроматографии . матриц [21]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Джагдер, Бат-Эрдэне; Уэлч, Джеффри; Аге-Зинсу, Кондо-Франсуа; Маркиз, Кристофер П. (14 мая 2013 г.). «Основы и электрохимические применения гидрогеназ, поглощающих [Ni – Fe]». РСК Прогресс . 3 (22): 8142. дои : 10.1039/c3ra22668a . ISSN 2046-2069 .
- ^ Jump up to: а б с Винье, Полетт М.; Биллоуд, Бернар (октябрь 2007 г.). «Происхождение, классификация и биологическая функция гидрогеназ: обзор». Химические обзоры . 107 (10): 4206–4272. дои : 10.1021/cr050196r . ПМИД 17927159 .
- ^ Волбеда, А.; Гарсин, Э.; Пирас, К.; де Лейси, Алабама; Фернандес, ВМ; Хачикян, ЕС; Фрей, М.; Фонтесилья-Кампс, JC (1996). «Структура активного сайта [NiFe] гидрогеназы: свидетельства существования биологически необычных лигандов Fe». Дж. Ам. хим. Соц . 118 (51): 12989–12996. дои : 10.1021/ja962270g .
- ^ Jump up to: а б Эйдснесс, МК; Скотт, РА; Прикрил, Британская Колумбия; ДерВартанян, Д.В.; Легалл, Дж.; Моура, И.; Моура, Джей-Джей; Пек, HD (1989). «Доказательства координации селеноцистеина с никелем в активном центре в гидрогеназах [NiFeSe] Desulfovibrio baculatus» . Труды Национальной академии наук . 86 (1): 147–151. дои : 10.1073/pnas.86.1.147 . ПМК 286421 . ПМИД 2521386 .
- ^ Jump up to: а б с Jmol: Java-просмотрщик химических структур в 3D с открытым исходным кодом. http://www.jmol.org/
- ^ Хигучи, Ю.; Яги, Т.; Ясуока, Н. (1997). «Необычная структура лиганда в активном центре Ni-Fe и дополнительный сайт Mg в гидрогеназе, выявленные с помощью рентгеноструктурного анализа высокого разрешения» . Структура . 5 (12): 1671–1680. дои : 10.1016/s0969-2126(97)00313-4 . ПМИД 9438867 .
- ^ Волбеда, А.; Харон, М.-Х.; Пирас, К.; Хачикян, ЕС; Фрей, М.; Фонтесилья-Кампс, JC (1995). «Кристаллическая структура никель-железогидрогеназы Desulfovibrio gigas». Природа . 373 (6515): 580–587. дои : 10.1038/373580a0 . ПМИД 7854413 . S2CID 4335445 .
- ^ Волбеда, А.; Мартин, Л.; Кавацца, К.; Мато, М.; Фабер, Б.В.; Роузбум, В.; Альбрахт, SPJ; Гарсин, Э.; Руссе, М.; Фонтекилла-Кампс, JC (2005). «Структурные различия между готовыми и неготовыми окисленными состояниями гидрогеназ [NiFe]». Журнал биологической неорганической химии . 10 (3): 239–249. дои : 10.1007/s00775-005-0632-x . ПМИД 15803334 . S2CID 25953517 .
- ^ Монте, Ю.; Амара, П.; Волбеда, А.; Вернеде, X.; Хачикян Э.К.; Филд, MJ; Фрей, М.; Фонтесилла-Кампс, JC (1997). «Доступ газа к активному центру гидрогеназ Ni-Fe, исследованный методами рентгеновской кристаллографии и молекулярной динамики». Структурная и молекулярная биология природы . 4 (7): 523–526. дои : 10.1038/nsb0797-523 . ПМИД 9228943 . S2CID 19356968 .
- ^ Матиас, премьер-министр; Соареш, СМ; Сарайва, LM; Коэльо, Р.; Мораис, Дж.; Ле Галль, Дж.; Каррондо, Массачусетс (2001). «[NiFe] гидрогеназа из Desulfovibrio desulfuricans ATCC 27774: секвенирование гена, определение и уточнение трехмерной структуры при 1,8 Å и моделирование исследований ее взаимодействия с тетрагемовым цитохромом с3». Журнал биологической неорганической химии . 6 (1): 63–81. дои : 10.1007/s007750000167 . ПМИД 11191224 . S2CID 9661059 .
- ^ Гарсин, Э.; Вернеде, X.; Хачикян, ЕС; Волбеда, А.; Фрей, М.; Фонтесилла-Кампс, JC (1999). «Кристаллическая структура восстановленной гидрогеназы [NiFeSe] дает представление об активированном каталитическом центре» . Структура . 7 (5): 557–566. дои : 10.1016/s0969-2126(99)80072-0 . ПМИД 10378275 .
- ^ Jump up to: а б Чиу, Т.-В.; Лиав, В.-Ф. (2008). «Никель-тиолатные и железо-тиолатные цианокарбонильные комплексы: моделирование сайтов никеля и железа гидрогеназы [NiFe]». Comptes Rendus Chimie . 11 (8): 818–833. дои : 10.1016/j.crci.2008.04.003 .
- ^ Jump up to: а б с д и ж г час я Огата, Х.; Любиц, В.; Хигучи, Ю. (2009). «[NiFe] гидрогеназы: структурные и спектроскопические исследования механизма реакции». Далтон Транс . 37 (37): 7577–7587. дои : 10.1039/b903840j . ПМИД 19759926 .
- ^ Ламеле, ЮВ; Альбрахт, SPJ; Армстронг, ФА (2004). «Поэтапные исследования электрохимического потенциала аэробных взаимопревращений [NiFe]-гидрогеназы из Allochromatium vinosum: понимание загадочной разницы между неготовыми и готовыми окисленными неактивными состояниями». Журнал Американского химического общества . 126 (45): 14899–14909. дои : 10.1021/ja047939v . ПМИД 15535717 .
- ^ Огата, Х.; Мидзогучи, Ю.; Мизуно, Н.; Мики, К.; Адачи, С.-и.; Ясуока, Н.; Яги, Т.; Ямаути, О.; Хирота, С.; Хигучи, Ю. (2002). «Структурные исследования комплекса монооксида углерода [NiFe] гидрогеназы из Desulfovibrio vulgaris Miyazaki F: предложение относительно места начальной активации дигидрогена». Журнал Американского химического общества . 124 (39): 11628–11635. дои : 10.1021/ja012645k . ПМИД 12296727 .
- ^ Jump up to: а б с д Любиц, Вольфганг ; Огата, Хидеаки; Рюдигер, Олаф; Рейджерс, Эдвард (23 апреля 2014 г.). «Гидрогеназы» . Химические обзоры . 114 (8): 4081–4148. дои : 10.1021/cr4005814 . ПМИД 24655035 .
- ^ Jump up to: а б с д и Лакасс, Майкл Дж.; Замбл, Дебора Б. (29 марта 2016 г.). «[NiFe]-Созревание гидрогеназы». Биохимия . 55 (12): 1689–1701. doi : 10.1021/acs.biochem.5b01328 . ПМИД 26919691 .
- ^ Jump up to: а б с д Питерс, Джон В.; Шут, Геррит Дж.; Бойд, Эрик С.; Малдер, Дэвид В.; Шепард, Эрик М.; Бродерик, Джоан Б.; Кинг, Пол В.; Адамс, Майкл WW (июнь 2015 г.). «Разнообразие, механизм и созревание [FeFe]- и [NiFe]-гидрогеназ» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1853 (6): 1350–1369. дои : 10.1016/j.bbamcr.2014.11.021 . ПМИД 25461840 .
- ^ Джагдер, Бат-Эрдэне; Уэлч, Джеффри; Брейди, Нэди; Маркиз, Кристофер П. (26 июля 2016 г.). «Создание и использование растворимого промотора гидрогеназы (PSH) Cupriavidus necatorH16, слитого с togfp (зеленый флуоресцентный белок)» . ПерДж . 4 : е2269. дои : 10.7717/peerj.2269 . ISSN 2167-8359 . ПМЦ 4974937 . ПМИД 27547572 .
- ^ Джагдер, Бат-Эрдэне; Чен, Чжилян; Пинг, Даррен Тан Тек; Лебхар, Хелен; Уэлч, Джеффри; Маркиз, Кристофер П. (25 марта 2015 г.). «Анализ изменений растворимой гидрогеназы и глобальной экспрессии генов у Cupriavidus necator (Ralstonia eutrofa) H16, выращенного в гетеротрофной диауксической периодической культуре» . Заводы по производству микробных клеток . 14 (1): 42. дои : 10.1186/s12934-015-0226-4 . ISSN 1475-2859 . ПМК 4377017 . ПМИД 25880663 .
- ^ Джагдер, Бат-Эрдэне; Лебхар, Хелен; Аге-Зинсу, Кондо-Франсуа; Маркиз, Кристофер П. (01 января 2016 г.). «Производство и очистка растворимой гидрогеназы из Ralstonia eutrofa H16 для потенциального применения водородных топливных элементов» . МетодыX . 3 : 242–250. дои : 10.1016/j.mex.2016.03.005 . ПМЦ 4816682 . ПМИД 27077052 .
