Зеленый флуоресцентный белок
| Зеленый флуоресцентный белок | |||
|---|---|---|---|
 Структура зеленого флуоресцентного белка Aequorea victoria . [1] | |||
| Идентификаторы | |||
| Символ | GFP | ||
| Пфам | PF01353 | ||
| Пфам Клан | CL0069 | ||
| ИнтерПро | ИПР011584 | ||
| КАТ | 1ема | ||
| СКОП2 | 1ema / SCOPe / СУПФАМ | ||
| |||
| Зеленый флуоресцентный белок | |||
|---|---|---|---|
| Идентификаторы | |||
| Организм | |||
| Символ | GFP | ||
| ЮниПрот | P42212 | ||
| |||
Зеленый флуоресцентный белок ( GFP ) представляет собой белок , который проявляет зеленую флуоресценцию при воздействии света в диапазоне от синего до ультрафиолетового . [2] [3] Метка GFP традиционно относится к белку, впервые выделенному из медузы Aequorea victoria , и иногда его называют avGFP . Однако GFP были обнаружены и у других организмов, включая кораллы , морские анемоны , зоанитиды , копеподы и ланцетники . [4]
GFP A. victoria имеет основной пик возбуждения при длине волны 395 нм и второстепенный пик при 475 нм. Пик его излучения находится на длине волны 509 нм, что находится в нижней зеленой части видимого спектра . флуоресценции Квантовый выход (QY) GFP составляет 0,79. GFP морской анютины глазки ( Renilla reniformis ) имеет один основной пик возбуждения при 498 нм. GFP является отличным инструментом во многих формах биологии благодаря своей способности образовывать внутренний хромофор, не требуя каких-либо дополнительных кофакторов , генных продуктов или ферментов / субстратов, кроме молекулярного кислорода. [5]
В клеточной и молекулярной биологии GFP ген часто используется в качестве репортера экспрессии . [6] Его использовали в модифицированных формах для изготовления биосенсоров , и было создано множество животных, которые экспрессируют GFP, что демонстрирует доказательство концепции того, что ген может экспрессироваться в данном организме, в выбранных органах или в представляющих интерес клетках. GFP можно вводить животным или другим видам с помощью трансгенных методов и сохранять в их геноме и геноме их потомства. На сегодняшний день GFP экспрессируется у многих видов, включая бактерии, дрожжи, грибы, рыбы и млекопитающие, в том числе в клетках человека. 10 октября 2008 года ученые Роджер Ю. Цянь , Осаму Симомура и Мартин Чалфи были удостоены Нобелевской премии по химии 2008 года за открытие и разработку зеленого флуоресцентного белка.
Большинство коммерчески доступных генов GFP и подобных флуоресцентных белков имеют длину около 730 пар оснований. Натуральный белок содержит 238 аминокислот. Его молекулярная масса составляет 27 кД. [7] Следовательно, слияние гена GFP с геном интересующего белка может значительно увеличить размер и молекулярную массу белка, а также может нарушить естественную функцию белка или изменить его местоположение или траекторию транспорта внутри клетки. [8]
Предыстория [ править ]


GFP дикого типа (wtGFP) [ править ]
В 1960-х и 1970-х годах GFP вместе с отдельным люминесцентным белком экворином ( ферментом , катализирующим расщепление люциферина , выделяющим свет), был впервые выделен из медузы Aequorea victoria и его свойства изучены Осаму Шимомура . [9] У A. victoria флуоресценция GFP возникает при экворина взаимодействии с Ca. 2+ ионы, вызывающие голубое свечение. Часть этой люминесцентной энергии передается GFP, сдвигая общий цвет в сторону зеленого. [10] Однако его полезность как инструмента для молекулярных биологов начала осознаваться только в 1992 году, когда Дуглас Прашер сообщил о клонировании и нуклеотидной последовательности wtGFP в Gene . [11] Финансирование этого проекта закончилось, поэтому Прашер отправил образцы кДНК в несколько лабораторий. Лаборатория Мартина Чалфи экспрессировала кодирующую последовательность wtGFP с удаленными первыми несколькими аминокислотами в гетерологичных клетках E. coli и C. elegans , опубликовав результаты в журнале Science в 1994 году. [12] Лаборатория Фредерика Цудзи независимо сообщила об экспрессии рекомбинантного белка месяц спустя. [13] Примечательно, что молекула GFP сворачивалась и флуоресцировала при комнатной температуре без необходимости использования экзогенных кофакторов, специфичных для медуз. Хотя этот почти wtGFP был флуоресцентным, он имел несколько недостатков, в том числе двухпиковые спектры возбуждения, чувствительность к pH, чувствительность к хлоридам, плохой квантовый выход флуоресценции, плохую фотостабильность и плохую укладку при 37 ° C (99 ° F).
Первым сообщением о кристаллической структуре GFP была структура мутанта S65T, опубликованная группой Remington в журнале Science в 1996 году. [14] Месяц спустя группа Филлипса независимо сообщила о структуре GFP дикого типа в журнале Nature Biotechnology . [15] Эти кристаллические структуры обеспечили жизненно важную основу для формирования хромофора и взаимодействия соседних остатков. Исследователи модифицировали эти остатки путем направленного и случайного мутагенеза, чтобы получить широкий спектр производных GFP, используемых сегодня. Дальнейшие исследования GFP показали, что он устойчив к детергентам, протеазам, обработке гуанидинийхлоридом (GdmCl) и резким изменениям температуры. [16]
Производные GFP [ править ]

Из-за возможности широкого использования и растущих потребностей исследователей было создано множество различных мутантов GFP. [17] [18] Первым значительным улучшением стала точечная мутация (S65T), о которой в 1995 году сообщил в журнале Nature Роджер Цянь . [19] Эта мутация резко улучшила спектральные характеристики GFP, что привело к увеличению флуоресценции, фотостабильности и смещению основного пика возбуждения до 488 нм при сохранении пика эмиссии при 509 нм. Это соответствовало спектральным характеристикам общедоступных наборов фильтров FITC , что повышало практичность использования исследователем общего профиля. Точечный мутант этого каркаса с эффективностью сворачивания при 37 ° C (F64L), дающий улучшенный GFP (EGFP), был обнаружен в 1995 году лабораториями Таструпа. [20] и Фальков. [21] EGFP позволил практическое использование GFP в клетках млекопитающих. EGFP имеет коэффициент затухания (обозначенный ε) 55 000 M. −1 см −1 . [22] флуоресценции Квантовый выход (QY) EGFP составляет 0,60. Относительная яркость, выраженная как ε•QY, составляет 33 000 M. −1 см −1 .
В 2006 году сообщалось о суперфолдере GFP (sfGFP), серии мутаций, которые позволяют GFP быстро сворачиваться и созревать даже при слиянии с плохо сворачивающимися пептидами. [23]
Было сделано множество других мутаций, включая цветные мутанты; в частности, синий флуоресцентный белок (EBFP, EBFP2, Azurite, mKalama1), голубой флуоресцентный белок (ECFP, Cerulean, CyPet, mTurquoise2) и желтого флуоресцентного белка производные (YFP, Citrine, Venus, YPet). Производные BFP (кроме mKalama1) содержат замену Y66H. Они демонстрируют широкую полосу поглощения в ультрафиолете с центром около 380 нанометров и максимум излучения при 448 нанометрах. Был разработан мутант зеленого флуоресцентного белка (BFPms1), который преимущественно связывает Zn(II) и Cu(II). BFPms1 имеет несколько важных мутаций, включая хромофор BFP (Y66H), Y145F для более высокого квантового выхода, H148G для создания отверстия в бета-цилиндре и несколько других мутаций, которые увеличивают растворимость. Связывание Zn(II) увеличивает интенсивность флуоресценции, а связывание Cu(II) тушит флуоресценцию и смещает максимум поглощения с 379 до 444 нм. Следовательно, их можно использовать в качестве биосенсора Zn. [24]

Связывание хромофора. Критической мутацией в производных циана является замена Y66W, которая приводит к образованию хромофора с индольным, а не фенольным компонентом. Требуется несколько дополнительных компенсаторных мутаций в окружающем стволе, чтобы восстановить яркость этого модифицированного хромофора из-за увеличения объема индольной группы. У ECFP и Cerulean N-концевая половина седьмой цепи имеет две конформации. Обе эти конформации имеют сложный набор ван-дер-ваальсовых взаимодействий с хромофором. Мутации Y145A и H148D в Cerulean стабилизируют эти взаимодействия и позволяют хромофору быть более плоским, лучше упакованным и менее склонным к столкновительному тушению. [25]
Дополнительный сайт-направленный случайный мутагенез в сочетании с скринингом на основе времени жизни флуоресценции дополнительно стабилизировал седьмую β-цепь, в результате чего появился яркий вариант mTurquoise2 с квантовым выходом (QY) 0,93. [26] Смещение длины волны производных YFP в красную область достигается мутацией T203Y и обусловлено взаимодействиями укладки π-электронов между замещенным остатком тирозина и хромофором. [3] Эти два класса спектральных вариантов часто используются в экспериментах по резонансной передаче энергии Фёрстера (FRET). Генетически закодированные репортеры FRET, чувствительные к сигнальным молекулам клетки, таким как кальций или глутамат, состоянию фосфорилирования белков, комплементации белков, димеризации рецепторов и другим процессам, обеспечивают высокоспецифичные оптические данные о клеточной активности в режиме реального времени.
Полурациональный мутагенез ряда остатков привел к появлению чувствительных к pH мутантов, известных как pHluorins, а позже и суперэклиптических pHluorins. Используя быстрое изменение pH при слиянии синаптических пузырьков, pHluorins, помеченные синаптобревином, были использованы для визуализации синаптической активности в нейронах. [27]
Редокс-чувствительный GFP ( roGFP ) был создан путем введения цистеинов в структуру бета-цилиндра. Окислительно -восстановительное состояние цистеинов определяет флуоресцентные свойства roGFP . [28]
Номенклатура [ править ]
Номенклатура модифицированных GFP часто сбивает с толку из-за совпадения нескольких версий GFP с одним именем. Например, mGFP часто относится к GFP с N-концевым пальмитоилированием , которое заставляет GFP связываться с клеточными мембранами . Однако тот же термин также используется для обозначения мономерного GFP, что часто достигается за счет нарушения интерфейса димера мутацией A206K. [29] GFP дикого типа имеет слабую тенденцию к димеризации при концентрациях выше 5 мг/мл. mGFP также означает «модифицированный GFP», который был оптимизирован за счет замены аминокислот для стабильной экспрессии в растительных клетках.
В природе [ править ]

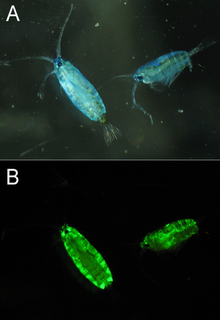
Цель как (первичной) биолюминесценции (в результате действия экворина на люциферин), так и (вторичной) флуоресценции GFP у медуз неизвестна. GFP экспрессируется совместно с экворином в небольших гранулах по краю колокольчика медузы. Пик вторичного возбуждения (480 нм) GFP действительно поглощает часть синего излучения экворина, придавая биолюминесценции более зеленый оттенок. Остаток серина 65 хромофора GFP отвечает за двухпиковые спектры возбуждения GFP дикого типа. Он консервативен во всех трех изоформах GFP, первоначально клонированных Прашером. Почти все мутации этого остатка объединяют спектры возбуждения в один пик при 395 или 480 нм. Точный механизм этой чувствительности сложен, но, по-видимому, он включает в себя передачу водорода от серина 65 глутамату 222, что влияет на ионизацию хромофора. [3] Поскольку одна мутация может значительно усилить пик возбуждения 480 нм, что делает GFP гораздо более эффективным партнером экворина, A. victoria , по-видимому, эволюционно предпочитает менее эффективный двухпиковый спектр возбуждения. Роджер Цзянь предположил, что изменение гидростатического давления с глубиной может повлиять на способность серина 65 отдавать водород хромофору и изменить соотношение двух пиков возбуждения. Таким образом, медуза может менять цвет своей биолюминесценции с глубиной. Однако сокращение популяции медуз в Фрайдей-Харборе , где первоначально был обнаружен GFP, затруднило дальнейшее изучение роли GFP в естественной среде обитания медуз.
Известно, что большинство видов ланцетника производят GFP в различных частях тела. [30] В отличие от A. victoria , ланцетники не излучают собственный синий свет, и происхождение их эндогенного GFP до сих пор неизвестно. Некоторые предполагают, что он привлекает планктон ко рту ланцетника, служа пассивным охотничьим механизмом. Он также может служить фотозащитным агентом для личинок, предотвращая повреждения, вызванные синим светом высокой интенсивности, преобразуя его в зеленый свет более низкой интенсивности. Однако эти теории не были проверены.
GFP-подобные белки были обнаружены у многих видов морских копепод , особенно из семейств Pontellidae и Aetideidae . [31] GFP, выделенный из Pontella mimocerami, продемонстрировал высокий уровень яркости с квантовым выходом 0,92, что делает его почти в два раза ярче, чем обычно используемый EGFP, выделенный из A. victoria. [32]
белки флуоресцентные Другие

Существует множество GFP-подобных белков, которые, несмотря на то, что относятся к тому же семейству белков, что и GFP, не происходят напрямую от Aequorea victoria . К ним относятся dsRed , eqFP611, Dronpa, TagRFPs, KFP, EosFP/IrisFP, Dendra и так далее. Будучи развитыми из белков разных организмов, эти белки иногда могут проявлять неожиданный подход к образованию хромофора. Некоторые из них, такие как KFP, созданы из природных нефлуоресцентных или слабофлуоресцентных белков, которые можно значительно улучшить с помощью мутагенеза. [33] Когда используются GFP-подобные стволы с различными спектральными характеристиками, спектры возбуждения одного хромофора могут использоваться для питания другого хромофора (FRET), что позволяет осуществлять преобразование длин волн света. [34]
FMN-связывающие флуоресцентные белки (FbFP) были разработаны в 2007 году и представляют собой класс небольших (11–16 кДа) кислороднезависимых флуоресцентных белков, которые происходят из рецепторов синего света. Они предназначены специально для использования в анаэробных или гипоксических условиях, поскольку для образования и связывания хромофора флавина не требуется молекулярный кислород, как в случае с синтезом хромофора GFP. [35]

Флуоресцентные белки с другими хромофорами, такие как UnaG с билирубином, могут проявлять уникальные свойства, такие как излучение с красным смещением выше 600 нм или фотоконверсия из состояния зеленого излучения в состояние красного излучения. Они могут иметь длины волн возбуждения и излучения, достаточно удаленные друг от друга, чтобы обеспечить преобразование красного и зеленого света.
Новый класс флуоресцентных белков был выделен из цианобактериального ( Trichodesmium erythraeum ) фикобилипротеина , α- аллофикоцианина получил название малого ультракрасного флуоресцентного белка ( smURFP , и в 2016 году ). smURFP автокаталитически самостоятельно включает хромофор биливердин без необходимости использования внешнего белка . известный как лиаза . [36] [37] медуз и кораллов GFP-подобные белки, полученные из , требуют кислорода и производят стехиометрическое количество перекиси водорода при образовании хромофора . [38] smURFP не требует кислорода и не производит перекись водорода использует хромофор биливердин и . smURFP имеет большой коэффициент экстинкции (180 000 M −1 см −1 ) и имеет скромный квантовый выход (0,20), что делает его биофизическую яркость сравнимой с eGFP и примерно в 2 раза ярче, чем большинство красных или дальнекрасных флуоресцентных белков, полученных из кораллов . Спектральные свойства smURFP аналогичны органическому красителю Cy5 . [36] [39]

Обзоры новых классов флуоресцентных белков и их применения можно найти в цитируемых обзорах. [40] [41]
Структура [ править ]
GFP имеет структуру бета-цилиндра, состоящую из одиннадцати β-нитей со складчатым расположением листов, с альфа-спиралью, содержащей ковалентно связанный хромофор 4-( п -гидроксибензилиден)имидазолидин-5-он (HBI), проходящий через центр. [3] [14] [15] Пять более коротких альфа-спиралей образуют колпачки на концах структуры. Структура бета-цилиндра представляет собой почти идеальный цилиндр длиной 42 Å и диаметром 24 Å (в некоторых исследованиях сообщается о диаметре 30 Å). [16] ), [14] создавая так называемое образование «β-can», уникальное для GFP-подобного семейства. [15] HBI, спонтанно модифицированная форма трипептида Ser65-Tyr66-Gly67, не флуоресцирует в отсутствие правильно свернутого каркаса GFP и существует в основном в неионизированной фенольной форме в wtGFP. [42] Обращенные внутрь боковые цепи бочонка индуцируют специфические реакции циклизации в Ser65-Tyr66-Gly67, которые вызывают ионизацию HBI до фенолятной формы и образование хромофора . Этот процесс посттрансляционной модификации называется созреванием . [43] Сеть водородных связей и взаимодействия электронов с этими боковыми цепями влияют на цвет, интенсивность и фотостабильность GFP и его многочисленных производных. [44] Плотно упакованный корпус цилиндра исключает молекулы растворителя, защищая флуоресценцию хромофора от тушения водой. Помимо автоциклизации Ser65-Tyr66-Gly67, по остатку Tyr66 происходит реакция 1,2-дегидрирования. [16] Помимо трех остатков, образующих хромофор, такие остатки, как Gln94, Arg96, His148, Thr203 и Glu222, действуют как стабилизаторы. Остатки Gln94, Arg96 и His148 способны стабилизироваться за счет делокализации заряда хромофора. Arg96 является наиболее важным стабилизирующим остатком, поскольку он вызывает необходимые структурные перестройки, необходимые для кольца HBI. Любая мутация остатка Arg96 приведет к снижению скорости развития хромофора, поскольку правильные электростатические и стерические взаимодействия будут потеряны. Tyr66 является реципиентом водородных связей и не ионизируется, создавая благоприятную электростатику. [45]

 |  |
хромофора в Автокаталитическое образование wtGFP
- Синтетический аналог см. также 3,5-дифтор-4-гидроксибензилиденимидазолинон .
Механически процесс включает циклизацию, опосредованную основаниями, за которой следуют дегидратация и окисление. В реакции 7а с 8 происходит образование енамина из имина, а в реакции 7б с 9 происходит отрыв протона. [46] Образовавшийся флуорофор ГБЖ выделен зеленым цветом.
Реакции катализируются остатками Glu222 и Arg96. [46] [47] Аналогичный механизм возможен и с треонином вместо Ser65.
Приложения [ править ]
анализы Репортерские
Зеленый флуоресцентный белок может быть использован в качестве репортерного гена . [48] [49]
Например, GFP можно использовать в качестве репортера уровней экологической токсичности. Было показано, что этот белок является эффективным способом измерения уровня токсичности различных химических веществ, включая этанол, параформальдегид , фенол, триклозан и парабен. GFP отлично подходит в качестве репортерного белка, поскольку он не оказывает влияния на хозяина при попадании в его клеточную среду. Благодаря этой способности не требуется никаких внешних красителей для визуализации, АТФ или кофакторов. Что касается уровней загрязняющих веществ, флуоресценцию измеряли, чтобы оценить эффект, который загрязняющие вещества оказывают на клетку-хозяина. Также измеряли клеточную плотность клетки-хозяина. Результаты исследования, проведенного Song, Kim и Seo (2016), показали, что по мере увеличения уровня загрязняющих веществ наблюдается снижение как флуоресценции, так и плотности клеток. Это свидетельствовало о том, что клеточная активность снизилась. Дополнительные исследования этого конкретного применения, чтобы определить механизм, с помощью которого GFP действует как маркер загрязнителя. [50] Аналогичные результаты наблюдались у рыбок данио, поскольку рыбки данио, которым вводили GFP, были примерно в двадцать раз более восприимчивы к распознаванию клеточных стрессов, чем рыбки данио, которым не вводили GFP. [51]
Преимущества [ править ]
Самым большим преимуществом GFP является то, что он может передаваться по наследству, в зависимости от того, как он был введен, что позволяет продолжать изучение клеток и тканей, в которых он экспрессируется. Визуализация GFP неинвазивна и требует только освещения синим светом. GFP сам по себе не вмешивается в биологические процессы, но при слиянии с представляющими интерес белками для поддержания функции интересующего белка требуется тщательный дизайн линкеров. Более того, при использовании с мономером он способен легко диффундировать по клеткам. [52]
Флуоресцентная микроскопия [ править ]

Доступность GFP и его производных полностью изменила определение флуоресцентной микроскопии и способов ее использования в клеточной биологии и других биологических дисциплинах. [53] В то время как большинство небольших флуоресцентных молекул, таких как FITC (изотиоцианат флуоресцеина), сильно фототоксичны при использовании в живых клетках, флуоресцентные белки, такие как GFP, обычно гораздо менее вредны при освещении в живых клетках. Это привело к разработке высокоавтоматизированных систем флуоресцентной микроскопии живых клеток, которые можно использовать для наблюдения за клетками с течением времени, экспрессирующими один или несколько белков, помеченных флуоресцентными белками.
Существует множество методов использования GFP в эксперименте по визуализации живых клеток. Самый прямой способ использования GFP — напрямую присоединить его к интересующему белку. Например, GFP можно включить в плазмиду, экспрессирующую другие гены, чтобы указать на успешную трансфекцию интересующего гена. Другой метод — использовать GFP, который содержит мутацию, при которой флуоресценция со временем меняется с зеленого на желтый, что называется флуоресцентным таймером. С помощью флуоресцентного таймера исследователи могут изучать состояние производства белка, например, недавно активированное, постоянно активированное или недавно деактивированное, на основе цвета, сообщаемого флуоресцентным белком. [54] Еще один пример: ученые модифицировали GFP так, чтобы он стал активным только после воздействия радиации, предоставив исследователям инструмент для избирательной активации определенных частей клетки и наблюдения за тем, где белки, помеченные GFP, перемещаются из исходного местоположения. [55] Это всего лишь два примера в растущей области флуоресцентной микрокопии, а более полный обзор биосенсоров, использующих GFP и другие флуоресцентные белки, можно найти здесь. [56]
Например, GFP широко использовался при маркировке сперматозоидов различных организмов в целях идентификации, например, у Drosophila melanogaster , где экспрессия GFP может использоваться в качестве маркера определенной характеристики. GFP также может быть выражен в различных структурах, позволяющих морфологическое различие. В таких случаях ген продукции GFP встраивается в геном организма в участок ДНК, кодирующий целевые белки и контролируемый той же регуляторной последовательностью ; то есть регуляторная последовательность гена теперь контролирует выработку GFP в дополнение к меченому белку(ам). В клетках, где экспрессируется ген и продуцируются меченые белки, одновременно вырабатывается GFP. Таким образом, только те клетки, в которых экспрессируется меченый ген или продуцируются целевые белки, будут флуоресцировать при наблюдении под флуоресцентной микроскопией. Анализ таких замедленных фильмов переопределил понимание многих биологических процессов, включая сворачивание белков, транспорт белков и динамику РНК, которые в прошлом изучались с использованием фиксированного (т. е. мертвого) материала. Полученные данные также используются для калибровки математических моделей внутриклеточных систем и оценки скорости экспрессии генов. [57] Аналогичным образом, GFP можно использовать в качестве индикатора экспрессии белка в гетерологичных системах. В этом сценарии слитые белки, содержащие GFP, вводятся опосредованно, с использованием РНК конструкции, или напрямую, с самим меченым белком. Этот метод полезен для изучения структурных и функциональных характеристик меченого белка в макромолекулярном или одномолекулярном масштабе с помощью флуоресцентной микроскопии.
Микроскоп Vertico SMI, использующий технологию SPDM Phymod, использует так называемый эффект «обратимого фотообесцвечивания» флуоресцентных красителей, таких как GFP и его производные, для локализации их в виде одиночных молекул с оптическим разрешением 10 нм. Это также можно выполнить путем совместной локализации двух производных GFP (2CLM). [58]
Еще одним мощным применением GFP является экспрессия белка в небольших наборах специфических клеток. Это позволяет исследователям оптически обнаруживать определенные типы клеток in vitro (в чашке) или даже in vivo (в живом организме). [59] Генетическое объединение нескольких спектральных вариантов GFP — полезный трюк для анализа схем мозга ( Brainbow ). [60] Другие интересные применения флуоресцентных белков в литературе включают использование FP в качестве датчиков нейрона мембранного потенциала . [61] отслеживание рецепторов AMPA на клеточных мембранах, [62] проникновение вируса и заражение отдельными вирусами гриппа и лентивирусными вирусами, [63] [64] и т. д.
Также было обнаружено, что новые линии трансгенных крыс GFP могут быть полезны для генной терапии, а также регенеративной медицины. [65] При использовании GFP с «высоким уровнем экспрессии» трансгенные крысы демонстрируют высокую экспрессию в большинстве тканей и многих клетках, которые не были охарактеризованы или были лишь плохо охарактеризованы у предыдущих трансгенных крыс GFP.
Было показано, что GFP полезен в криобиологии в качестве анализа жизнеспособности . Корреляция жизнеспособности, измеренная с помощью анализа трипанового синего , составила 0,97. [66] Другим применением является использование котрансфекции GFP в качестве внутреннего контроля эффективности трансфекции в клетках млекопитающих. [67]
Новое возможное использование GFP включает использование его в качестве чувствительного монитора внутриклеточных процессов с помощью лазерной системы eGFP, изготовленной из линии клеток эмбриональной почки человека. Первый сконструированный живой лазер создан с помощью клетки, экспрессирующей eGFP, внутри отражающей оптической полости и воздействующей на нее импульсами синего света. При определенном пороге импульса оптический выходной сигнал eGFP становится более ярким и полностью однородным, окрашенным в чистый зеленый цвет с длиной волны 516 нм. Прежде чем излучаться в виде лазерного света, свет отражается взад и вперед внутри полости резонатора и проходит через ячейку множество раз. Изучая изменения оптической активности, исследователи смогут лучше понять клеточные процессы. [68] [69]
GFP широко используется в исследованиях рака для маркировки и отслеживания раковых клеток. Раковые клетки, меченные GFP, использовались для моделирования метастазирования — процесса, посредством которого раковые клетки распространяются в отдаленные органы. [70]
Разделить GFP [ править ]
GFP можно использовать для анализа колокализации белков. Это достигается путем «разделения» белка на два фрагмента, которые способны самособираться, а затем слияния каждого из них с двумя интересующими белками. По отдельности эти неполные фрагменты GFP не способны флуоресцировать. Однако если два представляющих интерес белка колокализуются, то два фрагмента GFP собираются вместе, образуя GFP-подобную структуру, которая способна флуоресцировать. Таким образом, измеряя уровень флуоресценции, можно определить, колокализуются ли два представляющих интерес белка. [71]
Макрофотография [ править ]
Макромасштабные биологические процессы, такие как распространение вирусных инфекций, можно отслеживать с помощью маркировки GFP. [72] В прошлом для освещения живых организмов использовался мутагенный ультрафиолетовый свет (УФ) (например, см. [73] ), чтобы обнаружить и сфотографировать экспрессию GFP. Недавно появился метод использования неготагенных светодиодных фонарей. [74] были разработаны для макросъемки. [75] В этом методе используется насадка для эпифлуоресцентной камеры. [76] основан на том же принципе, который используется в конструкции эпифлуоресцентных микроскопов .
Трансгенные животные домашние

Альба , зелено-флуоресцентный кролик, был создан французской лабораторией по заказу Эдуардо Каца с использованием GFP в целях искусства и социальных комментариев. [77] Американская компания Yorktown Technologies продает аквариумным магазинам зеленых флуоресцентных рыбок данио ( GloFish ), которые изначально были разработаны для обнаружения загрязнений в водных путях. NeonPets, американская компания, продает зеленые флуоресцентные мыши для индустрии домашних животных под названием NeonMice. [78] Зеленые флуоресцентные свиньи, известные как Ноэлы, были выведены группой исследователей под руководством У Шинн-Чи из Департамента зоотехники и технологий Национального Тайваньского университета . [79] Японско-американская группа создала зелено-флуоресцентных кошек в качестве доказательства концепции потенциального использования их в качестве модельных организмов для болезней, в частности ВИЧ . [80] В 2009 году южнокорейская команда из Сеульского национального университета вывела первых трансгенных биглей с клетками фибробластов морских анемонов. Собаки излучают красный флуоресцентный свет, и они предназначены для того, чтобы позволить ученым изучать гены, вызывающие у человека такие заболевания, как нарколепсия и слепота. [81]
Искусство [ править ]
Юлиан Восс-Андре , художник немецкого происхождения, специализирующийся на «белковых скульптурах». [82] создал скульптуры, основанные на структуре GFP, в том числе «Зеленый флуоресцентный белок» высотой 1,70 м (5 футов 6 дюймов) (2004). [83] и «Стальная медуза» высотой 1,40 м (4 фута 7 дюймов) (2006 г.). Последняя скульптура расположена на месте открытия GFP Шимомурой в 1962 году, Вашингтонского университета в лабораториях Фрайдей-Харбор . [84]

См. также [ править ]
Ссылки [ править ]
- ^ Ормо М., Кубитт А.Б., Каллио К., Гросс Л.А., Цьен Р.Ю., Ремингтон С.Дж. (сентябрь 1996 г.). «Кристаллическая структура зеленого флуоресцентного белка Aequorea victoria». Наука . 273 (5280): 1392–5. Бибкод : 1996Sci...273.1392O . дои : 10.1126/science.273.5280.1392 . ПМИД 8703075 . S2CID 43030290 .
- ^ Прендергаст Ф.Г., Манн К.Г. (август 1978 г.). «Химические и физические свойства экворина и зеленого флуоресцентного белка, выделенного из Aequorea forskålea». Биохимия . 17 (17): 3448–53. дои : 10.1021/bi00610a004 . ПМИД 28749 .
- ^ Jump up to: Перейти обратно: а б с д Цянь Р.Ю. (1998). «Зеленый флуоресцентный белок» (PDF) . Ежегодный обзор биохимии . 67 : 509–44. doi : 10.1146/annurev.biochem.67.1.509 . ПМИД 9759496 .
- ^ Салих А (2019). «Флуоресцентные белки» . В Кокс Дж. (ред.). Основы флуоресцентной визуализации . Бока-Ратон: издательство Jenny Stanford Publishing. п. 122. дои : 10.1201/9781351129404 . ISBN 9781351129404 . S2CID 213688192 .
- ^ Степаненко О.В., Верхуша В.В., Кузнецова И.М., Уверский В.Н., Туроверов К.К. (август 2008 г.). «Флуоресцентные белки как биомаркеры и биосенсоры: освещают молекулярные и клеточные процессы цветным светом» . Современная наука о белках и пептидах . 9 (4): 338–69. дои : 10.2174/138920308785132668 . ПМК 2904242 . ПМИД 18691124 .
- ^ Филлипс Дж.Дж. (октябрь 2001 г.). «Зеленый флуоресцентный белок - яркая идея для изучения локализации бактериальных белков». Письма FEMS по микробиологии . 204 (1): 9–18. дои : 10.1016/S0378-1097(01)00358-5 . ПМИД 11682170 .
- ^ Укерт В., Педерсен Л., Гюнцбург В. (2000). «Ретровирусный вектор зеленого флуоресцентного белка: создание клеток-продуцентов с высоким титром и вирусного супернатанта». Генная терапия рака . Методы молекулярной медицины. Том. 35. С. 275–85. дои : 10.1385/1-59259-086-1:275 . ISBN 1-59259-086-1 . ПМИД 21390811 .
- ^ Гудман С.Р., изд. (2008). «Глава 1 - Инструменты клеточного биолога: зеленый флуоресцентный белок». Медицинская клеточная биология (3-е изд.). Амстердам: Elsevier/Academic Press. стр. 14–25. дои : 10.1016/B978-0-12-370458-0.50006-2 . ISBN 978-0-12-370458-0 . S2CID 90224559 .
- ^ Шимомура О, Джонсон Ф.Х., Сайга Ю (июнь 1962 г.). «Извлечение, очистка и свойства экворина, биолюминесцентного белка из светящегося гидромедузана Aequorea». Журнал клеточной и сравнительной физиологии . 59 (3): 223–39. дои : 10.1002/jcp.1030590302 . ПМИД 13911999 .
- ^ Морис Х., Шимомура О., Джонсон Ф.Х., Винант Дж. (июнь 1974 г.). «Межмолекулярный перенос энергии в биолюминесцентной системе Aequorea». Биохимия . 13 (12): 2656–62. дои : 10.1021/bi00709a028 . ПМИД 4151620 .
- ^ Прашер, округ Колумбия, Экенроде В.К., Уорд В.В., Прендергаст Ф.Г., Кормье М.Дж. (февраль 1992 г.). «Первичная структура зеленого флуоресцентного белка Aequorea victoria». Джин . 111 (2): 229–33. дои : 10.1016/0378-1119(92)90691-H . ПМИД 1347277 .
- ^ Чалфи М., Ту Ю., Ойскирхен Дж., Уорд В.В., Прашер, округ Колумбия (февраль 1994 г.). «Зеленый флуоресцентный белок как маркер экспрессии генов». Наука . 263 (5148): 802–5. Бибкод : 1994Sci...263..802C . дои : 10.1126/science.8303295 . ПМИД 8303295 . S2CID 9043327 .
- ^ Иноуе С., Цудзи Ф.И. (март 1994 г.). «Зеленый флуоресцентный белок Aequorea. Экспрессия гена и характеристики флуоресценции рекомбинантного белка» . Письма ФЭБС . 341 (2–3): 277–80. дои : 10.1016/0014-5793(94)80472-9 . ПМИД 8137953 .
- ^ Jump up to: Перейти обратно: а б с Ормо М., Кубитт А.Б., Каллио К., Гросс Л.А., Цьен Р.Ю., Ремингтон С.Дж. (сентябрь 1996 г.). «Кристаллическая структура зеленого флуоресцентного белка Aequorea victoria». Наука . 273 (5280): 1392–5. Бибкод : 1996Sci...273.1392O . дои : 10.1126/science.273.5280.1392 . ПМИД 8703075 . S2CID 43030290 .
- ^ Jump up to: Перейти обратно: а б с Ян Ф., Мосс Л.Г., Филлипс Г.Н. (октябрь 1996 г.). «Молекулярная структура зеленого флуоресцентного белка» (PDF) . Природная биотехнология . 14 (10): 1246–51. дои : 10.1038/nbt1096-1246 . hdl : 1911/19233 . ПМИД 9631087 . S2CID 34713931 .
- ^ Jump up to: Перейти обратно: а б с Брейц К., Сиксма Т.К., Китс П.А., Кейн С.Р., Цьен Р.Ю., Ормо М., Ремингтон С.Дж. (март 1997 г.). «Структурная основа двойного возбуждения и фотоизомеризации зеленого флуоресцентного белка Aequorea victoria » . Труды Национальной академии наук Соединенных Штатов Америки . 94 (6): 2306–2311. Бибкод : 1997PNAS...94.2306B . дои : 10.1073/pnas.94.6.2306 . ЧВК 20083 . ПМИД 9122190 .
- ^ Шанер, Северная Каролина, Штайнбах, Пенсильвания, Цянь Р.Ю. (декабрь 2005 г.). «Руководство по выбору флуоресцентных белков» (PDF) . Природные методы . 2 (12): 905–9. дои : 10.1038/nmeth819 . ПМИД 16299475 . S2CID 10024284 .
- ^ Вильгельмссон М, Тор Ю (2016). Флуоресцентные аналоги биомолекулярных строительных блоков: конструкция и применение . Нью-Джерси: Уайли. ISBN 978-1-118-17586-6 .
- ^ Хейм Р., Кубитт А.Б., Цянь Р.Ю. (февраль 1995 г.). «Улучшенная зеленая флуоресценция» (PDF) . Природа . 373 (6516): 663–4. Бибкод : 1995Natur.373..663H . дои : 10.1038/373663b0 . ПМИД 7854443 . S2CID 40179694 .
- ^ Патент США 6172188 , Таструп О., Таллин С., Конгсбак Поулсен Л., Бьёрн С., «Флуоресцентные белки», опубликовано 9 января 2001 г.
- ^ Кормак Б.П., Вальдивия Р.Х., Фальков С. (1996). «Оптимизированные для FACS мутанты зеленого флуоресцентного белка (GFP)» . Джин . 173 (1 номер спецификации): 33–38. дои : 10.1016/0378-1119(95)00685-0 . ПМИД 8707053 .
- ^ Макрей С.Р., Браун К.Л., Бушелл Г.Р. (май 2005 г.). «Быстрая очистка EGFP, EYFP и ECFP с высоким выходом и чистотой». Экспрессия и очистка белков . 41 (1): 121–127. дои : 10.1016/j.pep.2004.12.030 . ПМИД 15802229 .
- ^ Педелак Дж.Д., Кабантус С., Тран Т., Тервиллигер Т.К., Уолдо Г.С. (январь 2006 г.). «Разработка и характеристика суперпапки зеленого флуоресцентного белка». Природная биотехнология . 24 (1): 79–88. дои : 10.1038/nbt1172 . ПМИД 16369541 . S2CID 2966399 .
- ^ Барондо Д.П., Кассманн К.Дж., Тайнер Дж.А., Гецофф Э.Д. (апрель 2002 г.). «Структурная химия биосенсора зеленого флуоресцентного белка Zn». Журнал Американского химического общества . 124 (14): 3522–3524. дои : 10.1021/ja0176954 . ПМИД 11929238 .
- ^ Лелимузен М, Нуарклерк-Савой М, Лазарено-Саес С, Пэтцольд Б, Ле Вот С, Шазаль Р, Машбёф П, Филд МЖ, Буржуа Д, Ройан А (октябрь 2009 г.). «Внутренняя динамика ECFP и квантового выхода флуоресценции контроля Cerulean». Биохимия . 48 (42): 10038–10046. дои : 10.1021/bi901093w . ПМИД 19754158 .
- ^ Гоедхарт Дж., фон Штеттен Д., Нуарклерк-Савой М., Лелимузен М., Йосен Л., Хинк М.А., ван Веерен Л., Гаделла Т.В., Ройант А. (2012). «Направляемая структурой эволюция голубых флуоресцентных белков к квантовому выходу 93%» . Природные коммуникации . 3 : 751. Бибкод : 2012NatCo...3..751G . дои : 10.1038/ncomms1738 . ПМЦ 3316892 . ПМИД 22434194 .
- ^ Мизенбёк Г., Де Анджелис Д.А., Ротман Дж.Э. (июль 1998 г.). «Визуализация секреции и синаптической передачи с помощью pH-чувствительных зеленых флуоресцентных белков». Природа . 394 (6689): 192–5. Бибкод : 1998Natur.394..192M . дои : 10.1038/28190 . ПМИД 9671304 . S2CID 4320849 .
- ^ Хэнсон Г.Т., Аггелер Р., Оглсби Д., Кэннон М., Капальди Р.А., Цьен Р.Ю., Ремингтон С.Дж. (март 2004 г.). «Исследование окислительно-восстановительного потенциала митохондрий с помощью редокс-чувствительных индикаторов зеленого флуоресцентного белка» . Журнал биологической химии . 279 (13): 13044–53. дои : 10.1074/jbc.M312846200 . ПМИД 14722062 .
- ^ Захариас Д.А., Скрипка Дж.Д., Ньютон AC, Цянь Р.Ю. (май 2002 г.). «Разделение липид-модифицированных мономерных GFP на мембранные микродомены живых клеток». Наука . 296 (5569): 913–16. Бибкод : 2002Sci...296..913Z . дои : 10.1126/science.1068539 . ПМИД 11988576 . S2CID 14957077 .
- ^ Юэ JX, Голландия ND, Голландия LZ, Дехейн Д.Д. (июнь 2016 г.). «Эволюция генов, кодирующих зеленые флуоресцентные белки: данные головохордовых (амфиоксус)» . Научные отчеты . 6 (1): 28350. Бибкод : 2016NatSR...628350Y . дои : 10.1038/srep28350 . ПМЦ 4911609 . ПМИД 27311567 .
- ^ Hunt ME, Scherrer MP, Ferrari FD, Matz MV (июль 2010 г.). «Очень ярко-зеленые флуоресцентные белки копепод Pontella mimocerami Pontellid» . ПЛОС ОДИН . 5 (7): е11517. Бибкод : 2010PLoSO...511517H . дои : 10.1371/journal.pone.0011517 . ПМК 2904364 . ПМИД 20644720 .
- ^ «эГФП» . ФПбаза .
- ^ Чудаков Д.М., Белоусов В.В., Зарайский А.Г., Новоселов В.В., Староверов Д.Б., Зоров Д.Б., Лукьянов С., Лукьянов К.А. (февраль 2003 г.). «Kindling флуоресцентные белки для точного фотомаркирования in vivo». Природная биотехнология . 21 (2): 191–4. дои : 10.1038/nbt778 . ПМИД 12524551 . S2CID 52887792 .
- ^ Wiens MD, Shen Y, Li X, Salem MA, Smisdom N, Zhang W, Brown A, Campbell RE (декабрь 2016 г.). «Тандемный зелено-красный гетеродимерный флуоресцентный белок с высокой эффективностью FRET». ХимБиоХим . 17 (24): 2361–2367. дои : 10.1002/cbic.201600492 . ПМИД 27781394 . S2CID 4301322 .
- ^ Дреппер Т., Эггерт Т., Цирколоне Ф., Хек А., Краусс У., Гутерл Дж.К. и др. (апрель 2007 г.). «Репортерные белки для флуоресценции in vivo без кислорода». Природная биотехнология . 25 (4): 443–445. дои : 10.1038/nbt1293 . ПМИД 17351616 . S2CID 7335755 .
- ^ Jump up to: Перейти обратно: а б Родригес Э.А., Тран Г.Н., Гросс Л.А., Крисп Дж.Л., Шу X, Лин Дж.Ю., Цянь Р.Ю. (сентябрь 2016 г.). «Далеко-красный флуоресцентный белок произошел из цианобактериального фикобилипротеина» . Природные методы . 13 (9): 763–9. дои : 10.1038/nmeth.3935 . ПМК 5007177 . ПМИД 27479328 .
- ^ Мэттсон С., Тран Г.Н., Родригес Э.А. (2023). «Направленная эволюция флуоресцентных белков у бактерий». В Шарме М. (ред.). Флуоресцентные белки . Методы молекулярной биологии. Том. 2564. Нью-Йорк, штат Нью-Йорк: Springer US. стр. 75–97. дои : 10.1007/978-1-0716-2667-2_4 . ISBN 978-1-0716-2666-5 . ПМИД 36107338 .
- ^ Цянь Р.Ю. (1 января 1998 г.). «Зеленый флуоресцентный белок». Ежегодный обзор биохимии . 67 (1): 509–44. doi : 10.1146/annurev.biochem.67.1.509 . ПМИД 9759496 . S2CID 8138960 .
- ^ Маити, Атану; Буффало, Космо З.; Саурабх, Саумья; Монтесинос-Франхола, Фелипе; Хачи, Джастин С.; Конлон, Уильям Дж.; Тран, Джеральдин Н.; Хасан, Бакар; Уолтерс, Кайли Дж.; Дробыжев Михаил; Мёрнер, МЫ; Гош, Парфо; Мацуо, Хироши; Цянь, Роджер Ю.; Лин, Джон Ю. (12 июля 2023 г.). «Структурная и фотофизическая характеристика небольшого ультракрасного флуоресцентного белка» . Природные коммуникации . 14 (1): 4155. Бибкод : 2023NatCo..14.4155M . дои : 10.1038/s41467-023-39776-9 . ISSN 2041-1723 . ПМЦ 10338489 . ПМИД 37438348 .
- ^ Родригес Э.А., Кэмпбелл Р.Э., Лин Дж.Ю., Линь М.З., Мияваки А., Палмер А.Е., Шу Х, Чжан Дж., Цянь Р.Ю. (февраль 2017 г.). «Набор инструментов для выращивания и свечения флуоресцентных и фотоактивных белков» . Тенденции биохимических наук . 42 (2): 111–129. дои : 10.1016/j.tibs.2016.09.010 . ПМК 5272834 . ПМИД 27814948 .
- ^ Монтесинос-Франхола Ф., Лин Дж.Ю., Родригес Э.А. (16 ноября 2020 г.). «Флуоресцентные белки для визуализации in vivo, где биливердин?». Труды Биохимического общества . 48 (6): 2657–2667. дои : 10.1042/BST20200444 . ПМИД 33196077 . S2CID 226971864 .
- ^ Бокман С.Х., Уорд WW (1982). «Обратимая денатурация зеленого флуоресцентного белка Aequorea: физическое разделение и характеристика ренатурированного белка». Биохимия . 21 (19): 4535–4540. дои : 10.1021/bi00262a003 . ПМИД 6128025 .
- ^ Пауэлс Л.Дж., Чжан Л., Чан Н.Х., Доррестейн ПК, Вахтер Р.М. (сентябрь 2008 г.). «Исследования кинетического изотопного эффекта на скорость образования хромофора de novo в быстро- и медленно созревающих вариантах GFP» . Биохимия . 47 (38): 10111–22. дои : 10.1021/bi8007164 . ПМК 2643082 . ПМИД 18759496 .
- ^ Чудаков Д.М., Мац М.В., Лукьянов С., Лукьянов К.А. (июль 2010 г.). «Флуоресцентные белки и их применение для визуализации живых клеток и тканей». Физиологические обзоры . 90 (3): 1103–63. doi : 10.1152/physrev.00038.2009 . ПМИД 20664080 . S2CID 10767597 .
- ^ Степаненко О.В., Верхуша В.В., Шавловский М.М., Кузнецова И.М., Уверский В.Н., Туроверов К.К. (ноябрь 2008 г.). «Понимание роли Arg96 в структуре и стабильности зеленого флуоресцентного белка» . Белки . 73 (3): 539–551. дои : 10.1002/prot.22089 . ПМК 2908022 . ПМИД 18470931 .
- ^ Jump up to: Перейти обратно: а б Розенов М.А., Хаффман Х.А., Фэйл М.Е., Вахтер Р.М. (апрель 2004 г.). «Кристаллическая структура варианта зеленого флуоресцентного белка Y66L поддерживает механизм циклизации-окисления-дегидратации для созревания хромофора». Биохимия . 43 (15): 4464–4472. дои : 10.1021/bi0361315 . ПМИД 15078092 .
- ^ Ма Ю, Ю Дж. Г., Сунь Кью, Ли Зи, Смит С.С. (01 июля 2015 г.). «Механизм дегидратации при созревании хромофора зеленого флуоресцентного белка дикого типа: теоретическое исследование». Письма по химической физике . 631–632: 42–46. Бибкод : 2015CPL...631...42M . дои : 10.1016/j.cplett.2015.04.061 . ISSN 0009-2614 .
- ^ Джагдер Б.Е., Уэлч Дж., Брейди Н., Маркиз С.П. (26 июля 2016 г.). «Создание и использование слияния растворимого промотора гидрогеназы (PSH) Cupriavidus necator H16 с gfp (зеленым флуоресцентным белком)» . ПерДж . 4 : е2269. дои : 10.7717/peerj.2269 . ПМЦ 4974937 . ПМИД 27547572 .
- ^ Арун К.Х., Каул С.Л., Рамарао П. (2005). «Зеленые флуоресцентные белки в исследовании рецепторов: новый инструмент для открытия лекарств». Журнал фармакологических и токсикологических методов . 51 (1): 1–23. дои : 10.1016/j.vascn.2004.07.006 . ПМИД 15596111 .
- ^ Сон ЮХ, Ким К.С., Со Дж.Х. (апрель 2016 г.). «Неинвазивный мониторинг токсичности окружающей среды с помощью зеленого флуоресцентного белка, экспрессирующего Escherichia coli». Корейский журнал химической инженерии . 33 (4): 1331–6. дои : 10.1007/s11814-015-0253-1 . S2CID 62828580 .
- ^ Пан Ю., Лейферт А., Граф М., Шифер Ф., Торё-Бовелет С., Брода Дж., Холлоран М.С., Холлерт Х., Лааф Д., Саймон У., Янен-Дехент В. (март 2013 г.). «Высокочувствительный анализ токсичности наночастиц в режиме реального времени у рыбок данио, экспрессирующих зеленый флуоресцентный белок». Маленький . 9 (6). Вайнхайм-ан-дер-Бергштрассе, Германия: 863–9. дои : 10.1002/smll.201201173 . ПМИД 23143852 .
- ^ Чалфи М. (июнь 2009 г.). «GFP: Освещая жизнь» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (25): 10073–10080. Бибкод : 2009PNAS..10610073C . дои : 10.1073/pnas.0904061106 . ПМК 2700921 . ПМИД 19553219 .
- ^ Юсте Р. (декабрь 2005 г.). «Флуоресцентная микроскопия сегодня». Природные методы . 2 (12): 902–4. дои : 10.1038/nmeth1205-902 . ПМИД 16299474 . S2CID 205418407 .
- ^ Терских А, Фрадков А, Ермакова Г, Зарайский А, Тан П, Каява АВ и др. (ноябрь 2000 г.). « «Флуоресцентный таймер»: белок, меняющий цвет со временем». Наука . 290 (5496): 1585–8. Бибкод : 2000Sci...290.1585T . дои : 10.1126/science.290.5496.1585 . ПМИД 11090358 .
- ^ Паттерсон Г.Х., Липпинкотт-Шварц Дж. (сентябрь 2002 г.). «Фотоактивируемый GFP для селективного фотомаркирования белков и клеток». Наука . 297 (5588): 1873–7. Бибкод : 2002Sci...297.1873P . дои : 10.1126/science.1074952 . ПМИД 12228718 . S2CID 45058411 .
- ^ Линь В., Мехта С., Чжан Дж. (октябрь 2019 г.). «Генетически закодированные флуоресцентные биосенсоры освещают передачу сигналов киназы при раке» . Журнал биологической химии . 294 (40): 14814–14822. дои : 10.1074/jbc.REV119.006177 . ПМК 6779441 . ПМИД 31434714 .
- ^ Коморовски М., Финкенштедт Б., Рэнд Д. (июнь 2010 г.). «Использование одного флуоресцентного репортерного гена для определения периода полураспада внешнего шума и других параметров экспрессии генов» . Биофизический журнал . 98 (12): 2759–2769. Бибкод : 2010BpJ....98.2759K . дои : 10.1016/j.bpj.2010.03.032 . ПМЦ 2884236 . ПМИД 20550887 .
- ^ Гункель М., Эрдель Ф., Риппе К., Леммер П., Кауфманн Р., Хёрманн С., Амбергер Р., Кремер С. (июнь 2009 г.). «Двухцветная локализационная микроскопия клеточных наноструктур» . Биотехнологический журнал . 4 (6): 927–38. дои : 10.1002/biot.200900005 . ПМИД 19548231 . S2CID 18162278 .
- ^ Чудаков Д.М., Лукьянов С., Лукьянов К.А. (декабрь 2005 г.). «Флуоресцентные белки как инструментарий для визуализации in vivo». Тенденции в биотехнологии . 23 (12): 605–13. дои : 10.1016/j.tibtech.2005.10.005 . ПМИД 16269193 .
- ^ Ливет Дж., Вайсман Т.А., Кан Х., Драфт Р.В., Лу Дж., Беннис Р.А., Санес Дж.Р., Лихтман Дж.В. (ноябрь 2007 г.). «Трансгенные стратегии комбинаторной экспрессии флуоресцентных белков в нервной системе». Природа . 450 (7166): 56–62. Бибкод : 2007Natur.450...56L . дои : 10.1038/nature06293 . ПМИД 17972876 . S2CID 4402093 .
- ^ Бейкер Б.Дж., Муто Х., Димитров Д., Акеманн В., Перрон А., Ивамото Ю., Джин Л., Коэн Л.Б., Исакофф Э.Ю., Пиерибоне В.А., Хьюз Т., Кнопфель Т. (август 2008 г.). «Генетически кодированные флуоресцентные сенсоры мембранного потенциала» . Биология клеток мозга . 36 (1–4): 53–67. дои : 10.1007/s11068-008-9026-7 . ПМК 2775812 . ПМИД 18679801 .
- ^ Адесник Х., Николл Р.А., премьер-министр Англии (декабрь 2005 г.). «Фотоинактивация нативных АМРА-рецепторов выявляет их трафик в реальном времени» . Нейрон . 48 (6): 977–85. дои : 10.1016/j.neuron.2005.11.030 . ПМИД 16364901 .
- ^ Лакадамиали М., Раст М.Дж., Бэбкок Х.П., Чжуан Икс (август 2003 г.). «Визуализация заражения отдельными вирусами гриппа» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (16): 9280–5. Бибкод : 2003PNAS..100.9280L . дои : 10.1073/pnas.0832269100 . ПМК 170909 . ПМИД 12883000 .
- ^ Джу Ки, Ван Пи (октябрь 2008 г.). «Визуализация целевой трансдукции с помощью сконструированных лентивирусных векторов» . Генная терапия . 15 (20): 1384–96. дои : 10.1038/gt.2008.87 . ПМК 2575058 . ПМИД 18480844 .
- ^ Реми С., Тессон Л., Усал С., Меноре С., Боннамен В., Нерьер-Даген В., Россиньоль Дж., Бойер С., Нгуен Т.Х., Навейан П., Лескодрон Л., Анегон I (октябрь 2010 г.). «Новые линии трансгенных крыс GFP, актуальные для регенеративной медицины и генной терапии». Трансгенные исследования . 19 (5): 745–63. дои : 10.1007/s11248-009-9352-2 . ПМИД 20094912 . S2CID 42499768 .
- ^ Эллиотт Дж., МакГрат Дж., Крокетт-Тораби Э. (июнь 2000 г.). «Зеленый флуоресцентный белок: новый анализ жизнеспособности для криобиологических применений». Криобиология . 40 (4): 360–369. дои : 10.1006/cryo.2000.2258 . ПМИД 10924267 .
- ^ Фахрудин Н., Ладурнер А., Атанасов А.Г., Хейсс Э.Х., Баумгартнер Л., Маркт П., Шустер Д., Эллмерер Е.П., Вольбер Г., Роллингер Дж.М., Ступпнер Х., Дирш В.М. (апрель 2010 г.). «Компьютерное открытие, проверка и механистическая характеристика новых неолигнановых активаторов гамма-рецептора, активируемого пролифератором пероксисомы» . Молекулярная фармакология . 77 (4): 559–66. дои : 10.1124/моль.109.062141 . ПМЦ 3523390 . ПМИД 20064974 .
- ^ Gather MC, Юн Ш. (2011). «Одноклеточные биологические лазеры». Природная фотоника . 5 (7): 406–410. Бибкод : 2011NaPho...5..406G . дои : 10.1038/nphoton.2011.99 . S2CID 54971962 .
- ^ Мэтсон Дж (2011). «Зеленый флуоресцентный белок создает живые лазеры» . Научный американец . Проверено 13 июня 2011 г.
- ^ Курос-Мехр Х., Бечис С.К., Слорач Э.М., Литтлпейдж Л.Е., Эгеблад М., Эвальд А.Дж., Пай С.Ю., Хо И.С., Верб З. (февраль 2008 г.). «GATA-3 связывает дифференцировку и диссеминацию опухоли в модели рака молочной железы в просвете» . Раковая клетка . 13 (2): 141–52. дои : 10.1016/j.ccr.2008.01.011 . ПМК 2262951 . ПМИД 18242514 .
- ^ Кабантус С., Тервиллигер Т.К., Уолдо Г.С. (январь 2005 г.). «Мечение и обнаружение белков с помощью сконструированных самособирающихся фрагментов зеленого флуоресцентного белка». Природная биотехнология . 23 (1): 102–7. дои : 10.1038/nbt1044 . ПМИД 15580262 . S2CID 25833063 .
- ^ Родман МК, Ядав Н.С., Артус Н.Н. (1 сентября 2002 г.). «Прогрессирование подавления трансгена, вызванного геминивирусом, связано с метилированием трансгена». Новый фитолог . 155 (3): 461–468. дои : 10.1046/j.1469-8137.2002.00467.x . ПМИД 33873315 .
- ^ Чжу Ю.Дж., Агбаяни Р., Мур П.Х. (апрель 2004 г.). «Зеленый флуоресцентный белок как маркер визуальной селекции трансформации папайи (Carica papaya L.)». Отчеты о растительных клетках . 22 (9): 660–7. дои : 10.1007/s00299-004-0755-5 . ПМИД 14749892 . S2CID 23198182 .
- ^ Нива Ю., Хирано Т., Ёсимото К., Симидзу М., Кобаяши Х. (1999). «Неинвазивное количественное обнаружение и применение нетоксичного зеленого флуоресцентного белка типа S65T в живых растениях» . Заводской журнал . 18 (4): 455–63. дои : 10.1046/j.1365-313X.1999.00464.x . ПМИД 10406127 . S2CID 292648 .
- ^ Бейкер С.С., Видикан CB, Кэмерон Д.С., Грейб Х.Г., Яроцки CC, Сетапутри А.В., Спикуцца CH, Берр А.А., Вакас М.А., Толберт Д.А. (01.01.2012). «Эпифлуоресцентная насадка улучшает цифровую фотографию всего растения Arabidopsis thaliana, экспрессирующую смещенный в красную сторону зеленый флуоресцентный белок» . Растения АОБ . 2012 : пожалуйста003. дои : 10.1093/aobpla/pls003 . ПМК 3296078 . ПМИД 22479674 .
- ^ «PlantEdDL - Использование цифровых камер SRL в количественном исследовании растений, экспрессирующих зеленый флуоресцентный белок (GFP)» . Planted.botany.org . Проверено 23 марта 2016 г.
- ^ Кац Э. «Зайка GFP» .
- ^ «Светящиеся в темноте неоновые мыши» . Архивировано из оригинала 14 февраля 2009 года . Проверено 30 августа 2016 г.
- ^ Ученые на Тайване разводят флуоресцентно-зеленых свиней.
- ^ Вонгсрикеао П., Саенс Д., Ринкоски Т., Отой Т., Пошла Э. (2011). «Трансгенез противовирусных факторов рестрикции у домашней кошки» . Природные методы . 8 (10): 853–9. дои : 10.1038/nmeth.1703 . ПМК 4006694 . ПМИД 21909101 .
- ^ «Флуоресцентный щенок — первая в мире трансгенная собака »
- ^ Восс-Андре Дж (2005). «Белковые скульптуры: строительные блоки жизни вдохновляют искусство». Леонардо . 38 : 41–45. дои : 10.1162/leon.2005.38.1.41 . S2CID 57558522 .
- ^ Павляк А (2005). «Вдохновляющие белки». Физический журнал . 4:12 .
- ^ «Скульптура Джулиана Восса-Андре» . Проверено 14 июня 2007 г.
Дальнейшее чтение [ править ]
- Пиерибоне В., Грубер Д. (2006). Сияние в темноте: революционная наука биофлуоресценции . Кембридж: Белкнап Пресс. ISBN 978-0-674-01921-8 . OCLC 60321612 . Научно-популярная книга, описывающая историю и открытие GFP.
- Циммер М (2005). Светящиеся гены: революция в биотехнологии . Буффало, Нью-Йорк: Книги Прометея. ISBN 978-1-59102-253-4 . OCLC 56614624 .
Внешние ссылки [ править ]
- Подробная статья о флуоресцентных белках в Scholarpedia.
- Краткое изложение знаковых документов GFP
- Интерактивный Java-апплет, демонстрирующий химию образования хромофора GFP.
- Видео лекции Роджера Цзяня, лауреата Нобелевской премии 2008 года, о флуоресцентных белках
- Спектры возбуждения и испускания различных флуоресцентных белков
- Тематический выпуск Green Fluorescent Protein Chem Soc Rev, посвященный лауреатам Нобелевской премии по химии 2008 года профессорам Осаму Шимомуре , Мартину Чалфи и Роджеру Ю. Циену.
- Молекула месяца, июнь 2003 г .: иллюстрированный обзор GFP Дэвида Гудселла.
- Молекула месяца, июнь 2014 г .: иллюстрированный обзор GFP-подобных вариантов Дэвида Гудселла.
- Зеленый флуоресцентный белок на FPbase, базе данных флуоресцентных белков
- Обзор всей структурной информации, доступной в PDB для UniProt : P42212 (зеленый флуоресцентный белок) в PDBe-KB .
