Синаптобревин
| Синаптобревин | |||
|---|---|---|---|
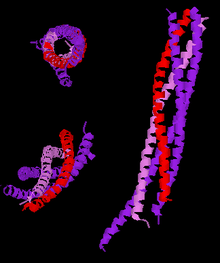 Три разных взгляда на структуру усеченного нейронального комплекса SNARE с высоким разрешением. Легенда: синаптобревин-2 (красный), синтаксин-1 (розовый), SNAP-25 (фиолетовый). | |||
| Идентификаторы | |||
| Символ | Синаптобревин | ||
| Пфам | PF00957 | ||
| ИнтерПро | ИПР016444 | ||
| PROSITE | PDOC00368 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1sfc / SCOPe / СУПФАМ | ||
| Суперсемейство OPM | 197 | ||
| белок OPM | 4wy4 | ||
| Мембраном | 351 | ||
| |||
Синаптобревины ( изотипы синаптобревинов 1-2 ) представляют собой небольшие интегральные мембранные белки секреторных везикул с молекулярной массой 18 килодальтон (кДа), которые являются частью семейства мембранных белков, ассоциированных с везикулами (ВАМП). [1] [2] [3] [4] [5]
Синаптобревин — один из белков SNARE, участвующих в формировании комплексов SNARE.
Структура
[ редактировать ]Из четырех α-спиралей основного комплекса SNARE одна представлена синаптобревином, одна — синтаксином и две — SNAP-25 (в нейронах).
Функция
[ редактировать ]Белки SNARE являются ключевыми компонентами молекулярного механизма, который управляет слиянием мембран при экзоцитозе . Однако их функция подлежит тонкой настройке с помощью различных регуляторных белков, называемых мастерами SNARE .
Классификация
[ редактировать ]Q/R В номенклатуре для организации белков SNARE члены семейства VAMP/синаптобревин классифицируются как R-SNARE , названные так из-за присутствия аргинина в определенном месте в первичной последовательности белка (в отличие от SNAREs белка). целевая мембрана, содержащая глютамин и называемая Q-SNARE ). Синаптобревин классифицируется как V-SNARE в номенклатуре V/T, альтернативной схеме классификации, в которой SNARE классифицируются как V-SNARE и T-SNARE из-за их локализации в везикулах и мембранах-мишенях соответственно. [6]
Клиническое значение
[ редактировать ]Синаптобревин разрушается под действием тетаноспазмина , белка, полученного из бактерии Clostridium tetani , вызывающей столбняк . Родственная бактерия Clostridium botulinum продуцирует ботулинический токсин . Существуют различные серотипы ботулинического токсина, каждый из которых расщепляет определенные пептидные связи определенных нейрональных белков SNARE, и синаптобревин является этим белком-мишенью для нескольких серотипов.
Белки человека, содержащие этот домен
[ редактировать ]СЕК22А ; СЕК22Б ; ВАМП1 ; ВАМП2 ; ВАМП3 ; ВАМП4 ; ВАМП5 ; ВАМП7 ; ВАМП8 ; ЮКТ6 ;
Ссылки и примечания
[ редактировать ]- ^ Баумерт М., Мэйкокс П.Р., Навоне Ф., Де Камилли П., Ян Р. (1 февраля 1989 г.). «Синаптбревин: интегральный мембранный белок массой 18 000 дальтон, присутствующий в небольших синаптических пузырьках мозга крысы» . ЭМБО Дж . 8 (2): 379–84. дои : 10.1002/j.1460-2075.1989.tb03388.x . ПМК 400817 . ПМИД 2498078 .
- ^ Бок Дж.Б., Шеллер Р.Х. (октябрь 1999 г.). «Белки SNARE опосредуют слияние липидных бислоев» . Учеб. Натл. акад. наук. США . 96 (22): 12227–9. Бибкод : 1999PNAS...9612227B . дои : 10.1073/pnas.96.22.12227 . ПМК 34255 . ПМИД 10535902 .
- ^ Эрнст Дж. А., Брунгер А. Т. (2003). «Структура высокого разрешения, стабильность и связывание синаптотагмина укороченного нейронального комплекса SNARE» . J Биол Хим . 278 (10): 8630–6. дои : 10.1074/jbc.M211889200 . ПМИД 12496247 .
- ^ Фассауэр Д., Саттон Р.Б., Брунгер А.Т., Ян Р. (декабрь 1998 г.). «Консервативные структурные особенности синаптического слитого комплекса: белки SNARE, переклассифицированные как Q- и R-SNARE» . Учеб. Натл. акад. наук. США . 95 (26): 15781–6. Бибкод : 1998PNAS...9515781F . дои : 10.1073/pnas.95.26.15781 . ПМК 28121 . ПМИД 9861047 .
- ^ Вебер Т., Земельман Б.В., Макнью Дж.А., Вестерманн Б., Гмахл М., Парлати Ф., Соллнер Т.Х., Ротман Дж.Е. (1998). «SNAREpins: минимальное оборудование для слияния мембран» . Клетка . 92 (6): 759–72. doi : 10.1016/S0092-8674(00)81404-X . ПМИД 9529252 . S2CID 5637048 .
- ^ Хуан С. Бонифачино и Бенджамин С. Глик. «Механизмы почкования и слияния пузырьков». Клетка, Том. 116, 153–166, 23 января 2004 г.,
Внешние ссылки
[ редактировать ]- Синаптобревин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Информация о назначении Миоблока (римаботулинумтоксина В)