Гель-электрофорез белков

Электрофорез белков — это метод анализа белков в жидкости или экстракте. Электрофорез агарозы можно проводить с небольшим объемом образца несколькими альтернативными способами с использованием поддерживающей среды, а именно или полиакриламида , или без нее . Варианты гель-электрофореза включают SDS-PAGE , электрофорез в свободном потоке , электрофокусирование , изотахофорез , аффинный электрофорез , иммуноэлектрофорез , контрэлектрофорез и капиллярный электрофорез . Каждый вариант имеет множество подтипов со своими преимуществами и ограничениями. Гель-электрофорез часто проводят в сочетании с электроблоттингом или иммуноблоттингом, чтобы получить дополнительную информацию о конкретном белке. [1]
Денатурирующие гелевые методы
[ редактировать ]SDS-СТРАНИЦА
[ редактировать ]SDS-PAGE, электрофорез в полиакриламидном геле с додецилсульфатом натрия , описывает набор связанных методов разделения белков в соответствии с их электрофоретической подвижностью (функция молекулярной массы полипептидной цепи) в денатурированном (развернутом) состоянии. В большинстве белков связывание ДСН с полипептидной цепью обеспечивает равномерное распределение заряда на единицу массы, что приводит к фракционированию по приблизительному размеру во время электрофореза. [2]
SDS представляет собой сильный детергент, используемый для денатурации нативных белков до развернутых индивидуальных полипептидов . Когда белковая смесь нагревается до 100 °C в присутствии ДСН, детергент обволакивает основную цепь полипептида. В этом процессе собственные заряды полипептидов становятся незначительными по сравнению с отрицательными зарядами, вносимыми SDS. Таким образом, полипептиды после обработки становятся стержнеобразными структурами, обладающими одинаковой плотностью заряда, то есть одинаковым суммарным отрицательным зарядом на единицу длины. Электрофоретическая подвижность этих белков будет линейной функцией логарифмов их молекулярных масс. [3]
Нативные гелевые методы
[ редактировать ]Нативные гели, также известные как неденатурирующие гели, анализируют белки, которые все еще находятся в свернутом состоянии. Таким образом, электрофоретическая подвижность зависит не только от соотношения заряда и массы, но и от физической формы и размера белка. [4]
Синий родной СТРАНИЦА
[ редактировать ]BN-PAGE — это нативный метод PAGE , при котором краситель Кумасси бриллиантовый синий обеспечивает необходимые заряды белковым комплексам для электрофоретического разделения. [5] [6] Недостатком кумасси является то, что при связывании с белками он может действовать как детергент, комплексов вызывая диссоциацию . Другим недостатком является потенциальное гашение хемолюминесценции или (например, при последующем вестерн-блоттинге анализах активности) или флуоресценции белков с простетическими группами (например, гем или хлорофилл ) или меченных флуоресцентными красителями. [ нужна ссылка ]
Очистить исходную СТРАНИЦУ
[ редактировать ]CN-PAGE (обычно называемый Native PAGE) разделяет кислые водорастворимые и мембранные белки в полиакриламидном градиентном геле. Он не использует заряженный краситель, поэтому электрофоретическая подвижность белков в CN-PAGE (в отличие от метода сдвига заряда BN-PAGE) связана с собственным зарядом белков. [7] Расстояние миграции зависит от заряда белка, его размера и размера пор геля. Во многих случаях этот метод имеет более низкое разрешение, чем BN-PAGE, но CN-PAGE дает преимущества всякий раз, когда краситель Кумасси мешает дальнейшим аналитическим методам, например, он был описан как очень эффективный метод микромасштабного разделения для FRET -анализа. [8] Кроме того, поскольку CN-PAGE не требует суровых условий BN-PAGE, он может сохранять супрамолекулярные сборки мембранных белковых комплексов, которые диссоциируются в BN-PAGE. [7]
Препаративная нативная СТРАНИЦА
[ редактировать ]Представляющие интерес свернутые полиакриламидного белковые комплексы разделяются чисто и предсказуемо без риска денатурации благодаря специфическим свойствам геля, буферного раствора для электрофореза, электрофоретического оборудования и используемых стандартизированных параметров. Отделенные белки непрерывно элюируются физиологическим элюентом и транспортируются в коллектор фракций. высокого разрешения В каждой из четырех-пяти фракций PAGE различные металлические кофакторы могут быть идентифицированы и абсолютно количественно определены с помощью ICP-MS . Связанные структуры выделенных металлопротеинов в этих фракциях можно специфически определить методом ЯМР- спектроскопии в растворе. [9]
Буферные системы
[ редактировать ]
Большинство разделений белков выполняется с использованием «прерывистой» (или DISC) буферной системы, которая значительно повышает четкость полос внутри геля. Во время электрофореза в прерывистой гелевой системе на ранней стадии электрофореза формируется ионный градиент, который заставляет все белки фокусироваться в одну резкую полосу. Формирование ионного градиента достигается выбором значения pH, при котором ионы буфера имеют лишь умеренный заряд по сравнению с белками, покрытыми ДСН. Эти условия создают среду, в которой реакции Кольрауша определяют молярную проводимость . В результате белки, покрытые ДСН, концентрируются в несколько раз в тонкой зоне порядка 19 мкм в течение нескольких минут. На этом этапе все белки мигрируют с одинаковой скоростью путем изотахофореза . Это происходит в области геля, которая имеет более крупные поры, поэтому матрица геля не замедляет миграцию во время фокусировки или «укладки». [10] [11] Разделение белков по размерам достигается в нижней, «рассасывающейся» области геля. Рассасывающийся гель обычно имеет гораздо меньший размер пор, что приводит к эффекту просеивания, который теперь определяет электрофоретическую подвижность белков. В то же время разделяющая часть геля также имеет значение pH, при котором буферные ионы в среднем несут больший заряд, заставляя их «обгонять» белки, покрытые SDS, и устранять ионный градиент и, тем самым, эффект штабелирования. [ нужна ссылка ]
Очень распространенной прерывистой буферной системой является трис-глицин или система « Лэммли », которая суммируется при pH 6,8 и распадается при pH ~ 8,3-9,0. Недостатком этой системы является то, что эти значения pH могут способствовать образованию дисульфидных связей между остатками цистеина в белках, поскольку pKa цистеина находится в диапазоне 8-9 и поскольку восстанавливающий агент, присутствующий в загрузочном буфере, не мигрирует совместно с белками. Последние достижения в технологии буферизации облегчают эту проблему, растворяя белки при pH значительно ниже pKa цистеина (например, бис-трис , pH 6,5) и включают восстанавливающие агенты (например, бисульфит натрия), которые перемещаются в гель раньше белков, поддерживать восстановительную среду. Дополнительным преимуществом использования буферов с более низкими значениями pH является то, что акриламидный гель более стабилен при более низких значениях pH, поэтому перед использованием гели можно хранить в течение длительного периода времени. [12] [13]
SDS-градиентный гель-электрофорез белков
[ редактировать ]При приложении напряжения анионы (и отрицательно заряженные молекулы образца) мигрируют к положительному электроду (аноду) в нижней камере, ведущим ионом является Cl. − (высокая мобильность и высокая концентрация); глицинат — хвостовой ион (малая подвижность и низкая концентрация). Частицы SDS-белка не могут свободно мигрировать на границе между Cl − гелевого буфера и Gly − катодного буфера. Фридрих Кольрауш обнаружил, что закон Ома применим и к растворенным электролитам . Из-за падения напряжения между Cl − и глицин-буферы, белки сжимаются (укладываются) в тонкие микрометровые слои. [14] Граница движется через градиент пор, и белковый пакет постепенно рассеивается из-за увеличения сопротивления трения гелевой матрицы. Укладка и раскладка происходит непрерывно в градиентном геле, причем каждый белок находится в своем положении. Для полной раскладки белков концентрация полиакриламидного геля должна превышать 16% Т. Двухгелевая система «Лэммли» представляет собой простой градиентный гель. Прерывистость pH буферов не имеет значения для качества разделения, и «штабелирующий гель» с другим pH не требуется. [15]
Визуализация
[ редактировать ]Самый популярный белковый краситель — Кумасси бриллиантовый синий . Это анионный краситель, который неспецифически связывается с белками. Белки в геле фиксируются уксусной кислотой и одновременно окрашиваются. Избыток красителя, включенного в гель, можно удалить путем окрашивания тем же раствором без красителя. Белки обнаруживаются как синие полосы на прозрачном фоне. [16] [17]
Когда необходим более чувствительный метод, чем окрашивание Кумасси, обычно используют окрашивание серебром. Окрашивание серебром является чувствительной процедурой для обнаружения следовых количеств белков в гелях, но также позволяет визуализировать нуклеиновые кислоты или полисахариды. [17]
На рынке доступны методы визуализации без использования красителей, таких как кумасси и серебро. [18] Например, компания Bio-Rad Laboratories продает «неокрашенные» гели для гель-электрофореза в SDS-PAGE. Альтернативно можно использовать обратимые флуоресцентные красители, например, от Azure Biosystems, например AzureRed или Azure TotalStain Q. [17] [18] [19]
Как и при гель-электрофорезе нуклеиновых кислот, следящий краситель часто используется . В буфер для образца обычно включают анионные красители с известной электрофоретической подвижностью. Очень распространенный краситель для отслеживания — бромфеноловый синий . Этот краситель окрашен при щелочном и нейтральном pH и представляет собой небольшую отрицательно заряженную молекулу, которая движется к аноду. Будучи высокомобильной молекулой, она опережает большинство белков. [20]
Медицинские применения
[ редактировать ]
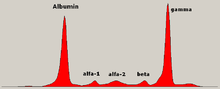
В медицине электрофорез белков — метод анализа белков преимущественно сыворотки крови . До широкого распространения гель-электрофореза электрофорез белков проводился как электрофорез в свободном потоке (на бумаге) или как иммуноэлектрофорез. [ нужна ссылка ]
Традиционно два класса белков крови рассматривают : сывороточный альбумин и глобулин . Обычно они равны в пропорциях, но альбумина молекула намного меньше и имеет небольшой отрицательный заряд, что приводит к накоплению альбумина на электрофоретическом геле. Небольшая полоска перед альбумином представляет собой транстиретин (также называемый преальбумином). Некоторые формы лекарств или химических веществ в организме могут вызывать появление собственных полос, но обычно они небольшие. Аномальные полосы (спайки) наблюдаются при моноклональной гаммапатии неопределенного значения и множественной миеломе и полезны при диагностике этих состояний. [ нужна ссылка ]
Глобулины классифицируются по характеру полос (с указанием их основных представителей): [ нужна ссылка ]
- Альфа- (α) -диапазон состоит из двух частей: 1 и 2:
- α 1 - α 1 -антитрипсин , α 1 -кислый гликопротеин.
- α 2 - гаптоглобин , α 2 -макроглобулин , α 2 -антиплазмин , церулоплазмин .
- Бета- ( β )-диапазон – трансферрин , ЛПНП , комплемент
- Гамма- (IgA, IgD (γ)-диапазон – иммуноглобулины , IgE, IgG и IgM). парапротеины (при множественной миеломе). В этой полосе обычно появляются
См. также
[ редактировать ]- Аффинный электрофорез
- Электроблоттинг
- Электрофокусировка
- Быстрый параллельный протеолиз (FASTpp)
- Гель-электрофорез
- Иммуноэлектрофорез
- Иммунофиксация
- Нативный гель-электрофорез
- Препротеин
- QPNC-СТРАНИЦА
- SDD-ВОЗРАСТ
Ссылки
[ редактировать ]- ^ Михов, Будин (2022). Основы электрофореза: основная теория и практика . Де Грюйтер. п. 490. дои : 10.1515/9783110761641 . ISBN 9783110761641 . S2CID 247987700 .
- ^ Стрингер, Р. (2005). «Электрофорез». Энциклопедия аналитической науки (2-е изд.). Больница Королевского университета Ливерпуля. п. 360. дои : 10.1016/B0-12-369397-7/00120-5 . ISBN 978-0-12-369397-6 .
- ^ Мередит, Южная Каролина (1984). «Определение молекулярной массы белков методом гель-проникающей хроматографии в органических растворителях» . Журнал биологической химии . 259 (19): 11682–11685. дои : 10.1016/s0021-9258(20)71263-9 . ISSN 0021-9258 . ПМИД 6480578 .
- ^ Эйбель, Хольгер; Браун, Ханс-Петер; Миллар, А. Харви (2005). «Синий нативный PAGE в растениях: инструмент анализа белок-белковых взаимодействий» . Растительные методы . 1 (1): 11. дои : 10.1186/1746-4811-1-11 . ISSN 1746-4811 . ПМК 1308860 . ПМИД 16287510 .
- ^ Шеггер, Герман; фон Ягов, Гебхард (1991). «Синий нативный электрофорез для выделения мембранных белковых комплексов в ферментативно активной форме». Аналитическая биохимия . 199 (2): 223–231. дои : 10.1016/0003-2697(91)90094-А . ПМИД 1812789 .
- ^ Виттиг, Илька; Браун, Ханс-Петер; Шеггер, Герман (2006). «Голубая родная СТРАНИЦА». Нат. Проток . 1 (1): 418–428. дои : 10.1038/нпрот.2006.62 . ПМИД 17406264 . S2CID 19715017 .
- ^ Jump up to: а б Виттиг, Илька; Шеггер, Герман (11 октября 2005 г.). «Преимущества и ограничения Clear-native PAGE» . Протеомика . 5 (17): 4338–4346. дои : 10.1002/pmic.200500081 . ПМИД 16220535 . S2CID 23396231 .
- ^ Гэвин, Пол Д.; Девениш, Родни Дж.; Прескотт, Марк (2003). «FRET выявляет изменения во взаимодействии F 1 – ножка статора при активности F 1 F 0 -АТФ-синтазы» . Биохим Биофиз Акта . 1607 (2–3): 167–79. дои : 10.1016/j.bbabio.2003.09.013 . ПМИД 14670607 .
- ^ Кастенхольц, Бернд (2004). «Препаративный непрерывный электрофорез в нативном полиакриламидном геле (PNC-PAGE): эффективный метод выделения кофакторов кадмия в биологических системах» . Аналитические письма . 37 (4): 657–665. дои : 10.1081/AL-120029742 . ISSN 0003-2719 . S2CID 97636537 .
- ^ Орнштейн, Леонард (декабрь 1964 г.). «Дисковый электрофорез. I. Предпосылки и теория» . Анналы Нью-Йоркской академии наук . 121 (2): 321–349. Бибкод : 1964NYASA.121..321O . CiteSeerX 10.1.1.140.7598 . дои : 10.1111/j.1749-6632.1964.tb14207.x . ПМИД 14240533 . S2CID 28591995 .
- ^ Дэвис, Барух Дж. (декабрь 1964 г.). «Дисковый электрофорез. 2. Метод и применение к белкам сыворотки крови человека» . Анналы Нью-Йоркской академии наук . 121 (2): 404–427. Бибкод : 1964NYASA.121..404D . дои : 10.1111/j.1749-6632.1964.tb14213.x . ПМИД 14240539 . S2CID 30512118 .
- ^ Шеггер, Герман; фон Ягов, Гебхард (1 ноября 1987 г.). «Трицин-додецилсульфат натрия-электрофорез в полиакриламидном геле для разделения белков в диапазоне от 1 до 100 кДа» . Аналитическая биохимия . 166 (2): 368–379. дои : 10.1016/0003-2697(87)90587-2 . ISSN 0003-2697 . ПМИД 2449095 .
- ^ Уилтфанг, Йенс; Арольд, Норберт; Нойхофф, Волкер (1991). «Новая многофазная буферная система для электрофореза в додецилсульфат-полиакриламидном геле белков и пептидов с молекулярной массой 100 000–1000 и их обнаружения с пикомолярной чувствительностью» . Электрофорез . 12 (5): 352–366. дои : 10.1002/elps.1150120507 . ISSN 0173-0835 . ПМИД 1718736 . S2CID 40101706 .
- ^ Кольрауш, Фридр (1897). «О концентрационных сдвигах, вызванных электролизом внутри растворов и смесей растворов» . Анналы физики и химии . 62 (10): 209–239. Бибкод : 1897АнП...298..209К . дои : 10.1002/andp.18972981002 .
- ^ Вестермайер, Райнер (2 мая 2016 г.). Электрофорез на практике: Руководство по методам и применению разделения ДНК и белков, A (5-е изд.). Уайли. п. 43. дои : 10.1002/9783527695188 . ISBN 978-3-527-69518-8 .
- ^ Вестермайер, Райнер (26 февраля 2016 г.). Электрофорез на практике: Руководство по методам и применению разделения ДНК и белков (5-е изд.). Уайли . дои : 10.1002/9783527695188 . ISBN 978-3-527-69518-8 .
- ^ Jump up to: а б с Сасс, Иоахим; Галлахер, Шон Р. (2009). «Окрашивание белков в гелях» . Современные протоколы молекулярной биологии . 85 (1): Раздел 10.6. дои : 10.1002/0471142727.mb1006s85 . ISSN 1934-3639 . ПМИД 19170026 . S2CID 205153300 .
- ^ Jump up to: а б Певица Виктория Л.; Хаугланд, Ричард П. (1999). «Флуоресцентная визуализация нуклеиновых кислот и белков в гелях». Флуоресцентные и люминесцентные зонды биологической активности (2-е изд.). Академическая пресса. стр. 58–61. дои : 10.1016/b978-012447836-7/50006-3 . ISBN 978-0-12-447836-7 .
- ^ «Внутригельная флуоресценция» . Лазурные биосистемы . Проверено 2 декабря 2023 г.
- ^ Вестермайер, Райнер (2 мая 2016 г.). Электрофорез на практике: Руководство по методам и применению разделения ДНК и белков, A (5-е изд.). Уайли . стр. 2, 12, 121. doi : 10.1002/9783527695188 . ISBN 978-3-527-69518-8 .