Быстрый параллельный протеолиз
Быстрый параллельный протеолиз ( FASTpp ) — это метод определения термостабильности белков путем измерения того , какая часть белка сопротивляется быстрому протеолитическому расщеплению. [1]
История и предыстория
[ редактировать ]Протеолиз широко используется в биохимии и клеточной биологии для исследования структуры белков . [2] [3] При «ограниченном протеолизе трипсина» небольшие количества протеаз переваривают как свернутый , так и развернутый белок, но с существенно разной скоростью: неструктурированные белки разрезаются быстрее, а структурированные белки разрезаются с более медленной скоростью (иногда на порядки). Недавно было предложено несколько других методов анализа стабильности белков, основанных на протеолизе, с использованием других протеаз с высокой специфичностью расщепления развернутых белков. К ним относятся импульсный протеолиз, [4] Протеолитическая сканирующая калориметрия [5] и FASTpp.
Как это работает
[ редактировать ]FASTpp измеряет количество белка, который сопротивляется перевариванию в различных условиях. С этой целью используется термостабильная протеаза, которая специфически расщепляет открытые гидрофобные остатки. Анализ FASTpp сочетает в себе термическое разворачивание, специфичность термостабильной протеазы в отношении развернутой фракции и разделительную способность SDS-PAGE . [6] Благодаря этой комбинации FASTpp может обнаруживать изменения в свернутой фракции в широком физико-химическом диапазоне условий, включая температуры до 85 °C, pH 6–9, наличие или отсутствие всего протеома . Область применения варьируется от биотехнологии до изучения точечных мутаций и анализа связывания лигандов .
Приложения
[ редактировать ]FASTpp использовался для проверки: [1]
- Влияние лизата на стабильность белка
- Термическая стабильность протеома [7]
- Совмещенное складывание и переплет [8]
- Влияние лиганда на складку и стабильность фракции [9]
- Влияние мутаций на складку и стабильность фракций (например, точковые / миссенс-мутации) [9] [10] )
- Кинетическая стабильность белка [11]
Технология
[ редактировать ]Во-первых, клеточный лизат получают путем взбивания стеклянных шариков, гомогенизации под давлением или методов химического или физического лизиса, которые не денатурируют интересующий белок(ы). (Необязательно для целевого анализа) интересующий белок очищается из этого лизата с помощью аффинных методов, основанных на внутренне неупорядоченных метках. [12] или другие подходящие стратегии очистки, часто включающие несколько ортогональных хроматографических стадий.
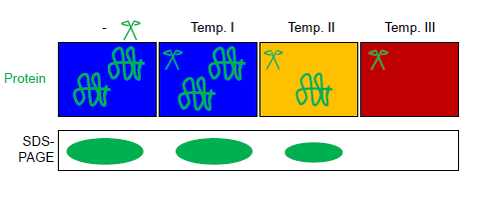
Этот раствор белка (общего или очищенного) разливают в несколько пробирок с ПЦР-стрипом. Все аликвоты параллельно подвергаются воздействию термоградиентной ПЦР-циклера при различных максимальных температурах в присутствии термостабильной протеазы термолизина (см. рисунок). Автоматический контроль температуры достигается с помощью термоградиентного циклера (обычно используемого для ПЦР ). Продукты реакции можно разделить с помощью SDS-PAGE или вестерн-блоттинга . [6] Протеаза термолизин может быть полностью инактивирована ЭДТА . Эта особенность термолизина делает FASTpp совместимым с последующим расщеплением трипсином , например, для масс-спектрометрии . [13] [14] [7]
Ссылки
[ редактировать ]- ^ Jump up to: а б Минде, ДП; Морис, ММ; Рюдигер, SGD (2012). Уверский, Владимир Н (ред.). «Определение биофизической стабильности белков в лизатах с помощью анализа быстрого протеолиза, FASTpp» . ПЛОС ОДИН . 7 (10): е46147. Бибкод : 2012PLoSO...746147M . дои : 10.1371/journal.pone.0046147 . ПМЦ 3463568 . ПМИД 23056252 .
- ^ Джонсон, Делавэр; Сюэ, Б.; Зикмайер, доктор медицины; Мэн, Дж.; Кортезе, MS; Олдфилд, CJ; Ле Галль, Т.; Дункер, АК; Уверский, В.Н. (2012). «Высокопроизводительная характеристика внутренних нарушений в белках в рамках Инициативы по структуре белков» . Журнал структурной биологии . 180 (1): 201–215. дои : 10.1016/j.jsb.2012.05.013 . ПМЦ 3578346 . ПМИД 22651963 .
- ^ Хоелен, Х.; Кляйзен, Б.; Шмидт, А.; Ричардсон, Дж.; Чариту, П.; Томас, П.Дж.; Браакман, И. (2010). Уверский, Владимир Н (ред.). «Первичный дефект сворачивания и спасение ΔF508 CFTR возникают во время трансляции мутантного домена» . ПЛОС ОДИН . 5 (11): е15458. Бибкод : 2010PLoSO...515458H . дои : 10.1371/journal.pone.0015458 . ПМЦ 2994901 . ПМИД 21152102 .
- ^ Парк, К.; Маркизи, С. (2005). «Импульсный протеолиз: простой метод количественного определения стабильности белка и связывания лигандов». Природные методы . 2 (3): 207–212. дои : 10.1038/nmeth740 . ПМИД 15782190 . S2CID 21364478 .
- ^ Тур-Арландис, Г.; Родригес-Ларреа, Д.; Ибарра-Молеро, Б.; Санчес-Руис, ЖМ (2010). «Протеолитическая сканирующая калориметрия: новая методология, исследующая фундаментальные особенности кинетической стабильности белков» . Биофизический журнал . 98 (6):L12–L14. Бибкод : 2010BpJ....98L..12T . дои : 10.1016/j.bpj.2009.11.028 . ПМК 2849053 . ПМИД 20303845 .
- ^ Jump up to: а б Леммли, Великобритания (1970). «Расщепление структурных белков при сборке головки бактериофага Т4». Природа . 227 (5259): 680–685. Бибкод : 1970Natur.227..680L . дои : 10.1038/227680a0 . ПМИД 5432063 . S2CID 3105149 .
- ^ Jump up to: а б Лойенбергер, П; Ганша, С; Кахраман, А (2017). «Общеклеточный анализ термического разворачивания белка выявляет детерминанты термостабильности». Наука . 355 (6327): eaai7825. дои : 10.1126/science.aai7825 . ПМИД 28232526 . S2CID 8432125 .
- ^ Демарест, С.Дж.; Мартинес-Ямут, М.; Чунг, Дж.; Чен, Х.; Сюй, В.; Дайсон, Х.Дж .; Эванс, Р.М.; Райт, ЧП (2002). «Взаимное синергетическое сворачивание при рекрутировании CBP/p300 коактиваторами ядерных рецепторов p160». Природа . 415 (6871): 549–553. дои : 10.1038/415549а . ПМИД 11823864 . S2CID 4423920 .
- ^ Jump up to: а б Робашкевич, К.; Островская З.; Циранка-Чая, А.; Морачевска, Дж. (2015). «Нарушение взаимодействия тропомиозина и тропонина снижает активацию тонких нитей актина». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1854 (5): 381–390. дои : 10.1016/j.bbapap.2015.01.004 . ПМИД 25603119 .
- ^ Минде, ДП; Анварян З.; Рюдигер, СГ; Морис, ММ (2011). «Беспорядок: как миссенс-мутации в белке-супрессоре опухолей APC приводят к раку?» . Молекулярный рак . 10 :101. дои : 10.1186/1476-4598-10-101 . ПМК 3170638 . ПМИД 21859464 .
- ^ Тур-Арландис, Г.; Родригес-Ларреа, Д.; Ибарра-Молеро, Б.; Санчес-Руис, ЖМ (2010). «Протеолитическая сканирующая калориметрия: новая методология, исследующая фундаментальные особенности кинетической стабильности белков» . Биофизический журнал . 98 (6):L12–L14. Бибкод : 2010BpJ....98L..12T . дои : 10.1016/j.bpj.2009.11.028 . ПМК 2849053 . ПМИД 20303845 .
- ^ Минде, ДП; Халфф, EF; Танс, С.Дж. (2013). «Проектирование беспорядка: рассказы о неожиданных хвостах» . Внутренне неупорядоченные белки . 1 (1): e26790. дои : 10.4161/idp.26790 . ПМК 5424805 . ПМИД 28516025 .
- ^ Чанг, Ю; Шлебах, JP; Верхеул, РА; Парк, К. (2012). «Упрощенный протеомный подход к обнаружению белок-лигандных взаимодействий» . Белковая наука . 21 (9): 1280–7. дои : 10.1002/pro.2112 . ПМЦ 3631357 . ПМИД 22733688 .
- ^ Парк, С; Маркизи, С. (2005). «Импульсный протеолиз: простой метод количественного определения стабильности белка и связывания лигандов». Природные методы . 2 (3): 207–12. дои : 10.1038/nmeth740 . ПМИД 15782190 . S2CID 21364478 .